 15.08.2024
15.08.2024
Возможности хирургического лечения при метастазах в шейном отделе позвоночника
Предложены стратегия мультидисциплинарного планирования клинических исследований с высокой достоверностью данных и тактика хирургического лечения метастазов в шейном отделе позвоночника, расширяющие спектр лечебных возможностей при данной патологии
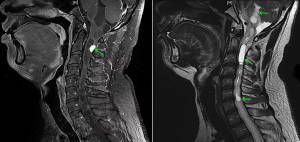
Костные метастазы являются частым проявлением генерализованного онкологического заболевания. Метастазы в позвоночнике отмечаются в среднем у 10 % пациентов с онкологическим диагнозом: наиболее часто поражается грудной (70 %) и поясничный (20 %) отделы, реже (10 %) патологический процесс локализуется в шейном отделе позвоночника [3, 6].
Клиническими симптомами метастазов в позвоночнике являются болевой синдром, часто остро выраженный, и неврологический дефицит, при поражении шейного отдела остро выраженный в 50 % случаев [3, 4]. Остеолитический эффект опухоли на тело позвонка проявляется нарушением его костной структуры с возможным последующим проникновением в кортикальный слой. Происходящая в результате этого существенная деструкция кости приводит к нарушению биомеханических свойств позвонка и его возможному перелому, а также к дисфункции и нестабильности всего позвоночнодвигательного сегмента.
Боль, вызванная опухолью, носит острый, постоянный характер, с тенденцией к усилению в ночное время [4]. Возрастание частоты и интенсивности болевого синдрома необходимо рассматривать как предупреждающий сигнал организма о возможности патологического перелома. Ряд признаков, свидетельствующих о возможной онкологической этиологии боли в спине, называют «красными флажками». Описанию этих признаков посвящено несколько работ [1, 4]. При метастатическом поражении шейного отдела позвоночника клинические данные настолько малочисленны, что не могут быть специфическими маркерами онкологического процесса [3].
В случае утраты телом позвонка опорной функции, наступившей в результате метастатического процесса, хирургическая тактика включает резекцию опухоли, декомпрессию нервных структур и адекватную стабилизацию. Как показали проведенные исследования, у пациентов с метастатическим поражением шейного отдела позвоночника сочетание хирургического лечения и радиотерапии, в отличие от лечения только облучением, оказывает лучший эффект [12].
Вопрос о целесообразности хирургического вмешательства при метастатическом поражении шейного отдела позвоночника до сих пор остается спорным, поскольку не существует достаточного количества достоверных доказательств и клинических исследований [3]. При выборе тактики лечения каждый нейрохирург основывается на собственном опыте и технических возможностях клиники, так как нельзя заранее определить, какая из хирургических методик в конкретной ситуации будет стандартом. Именно противоречивость и разнонаправленность сведений о хирургическом лечении метастатического поражения шейного отдела позвоночника выступила побудительным мотивом публикации данного материала.
Цель исследования — анализ некоторых аспектов хирургического лечения метастазов в шейном отделе позвоночника.
Анатомия метастазов в шейном отделе позвоночника. Наиболее часто метастазы в позвоночнике локализуются в телах позвонков. Преимущественное поражение переднего столба связано с механизмом распространения опухолевых клеток гематогенным путем: венозное сплетение Бетсона является основным путем проникновения в позвоночник опухолевых микроэмболов. Дальнейшее распространение опухоли связано с ретроградным давлением вследствие любого физического напряжения или повышенного внутрибрюшного давления, затем опухолевые микроэмболы оседают в губчатой ткани позвонка [5]. Наиболее частым результатом этих процессов является поражение задней части тела позвонка, которое, в свою очередь, оказывает биомеханическое влияние на развитие вторичных остеолитических изменений.
Цель хирургического лечения. Хирургическое лечение метастазов в шейном отделе позвоночника является оптимальным способом коррекции местных анатомических и биомеханических симптомов. Декомпрессия и стабилизация позвоночника с последующим курсом радиотерапии в большинстве случаев снижают болевой синдром и предохраняют нервные структуры на продолжительный срок от дальнейшего негативного влияния заболевания. Внутренняя фиксация с максимальной первичной стабилизацией создает условия для ранней послеоперационной мобилизации пациента с минимальной внешней механической опорой или даже без таковой.
Таким образом, целью хирургического вмешательства в данном случае является улучшение качества его жизни, обусловленное снижением интенсивности болевого синдрома и увеличением его двигательной активности.
Исключение составляют онкологические пациенты с единичными метастазами, где удаление солитарного метастаза и первичной опухоли приводит к подавлению ракового заболевания в целом. Для таких пациентов хирургическое лечение носит радикальный характер.
У больных с уже сформированным неврологическим дефицитом хирургическое вмешательство может не достичь поставленной цели. Как и в случае любой другой операции на позвоночнике, хирург должен спланировать ожидаемый результат и риск предстоящей операции и только после этого решить, не является ли паллиативное лечение более приемлемым решением для конкретного пациента. Частота оперативных вмешательств на шейном отделе позвоночника, по сравнению со случаями, когда поражение охватывает грудной или поясничный отделы, обусловлена относительной легкостью хирургического доступа [12].
Дооперационное обследование.
При метастатическом поражении в шейном отделе дооперационное обследование играет важную роль, гораздо большую, чем при любых других патологических процессах в позвоночнике [10].
Кроме вопроса об анатомической локализации процесса, определения границ резекции и метода замещения тела (тел) позвонка, необходимо учитывать среднюю продолжительность жизни пациента и ее предполагаемое качество. Важно учитывать сопутствующие заболевания, общее состояние здоровья и потенциальный уровень неврологического дефицита. Наконец, в процессе выбора тактики хирургического лечения должны быть отражены гистологические и патоморфологические характеристики генерализованного опухолевого процесса. Все эти характеристики вместе с возможными результатами комбинированного онкологического лечения определяют возможность и вид оперативного вмешательства. Средняя продолжительность жизни больного зависит от наличия метастазов в других органах, общего состояния здоровья, степени двигательного дефицита и определяется для каждого вида опухоли в отдельности. Для определения средней продолжительности жизни наиболее часто используется система балльной оценки Tokuhashi [10] (табл. 1).
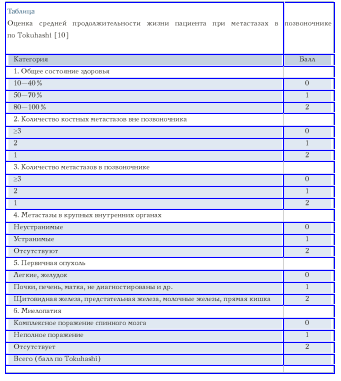
В случае, когда средняя продолжительность жизни пациента с метастазами составляет менее 3 мес. (<5 по шкале Tokuhashi), период выживания определяется как краткосрочный, более 12 мес. (>9 по шкале Tokuhashi) — как долгосрочный. Средний период выживания определяется интервалом между 3 и 12 мес. (6—8 по системе Tokuhashi).
В процессе принятия решения нейрохирург должен руководствоваться конкретными критериями. Если предполагаемая средняя продолжительность жизни при метастазах не превышает 3 мес., то хирургическое лечение обычно считается необоснованным. В случае поражения позвоночно-двигательного сегмента на шейном уровне (при угрозе развития пара- или тетраплегии), когда оперативное вмешательство может улучшить качество жизни пациента, этот временной рубеж может быть снижен по непосредственной просьбе информированного пациента или членов его семьи. В таких случаях операция включает только щадящую паллиативную резекцию опухоли, декомпрессию с заполнением образованного дефекта костным цементом. При этом стараются избегать сложных реконструктивных операций и минимизировать хирургическую агрессию для максимального сокращения периода госпитализации в специализированном отделении: выписка или перевод в другое отделение на 2—3-й день после операции.
Декомпрессия
В области шейного отдела позвоночника применяется переднебоковой ретрофарингеальный доступ, обеспечивающий анатомически наиболее доступный и физиологически обоснованный доступ к позвоночному столбу с минимальным хирургическое лечение при метастазах в шейном отделе позвоночника пересечением поддерживающих мышц шеи.
Передняя цервикальная соматэктомия (в некоторых случаях многоэтапная) в зависимости от биологических характеристик и размера опухоли выполняется в нескольких вариантах:
- переднемедиальная или частичная соматэктомия; средняя соматэктомия, включающая резекцию средней части тела позвонка в случаях полного заднепереднего поражения;
- полное удаление тела позвонка (тотальная соматэктомия).
Кроме передней соматэктомии при необходимости проводят расширенную соматэктомию (удаление всего переднего сегмента) и тотальную вер- теброэктомию (удаление переднего сегмента, дуги и суставных бугорков). В некоторых случаях декомпрессия может быть достигнута путем простой экстирпации (экскохлеации) метастатического образования без резекции тела смежного позвонка (рис. 1).
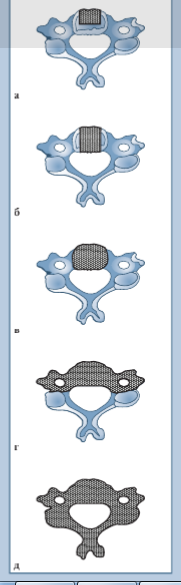

Варианты реконструкции тела позвонка. Реконструкция переднего столба шейного отдела позвоночника после резекции может проводиться несколькими способами, имеющими различные цели, и требует индивидуального подхода в конкретном случае. У каждого из вариантов замещения тела позвонка есть свои преимущества и недостатки.
Ниже приведено описание замещения тела позвонка костным трансплантатом или его заменителями. Данный подход используется в случаях предполагаемой длительной продолжительности жизни, так как предусматривает костную консолидацию. Все другие способы реконструкции являются паллиативными методами, обеспечивающими, в первую очередь, адекватную оперированного позвоночно-двигательного сегмента. Образования костной консолидации в этих случаях не ожидается из-за короткого прогнозируемого периода жизни либо по причине неполной радикальности резекции
Замещение удаленного тела позвонка и прилегающих дисков является исторически самым ранним и наиболее физиологическим способом реконструкции переднего позвоночного столба. После развития костной консолидации между трансплантатом и прилегающими телами позвонков можно ожидать долговременную стабилизацию всего оперированного позвоночно-двигательного сегмента. Применение данного метода сопряжено с соблюдением целого ряда условий. Для обеспечения остеопродуктивной стадии костной консолидации пациенту необходим длительный прием минеральных веществ, который может быть затруднен у онкологических больных, страдающих диспепсией. Другим предварительным условием физиологической консолидации является нормальное состояние иммунной системы больного, необходимое для первой стадии костной пролиферации. В дальнейшем процесс костной консолидации требует наличия необходимых мезенхимных элементов в зоне костеобразования, поэтому в случае применения местной или системной радиотерапии, угнетающей образование клеточных элементов, могут возникнуть проблемы в процессе лечения.
Применение костного трансплантата для замещения удаленного тела позвонка или его части требует радикальной резекции метастатического образования. Местный рецидив остеолитического метастаза может не только препятствовать развитию консолидации, но даже разрушить сам трансплантат и впоследствии послужить причиной несостоятельности всей конструкции.
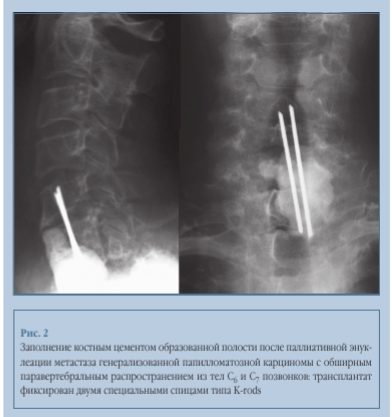
Полиметилметакрилат (ПММА) в лечении онкологических заболеваний используется с 1967 г. [9] в основном у пациентов с ограниченным сроком жизни. Дефект, образующийся в результате удаления опухоли, может быть успешно замещен аморфным цементным веществом, в результате чего достигается максимальный контакт с прилежащей нормальной костной тканью. Последующая экзотермическая полимеризация обеспечивает относительно высокую первичную стабильность [7]. Опухолевая ткань не проникает в цемент, и последующая радиотерапия не приводит к вторичному излучению со стороны ПММА.
Однако имеющийся клинический опыт применения данного метода выявил относительно высокий процент случаев смещения трансплантата при разгибании позвоночника [11].
Это привело специалистов к разработке фиксации полиметилметакрилатного трансплантата к телам прилежащих позвонков. Наиболее известный и часто используемый метод — вертикальная фиксация цементных трансплантатов к вышележащим позвонкам с помощью двух спиц (рис. 2). Костный цемент также может быть использован для заполнения металлических кейджей, о которых будет сказано ниже.
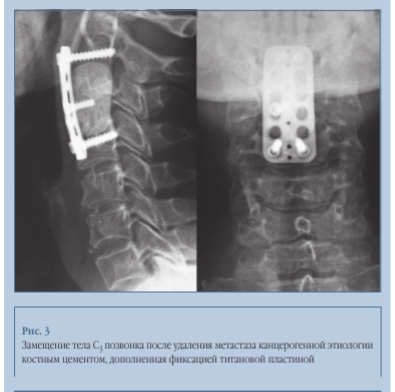
Другим вариантом лечения является стабилизация шейного отдела с помощью традиционной внутренней фиксации титановыми пластинами (рис. 3). В этом случае достигается еще большая стабилизация, но металлоконструкция нежелательна из-за возможного послеоперационного курса радиотерапии.
Применение полых металлических конструкций «Harms» (кейджи типа корзины) стало новым направлением в хирургии метастазов в шейном отделе позвоночника (рис. 4).
Костный дефект после резекции опухоли в шейном отделе с восстановлением его лордоза можно замещать фиксирующей конструкцией подходящего размера. Кейдж для замещения готовят вне операционного поля путем формирования конструкции необходимых размеров. При этом кейдж заполняют костной тканью, ее заменителями или костным цементом, а затем имплантируют в образованный после резекции метастаза дефект. В результате достигается надежное костное сращение. В случае рецидива опухоли в месте вмешательства состоятельность конструкции сохраняется, так как кейдж обеспечивает достаточную биомеханическую опору. Острые края кейджа, находясь на относительно небольшой поверхности, под воздействием нагрузки обеспечивают врезание всей конструкции в прилежащие позвонки, что формирует дополнительную фиксацию оперированного позвоночного сегмента. Для профилактики несостоятельности при разгибании (ретрофлексии) и развития деформации конструкцию дополняют передними фиксирующими пластинами.
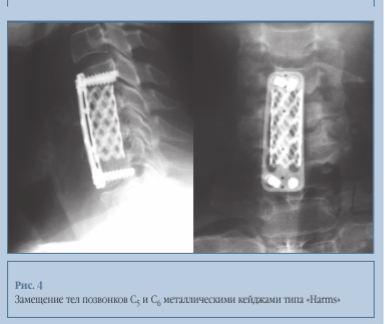
Существенным недостатком данного типа конструкций является небольшая контактная поверхность и, как следствие, относительно низкая первичная стабильность [8]. Это объясняется тем, что имплантат, готовящийся вне операционной раны, неидеально заполняет пространство между краями обоих тел смежных позвонков. Кроме того, конструкция кейджа обусловливает в будущем вынужденную фиксацию оперированного сегмента.
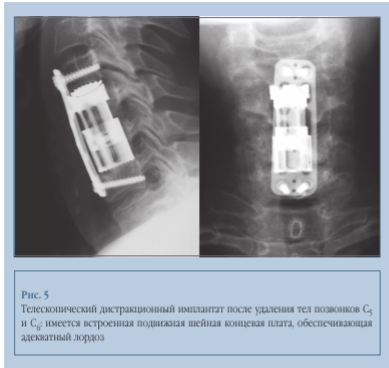
Имплантат усовершенствованного типа (телескопическая дистракционная «корзина») имеет ряд преимуществ перед вышеописанной металлоконструкцией (рис. 5). Его помещают в место дефекта позвонка и затем раскрывают до требуемой длины, добиваясь правильного угла наклона концевой платы конструкции. Дистракция имплантата внутри позвоночного дефекта способствует коррекции кифотического положения в шейном отделе — восстановлению лордоза, а отрегулированный угол концевой платы может способствовать достижению идеального прилегания к вышележащему позвонку. Таким образом, данный тип конструкции обеспечивает максимальную первичную стабильность в оперированном отделе позвоночника. В этом случае также рекомендуется комбинировать внутреннюю фиксацию с фиксацией передней пластиной для профилактики несостоятельности разгибания и развития деформации. Конечной целью операции в данном случае является сохранение движения в шейном отделе позвоночника, хотя не исключена фиксация, связанная с заполнением губчатой костной тканью изнутри и по периметру конструкции. Вполне оправданным считается применение описанного метода у молодых пациентов с ожидаемо высокой физической активностью и длительной прогнозируемой средней продолжительностью жизни, у которых невозможно радикальное вмешательство по причине распространения патологического процесса в область паравертебральных мягких тканей.
В случае установки передней шейной пластины необходимо отдавать предпочтение фиксации бикортикальными или блокируемыми монокортикальными шурупами, обеспечивающими оптимальную стабилизацию благодаря своим биомеханическими свойствам [2, 9]. Применение задней стабилизации (транспедикулярной стабилизации) в дальнейшем ведет к повышению первичной стабильности позвоночно-двигательного сегмента после циркулярной декомпрессии и представляется методом выбора в случае опухолевой деструкции суставов. В отдельных случаях при задней стабилизации рекомендуется добавление аутокостного материала.
Заключение
Хирургические вмешательства на позвоночнике весьма значимы в лечении пациентов с генерализованными онкологическими заболеваниями. Несмотря на то что оперативное лечение в этих случаях не может повысить среднюю выживаемость и не гарантирует устранения возможного неврологического дефицита, улучшение качества жизни и снижение интенсивности болевого синдрома убедительно говорят о высокой эффективности данной методики.
Тем не менее очень часто в онкологических клиниках пациентам с диагностированными метастазами в позвоночнике своевременно не назначается консультация нейрохирурга для решения вопроса о возможном оперативном лечении. Стратегия мультидисциплинарного планирования клинических исследований с высокой достоверностью данных и тактика лечения метастазов в шейном отделе позвоночника расширяют спектр лечебных возможностей при данной патологии.
Литература
Atanasiu J.P., Badatcheff F., Pidhorz L. Metastatic lesions of the cervical spine. A retrospective analysis of 20 cases // Spine. 1993. Vol. 18. P. 1279-1284.
Barsa P., Hackel M. System «cervenych praporku» v diagnostike a terapii bolesti zad // Bolest. 2004. Suppl. 2. P. 15-19.
Byvaltsev V., Barsa P., Suchomel P. Surgical strategy for treatment of cervical spine metastases // J. Maxillofacial and Oral Surgery. 2008. Vol. 7. P. 172-175.
Constans J.P., De Divitiis E., Donzelli R., et al. Spinal metastases with neurological manifestations. Review of 600 cases // J. Neurosurg 1983. Vol. 59. P. 111-118.
Coman D.R., de Long R.P. The role of the vertebral venous system in the metastasis of cancer to the spinal column: experiments with tumor-cell suspensions in rats and rabbits // Cancer. 1951. Vol. 4. P. 610-618.
Halligan M., Hubschmann O.R. Short-term and long-term failures of anterior polymethylmethacrylate construct with esophageal perforation // Spine. 1993. Vol. 18. P. 759-761.
Merk H., Koch H., Liebau C., et al. [Implantation of a Harms titanium mesh cylinder for vertebral body replacement in spinal metastases] // Z. Orthop. Ihre Grenzgeb. 2000. Vol. 138. P. 169-173. German.
Scoville W.B., Palmer A.H., Samra K., et al. The use of acrylic plastic for vertebral replacement or fixation in metastatic disease of the spine. Technical note // J. Neurosurg. 1967. Vol. 27. P. 274-279.
Tokuhashi Y., Matsuzaki H., Oda H., et al. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis // Spine. 2005. Vol. 30. P. 2186-2191.
Wilke H.J., Kettler A., Claes L. [Stabilizing effect and sintering tendency of 3 different cages and bone cement for fusion of cervical vertebrae segments] // Orthopade. 2002. Vol. 31. P. 472-480.
Whitecloud T.S. Anterior surgery for cervical spondylotic myelopathy. Smith-Robinson, Cloward, and vertebrectomy // Spine. 1988. Vol. 13. P. 861-863.
Авторы:
В.А. Бывальцев - Научный центр реконструктивной и восстановительной хирургии ВСНЦ СО РАМН, Иркутск
П. Барза - Центр нейрохирургии регионального госпиталя Либерец, Чехия
Теги: метастазы
234567 Начало активности (дата): 15.08.2024 23:06:00
234567 Кем создан (ID): 989
234567 Ключевые слова: метастазы, шейный отдел позвоночника, система балльной оценки Tokuhashi, реконструкция тела позвонка
12354567899
Похожие статьи
"Слепые пятна" в анализе компьютерной томографии области головы и шеиРентген на дому 8 495 22 555 6 8
Клинический случай хордомы крестца и копчика, имеющей массивный внутритазовый компонент (хирургическое лечение с кратким обзором литературы)
70% гибридных радионуклидных исследований проводится в РОКБ для выявления онкопатологии
В НИИ Склифосовского обратилась женщина с жалобами на наличие большого грыжевого выпячивания



