 08.07.2024
08.07.2024
Влияние окисленного декстрана на метаболизм внеклеточного матрикса органов мышей с липополисахарид-индуцированноой пневманией
Острое повреждение легких (ОПЛ), особенно его тяжелая форма — острый респираторный дистресс-синдром (ОРДС), представляет огромную проблему для здравоохранения, поскольку показатели смертности все еще остаются высокими.
Известно, что липополисахарид (ЛПС), основной компонент внешней оболочки клеток грамотрицательных бактерий, является доминирующим фактором индукции воспаления [1], и его часто применяют для моделирования острых системных воспалительных реакций [2-4]. Для моделирования ОПЛ используют интратрахеальный [5] или эндотрахеальный способ введения ЛПС [1], поскольку такие подходы эффективно индуцировали ОПЛ. Однако они сопряжены с риском травматизации дыхательных путей, особенно у мелких животных, и требуют дополнительного хирургического вмешательства и обезболивающих процедур. В этой связи поиск более физиологичных способов моделирования ОПЛ представляется актуальным.
Тяжесть состояния при ОПЛ обусловлена не только развитием стойкого воспаления и фиброза легких, но также синдромом полиорганн- ной недостаточности разной степени тяжести [6]. Если проявления воспаления при ОПЛ общеизвестны, то фиброз как результат ремоделирования внеклеточного матрикса (ВКМ) остается в большей степени неизученным. Такое обстоятельство отразилось на слабой разработке вопросов профилактики и лечения фиброзных заболеваний [7], особенно на ранних его сроках, в связи с чем актуализируется вопрос о возможности регуляции этого процесса.
На сегодня известны два антифибротических средства — пирфени- дон и нинтеданиб, рекомендованные для лечения идиопатического фиброза легких [8, 9], которые для широкого круга пациентов пока не всегда доступны.
Недавно было продемонстрировано антифиброти- ческое действие более доступного соединения — окисленного декстра- на с молекулярной массой 40 кДа (ОД-40) на модели спаечной болезни брюшины у крыс [10, 11]. Поскольку действие ОД-40 приводило к снижению количества спаек и объемной плотности коллагеновых волокон в них [10], а также содержания общих гликозаминоглика- нов (ГАГ) и белковосвязанного ги- дроксипролина (белГОП) в сыворотке крови уже на 7-е сутки после моделирования спаечного процесса [11], невольно возник вопрос о возможности его использования для ранней профилактики фиброза при ОПЛ.
Как правило, моделируя ОПЛ, исследования ограничиваются изучением отдельных сторон его патогенеза в легких, поскольку предполагается исключительное действие ЛПС на органы дыхания и не рассматривается реакция на другие органы.
С учетом вышесказанного цель настоящего исследования заключалась в изучении метаболизма ВКМ в легких, печени и селезенке мышей при интраназальном введении ЛПС и ингаляции ОД-40.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполняли на двухмесячных мышах линии ICR (n = 21), полученных из питомника ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора (Россия). Во время двухнедельного карантина и на протяжении исследования животные находились в стандартных условиях вивария, имели свободный доступ к воде и корму. Соблюдались все принципы и правила работы с подопытными животными. Исследование получило одобрение локального этического комитета ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины» (протокол № 15 от 01.04.2024 г.).
В этом исследовании использовались только мыши-самцы, поскольку известно, что они более восприимчивы к повреждению легких, вызванному ЛПС [12]. Животных разделили случайным образом на три группы — в каждой по 7 мышей: 1-ю группу составили интактные животные, мышам 2-й и 3-й групп воспроизводилась модель ОПЛ однократным интраназальным введением ЛПС, полученного из Escherichia соН (Sigma-Aldrich, США), в дозе 20 мкл (2 мг/мл в 9%-ном растворе NaCl) [13]. Мышам 3-й группы через 10 минут после введения 20 мкл ЛПС в течение 5 минут проводили ингаляции с помощью ультразвукового ингалятора «Комфорт-02-Smart» (Россия) 2%-ного водного раствора ОД-40 из расчета 20 мкл на животное [14]. Через 24 часа животных выводили из эксперимента под легким эфирным наркозом путем дислокации шейных позвонков.
Собирали кровь для получения сыворотки. Выделяли печень, легкие и селезенку, готовили 10%-ные гомогенаты. Гомогенаты и сыворотку крови хранили при —70 °С. Определяли содержание сульфа- тированных ГАГ (сГАГ) [15], свободного ГОП (свГОП) и белГОП, в сыворотке крови — дополнительно пептидносвязанный ГОП (пепГОП) согласно описанию [16]. Методами ИФА оценивали содержание гипоксия-индуцибельного факто- ра-1а (HIF-1a), гиалуронансинтазы 2 (HAS2), эластина согласно инструкции производителя (ABclonal Biotechnology Со., Ltd, Китай).
О регуляции метаболизма ВКМ судили по суммарной активности матриксных металлопротеиназ (ММП) [17], активности гиалуронидаз [18] и а2-макроглобулина (а2-МГ) [19], содержанию тканевых ингибиторов металлопротеиназ — ТИМП-1 и ТИМП-2 (Abcam Со., США). Активность гиалу- ронидаз, ММП, а2-МГ, содержание сГАГ, фракций ГОП, HIF-1a, HAS2, эластина и ТИМП в органах пересчитывали на белок, измеренный по методу Bradford.
При выполнении работы использовали оборудование ЦКП «Современные оптические системы» и ЦКП «Спектрометрические измерения» ФИЦ ФТМ.
Для статистической обработки полученных результатов использовали пакет прикладных программ Statistica v. 10,0 (StatSoft Inc., США). В связи с тем, что в большинстве случаев распределение признаков в выборках не подчинялось закону нормального распределения использовали непараметрический метод: учитывали медиану (Ме), нижний и верхний квартили (Q25; Q75). Для проверки статистической гипотезы разности значений для двух независимых переменных использовали U-критерий Манна — Уитни. Критическим уровнем значимости при проверке статистической гипотезы принимали p < 0,05.
РЕЗУЛЬТАТЫ
Ответная реакция компонентов ВКМ на введение ЛПС и ОД-40 оказалась различной в изученных органах. В легких мышей 2-й группы отмечено увеличение содержание сГАГ, эластина, фракций ГОП, которое можно связать с ростом активности ММП и содержания ТИМП-1 и ТИМП-2, отражающих активацию метаболизма основных компонентов ВКМ, с развитием фиброэластогенеза (табл.). Наряду с этим повышенное содержание HAS2 позволяет ожидать и активацию синтеза гиалуронана, происходящего при нарастании гипоксии, о чем свидетельствовало повышенное содержание HIF-1a в 1,8 раза относительно данных 1-й группы.
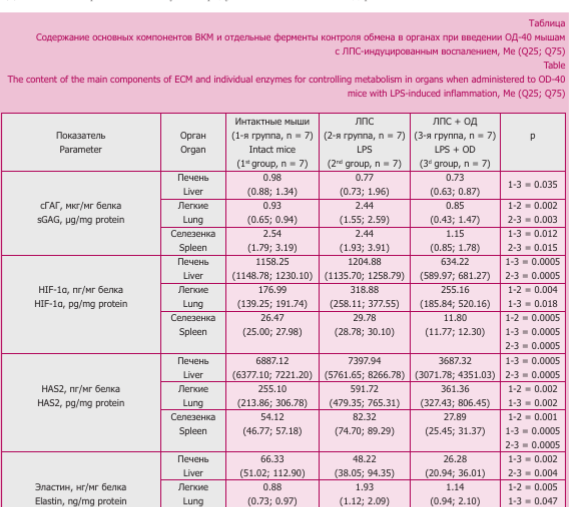
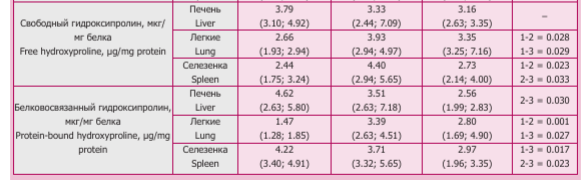
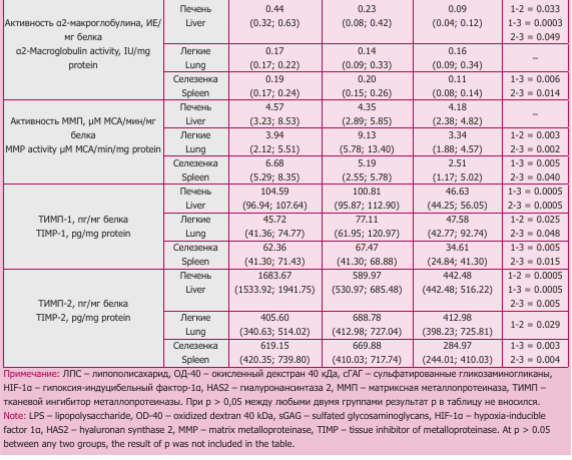
В селезенке мышей 2-й группы повышенными оказались показатели HIF-1a, HAS2 и свГОП относительно данных 1-й группы, что свидетельствует об усилении деградации коллагенов в условиях гипоксии (табл.). У мышей 3-й группы отмечено снижение содержания сГАГ, эластина, белГОП, ТИМП-1 и ТИМП-2, HIF-1a, HAS2, активности а2-МГ и ММП по сравнению с данными 1-й и 2-й групп. Уровень свГОП был ниже, чем во 2-й группе и не отличался от 1-й. В этой группе животных на фоне ингибирования активности ферментов, контролирующих обмен ВКМ, снижалось содержание компонентов, формирующих фиброзную ткань.
В сыворотке крови у мышей 2-й группы увеличилась активность ММП (223,14 (183,45; 243,16) мкМ МСА/мл/мин, р = 0,0005) и содержание пепГОП (16,10 (13,97; 16,44) мкг/мл, р = 0,0005) относительно 1-й (125,11 (112,25; 126,71) мкМ МСА/мл/мин и 9,68 (9,60; 9,70) мкг/мл соответственно). У животных 3-й группы отмечено снижение активности гиалурони- даз (8,45 (8,04; 9,54) мкМ NAG/ мин/л) и содержания всех фракций ГОП (свГОП 21,30 (19,56; 22,40), пепГОП (10,00 (9,46; 10,40), бел- ГОП (17,80 (17,51; 18,00) мкг/мл), р < 0,050 по сравнению с данными 2-й группы (активность гиалурони- даз 10,55 (10,05; 11,40) мкМ NAG/ мин/л, свГОП 24,86 (23,50; 29,60), пепГОП (16,10 (13,97; 16,44), бел- ГОП (19,21 (19,11; 19,40) мкг/мл, соответственно), что соответствует изменениям в селезенке.
Таким образом, результаты исследования показали, что при введении ЛПС мышам через 24 часа в легких происходит избыточное отложение коллагенов, повышение содержание HAS2, сГАГ, HIF-1a, эластина и активация ферментов. В это же время в печени и селезенке изменения были незначительными (снижение активности а2-МГ и содержания ТИМП-2 в печени; рост содержания HIF-1a, HAS2 и увеличение свГОП в селезенке).
Однако после ингаляции ОД-40 наиболее выраженным оказалось ремоделирование ВКМ в селезенке, проявившееся в снижении всех изучаемых показателей, которые отражают уменьшение тканевой гипоксии, снижении интенсивности обмена коллагенов, приводящее в целом к уменьшению фиброза. В печени в условиях снижения ингибиторов протеаз — специфических (ТИМП-1 и ТИМП-2) и неспецифических (а2-МГ), был подавлен синтез коллагенов, тогда как деградация их не изменялась, поскольку активность ММП и содержание свГОП сохранялись на уровне 2-й группы. В легких введение ОД-40 привело к снижению активности ММП и содержания ТИМП-1 до значений контрольной группы, тем не менее, интенсивность обмена коллагенов оставалась на уровне группы ЛПС.
ОБСУЖДЕНИЕ
Результаты исследования показали, что однократное интрана- зальное введение ЛПС позволило смоделировать ОПЛ и зафиксировать признаки фиброза в легких на раннем сроке (через 24 часа). Об этом свидетельствует повышенное содержание белГОП, отражающее количество синтезированного белка коллагена. Одновременно увеличенное содержание свГОП свидетельствует об ускоренном метаболизме коллагенов в легких мышей в группе ЛПС.
В другом исследовании при ин- трахеальном введении ЛПС также через 24 часа были отмечены увеличение содержания коллагеновых волокон III типа и утолщение альвеолярного интерстиция, цитоплазматическая деструкция пневмоцитов II типа, иммуногистохимически обнаружено повышение экспрессии ММП-9 в нейтрофилах [2]. Одновременно авторы отметили изменения механических и морфометрических параметров легких (резистивного и вязкоупругого давления, статической эластичности). В исследовании S.T. Tsikis и соавт. [20] после интратрахеаль- ного введения ЛПС мышам-самцам C57BL/6J через 24 часа было выявлено снижение экспрессии васкулоэндотелиального фактора роста в легких, переносимости физических нагрузок и работоспособности, которые сохранялись до 4 недель.
Интраназальное введение ЛПС индуцировало ремоделирование других компонентов ВКМ: эластина и ГАГ (увеличение сГАГ, вероятно, связанное с повышением содержания HAS2) (табл.). Есть данные о значительном снижении экспрессии гена фибронектина, но увеличение содержания коллагена III типа в легких крыс Sprague- Dawley получено через 24 часа после интрахеального введения ЛПС [21]. На мышиной модели ОПЛ, индуцированного ЛПС, уже через 24 часа была повышена экспрессия люмикана в стенках альвеол и эпителии дыхательных путей, увеличено содержание люмикана, фибро- нектина и фактора некроза опухоли а, а1 коллаген III типа [COL3A1] в жидкости бронхоальвеолярного лаважа [22]. Содержание люмикана коррелировало с провоспалительными и профибротическими уровнями цитокинов в жидкости бронхоальвеолярного лаважа.
В легких отмечено двукратное увеличение содержания HIF-1 а (табл.). Повышенную экспрессию мРНК HIF-1 а и воспалительных цитокинов в легочной ткани наблюдали и раньше [23]. Известно, что ЛПС запускает воспалительную реакцию в легких [1, 22], отражаясь на дыхательной функции крови. Сообщалось, что внутривенное введение ЛПС телятам буйволов вызывает нарушение кислотно-основного состояния крови, которое проявлялось артериальной гипоксемией и венозной гипероксией, снижением оксигенации артериальной и увеличением оксигенации венозной крови [24]. Эти данные свидетельствуют о развитии дыхательной (газообменной) недостаточности в легких и тканевой гипоксии. Поскольку HIF-1 а экспрессируется в условиях гипоксии, его увеличение указывает на раннее развитие тканевой гипоксии (уже через 24 часа) после введения ЛПС.
Имеются данные, свидетельствующие о том, что развитию гипоксии способствует также отмеченное в легких через 12 часов после инъекции ЛПС выраженное утолщение альвеолярной перегородки, которое следует рассматривать как результат интерстициального фиброза и коллапса альвеолярного пространства [5].
На более жесткой модели ЛПС-индуцированного ОПЛ, воспроизведенного на крысах трехкратным введением ЛПС (через эндотрахеальную трубку, внутрибрюшинно и через эндотрахеальную трубку), уже на 1-е сутки была обнаружена повышенная экспрессия а-гладкомышечного актина, белка, маркера активации миофибробластов, интенсивное окрашивание коллагеновых волокон, на 3-и сутки — увеличение содержания ГОП в легких [1].
Незначительные изменения, обнаруженные в метаболизме ВКМ печени и селезенке при интрана- зальном введении ЛПС, можно связать с отсутствием непосредственного воздействия ЛПС, тогда как в легких биохимические процессы, участвующие в фиброэластогенезе, способны быстро реагировать на индуктор воспаления и фиброза. Как отмечалось выше, прямых данных о влиянии ЛПС на обмен ВКМ в печени и селезенке не выявлено.
Однако есть сообщения, что ЛПС подвергается деацилированию в печени и селезенке ацилоксиацилгидролазой, эндогенной липазой, которая избирательно удаляет вторичные жирные ацильные цепи, необходимые для распознавания ЛПС его сигнальным рецептором млекопитающих, ко-рецепторным миелоидным дифференцировочным белком 2 (MD-2-TLR4) [25]. Авторы показали, что клетки Купфера продуцируют ацилоксиацилгидролазу, необходимую для деацилирования ЛПС в печени in vivo. Именно деацилирование, опосредованное ацилоксиацилгидролазой, по мнению авторов, является ранее недооцененным механизмом, который предотвращает длительные воспалительные реакции на грамотрицательные бактерии и ЛПС в печени.
Разную реакцию органов на введение ЛПС в некоторой степени объясняют результаты, полученные в эксперименте со спленэктомированными крысами [26]. Через 12 часов после внутривенного введения ЛПС (5 мг/кг) у ложнооперированных крыс наблюдали снижение концентрации АТФ и перекиси липидов в ткани печени и увеличение концентрации лактатдегидрогеназы в сыворотке крови по сравнению с данными спленэктомированных животных.
При этом средняя концентрация белка в жидкости бронхоальвеолярного лаважа не отличалась между группами, что позволило авторам сделать вывод о том, что селезенка не влияет на повреждение легких.
Более подробная информация о сложных межклеточных и межорганных взаимосвязях, направленных на борьбу с инфекцией и защиту тканей, представлена в ряде работ [27, 28].
В нашем исследовании после ингаляции ОД-40 в печени и селезенке уменьшалось содержание HIF- 1а, в легких наметилась тенденция к снижению. Эти результаты перекликаются с работой [24], где внутривенное введение 7,2%-ного раствора NaCl в дозе 4 мл/ кг массы тела в течение 6,5 мин с последующим введением декстра- на-40 в дозе 10 мл/кг массы тела через 120 и 300 минут после внутривенного введения ЛПС телятам буйволов значительно увеличивало оксигенацию артериальной крови и уменьшало гипоксемию. По-видимому, ОД-40 в нашем случае проявил антигипоксическое действие, регулируя HIF-1 а. Однако для подтверждения этой гипотезы необходимы целенаправленные исследования с ОД-40.
Известно, что декстран-40 проявляет антиоксидантную, а также иммуномодулирующую активность, поскольку он ингибирует реакции перекисного окисления липидов и стимулирует пролиферацию макрофагов на выработку оксида азота [29]. Результаты настоящего исследования позволяют предполагать, что ОД-40 может проявлять антигипоксическое и антифибро- тическое действие у мышей через 24 часа после индукции ЛПС-инду- цированного воспаления.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали возможность моделирования ОПЛ у мышей щадящим интрана- зальным способом введения ЛПС. Признаки развития фиброза в легких наблюдались уже через 24 часа после индукции. При этом в печени и селезенке изменения метаболизма ВКМ были незначительные.
В легких мышей ингаляционное введение ОД-40 привело к нормализации активности ММП, содержания сГАГ и ТИМП-1. Однако такие показатели, как HIF-1a, HAS2, эластин, свГОП, белГОП, соответствовали данным ЛПС-инфицированных мышей, оставаясь выше контроля, что можно рассматривать как возможность дальнейшего прогрессирования фиброза в органе. В печени был снижен уровень HIF-1a, HAS2, эластина, белГОП, ТИМП-1, ТИМП-2 и активности а2-МГ, отражающий снижение синтеза коллагенов. В селезенке была ингибирована активность ферментов, контролирующих обмен ВКМ, что привело к снижению содержания компонентов, формирующих фиброзную ткань.
При введении ОД-40 ЛПС-ин- дуцированным мышам значимое уменьшение содержания HIF-1 а в печени и селезенке и тенденция к снижению в легких могут служить проявлением антигипоксического эффекта ОД-40.
Антифибротическое действие ОД-40 в печени связано с подавлением синтеза коллагена, в селезенке — с замедлением обмена коллагенов. Для объяснения полученных результатов необходимы дополнительные исследования.
ЛИТЕРАТУРА
Santos FB, Nagato LK, Boechem NM, Negri EM, Guimaraes A, Capelozzi VL, et al. Time course of lung parenchyma remodeling in pulmonary and extrapulmonary acute lung injury. J. Appl. Physiol. 2006; 100(1): 98-106
Mohamed HA, Elbastawisy YM, Elsaed WM. Attenuation of lipo- polysaccharide-induced lung inflammation by ascorbic acid in rats: Histopathological and ultrastructural study. SAGE Open Med. 2019; 7: 2050312119828260.
Du Y, Zhu P, Wang X, Mu M, Li H, Gao Y, et al. Pirfenidone alleviates lipopolysaccharide-induced lung injury by accentuating BAP31 regulation of ER stress and mitochondrial injury. J Autoim- mun. 2020; (112): 102464.
Girsh AO, Mishchenko SV, Stepanov SS, Klementyev AV, Leyder- man IN, Stukanov MM, et al. Organ and system dysfunctions in patients with acute respiratory distress syndrome. Polytrauma. 2022; (2): 18-25. Russian (Гирш А.О., Мищенко С.В., Степанов С.С., Клементьев А.В., Лейдерман И.Н., Стуканов М.М. и др. Дисфункция органов и систем у больных с острым респираторным дистресс-синдромом //Политравма. 2022. № 2. С. 18-25.) DOI: 10.24412/1819-1495-2022-2-18-25
Wu KK. Control of tissue fibrosis by 5-methoxytryptophan, an innate anti-inflammatory metabolite. Front Pharmacol. 2021; (12): 759199. DOI: 10.3389/fphar.2021.759199
Lehmann M, Buhl L, Alsafadi HN, Klee S, Hermann S, Mutze K, et al. Differential effects of Nintedanib and Pirfenidone on lung alveolar epithelial cell function in ex vivo murine and human lung tissue cultures of pulmonary fibrosis. Respir Res. 2018; 19(1): 175. DOI: 10.1186/s12931-018-0876-y
Sugino K, Ono H, Watanabe N, Ando M, Tsuboi E, Homma S, et al. Efficacy of early antifibrotic treatment for idiopathic pulmonary fibrosis. BMC Pulm Med. 2021; 21(1): 218. DOI: 10.1186/ S12890-021-01595-3
Karpov MA, Shkurupy VA, Troitskii AV. The study of efficiency of the approach to prevent the adhesions in the abdominal cavity of rats. Bul. Exp Biol Med. 2021; 171(4): 416-420. DOI: 10.1007/ s10517-021-05240-1
Kim LB, Putyatina AN, Russkikh GS, Komkov NA. Effect of oxidized dextran on the adhesive process in rats. Polytrauma. 2023; (1): 83-88. Russian (Ким Л.Б., Путятина А.Н., Русских Г.С., Комков Н.А. Влияние окисленного декстрана на спаечный процесс у крыс // Политравма. 2023. № 1. С. 83-88.) DOI: 10.24412/1819-1495-2023- 1-83-88
Card JW, Carey MA, Bradbury JA, DeGraff LM, Morgan DL, Moorman MP, et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. J Immunol. 2006; 177(1); 621-630.
Means for the prevention of interstitial pneumonia: patent for invention No. 2747550, May 6, 2021. AV Troitsky, TN Bystrova, AA Staro- stenko, AN Kopylov; applicant and patentee: Federal Research Center for Basic and Translational Medicine; application from November 24, 2011, published on May 6, 2021. Bulletin No. 13; 1-10 p. Russian (Средство для профилактики интерстициальной пневмонии: патент на изобретение № 2747550 от 06.05.2021 г. /А.В. Троицкий, Т.Н. Быстрова, А.А. Старостенко, А.Н. Копылов; заявитель и патентообладатель ФИЦ ФТМ; заявл. 24.11.2020, опуб. 06.05.2021. Бюлл. № 13. С. 1-10.)
Oke SL, Hurtig MB, Keates RA, Wright JR, Lumsden JH. Assessment of three variations of the 1,9-dimethylmethylene blue assay for measurement of sulfated glycosaminoglycan concentrations in equine synovial fluid. Am J Vet Res. 2003; 64(7): 900-906. DOI: 10.2460/ajvr.2003.64.900
Putyatina AN, Kim LB, Russkikh GS. Assessing the collagen metabolism in experimental BCG-induced tuberculous inflammation. Proceedings of the National Academy of Sciences of Belarus. Medical series. 2024; 21(1): 62-67. Russian (Путятина А.Н., Ким Л.Б., Русских Г.С. Оценка метаболизма коллагенов при экспериментальном БЦЖ-индуцированном туберкулезном воспалении //Вес. Нац. a^. навук Беларусь Сер. мед. навук. 2024. Т. 21, № 1. С. 62-67.) DOI: 10.29235/1814-6023-2024-21-1-62- 67
de Grauw JC, van de Lest CH, van Weeren PR. Inflammatory mediators and cartilage biomarkers in synovial fluid after a single inflammatory insult: a longitudinal experimental study. Arthritis Res Ther. 2009; 11(2): R35. DOI: 10.1186/ar2640
Isman FK, Kucur M, Baysal B, Ozkan F. Evaluation of serum hyaluronic acid level and hyaluronidase activity in acute and chronic hepatitis C. J Int Med Res. 2007; 35(3): 346-352. DOI: 10.1177/147323000703500309
Yarovaya GA., Dotsenko VL, Pashintseva LP, Nartikova VF, Paskhi- na TS. Testing the activity of a1-antitrypsin and a2-macroglobulin in human blood plasma by a unified enzymatic method. Clinical Biochemistry Methods. Textbook. VN Orekhovich, eds., Moscow, TSOLIUV Publ., 1982, 22-26 p. Russian (Яровая Г.А., Доценко В.Л., Пашинцева Л.П., Нартикова В.Ф., Пасхина Т.С. Определение активности а1-антитрипсина и а2-макроглобулина в плазме крови человека унифицированным энзиматическим методом // Методы клинической биохимии: учебное пособие /под ред. В.Н. Ореховича. Москва: ЦОЛИУВ, 1982. С. 22-26.)
Tsikis ST, Fligor SC, Hirsch TI, Pan A, Yu LJ, Kishikawa H, et al. Lipopolysaccharide-induced murine lung injury results in long-term pulmonary changes and downregulation of angiogenic pathways. SciRep. 2022; 12(1): 10245.
Samoilova EV, Chepurnova DA, Fesenko AG, Korotaeva АА. Extracellular matrix components of rat lungs after direct and indirect lung injury. Bull Exp Bio. Med. 2022; 172(4): 407-409. DOI: 10.1007/ s10517-022-05403-8
Wang K, Wang Y, Cao Y, Wang H, Zhou Y, Gao L, et al. Lumican is elevated in the lung in human and experimental acute respiratory distress syndrome and promotes early fibrotic responses to lung injury. JTranslMed. 2022; 20(1): 392.
Shao B, Lu M, Katz SC, Varley AW, Hardwick J, Rogers TE, et al. A host lipase detoxifies bacterial lipopolysaccharides in the liver and spleen. J Biol Chem. 2007; 282(18): P. 13726-13735. DOI: 10.1074/jbc. M609462200
Hiraoka E, Nonami T, Kurokawa T, Kobayashi H, Takagi H. The role of the spleen in endotoxin-induced liver injury. Liver. 1995; 15(1): 35-38. DOI: 10.1111/j.1600-0676.1995.tb00104.x
Quinton LJ, Walkey AJ, Mizgerd JP. Integrative physiology of pneumonia. Physiol Rev. 2018; 98(3): 1417-1464. DOI: 10.1152/phys- rev.00032.2017
Fonseca MT, Moretti EH, Marques LMM, Machado BF, Brito CF, Guedes JT, et al. A leukotriene-dependent spleen-liver axis drives TNF production in systemic inflammation. Sci Signal. 2021; 14(679): eabb0969. DOI: 10.1126/scisignal.abb0969
Soeiro VC, Melo KR, Alves MG, Medeiros MJ, Grilo ML, Almeida- Lima J, et al. Dextran: influence of molecular weight in antioxidant properties and immunomodulatory potential. Int J Mol Sci. 2016; 17(8): 1340. DOI: 10.3390/ijms17081340
Сведения об авторах:
Ким Л.Б., д.м.н., главный научный сотрудник, руководитель группы биохимии соединительной ткани ФГБНУ ФИЦ ФТМ, г. Новосибирск, Россия.
Теги: острое повреждение легких
234567 Начало активности (дата): 08.07.2024 18:34:00
234567 Кем создан (ID): 989
234567 Ключевые слова: окисленный декстран 40 кДа (ОД-40); липополисахарид; острое повреждение легких (ОПЛ); гипоксия-индуцибельный фак- тор-1а; гиалуронансинтаза 2; гликозаминогликаны; коллагены; матрикс- ные металлопротеиназы/тканевые ингибиторы металлопротеиназ
12354567899
Похожие статьи
Клинико -психологические особенности сочетанной травмы участников военных действийОперационная политравма-стартовая позиция для удлинения конечночтей и регуляция роста
Рентген на дому 8 495 22 555 6 8
Клиническая и эпидемиологическая аспекты комбинированных травм
Тяжелая черепно-мозговая травма плода при автомобильной аварии: обзор литературы и клиническое наблюдение



