 25.06.2024
25.06.2024
Результаты лечения пациентов с массивными костными дефектами вертлужной впадины
Дефицит костной основы не позволяет в достаточной степени достичь корректной установки компонентов и первичной стабильной фиксации
По данным Danish Hip Arthroplasty Register, основными причинами в случае впервые выполняемого ревизионного эндопротезирования тазобедренного сустава являются асептическое расшатывание, вывих эндопротеза, инфекция и перипротезный перелом [1]. При последующих вмешательствах доля перипротезной инфекции в структуре причин ре-ревизий увеличивается в 2 раза и становится одной из основных проблем, с которой необходимо справиться хирургу. Кроме этого, еще одной серьезной задачей является замещение костных дефектов в области вертлужной впадины. Как правило, в результате многочисленных оперативных вмешательств в анамнезе образуются массивные костные дефекты.
По данным литературы, к причинам образования дефицита костной массы относят также остеолиз, стресс-шилдинг, механическое расшатывание ацетабулярного компонента [2].
Дефицит костной основы не позволяет в достаточной степени достичь корректной установки компонентов и первичной стабильной фиксации.
Согласно широко известной классификации костных дефектов вертлужной впадины Paprovsky, наиболее сложными случаями являются типы дефектов ША, IIIB, в том числе с разобщением тазового кольца [3].
В качестве вариантов замещения используют jumbo cup, структурные аллотрансплантаты, антипротрузи- онные кейджи (antiprotrusio cages), аугменты и кейджи, индивидуальные импланты [2, 4]. Одним из возможных осложнений при использовании jumbo cup является импинджмент-синдром с сухожилием подвздошно-поясничной мышцы. Применение структурных аллотрансплантатов позволяет установить ацетабулярный компонент в истинное положение, но существует высокая вероятность развития остеолиза в послеоперационном периоде [5]. По данным литературы, применение антипротрузион- ных кейджей связано с высоким риском неудач, например, в случае отсутствия передней и задней колонн повышается нагрузка на конструкцию, что может привести к ее раннему расшатыванию [6]. Аугменты и кейджи имеют ограничение в применении при наличии разобщения таза, также есть риск поломки фланцев [7].
Использование аугментов сопряжено с необходимостью обработки костного ложа согласно их геометрии, что приводит к еще более выраженной потере костной ткани [8]. При проектировании индивидуального импланта учитывается геометрия дефекта, однако полученная конструкция может иметь сложную и массивную форму, что затрудняет ее позиционирование во время операции [8]. Кроме того, не исключается необходимость выполнения дополнительных опилов кости для установки импланта. Также имеет место быть и период ожидания изготовления индивидуальной конструкции.
Первая операция с установкой индивидуального импланта в нашей стране была проведена в 2015 году, но активное применение данной конструкции в хирургической практике началось несколькими годами позже. В настоящее время в качестве основных вариантов замещения обширных костных дефектов вертлужной впадины используются аугменты и индивидуальные импланты.
Цель исследования — оценить результаты лечения пациентов с обширными костными дефектами вертлужной впадины, замещенными индивидуальными имплантами или аугментами.
МАТЕРИАЛ И МЕТОДЫ
Одноцентровое ретроспективное нерандомизированное сравнительное исследование проведено с ноября 2019 года по май 2023 года на базе Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России. Исследование одобрено локальным этическим комитетом (протокол № 1 от 21.01.2022 г.) и соответствует этическим принципам Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинский исследований с участием человека» с поправками 2013 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
В исследование вошли 82 пациента с костными дефектами вертлужной впадины, соответствующие типам IIIA и IIIB по классификации Paprovsky, которым выполнялись операции по ревизионному эндопротезированию тазобедренного сустава. В 1-ю группу были включены 39 человек (23 (58,9 %) женщины и 16 (41,1 %) мужчин) с индивидуальным имплантом, во 2-ю — 43 пациента с аугментами (23 (53,5 %) женщины и 20 (46,5 %) мужчин).
Критерии включения:
- возраст пациентов от 18 до 85 лет;
- дефекты вертлужной впадины IIIA и IIIB, в том числе с разобщением тазового кольца согласно классификации Paprovsky;
- индекс массы тела (ИМТ) < 40;
- комплаентные пациенты, доступные для наблюдения и контроля. Критерии невключения:
- пациенты с ревматоидным артритом;
- пациенты с системными заболеваниями соединительной ткани;
- пациенты с инфекционно-воспалительным процессом;
- пациенты с хроническими патологиями в стадии декомпенсации;
- ИМТ более 40;
- некомплаентные пациенты;
- пациенты, не желающие подписать добровольное информированное согласие.
Критерии исключения:
- ре-ревизии по поводу инфекционного осложнения;
- наличие фактора, препятствующего оценке результатов ревизионного эндопротезирования.
Для визуализации костного дефекта в предоперационном периоде пациентам выполняли компьютерную томографию (КТ-исследова- ние) и обзорную рентгенограмму таза, которая также проводилась и после оперативного вмешательства.
Пациенты были опрошены до операции и повторно на сроке 2,5 года (медиана периода наблюдения для всей выборки) с применением шкал Harris Hip Score (HHS), Hip Disability Osteoarthritis Outcome Score (HOOS) и визуально-аналоговой шкалы боли (ВАШ).
Для определения тяжести состояния пациента с учетом имеющихся у него сопутствующих заболеваний использовали классификацию Американского общества анестезиологов (American Society of Anesthesiologists — ASA) [9].
Статистическая обработка данных осуществлялась с помощью программы Statistica v.13.3 (TIBCO Software Inc.). Данные на нормальность проверяли с помощью критерия Шапиро-Уилка и Q-Q plots. В зависимости от распределения количественные данные представлены в виде M ± Sd (M — среднее значения, Sd — стандартное отклонение) или Me [МКИ] (Me — медиана, МКИ — межквартильный интервал). Качественные данные представлены в виде P (P — процентная доля).
Для выявления статистически значимых различий нормально распределенных данных использовали t-критерий в модификации Уэлча для независимых выборок. Критерий Манна— Уитни применялся при сравнении двух независимых групп с данными, отличными от нормального распределения. Сравнения зависимых переменных при отсутствии нормального распределения проводились с помощью теста Вилкоксона. При частотном анализе таблиц сопряженности использовали хи-квадрат Пирсона, критерий Йейтса. Оценка выживаемости проводилась с помощью метода Каплан-Майера. Статистически значимыми считали различия при p < 0,05.
РЕЗУЛЬТАТЫ
Исследуемые группы были сопоставимы по полу и возрасту (табл. 1).
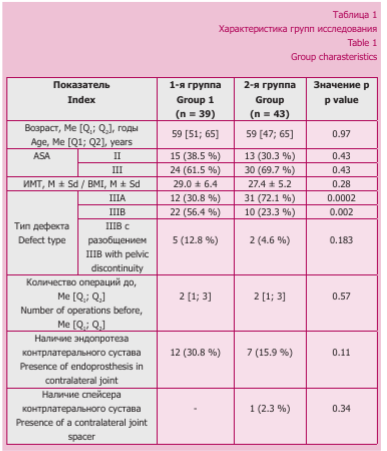
По данным КТ-исследования у пациентов, которым устанавливали индивидуальный имплант, в два раза чаще, чем во 2-й группе, выявлен дефект IIIB (22 человека (56,41 %)) (рис. 1). Применение аугментов преимущественно зафиксировано при замещении IIIA дефектов — у 31 (72,1 %) пациента (рис. 2).
Согласно классификации ASA, в исследуемой выборке встречалось 2 типа тяжести состояния пациентов: II (легкие системные заболевания) и III (тяжелые системные заболевания).
В 1-й группе у двух пациентов с контрлатеральной стороны ранее также был установлен индивидуальный имплант, и еще трое человек перенесли операции с установкой аугментов, во 2-й группе при операциях на другом тазобедренном суставе не было дефектов, которые бы требовали дополнительную металлоконструкцию для их замещения.
В обеих группах количество предшествующих операций варьировалось от 1 до 6. Наиболее часто встречающимися диагнозами в выборке стали расшатывание спей- сера и расшатывание эндопротеза (рис. 3 и 4).
У пациентов с диагнозом расшатывание спейсера тазобедренного сустава чаще всего был установлен артикулирующий спейсер (у 8 человек (20,5 %) из 1-й группы и 23 (53,5 %) — из 2-й), установка блоковидного спейсера предшествовала в 4 (10,2 %) случаях в когорте с индивидуальными имплантами и в 1 (2,3 %) — с аугментами, доли монополярного спейсера Tecres составили 1 (2,5 %) и 3 (7 %) человека соответственно, также у 1 (2,5 %) пациента с персонифицированным компонентом ранее был установлен биполярный спейсер.
Продолжительность операции в обеих группах была сопоставима и составила 125 [110; 160] мин у пациентов с индивидуальными имплантами и 117 [90; 145] мин — с аугментами (р = 0,05). Были выявлены статистически значимые различия по показателям кровопотери: наибольший объем зафиксирован в 1-й группе (550 [400;1000] мл) по сравнению со 2-й (350 [300; 425] мл) (p = 0,001).
Для замещения дефекта вертлужной впадины во 2-й группе применялись аугменты разного типа, в том числе и сочетание нескольких вариантов. Треть случаев составили клиновидные аугменты (wedge) — 12 (27,9 %), dome - 9 (20,9 %), flying buttrres — 8 (18,6 %), columns — 4 (9,3 %), flying buttrres + footing — 2 (4,6 %), и зафиксировано по 1 (2,3 %) использованию footing + wedge и flying buttrres + columns. Более чем в половине (29 (67,4 %)) случаев требовался только 1 аугмент для восполнения дефицита костной массы, у 9 (20,9 %) пациентов установлено 2 аугмента и 3 — у 5 (11,6 %). Выполнение костной пластики чаще осуществлялось при заполнении дефектов с помощью аугментов (14 (32,6 %) и 5 (12,8 %) соответственно). Применение аутотрансплантата было более распространено во 2-й группе.
Для снижения риска возникновения вывихов у пациентов с индивидуальными имплантами чаще применялись двойная мобильность (в 18 (46,1 %) случаях) и constrained система (12 (30,8 %)), в группе с аугментами данные компоненты использовались в меньшей степени и наибольшую долю (28 (65,1 %) случаев) составила стандартная 36 головка (табл. 2). При установке constrained системы в равной мере использовались головки размеров 28 и 32.
Более чем в половине случаев в каждой группе (26 (66,6 %) и 33 (76,7 %) соответственно) помимо ацетабулярного компонента производилась замена ножки эндопротеза.
Независимо от способа замещения дефектов вертлужной впадины наиболее часто использовались ножки Alloclassic SLL revision (13 (50,0 %) и 18 (54,5 %) соответственно) и Wagner Revision (10 (38,5 %) и 11 (33,3 %) соответственно).
В 1-й группе зафиксировано только 1 интраоперационное осложнение в виде перелома большого вертела при экстракции бедренного компонента. В послеоперационном периоде среди пациентов с индивидуальными имплантами были выявлены следующие осложнения: 2 (5,1 %) расшатывания персонифицированной конструкции, 1 (2,6 %) вывих головки эндопротеза, 1 (2,6 %) рецидив перипротезной инфекции.
В первых двух случаях один пациент перенес повторную операцию с установкой нового индивидуального импланта, другому костные дефекты были замещены аугментами. Для решения проблемы повторных вывихов предпринималось несколько попыток открытого вправления и рекомендация выполнения ревизионного эндопротезирования с изготовлением нового индивидуального импланта. Пациент с повторным нагноением в настоящее время ожидает госпитализацию на удаление эндопротеза и установку спейсера. У 6 пациентов с аугментами возникли осложнения, которые потребовали проведения повторной операции: 5 (11,6 %) случаев рецидива перипротезной инфекции и 1 (2,4 %) — расшатывание чашки.
В последующем двоим пациентам повторно был установлен спейсер и одному выполнена остеонекрэктомия, остальные готовятся к повторной госпитализации в отделение гнойной хирургии. Пациенту с расшатыванием чашки был установлен индивидуальный имплант с constrained системой. На рисунке 5 представлен график выживаемости металлоконструкций в исследуемых группах.
Доля пациентов, которым потребовалось повторное вмешательство, в 1-й группе составила 12,8 %, во второй — 13,9 %, таким образом процент выживаемости в группах был сопоставим: 87,2 и 86,1; p = 0,88.
Оценить результаты с помощью шкал опросников в послеоперационном периоде удалось у 31 пациента с индивидуальными имплантами и у 26 с аугментами на сроках 737 [408; 1041] и 1017 [838; 1303] дней соответственно (р = 0,04). В обеих группах при сравнении показателей до и после оперативного лечения были выявлены статистически значимые улучшения (табл. 3).
Результаты опроса после операции были сопоставимы. В обеих группах баллы после операции интерпретировались на невысоком уровне: по HSS как «неудовлетворительные», по HOOS как «удовлетворительные». Однако стоит отметить, что болевой синдром по ВАШ был незначительным. Несмотря на преобладание в обеих группах доли пациентов, использующих средства дополнительной опоры (19 (61,3 %) и 17 (65,4 %) человек соответственно, p = 0,74), существенное число лиц передвигается самостоятельно (12 (38,7 %) и 9 (34,6 %) человек соответственно, р = 0,78). Чаще всего в качестве дополнительной опоры пациенты как с индивидуальными имплантами, так и с аугментами используют трость (10 (32,3 %) и 11 (42,3 %) человек соответственно, p = 0,43).
Во 2-й группе зафиксирован больший процент лиц, которым для передвижения требуются ходунки (4 (15,8 %) и 2 (6,5 %) человека соответственно, p = 0,27).
ОБСУЖДЕНИЕ
За период с 2018 по 2023 год, согласно данным PubMed, только небольшое количество исследований посвящено замещению дефектов вертлужной впадины аугментами, в большинстве работ приводятся результаты использования индивидуальных имплантов. Возможно, в последнее время индивидуальные импланты применяются чаще в случаях значительной потери костной ткани.
По данным мета-анализа D. Broekhius и соавт. [11] осложнения после реконструкции обширных ацетабулярных дефектов (ША, ШВ Paprosky, III-IV AAOS) при помощи индивидуальных трехфланцевых имплантов составили 24 %.
Наиболее распространенными видами осложнений оказались вывих головки эндопротеза и глубокая перипротезная инфекция. Согласно нашим наблюдениям, процент осложнений в группе индивидуальных имплантов был ниже — 10,3 %, наиболее частой проблемой стало асептическое расшатывание (5,1 %).
Кроме этого, в данном анализе приводится связь осложнений с «поколением» индивидуальных имплантов (3D-прототипирование, наличие направителей для сверления и интраоперационного макета или техника «заливки» и преимущественно машинная обработка). Все представленные нами случаи использования индивидуальных имплантов соответствовали критериям «нового поколения», что может объяснить низкий процент осложнений. В этой же работе зафиксирован существенный прирост баллов по функциональной оценке у пациентов по шкале Harris, наиболее высокие показатели выявлены среди пациентов с индивидуальными имплантами, покрытыми гидроксиапатитом.
При среднем сроке наблюдений 57 мес. выживаемость имплантов составила 82,7 %. Более высокий показатель выживаемости (90,4 %), представленный нами, можно объяснить меньшим сроком наблюдения (медиана — 30 мес.).
Стандартные аугменты обладают характеристиками, которые способствуют процессу остеоинтеграции, весьма широкая линейка типо-раз- меров позволяет замещать в том числе и массивные костные дефекты, при этом обеспечивая достаточную фиксацию вертлужного компонента эндопротеза [10]. J. Lochel и соавт. [12] представили результаты 10-летнего наблюдения 62 случаев с использованием TM чашки и аугментов. Структура дефектов, соответствующих классификации Paprovsky, в описываемом исследовании: IIIA - 41,5 %, IIB - 24,5 %, IIIB — 17 %, при этом 9,4 % имели разобщение вертлужной впадины, IIC — 11,3 % IIA — 5,2 %. Выживаемость ацетабулярной конструкции составила 92,5 %.
Среди осложнений преобладала доля асептического расшатывания — 5,6 %, глубокая перипротезная инфекция составила 1,9 %. Функциональный результат по шкале Харриса статистически значимо увеличился в послеоперационном периоде по сравнению с показателями до операции. В данном случае, на наш взгляд, именно структура дефектов играет роль в принципиальной оценке функциональных результатов и выживаемости: в нашей работе представлены результаты наблюдений исключительно пациентов IIIA и IIIB по Paprosky в обеих группах, при этом в группе с индивидуальными имплантами преобладали IIIB дефекты (56,6 %).
В нашей практике за указанный период индивидуальные импланты устанавливались пациентам с дефектами IIA (7 человек), IIB (2 человека) и IIC (4 человека). Данной конструкции было отдано предпочтение по причине выраженного локального остеопороза в области седалищной и подвздошной костей.
В заключение следует отметить, что в последнее время появились работы, описывающие хорошие и отличные результаты при совместном использовании индивидуальных ацетабулярных конструкций в виде гемисферы и фланцев и индивидуальных аугментов [10, 13]. Данный подход перенимает лучшее от обеих конструкций, так как позволяет сохранить точное позиционирование винтов, относительную
простоту позиционирования гемисферы, в том числе с фланцами, и надежность использования металла по сравнению с костным трансплантатом в условиях обширных костных дефектов.
ЗАКЛЮЧЕНИЕ
Несмотря на невысокую функциональную оценку по шкалам Harris и HOOS, пациенты с индивидуальными имплантами и аугментами имеют значимый прирост показателей при сравнении результатов до и после операции и снижение уровня болевого синдрома, в том числе сопоставимый по группам. Стоит учитывать, что на данные результаты не могли не повлиять такие факторы, как обширные костные
дефекты вертлужной впадины и длительный ортопедический анамнез. При дефектах IIIB, особенно при разобщении таза, предпочтение отдавалось индивидуальной конструкции для их замещения.
ЛИТЕРАТУРА
The Danish Hip Arthroplasty Register (DHR), 2021 National Annual Report.
Ciriviri J, Nestrovski Z, Talevski D, Vranishokovski T, Kostov H. Treatment of acetabular defects with porous metal augments in revision hip surgery. Pril (Makedon Akad Nauk Umet Odd Med Nauki). 2019; 40(2): 33-39.
Alqwbani M, Wang Z, Wang Q, Li Q, Yang Z, Kang P. Porous tantalum shell and augment for acetabular defect reconstruction in revision total hip arthroplasty: a mid-term follow-up study. Int Orthop. 2022; 46(7): 1515-1520.
Karpukhin AS, Tikhilov RM, Tsybin AV. The use of structural allografts in revision surgery with massive acetabular defects. Modern problems of science and education. 2018; (1): 64. Russian (Карпухин А.С., Тихилов Р.М., Цыбин А.В. Применение структурных трансплантатов при проведении ревизионного эндопротезирования в условиях значительного ацетабулярного остеолиза //Современные проблемы науки и образования. 2018. № 1. С. 64.)
Roessler PP, Jaenisch M, Kuhlmann M, Wacker M., Wagenhauser PJ, Gravius S, et al. The augment-and-modular-cage revision system for reconstruction of severe acetabular defects - two-year clinical and radiographic results. Int Orthop. 2019; 43(10): 2269-2278. DOI: 10.1007/s00264-018-4271-6
Kovalenko AN, Dzhavadov AA, Shubnykov II, Bilyk SS, Denisov AO, Cherkasov MA, et al. Mid-term outcomes of using custom-made implants for revision hip arthroplasty. Traumatology and orthopedics of Russia. 2019; 25(3): 37-46. Russian (Коваленко А.Н., Джавадов А.А., Шубняков И.И., Билык С.С., Денисов А.О., Черкасов М.А. и др. Среднесрочные результаты использования индивидуальных конструкций при ревизионном эндопротезировании тазобедренного сустава //Травматология и ортопедия России. 2019. Т. 25, № 3. С. 37-46.) DOI: 10.21823/2311-2905-2019-25-3-37-46
Owens WD, Felts JA, Spitznagel EL. ASA physical status classifications a study of consistency of ratings. Anesthesiology. 1978; 49(4): 239-243. DOI: 10.1097/00000542-197810000-00003
Broekhuis D, Tordoir R, Vallinga Z, Schoones J, Pijls B, Nellissen R. Custom triflange acetabular components for large acetabular defect reconstruction in revision total hip arthroplasty: a systematic review and meta-analysis on 1218 patients. EFORT Open Rev. 2023; 8(7): 522-531. DOI: 10.1530/EOR-22-0081
Lochel J, Janz V, Hipfl C, Perka C, Wassilew GI. Reconstruction of acetabular defects with porous tantalum shells and augments in revision total hip arthroplasty at ten-year follow-up. Bone Joint J. 2019; 101-B(3): 311-316.
Сведения об авторах:
Ковалдов К.А., врач-травматолог-ортопед отделения травматологии и ортопедии № 1 Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород, Россия.
Морозова Е.А., лаборант-исследователь научно-клинического отдела Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород, Россия
Герасимов Е.А., врач-травматолог-ортопед отделения травматологии и ортопедии № 1 Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород, Россия.
Герасимов С.А., к.м.н., заведующий отделением травматологии и ортопедии № 1, врач-травматолог-ортопед Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород, Россия.
Подолян Д.И., клинический ординатор Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород, Россия.
Теги: тазобедренный сустав
234567 Начало активности (дата): 25.06.2024 16:08:00
234567 Кем создан (ID): 989
234567 Ключевые слова: ревизионное эндопротезирование; тазобедренный сустав; костные дефекты вертлужной впадины; индивидуальные импланты; аугменты; классификация Paprovsky
12354567899
Похожие статьи
Эволюция эндопротезирования первого плюснефалангового суставаРентген на дому 8 495 22 555 6 8
Возможности лечения методом радиочастотной денервации при коксартрозе различных стадий
Реконструкция тазобедренного сустава у молодых пациентов с диспластическим коксартрозом
Оценка травматичности хирургических доступов при выполнении тройной остеотомии таза у детей с диспластической нестабильностью тазобедренного сустава



