 10.06.2024
10.06.2024
Импакционная костная пластика как метод выбора в замещении дефектов вертлужной впадины при ревизионном эндопротезировании тазобедренного сустава: серия клинических случаев
Реконструкция вертлужной впадины при ревизионном эндопротезировании является непростой задачей в условиях массивных костных дефектов.
ВВЕДЕНИЕ
Реконструкция вертлужной впадины при ревизионном или первично-сложном эндопротезировании является непростой задачей в условиях массивных костных дефектов. Эта проблема особенно актуальна у молодых пациентов, когда важно восстановить центр вращения бедра, добиться стабильной фиксации имплантата, восстановить анатомию вертлужной впадины и костный массив тазовой кости. К настоящему моменту известны различные способы восполнения костных дефектов в виде использования реконструктивных кейджей [1], структурных трансплантатов [2], применения модульных систем аугментации [3], получивших развитие в последние годы аддитивных технологий [4] и импакционной костной пластики (ИКП) [5]. Локализация, геометрическая форма, размер и распространённость костного дефекта, как правило, определяют выбор способа реконструкции [6, 7]. Каждый из перечисленных методов отличается определенными достоинствами и преимуществами, однако иногда возникающие ограничения позволяют использовать только единственно возможный метод эффективной артропластики. В конкретной ситуации этим методом может быть достаточно универсальная технология ИКП, основным преимуществом которой является способность восстанавливать собственный массив тазовой кости, создавая, тем самым, предпосылки для успеха последующих неизбежных ревизий [8].
Цель работы — демонстрация возможностей технологии импакционной костной пластики X-Change при замещении дефектов вертлужной впадины в качестве метода выбора при ревизионном эндопротезировании тазобедренного сустава.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ клинических данных применения ИКП по оригинальной технологии X-Change с использованием специализированного инструментария в случаях первично-сложного и ревизионного эндопротезирования тазобедренного сустава с замещением костных дефектов области вертлужной впадины.
С 2015 по 2022 гг. в Федеральном центре травматологии, ортопедии и эндопротезирования (ФЦТОЭ, Барнаул) выполнено 87 операций у 83 пациентов на тазобедренных суставах с использованием ИКП по технологии X-Change в качестве основной техники. Из них в 10 случаях технологию применяли при первично-сложном протезировании (3 операции на бедренном сегменте, 7 — на вертлужной впадине).
В 77 операциях ревизионного эндопротезирования ИКП применяли в 36 случаях на вертлужном компоненте, в 29 случаях на бедренном компоненте и в 12 случаях одновременно на тазовом и бедренном сегменте. В некоторых случаях тазовой реконструкции ИКП на момент оперативного вмешательства оказалась единственным доступным методом, позволившим выполнить качественную реконструкцию вертлужной впадины. Три клинических случая вошли в данную серию, полностью отразив философию ИКП.
Показанием для применения ИКП на тазовом сегменте были массивные ограниченные и комбинированные дефекты вертлужной впадины:
в одном случае был массивный дефект ЗB по Paprosky, тип III по классификации AAOS сложной геометрии, обусловленной вторичной деформацией в результате механической выработки при расшатывании тазового компонента эндопротеза;
во втором случае — 2B дефект по Paprosky с минимальным костным запасом на фоне дисплазии и предшествующего неудачного первичного эндопротезирования;
в третьем случае — массивный ятрогенный дефект III типа по классификации AAOS после удаления тазового компонента во время лечения перипротезной инфекции, имеющей свои показания для установки спейсера и последующего его удаления.
На момент проведения оперативного лечения инфекция во всех случаях исключена на основании цитологического, микроскопического и бактериологического предоперационного исследования аспирата синовиальной жидкости из сустава, что также подтверждено результатами бактериологического исследования взятых во время операции биоптатов и удаленных компонентов эндопротеза.
В качестве костно-пластического материала (КПМ) использованы костные чипсы, изготовленные из аллокости, прошедшей термическую дезинфекцию по Марбургской системе костного банка. Для тазовой костной пластики чипсы изготавливали вручную размером около 10 мм3 с помощью кусачек Люера. Уплотнение КПМ производили с помощью профилирующих импакторов для вертлужной впадины из специализированного инструментария X-Change (Stryker). Во всех трех случаях в сочетании с ИКП использованы дополнительные конструкции: в виде реконструктивных сеток — в двух случаях и танталовый аугмент — в одном.
Клинический случай 1
Пациентка Б., 38 лет, поступила в ФЦТОЭ с жалобами на боли в области правого тазобедренного сустава, выраженное ограничение движений в нём, укорочение правой нижней конечности, хромоту. Из анамнеза выяснено, что в возрасте 26 лет перенесла гематогенный остеомиелит головки правой бедренной кости. По этому поводу проведена хирургическая санация, установлена промывная система дренирования правого тазобедренного сустава, сформировавшиеся свищи области правого тазобедренного сустава закрылись в течение года. Через год после санации очага инфекции в связи с прогрессированием болевого синдрома и нарушением опорной функции конечности проведено эндопротезирование правого тазобедренного сустава антигибридным эндопротезом DePuy Corail/Triloc. Заживление после эндопротезирования прошло без осложнений. Однако через 7 лет после операции артропластики пациентка стала отмечать периодическое появление болей, которые постепенно прогрессировали, появилось ограничение движений, хромота. При обследовании выявлены признаки расшатывания тазового компонента эндопротеза, с чем и направлена на ревизионное эндопротезирование в ФЦТОЭ. На момент обращения ходит самостоятельно, хромает на правую ногу. Конфигурация сустава визуально не изменена, послеоперационный рубец области правого тазобедренного сустава без признаков воспаления, при пальпации болезненности в области сустава нет. Умеренная гипотрофия мышц тазового пояса и бедра справа.
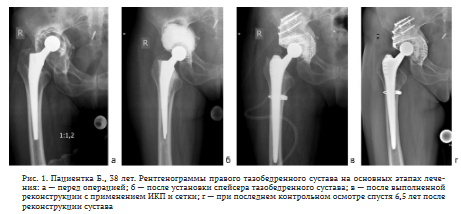
Относительное укорочение правой нижней конечности на 3 см. Объем активных движений: сгибание до 80°, отведение 10°, ротационные движения 5-0-5°, приведение 10°. При движениях испытывает умеренную боль. Функциональная оценка по шкале Харриса составила 55 баллов. По рентгенограммам определено расшатывание тазового компонента эндопротеза, дефект вертлужной впадины IIIB по W.G. Paprosky, признаки перипротезного остеолиза в проксимальном отделе бедренной кости в 1 и 7 зоне Груэна (рис. 1, а). По результатам цитологического и бактериологического исследования синовиальной жидкости данных за инфекционный процесс в суставе не получено.
Однако с учетом тяжелого инфекционного анамнеза и предстоящего объема реконструкции принято решение о двухэтапном реэндопротезировании через спейсирование сустава и уточнение данных повторного микробиологического исследования интраоперационных биоптатов.
После проведения первого этапа ревизионного эндопротезирования с установкой артикулирующего спейсера и получения отрицательных результатов бактериологического исследования принято решение о проведении второго этапа реэндопротезирования (рис. 1, б). При планировании оперативного вмешательства на суставе учтено, что использование пористых аугментов для реконструкции потребовало бы дополнительной адаптации костного ложа и привело бы к еще большему увеличению костного дефицита.
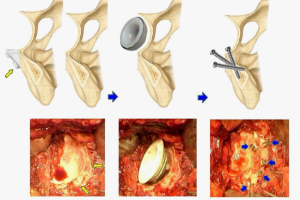
Для заполнения дефекта понадобилось бы несколько аугментов, а замещение такого массива металлом с учетом молодого возраста пациентки весьма вероятную повторную ревизию в перспективе делает еще более затруднительной. Принимая во внимание в целом ограниченную форму с наличием сегментарного дефекта медиальной стенки и верхнего края вертлужной впадины, которые могут быть ограничены с помощью сетки, методом выбора в качестве окончательного этапа реконструкции определена ИКП вертлужной впадины с использованием цементируемого тазового компонента.
Произведена ИКП вертлужной впадины с помощью ревизионного инструментария Stryker X-Change. По достижении восстановления объема на цементной основе произведена имплантация впадины Zimmer ZCA 47 мм.
Бедренный канал освобожден от остатков цемента. Предварительно с учетом низкого качества кости под малым вертелом проведен канатный серкляж и имплантирован бедренный компонент Zimmer Alloclassic SLL (рис. 1, в). В послеоперационном периоде пациентка активизирована, проведен первый этап реабилитации, без осложнений выписана на 12 сут. после операции. Рекомендована дозированная нагрузка на оперированную конечность в течение 12 нед.
На момент последнего контрольного осмотра через 6,5 лет после ревизионного вмешательства жалоб не предъявляет, ходит с полной нагрузкой на ногу без дополнительных средств опоры, бытовых и социальных ограничений не испытывает. На контрольных рентгенограммах спустя 6,5 лет после операции отмечаются рентгенологические признаки перестройки костно-пластического материала области вертлужной впадины, отсутствуют линии просветления на границе костно-пластический материал — цемент, положение компонентов эндопротеза прежнее, без признаков миграции, проседания или расшатывания. Отмечена децентрация головки эндопротеза в вертлужной впадине, а также смещение центра ротации на 4 мм краниально (рис. 1, г).
Клинический случай 2
Пациентка Б., 37 лет, направлена в ФЦТОЭ для ревизионного эндопротезирования левого тазобедренного сустава. Из анамнеза известно, что в детском возрасте на обоих тазобедренных суставах выполнены реконструктивные оперативные вмешательства по поводу двухстороннего врожденного вывиха бедренных костей. В последующем в связи с развитием коксартроза выполнено эндопротезирование левого тазобедренного сустава с дополнительным использованием укрепляющей конструкции Muller Ring, однако через 10 лет после операции развивается расшатывание и миграция тазового компонента эндопротеза.
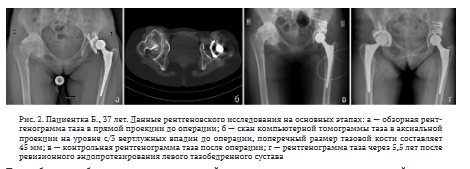
При поступлении отмечена хромота на левую ногу, область левого тазобедренного сустава деформирована, послеоперационный рубец области левого тазобедренного сустава без признаков воспаления. Умеренная гипотрофия мышц тазового пояса и бедра справа. Относительное укорочение правой нижней конечности на 2 см. Объем активных движений: сгибание до 75°, отведение 0°, ротационные движения 5-0-5°, приведение 5°. При движениях отмечена умеренная боль. Функциональная оценка по шкале Харриса составила 52 балла. При рентгенографии таза диагностирована миграция тазового компонента эндопротеза с формированием дефекта вертлужной впадины IIB типа по Paprosky (рис. 2, а). По данным компьютерной томографии также выявлено, что минимальный поперечный размер тазовой кости на уровне вертлужной впадины составляет 45 мм, чего совершенно недостаточно для установки минимальной доступной на тот момент впадины с высокопористым покрытием 44 мм в диаметре (рис. 2, б). Также отмечен дефицит костного покрытия вертлужной впадины, что, вероятно, в сумме и послужило причиной недостаточной фиксации и последующей миграции тазового компонента. Признаков расшатывания бедренного компонента не выявлено.
При выборе способа реконструкции вертлужной впадины учитывали экстремально малый размер тазовой кости в области левой вертлужной впадины, обусловленный дисплазией сустава, при котором дополнительная обработка вертлужной впадины могла привести к усугублению костного дефицита или развитию тяжелого осложнения в виде диссоциации тазовой кости, в связи с чем методом выбора решено считать ИКП с аугментацией надацетабулярного массива реконструктивной сеткой. Интраопе- рационно при попытке сформировать ложе для вертлужного компонента 44 мм подтверждены данные о дефиците костного покрытия впадины.
Пациентке проведено ревизионное эндопротезирование левого тазобедренного сустава с реконструкцией вертлужной впадины с помощью ИКП и аугментацией дефекта сеткой Stryker по технологии X-change c использованием специализированного инструментария. После наполнения костного дефекта КПМ с помощью специализированного инструментария и достижения восстановления формы вертлужной впадины на цементной основе произведена установка вкладыша размером HH под головку 32 мм от тазового компонента Zimmer Trilogy IT после его предварительной абразивной подготовки для лучшей адгезии костного цемента. На контрольных рентгенограммах после операции отмечено восстановление центра ротации, замещение области на- дацетабулярного массива костно-пластическим материалом с укреплением реконструктивной сеткой (рис. 2, в). Через 2 года пациентке выполнено эндопротезирование контралатерального сустава. Результат лечения отслежен на протяжении 5,5 лет. Рентгенологических признаков расшатывания, миграции компонентов эндопротеза или резорбции трансплантата не отмечено (рис. 2, г).
Клинический случай 3
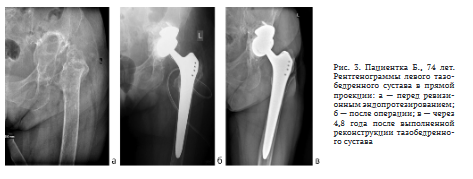
Пациентка Б., 74 лет, обратилась в ФЦТОЭ по поводу массивного ятрогенного комбинированного дефекта вертлужной впадины III типа по классификации AAOS после удаления нестабильной вертлужной впадины и бедренного компонента в одной из клиник при лечении перипротезной инфекции (рис. 3, a). На момент обращения пациентка передвигается при помощи костылей, левая нижняя конечность — неопорная. Относительное укорочение левой нижней конечности составляет 16 см за счет отсутствия проксимального эпифиза бедренной кости, дефекта вертлужной впадины и хондродиспла- зии левой голени. В области левого тазобедренного сустава отмечена рубцовая деформация мягких тканей за счет предшествующих оперативных вмешательств. Функциональная оценка по шкале Харриса составила 54 балла. При обследовании клинических и лабораторных признаков инфекционного процесса не выявлено. Поскольку на момент выполнения оперативного вмешательства в ФЦТОЭ аддитивные технологии активно не применяли, то с учетом размера костного дефекта рассматривали вариант костной пластики в сочетании с реконструктивным кейджем Бурха - Шнайдера. Однако во время операции ревизионного эндопротезирования при установке кейджа Бурха - Шнайдера его подвздошный фланец укладывался по самому краю костной опоры, а винты, таким образом, направлялись в дефект, поэтому надежно закрепить конструкцию было невозможно. Учитывая данные обстоятельства, наиболее оптимальным методом признана ИКП в сочетании с установкой аугмента из трабекулярного металла. В надацетабулярном массиве по наружному краю дефекта с помощью фрезы 60 мм сформировано ложе для аугмента. На подготовленную поверхность установлен аугмент из трабекулярного металла размером 54/20 мм и фиксирован двумя винтами 6,5 мм длиной по 30 мм каждый.
Дополнительное использование металлического аугмента позволило ограничить костный дефект и укрепить надацетабулярный массив, заместив, тем самым, часть дефекта. После заполнения оставшейся полости костными чипсами по методике X-change выполнена имплантация впадины Smith&Nephew Polarcup 47 мм с двойной мобильностью на цементной основе. Выбор впадины с двойной мобильностью обусловлен высокими рисками вывиха эндопротеза, связанными с возможными погрешностями позиционирования, скомпрометированным мышечным аппаратом на фоне неоднократных оперативных вмешательств и исходным укорочением левой нижней конечности на фоне хондродисплазии костей левой голени.
Имплантация ревизионного бедренного компонента Zimmer Alloclassic SLL произведена без особенностей. На контрольных послеоперационных рентгенограммах отмечено плотное наполнение дефекта КПМ, впадина установлена с частичной опорой на аугмент и импактированную аллокость. Также отмечена краниализация центра ротации на 1 см (рис. 3, б). Спустя 4,8 года после выполненного оперативного вмешательства видны отчетливые рентгенологические признаки перестройки КПМ, остеоинтеграции аугмента из трабекулярного металла. Признаки расшатывания компонентов эндопротеза и их миграции достоверно не определены (рис. 3, в).
РЕЗУЛЬТАТ
Отдаленные результаты отслежены в первом случае через 6,5 лет, во втором — 5,5 лет и в третьем случае — через 4,8 года. Достигнуты отличные и хорошие функциональные результаты по шкале Харриса (96, 97 и 89 баллов соответственно) с полной трудовой и социальной реабилитацией пациентов. При рентгенологическом исследовании на последнем контрольном осмотре в указанные сроки ни в одном случае не выявлено признаков расшатывания, миграции компонентов эндопротеза, аугмента или сетки. В доступном поле обзора имеются отчетливые признаки перестройки КМП, достоверных рентгенологических симптомов остеолизиса не выявлено. В первом клиническом случае отмечена децентрация головки эндопротеза, связанная с износом полиэтилена, и краниализация центра ротации на 4 мм в связи с ретракцией КПМ.
ОБСУЖДЕНИЕ
На современном этапе развития ревизионного эндопротезирования тазобедренного сустава при замещении костных дефектов интерес хирургов сместился в сторону более технологичных методов, таких как аддитивные технологии и модульные ревизионные системы из пористых металлов [3]. Большим достоинством модульных систем аугментации является их универсальность и стандартизация показаний при различных клинических ситуациях [9]. Аддитивные технологии с возможностью изготовления индивидуальных конструкций во многом закрыли вопрос замещения распространенных костных дефектов вертлужной впадины [4]. Тем не менее, при использовании данных систем также есть ограничения, связанные с необходимостью дополнительного моделирования костного ложа для аугмента, что усугубляет костный дефицит, а также лимитирование по времени, необходимому для проектирования, изготовления и имплантации индивидуальной конструкции. Замещение массивных дефектов металлом также может ограничивать возможности установки ревизионных конструкций при последующих оперативных вмешательствах. Технология ИКП в этом отношении является более универсальной. Она может быть использована в различных ситуациях ревизионного и первично-сложного эндопротезирования, таких как протрузия вертлужной впадины, асептическое расшатывание компонентов и ассоциированных с ним дефектах тазовой и бедренной кости и даже при лечении перипротезной инфекции при условии сохранности ограничивающих структур, стенки полости, которые позволяют создать давление для уплотнения костного материала [5]. Представленная серия клинических случаев, на наш взгляд, является примером ситуаций, в которых использование ИКП оказалось единственно возможным эффективным методом на момент проведения оперативного вмешательства в нашем центре.
Одной из технических проблем в эндопротезировании тазобедренного сустава при диспластическом коксартрозе является крайне малый размер вертлужной впадины, краниализация центра ротации и дефицит костного массива для надежной фиксации впадины эндопротеза, поэтому использование бесцементных вертлужных компонентов с диаметром 42-44 мм является достаточно частым [10, 11, 12]. Зачастую даже эти размеры оказываются избыточными, а при ревизионных вмешательствах на фоне дисплазии тазобедренного сустава реконструкция стандартными имплантатами малого размера также весьма затруднительна. В этой ситуации возникает вопрос об изготовлении индивидуальных имплантатов [13] или применении различных ревизионных конструкций, позволяющих перенести нагрузку на сохранившие опорность другие отделы вертлужной впадины и таза [14]. Современные системы ревизионного эндопротезирования предлагают большое количество аугментов различных форм и размеров, но в большинстве случаев линейка рассчитана на стандартные размеры анатомии. Поэтому в случае повторных операций или осложненных ситуаций, требующих реконструкции, малые анатомические размеры могут стать существенным ограничением для применения реконструктивных кейджей или металлических аугментов, как продемонстрировано в одном из клинических случаев. Использование ИКП, особенно при дефектах относительно небольших размеров, но значимых при малых размерах кости, что характерно для дисплазии, показало свою надежность и хорошие результаты [12]. Возможность аугментации дефекта с помощью металлической сетки и ИКП позволяет наполнять относительно небольшие дефекты неправильной формы без дополнительного их расширения или адаптации под КПМ [15].
При массивных дефектах сегментарного характера, особенно типа 3A по Paprosky, сочетание ИКП с реконструктивной сеткой прогностически менее благоприятно. В случаях, когда дефекты составляли более 50 % полости вертлужной впадины, отдалённые результаты показали невысокую выживаемость [16].
Ряд авторов также подчеркивает, что применение ИКП с сеткой и цементной чашкой следует рассматривать для реконструкции дефектов вертлужной впадины средних размеров, но не для массивных комбинированных дефектов [17, 18].

M. Wilson et al. из ортопедического центра клиники Exeter проанализировали 129 случаев первичного эндопротезирования вертлужной впадины с использованием ИКП для восстановления ее дефектов, которые классифицированы как полостные в 74 и сегментарные в 55 тазобедренных суставах. В среднем через 9,1 (6,2-14,3) года продемонстрирована 100 % выживаемость при полостных дефектах по сравнению с 82,6 % при сегментарных дефектах [12].
Тем не менее, комбинация ИКП с танталовыми аугментами существенно усовершенствовала данную технику для крупных неограниченных дефектов и показала достаточно перспективные результаты [19]. В работе K. Gill et al. при оценке результатов 15 ревизионных вмешательств на тазобедренных суставах у 14 пациентов, со средним сроком наблюдения 39 (25-83) мес., во всех случаях отмечены хорошие клинические результаты при отсутствии рентгенологических признаков расшатывания или миграции впадины [20].
В исследование W. Borland et al. включено 24 пациента с крупными дефектами 3A и 3B по Paprosky, которым проведена комплексная реконструкция вертлужной впадины с использованием трабекулярного металлического аугмента, ИКП и цементируемой чашки из полиэтилена высокой плотности при среднем возрасте 62 года. Медиана наблюдения составила 61 (32-81) мес. В пяти случаях отмечалась миграция полиэтиленовой чашки более 5 мм, в 1 случае произошел перелом аугмента, который потребовал повторного вмешательства через 13 мес. после ревизионной операции. Другим пациентам ревизия не потребовалась [21].
De la Torre-Escuredo et al., проведя анализ результатов применения ИКП в сочетании с реконструктивной сеткой, дополненной аугментом из пористого тантала в ревизионном эндопротезировании тазобедренного сустава у 5 пациентов молодого возраста (^ 50 лет) на момент операции с дефектами 3A и 3B по Paprosky, показали существенное улучшение по клиническим показателям при среднем периоде наблюдения 79 месяцев (60-101). При оценке рентгенологических данных не обнаружено существенных различий в угле отведения (р = 0,27) или миграции чашки (р = 0,31) между послеоперационным положением и на момент последнего контрольного осмотра. Ни у одного пациента не было линий просветления на границе кость-цемент при последнем осмотре и ни у одного пациента не было признаков расшатывания вокруг аугментов [22].
В нашем клиническом примере 3 использование данной комбинации позволило с помощью аугмента ограничить дефект, создавая дополнительную опору и условия для удержания импактированной костной массы в дефекте, что позволило заместить значительный дефект с восстановлением костного массива. Для достижения стабильности конструкции важно, чтобы аугмент плотно соприкасался с подвздошной костью при установке его в наиболее подходящее для этого положение. Для фиксации аугмента важно использовать не менее двух винтов 6,5 мм.
В данном случае аугмент действует как каркас для врастания и ремоделирования кости, обеспечивая при этом несущую структурную поддержку [19, 20, 21]. Отличные результаты, полученные в случаях применения аугментов из трабекулярного металла, подтверждаются не только остеокондуктивными свойствами этого материала, но и его остеоиндуктивными свойствами [23]. Еще одним важным преимуществом тантала является отсутствие сопутствующей резорбции, в отличие от структурных аллотрансплантатов.
Отдаленные результаты применения танталовых аугментов с бесцементной впадиной в реконструкции вертлужной впадины показывают достаточно высокую выживаемость последних [24]. Однако в случаях экстремально больших дефектов полное замещение металлическими аугментами требует качественной подготовки костного ложа, которое должно геометрически соответствовать форме аугмента [25, 26]. В условиях дефицита кости, например, при дефекте 3 типа по AAOS с сегментарно-кави- тарным дефицитом костной массы это может привести к еще большей потере кости. Замещение всего объема костного дефекта металлом также не оставляет шансов для создания костного запаса в области вертлужной впадины для успешного выполнения вероятных ревизий в будущем, особенно у молодых пациентов. В то же время использование костных чипсов при ИКП позволяет достичь плотного наполнения самых мелких дефектов и спрофилировать ложе, конгруэнтное тазовому компоненту эндопротеза. А использование имплантатов цементной фиксации позволяет дополнительно стабилизировать импактированный измельченный трансплантат самой цементной мантией и задействовать механизмы механотрансдукции, стимулирующие перестройку костно-пластического материала [27].
Достаточно надёжные решения в замещении экстремально больших костных дефектов в настоящий момент предлагают аддитивные технологии [4]. Важным отличием данных систем является замещение дефектов большим объемом металла, без дальнейших перспектив восполнения костного запаса в области вертлужной впадины. С учетом крайне высоких рисков у пациентов с применением индивидуальных конструкций среднесрочные результаты выживаемости 75-82,7 % [28, 29, 30] можно считать приемлемыми, но достаточно скромными при продолжительности жизни до 85-90 лет.
ЗАКЛЮЧЕНИЕ
Технология ИКП в представленных клинических наблюдениях продемонстрировала достаточную универсальность при замещении костных дефектов области вертлужной впадины при ревизионном и первично-сложном эндопротезировании тазобедренного сустава. Позволяя создать костный запас в области дефекта, она обеспечила более благоприятные условия для вероятных повторных ревизионных вмешательств в будущем, что является её основным преимуществом перед другими современными технологиями.
Комбинирование ИКП с металлическими аугментами из трабекулярного металла позволило создать стабильную опору для цементируемой впадины и ограничить дефект, обеспечивая благоприятные условия для реконструкции, что существенно расширяет возможности применения данной технологии при массивных сегментарных дефектах вертлужной впадины. В отдельных нестандартных случаях, обусловленных индивидуальными особенностями анатомии, дисплазией, сверхмалыми размерами вертлужной впадины в сочетании со сложной геометрией костного дефекта, ИКП использована в качестве метода выбора, позволяющего выполнить качественную реконструкцию с восстановлением анатомических взаимоотношений тазобедренного сустава, что существенно увеличивает арсенал технических возможностей ортопеда.
Gross AE, Goodman S. The current role of structural grafts and cages in revision arthroplasty of the hip. Clin Orthop RelatRes. 2004;(429):193-200. doi: 10.1097/01.blo.0000149822.49890.5e
Sporer SM, O'Rourke M, Chong P, Paprosky WG. The use of structural distal femoral allografts for acetabular reconstruction. Average ten-year follow-up. JBone Joint Surg Am. 2005;87(4):760-765. doi: 10.2106/JBJS.D.02099
Flecher X, Appy B, Parratte S, et al. Use of porous tantalum components in Paprosky two and three acetabular revision. A minimum five-year follow-up of fifty one hips. Int Orthop. 2017;41(5):911-916. doi: 10.1007/s00264-016-3312-2
Dall’Ava L, Hothi H, Di Laura A, et al. 3d Printed Acetabular Cups for Total Hip Arthroplasty: A Review Article. Metals. 2019;9(7):729. doi: 10.3390/met9070729
Mirza AH, Sadiq S. A Review and Description of Acetabular Impaction Bone Grafting: Updating the Traditional Technique. Hip Pelvis. 2021;33(4):173-180. doi: 10.5371/hp.2021.33.4.173
Garria-Cimbrelo E, Garria-Rey E. Bone defect determines acetabular revision surgery. Hip Int. 2014;24 Suppl 10:S33-S36. doi: 10.5301/hipint.5000162
Тихилов Р.М., Джавадов А.А., Коваленко А.Н. и др. Какие особенности дефекта вертлужной впадины влияют на выбор ацетабулярного компонента при ревизионном эндопротезировании тазобедренного сустава? Травматология и ортопедия России. 2020;26(2):31-49. doi: 10.21823/2311-2905-2020-26-2-31-49
Colo E, Rijnen WH, Schreurs BW. The biological approach in acetabular revision surgery: impaction bone grafting and a cemented cup. Hip Int. 2015;25(4):361-367. doi: 10.5301/hipint.5000267
Trabecular Metal Acetabular Augment and Restrictor and Augment Acetabular Assessment and Preparation. Surgical Technique. Zimmer Inc.; 2006.
Verettas DA, Chloropoulou P, Xarchas K, et al. Small diameter acetabulum and femoral head in total hip arthroplasty for developmental dysplasia of the hip, with no femoral osteotomy. Hip Int. 2015;25(3):209-214. doi: 10.5301/ hipint.5000222
Morag G, Zalzal P, Liberman B, et al. Outcome of revision hip arthroplasty in patients with a previous total hip replacement for developmental dysplasia of the hip. J Bone Joint Surg Br. 2005;87(8):1068-1072. doi: 10.1302/0301-620X.87B8.15949
Wilson MJ, Whitehouse SL, Howell JR, et al. The results of acetabular impaction grafting in 129 primary cemented total hip arthroplasties. J Arthroplasty. 2013;28(8):1394-1400. doi: 10.1016/j.arth.2012.09.019
Рукин Я.А., Лычагин А.В., Мурылев В.Ю. УЕ ФД. Ранние результаты эндопротезирования тазобедренного сустава с применением индивидуальных аугментов при диспластическом коксартрозе. Травматология и ортопедия России. 2020;26(2):50-59. doi: 10.21823/2311-2905-2020-26-2-50-59
Sirka A, Clauss M, Tarasevicius S, ET AL. Excellent long-term results of the Muller acetabular reinforcement ring in primary total hip arthroplasty: A prospective study on radiology and survival of 321 hips with a mean follow-up of 11 years. Acta Orthop. 2016;87(2):100-105. doi: 10.3109/17453674.2015.1103607
Waddell BS, Della Valle AG. Reconstruction of non-contained acetabular defects with impaction grafting, a reinforcement mesh and a cemented polyethylene acetabular component. Bone Joint J. 2017;99-B(1 Supple A):25-30. doi: 10.1302/0301-620X.99B1.BJJ-2016-0322.R1
Garria-Rey E, Madero R, Garria-Cimbrelo E. THA revisions using impaction allografting with mesh is durable for medial but not lateral acetabular defects. Clin Orthop Relat Res. 2015;473(12):3882-3891. doi: 10.1007/s11999-015-4483-7
Van Haaren EH, Heyligers IC, Alexander FG, Wuisman PI. High rate of failure of impaction grafting in large acetabular defects. J Bone Joint Surg Br. 2007;89(3):296-300. doi: 10.1302/0301-620X.89B3.18080
Buttaro MA, Comba F, Pusso R, Piccaluga F. Acetabular revision with metal mesh, impaction bone grafting, and a cemented cup. Clin Orthop Relat Res. 2008;466(10):2482-2490. doi: 10.1007/s11999-008-0442-x
Gehrke T, Bangert Y, Schwantes B, Gebauer M, Kendoff D. Acetabular revision in THA using tantalum augments combined with impaction bone grafting. Hip Int. 2013;23(4):359-365. doi: 10.5301/hipint.5000044
Gill K, Wilson MJ, Whitehouse SL, Timperley AJ. Results using Trabecular Metal™ augments in combination with acetabular impaction bone grafting in deficient acetabula. Hip Int. 2013;23(6):522-528. doi: 10.5301/hipint.5000053
Borland WS, Bhattacharya R, Holland JP, Brewster NT. Use of porous trabecular metal augments with impaction bone grafting in management of acetabular bone loss. Acta Orthop. 2012;83(4):347-352. doi: 10.3109/17453674.2012.718518
De la Torre-Escuredo B, Gomez-Garria E, Alvarez-Villar S, et al. Bone impaction grafting with trabecular metal augments in large defects in young patients: unravelling a new perspective in surgical technique. BMC Musculoskelet Disord. 2020;21(1):581. doi: 10.1186/s12891-020-03591-w
Hefni EK, Bencharit S, Kim SJ, et al. Transcriptomic profiling of tantalum metal implant osseointegration in osteopenic patients. BDJ Open. 2018;4:17042. doi: 10.1038/s41405-018-0004-6
Del Gaizo DJ, Kancherla V, Sporer SM, Paprosky WG. Tantalum augments for Paprosky IIIA defects remain stable at midterm followup. Clin OrthopRelatRes. 2012;470(2):395-401. doi: 10.1007/s11999-011-2170-x
Zhang X, Li Z, Wang W, et al. Mid-term results of revision surgery using double-trabecular metal cups alone or combined with impaction bone grafting for complex acetabular defects. J Orthop SurgRes. 2020;15(1):301. doi: 10.1186/s13018- 020-01828-x
Ansorge CH, Ohlmeier M, Ballhause TM, et al. Acetabular Reconstruction Using Multiple Porous Tantalum Augments: Three-Quarter Football Augment. Case Rep Orthop. 2022;2022:7954052. doi: 10.1155/2022/7954052
an der Donk S, Buma P, Verdonschot N, Schreurs BW. Effect of load on the early incorporation of impacted morsellized allografts. Biomaterials. 2002;23(1):297-303. doi: 10.1016/s0142-9612(01)00108-9
Gladnick BP, Fehring KA, Odum sM, et al. Midterm Survivorship After Revision Total Hip Arthroplasty With a Custom Triflange Acetabular Component. J Arthroplasty. 2018;33(2):500-504. doi: 10.1016/j.arth.2017.09.026
De Martino I, Strigelli V, Cacciola G, et al. Survivorship and Clinical Outcomes of Custom Triflange Acetabular Components in Revision Total Hip Arthroplasty: A Systematic Review. J Arthroplasty. 2019;34(10):2511-2518. doi: 10.1016/j.arth.2019.05.032
Froschen FS, Randau TM, Hischebeth GTR, et al. Mid-term results after revision total hip arthroplasty with custom-made acetabular implants in patients with Paprosky III acetabular bone loss. Arch Orthop Trauma Surg. 2020;140(2):263-273.
Информация об авторах:
Вадим Николаевич Гольник — заведующий отделением
Денис Анатольевич Джухаев — врач травматолог-ортопед
Юрий Михайлович Батрак — кандидат медицинских наук, заместитель главного врача
Виталий Викторович Павлов — доктор медицинских наук, главный научный сотрудник, начальник отделения
Теги: костная пластика
234567 Начало активности (дата): 10.06.2024 17:42:00
234567 Кем создан (ID): 989
234567 Ключевые слова: импакционная костная пластика, трабекулярные металлические аугменты, дефекты вертлужной впадины, ревизионное эндопротезирование
12354567899
Похожие статьи
Оценка эффективности вариантов артродезирования голеностопного суставаРентген на дому 8 495 22 555 6 8
Антеролатеральная связка коленного сустава как важный стабилизатор ротационной нестабильности коленного сустава
Применение преваскуляризированных костных скаффолдов in vivo (обзор литературы)
Совершенствование хирургического лечения пациентов с нестабильностью надколенника



