 08.05.2024
08.05.2024
Компьютерно-томографические признаки возможного аспергиллеза при динамическом наблюдении пациентов с COVID-19
Аспергиллёз лёгких, возникающий на фоне COVID-19, развивается как жизнеугрожающее осложнение, особенно у пациентов с тяжёлым течением заболевания и находящихся на лечении в отделениях реанимации и интенсивной терапии
ОБОСНОВАНИЕ
Данные литературы свидетельствуют, что аспергиллёз лёгких (АЛ), возникающий на фоне COVID-19 (COVID-АЛ; или COVID-associated pulmonary aspergillosis, CAPA), развивается как жизнеугрожающее осложнение, особенно у пациентов с острым респираторным дистресс-синдромом и у находящихся в отделении реанимации и интенсивной терапии [1-3].
Показатели смертности значительно различаются в опубликованных материалах с необъяснимо высоким уровнем в некоторых из них. Все работы объединяет тот факт, что в условиях отсутствия своевременной диагностики и лечения летальность может достигать 100% [4]. Частота встречаемости COVID-АЛ варьирует от 3 до 35% [5]. По мнению китайских и отечественных учёных, клинические проявления COVID-АЛ неспецифичны и скрадываются симптомами фонового заболевания [6, 7].
В 2020 году были приняты критерии COVID-AL. Экспертами стали представители Международного общества микологии человека и животных (International Sosiety for Human and Animal Mycology, ISHAM) и Европейской конфедерации медицинской микологии (European Confederation for Medical Mycology, ECMM) [8]. На основании имеющихся о заболевании данных предложено классифицировать микозы на доказанные, вероятные и возможные.
Доказанным аспергиллёз можно считать при подтверждении микоза гистопатологическим методом или на основании полимеразной цепной реакции. Учитывается также прямая микроскопия тканей с обнаружением морфологических элементов грибов, сходных с Aspergillus spp., и выделение Aspergillus spp. при посеве стерильного в норме материала от больного. Вероятный аспергиллёз устанавливается при сочетании типичных компьютерно-томографических (КТ) признаков микотического поражения лёгких, факторов риска, данных серологического исследования или обнаружения мицелия Aspergillus spp. при изучении материала бронхиоло-альвеолярного лаважа, мокроты и других нестерильных материалов от пациента. Возможный аспергиллёз характеризуется факторами риска и типичными КТ-признаками лёгочного микоза без лабораторного подтверждения диагноза [2].
Получить материал из зоны поражения не всегда возможно, а лабораторное подтверждение диагноза требует времени и специального оборудования. У любой категории больных доказанный аспергиллёз диагностируется реже чем в 10% случаев, веро ятный и возможный — в 73 и 17% соответственно [2], поэтому для выявления COVID-АЛ компьютерная томография может стать информативным инструментальным методом диагностики [9].
Цель исследования — определение КТ-при- знаков возможного присоединения аспергиллёза лёгких у пациентов с COVID-19 в процессе динамического наблюдения.
МЕТОДЫ
Дизайн исследования
Обсервационное рандомизированное контролируемое ретроспективное продольное исследование.
Проведён анализ КТ-симптомов возможного аспергиллёза у 646 пациентов с COVID-19, проходивших диагностику и лечение в клинических больницах Департамента здравоохранения Москвы в период с 2021 по 2023 год.
Критерии соответствия
Критерии включения: пациенты с верифицированным SARS-CoV-2 и динамическим КТ-контролем на протяжении не менее 2 месяцев.
Критерии исключения: КТ низкого качества, в том числе из-за двигательных артефактов.
Проведён анализ историй болезни 646 пациентов, у которых результаты мониторинга состояния составили не менее 2 месяцев. Общее количество КТ-исследований — 5279, среднее количество исследований у одного пациента — 8. Результаты обследования 144 пациентов выделены в основную группу: это были больные с нетипичными для COVID-19 рентгенологическими признаками и подозрением на наличие грибковых осложнений. К группе контроля отнесено 502 пациента с изменениями в лёгких, соответствующими только признакам поражения при COVID-19.
Этическая экспертиза
Дизайн и особенности настоящего исследования рассмотрены на заседании локального этического комитета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России 21 февраля 2022 года, протокол № 215.
Статистический анализ
Размер выборки предварительно не рассчитывался.
Использован программный пакет для статистического анализа Statistica 10.0 (StatSoft Inc., 2011, CA, США). Для определения линейных связей между показателями рассчитывали коэффициент корреляции Пирсона. Различия считались достоверными при p <0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Демографические характеристики пациентов приведены в табл. 1. Как видно из таблицы, в обеих группах, как основной (Группа 1), так и контрольной (Группа 2), преобладали пациенты пожилого и старческого возраста (в возрасте от 60 до 90 лет) — 65,96 и 56,78% соответственно, а также незначи тельно превалировали пациенты мужского пола, что соответствует данным отечественной и зарубежной литературы [10, 11].
Частота встречаемости сопутствующих заболеваний у этих пациентов приведена в табл. 2. В ряде случаев имело место сочетание нескольких заболеваний. У пациентов контрольной группы получены строго достоверные различия (порог 3о) при следующих заболеваниях: хроническая болезнь почек (20,83 и 9,16%; р <0,0001), цереброваскулярная болезнь (9,03 и 1,20%; p <0,0001) и аутоиммунные заболевания (16,67 и 4,78%; p <0,0001); также достоверно чаще (порог 2о) COVID-АЛ встречался у пациентов с эндокринными и заболеваниями желудочно-кишечного тракта.
Распределение пациентов по полу и возрасту в соответствии с международной классификацией ВоЗ, абс. (%) /

Частота встречаемости клинических проявлений в основной и контрольной группах пациентов представлена в табл. 3. При анализе данных следует отметить, что высокая температура сама по себе не является критерием отбора пациентов с подозрением на COVID-АЛ, тогда как лихорадка, рефрактерная к антибиотикотерапии, достоверно чаще определялась у пациентов с подозрением на аспергиллёз (77,78 и 47,01%; p <0,0001). У пациентов с подозрением на COVID-АЛ также чаще отмечался кашель (75,69 и 54,98%; p <0,0001). Пациенты с одышкой, находящиеся на искусственной вентиляции лёгких, чаще заболевали COVID-АЛ. Ни один из остальных изученных клинических показателей не даёт оснований для направленного поиска грибкового поражения у больных COVID-19. Особенно следует отметить, что уровни лимфоцитов и нейтрофилов в биохимическом анализе крови не различались достоверно в обеих группах пациентов.
Культуральный анализ мокроты или смыва, полученного при бронхоальвеолярном лаваже, проводился 29 (20,14%) пациентам основной группы. Результаты представлены в табл. 4. Следует отметить, что микробиологическое исследование выполнялось лишь каждому пятому пациенту, а подтверждение наличия грибкового поражения, в том числе аспергиллёза, получено в 18,76% случаев. Приходится отметить слабую настороженность лечащих врачей в отношении сочетанных с COVID-19 инфекционных патологических процессов. Несомненно, определяется высокий процент сочетанной микрофлоры.
В связи с пандемией, вызванной COVID-19, а также согласно рекомендациям Минздрава России, все КТ-исследования проводились в соответствии с соблюдением противоэпидемических требований и защиты персонала и пациентов, изложенных во Временных методических рекомендациях Министерства здравоохранения Российской Федерации [12]. Все КТ-исследования органов грудной клетки проводились без внутривенного введения контрастного препарата в соответствии со стандартными протоколами сканирования органов грудной клетки. Оценка полученных КТ-изобра- жений проводилась с использованием диагностического рабочего места врача-рентгенолога Agfa Enterprise Imaging 8.1.2 (SP5.6).
Основные результаты исследования
Описание метафорических симптомов представлено в работе А.Л. Юдина [13].
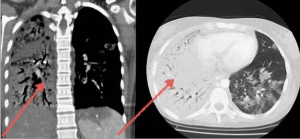
Нетипичные для COVID-19 одиночные очаги выявлены у 6 (4,2%) пациентов в сроки от 1 до 9 дней наблюдения, последующее формирование зоны консолидации отмечено у 1 (0,7%) пациента в течение 17 дней. Увеличение размеров, приводящее к образованию большого очага с чёткими и относительно ровными контурами (нодулярный аспергиллёз), отмечено у 5 (3,5%) пациентов в сроки от 5 до 16 дней с последующим формированием полости с мицетомой у 4 (2,8%) в течение 19-36 дней. У 25 (17,4%) пациентов в сроки до 1,5 недель выявлялись множественные очаги с преимущественно внутридольковым распределением, из них у 13 (9,0%) в периоды от 8 до 23 дней определялись консолидации, на фоне которых в сроки от 9 до 17 дней в 6 (4,2%) случаях сформировались полости неправильно округлой формы, а в 7 (4,9%) — типичные для инвазивного аспергиллёза полости в форме «воздушного серпа». У 10 (6,9%) пациентов в течение 5-12 дней от начала наблюдений отмечались утолщения стенок бронхов или локальные перибронховас- кулярные уплотнения по типу «перибронхиаль- ных манжет», вокруг которых в 9 (3,5%) случаях за 4-19 дней сформировались зоны консолидации. У 15 (10,4%) пациентов при анализе данных КТ исходно определялись бронхоэктазы, из них у 13 (9,0%) в сроки от 4 до 46 дней отмечено увеличение размеров или изменение формы бронхоэктазов (кистовидные или мешотчатые). Заполнение бронхоэктазов слизью и инфильтративные изменения в ткани лёгких вокруг бронхоэктазов опреде лялось у 2 (1,4%) пациентов в течение 14 и 19 дней соответственно. Наличие бронхоэктазов не является доказательным признаком аспергиллёза, однако, по нашему мнению, быстрое развитие бронхоэктазов (само по себе или на фоне сопутствующих патологических изменений в лёгких) должно в значительной степени настораживать в отношении грибкового поражения. У остальных 11 пациентов в дальнейшем обнаружено развитие признаков, характерных для аспергиллёза.
Консолидации как первичный симптом, подозрительный на COVID-АЛ, выявлены у 52 (36,1%) пациентов и определялись на 17-31-й дни от начала наблюдений. В течение 12-32 дней у 22 (15,3%) пациентов на фоне консолидаций сформировались полости, а у 24 (16,7%) — симптом «воздушный серп». Типичный для грибкового поражения симптом «гнездо» как первичная находка определялся в 9 (6,3%) случаях в сроки от 21 до 29 дней от начала наблюдений с последующей трансформацией в неправильно округлую полость у 7 (4,9%) и полость по типу «воздушного серпа» у 2 (1,4%) пациентов в течение 8-18 дней. Неправильно округлые полости с толстыми неровными стенками как первичная находка на фоне COVID-19 определялись у 27 (18,8%) пациентов через 9-29 дней от начала наблюдений, последующее формирование мицетомы отмечено в 6 (4,2%) случаях через 10-38 дней.
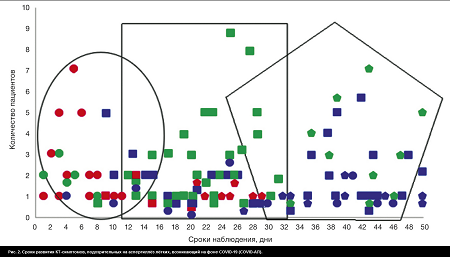
Таким образом, первичные признаки, подозрительные на COVID-АЛ, можно условно подразделить на типичные бронхогенные и условно небронхогенные (рис. 1). Из общего числа пациентов группы 1 бронхогенные симптомы (единичные и множественные внутридольковые очаги, «перибронхиальные манжеты», бронхоэктазы) отмечены у 56 (38,9%) пациентов, из которых у 43 (76,8%) выявлена их трансформация в признаки, характерные для грибкового поражения. Условно небронхогенные первичные симптомы (консолидации, симптом «гнездо», полости) определены у 88 (61,1%) пациентов. В процессе изучения динамики симптомов, подозрительных на COVID-АЛ, КТ-признаки, типичные для грибкового поражения, получены в 93 (64,6%) случаях.
Консолидации как первичный симптом заболевания и консолидации как трансформация очагов в динамике встречались в один временной интервал, что дало возможность собрать все симптомы развития COVID-АЛ в объединённую временную схему (рис. 2). Как видно, на первом этапе формируются бронхогенные симптомы (выделено овалом), которые обычно трансформируются в зоны консолидации и полостные образования (выделено прямоугольником), и далее формируются признаки, характерные для аспергиллёза (выделено пятиугольником).


ОБСУЖДЕНИЕ
Все категории аспергиллёза (доказанный, вероятный или возможный) следует считать показанием к проведению патогенетического лечения. В работе N. Lackner и соавт. [3] отмечено, что обнаружить возбудитель удаётся не более чем у 25-50% больных с инвазивным аспергиллёзом даже при целенаправленном поиске. Фактором риска развития данного осложнения считается лимфоцитопения, обусловленная как самой вирусной инфекцией, так и применением кортикостероидов и иммуносупрессоров. В нашей работе это утверждение не подтверждено. Аналогичные выводы об отсутствии выраженной лейкопении и нейтропении у данной
категории пациентов получены в работе О.Ю. Ку- цевалова и соавт. [4]. Метаанализ, представленный в работе W.H. Chong и соавт. [14], не подтвердил влияния больших доз кортикостероидов на развитие аспергиллёза у пациентов с COVID-19 в критическом состоянии.Отмечено, что наиболее частыми клиническими симптомами аспергиллёза у больных COVID-19 являются устойчивое к применению антибактериальных лекарственных средств повышение температуры тела более 38°С (90-100%) и прогрессирование дыхательной недостаточности (65-100%) [2]. Первый тезис о рефрактерной гипертермии получил подтверждение в нашей работе, однако прогрессирование дыхательной недостаточности отмечалось как в контрольной, так и основной группах пациентов, и признак оказался статистически недостоверным. В нашей работе подвергалось также сомнению утверждение о ценности таких симптомов у пациентов с аспергиллёзом, как кровохарканье и лёгочное кровотечение, выраженное в работе P. Koehler и соавт. [1].
КТ является наиболее важным инструментом визуализации поражения лёгких у пациентов с ко- ронавирусом, но многие признаки COVID-19-пнев- монии могут имитировать аспергиллёз, и, таким образом, поражения, указывающие на аспергил- лёз, могут быть скрытыми [15]. По этой причине мы не стали анализировать КТ-симптомы, встречающиеся как при COVID-19, так и при аспергиллёзе.
В работе W. Hong и соавт. [9] отмечено, что около 37% пациентов с аспергиллёзом имели типичные для COVID-19 признаки при проведении КТ, и это же исследование показало, что до 40% случаев аспергиллёза имели атипичный для COVID-19 вид на КТ-изображениях. Общие признаки, не объясняемые наличием COVID-19, включают полости, одиночные солидные узелки, консолидации без ореола «матового стекла», утолщение бронхиальной стенки и центрилобулярные узелки. Среди них преобладают полости и одиночные солидные узелки.
В работе G. Segrelles-Calvo и соавт. [16] отмечено, что инвазивный паттерн поражения дыхательных путей встречался намного чаще, чем ангиоинвазивный паттерн (57,1 и 7,1% соответственно). Возможно, это вызвано распространением колоний Aspergillus по дыхательным путям, имплантацией гриба и ростом колоний в микроскопически разрушенных или расширенных бронхах, инфицированных COVID-19, а не сосудистой инвазией и окклюзией лёгочных артерий малого и среднего размера. При гистопатологическом анализе выявлены изъязвление трахеи и инвазия поверхностных структур гифами, в то время как не найдено никаких доказательств ангиоинвазии у пациентов с инвазивным аспергиллёзным трахеобронхитом при COVID-19.
По данным работы G. Segrelles-Calvo и соавт. [16], среднее время постановки диагноза COVID-АЛ составляет от 12 до 19 дней после госпитализации. В работе W. Imoto и соавт. [17] утверждается, что очаги обнаруживают на 13-й день, а консолидации — на 20-й. Результаты нашей работы в первом приближении совпадают с этими данными, но мы, видимо, проследили более чёткую цепь событий при развитии COVID-АЛ: в течение первых двух недель с момента колонизации гриба определяются характерные признаки бронхогенного поражения, возможно, с формированием «микотического шара», третья и четвертая недели манифестируют развитием зон консолидации, нетипичных по форме для COVID-19, в том числе с симптомом «гнезда», и после этого образуются различные полостные структуры, нередко с типичными для аспергиллёза КТ-признаками.
ЛИТЕРАТУРА
2. Климко Н.Н., Шадривова О.В. Инвазивный аспергиллез при тяжелых респираторных вирусных инфекциях (гриппе и COVID-19) // Журнал инфектологии. 2021. Т. 13, № 4. С. 14-22. [Klimko NN, Shadrivova OV. Invasive aspergillosis in severe respiratory viral infections (influenza and COVID-19).
3. Jurnal infektologii. 2021;13(4):14-22. (In Russ).] EDN: IXYYEF doi: 10.22625/2072-6732-2021-13-4-14-24
4. Lackner N, Thome C, Ofner D, et al. COVID-19 associated pulmonary aspergillosis: Diagnostic performance, fungal epidemiology and antifungal susceptibility. J Fungi. 2022;8:93. doi: 10.3390/jof8020093
5. Куцевалова О.Ю., Антонец А.В., Крылов В.Б., и др. COVID-19- ассоциированные инвазивные микозы // Иммунопатология, аллергология, инфектология. 2021. № 4. С. 49-53. [Kutsevalova OU, Antonets AV, Krylov VB, et al. COVID-19 associated invasive mycoses. Immunopatologiya, allergologiya, infektologiya. 2021;(4):49-53. (In Russ).] EDN: KHWVHA doi: 10.14427/jipai.2021.4.49
6. Mitaka H, Kuno T, Takagi H, Patrawalla P. Incidence and mortality of COVID-19-associated pulmonary aspergillosis: A systematic review and meta-analysis. Mycoses. 2021; 64(9):993-1001. doi: 10.1111/myc.13292
7. Гусаров В.Г, Замятин М.Н., Камышова Д.А., и др. Инвазивный аспергиллез легких у больных COVID-19 //Журнал инфекто- логии 2021. Т. 13, № 1. С. 38-49. [Gusarov VG, Zamyatin MN, Kamyshova DA, et al. Invasive pulmonary aspergillosis in patients with COVID-19. Jurnal infektologii. 2021;13(1):38-49. (In Russ).] EDN: UEGCCK doi: 10.22625/2072-6732-2021-13-1-38-49
8. Wang J, Yang Q, Zhang P, et al. Clinical characteristics of invasive pulmonary aspergillosis in patients with COVID-19 in Zhejiang, China: A retrospective case series. Crit Care. 2020;24(1):299. doi: 10.1186/s13054-020-03046-7
9. Koehler P, Bassetti M, Chakrabarti A, et al. Defining and managing COVID-19-associated pulmonary aspergillosis: The 2020 ECMM/ISHAM consensus criteria for research and clinical guidance. Lancet Infect Dis. 2021;21(6):e149-162. doi: 10.1016/s1473-3099(20)30847-1
10. Hong W, White PL, Backx M, et al. CT findings of COVID-19- associated pulmonary aspergillosis: A systematic review and individual patient data analysis. Clin Imaging. 2022;90:11-18. doi: 10.1016/j.clinimag.2022.07.003
11. Shadrivova O, Gusev D, Vashukova M, et al. COVID-19- associated pulmonary aspergillosis in Russia. J Fungi. 2021; 7(12):1059. doi: 10.3390/jof7121059
12. Fortun J, Mateos M, Pedrosa EG, et al. Invasive pulmonary aspergillosis in patients with and without SARS-CoV-2 infection. J Fungi. 2023;9(2):130. doi: 10.3390/jof9020130
13. Временные методические рекомендации: профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 17 (14.12.2022). [Interim guidelines: Prevention, diagnosis and treatment of emerging coronavirus infection (COVID-19). Version 17 (14.12.2022). (In Russ).]
14. Юдин А.Л. Торакоабдоминальная компьютерная томография. Образы и симптомы. 2-е изд. Москва: Практика, 2023. 168 с. [Yudin AL. Thoracoabdominal computed tomography. Images and symptoms. 2nd ed.
15. Chong WH, Saha BK, Neu KP. Comparing the clinical characteristics and outcomes of COVID-19-associate pulmonary aspergillosis (CAPA): A systematic review and meta-analysis. Infection. 2022;50(1):43-56
17. Segrelles-Calvo G, Araujo GR, Pastor EL, et al. Prevalence of opportunistic invasive aspergillosis in COVID-19 patients with severe pneumonia. Mycoses. 2021;64(2):144-151. doi: 10.1111/myc.13219
ОБ АВТОРАХ
Автор, ответственный за переписку:
Юматова Елена Анатольевна, канд. мед. наук, доцент; адрес: России, 117997, Москва, ул. Островитянова, д. 1;
Соавторы:
Най Мьо Тун, аспирант;
Юдин Андрей Леонидович, д-р мед. наук, профессор;
Винокуров Антон Сергеевич, ассистент;
Теги: COVID-19
234567 Начало активности (дата): 08.05.2024 18:45:00
234567 Кем создан (ID): 989
234567 Ключевые слова: COVID-19; COVID-ассоциированный лёгочный аспергиллёз; компьютерная томография
12354567899
Похожие статьи
Рентген на дому 8 495 22 555 6 8Механизмы развития патологии опорно-двигательного аппарата после перенесённой инфекции COVID-19
Ракова сообщила о включении анализа снимков искусственным интеллектом в тариф ОМС
Течение COVID-19 у вакцинированных пациентов
Структура острых экзотоксикозов в первые три месяца пандемии COVID-19 (по данным отделения острых отравлений ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ»)
Иммунный ответ на новую коронавирусную инфекцию



