 09.03.2022
09.03.2022
Иммунный ответ на новую коронавирусную инфекцию
Настоящий краткий обзор посвящен анализу литературы о гуморальном и Т-клеточном иммунитете к новой коронавирусной инфекции
ОБОСНОВАНИЕ
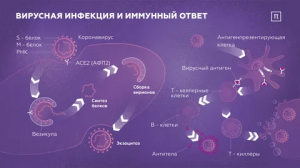
Коронавирусы являются оболочечными вирусами, геном которых представлен (+)-цепью РНК [1, 2]. Это самые большие вирусы среди всех РНК-содержащих вирусов. Семейство Coronaviridae состоит из двух подсемейств, основное из которых — Orthocoronaviridae — подразделяется на четыре рода: альфа-, бета-, гамма- и дельта-коронавирусы. Относящиеся к ним патогены могут заражать человека и других млекопитающих, птиц и амфибий. К альфа-коронавирусам относятся давно известный 229Е и открытый к 2003 г. NL63, которые заражают человека и вызывают острую респираторную вирусную инфекцию (ОРВИ) [2]. Среди бета-коронавирусов можно выделить классический ОС43 и обнаруженный в начале 2000-х годов HKU1, так же вызывающие ОРВИ. Кроме того, именно к этому роду относят появившиеся в 2002 и 2012 гг. вирусы, вызывающие острый респираторный синдром (SARS-CoV) и обнаруженный в 2012 г. их ближневосточный аналог (MERS-CoV) [1]. Эти инфекции очень похожи на коронавирусы летучих мышей и пришли в человеческую популяцию через промежуточные виды — цивет, панголин и верблюдов соответственно [3]. Все эти три вируса являются высокоопасными для людей: смертность при инфицировании ими составляет от 0,5–2% в случае SARS-CoV-2 до 30% при MERS-CoV [1] . Вызванные SARS-CoV и MERS-CoV вспышки закончились в течение нескольких месяцев, тогда как возникший в конце 2019 г. новый коронавирус очень быстро распространился в мире, вызвав пандемию: по оценкам, на конец марта 2021 г. количество инфицированных составляет почти 129 млн человек, более 2,8 млн из них погибло [4].Несмотря на крайне интенсивные поиски противовирусных препаратов прямого действия, т.е. блокирующих репликацию самого патогена, в клинической практике есть лишь несколько веществ для терапии (ремдесивир [5-7], фавипиравир [8, 9] и др. [5]), причем их эффективность до сих пор неоднозначна. Именно поэтому наиболее перспективным направлением борьбы с новой коронавирусной инфекцией является создание профилактических вакцин. На данный момент в России для клинического использования одобрены три вакцины: основанная на аденовирусных векторах Гам-КОВИД-Вак, представляющий собой инактивированные вирионы КовиВак и ЭпиВакКорона, имеющая три пептида-фрагмента белка Spike совместно с белком нуклеокапсида в качестве носителя. За пределами России используются как аналоги данных вакцин, так и мРНК вакцины, созданные компаниями Pfizer-Biontech и Moderna.
Геномная РНК нового коронавируса (SARS-CoV-2) и родственных ему вирусов состоит примерно из 30 тыс. нуклеотидов и содержит как минимум 14 отдельных и частично пересекающихся рамок считывания [10], кодирующих по крайней мере 15 белков [11]. Среди них можно выделить белки оболочки: Spike (отвечает за взаимодействие с рецептором на поверхности клеток), N (образует нуклеокапсид), мембранный (М) и поверхностный (Е) белки. Многие как структурные, так и неструктурные белки вируса являются сильными иммуногенами [12], однако в диагностике концентрируются исключительно на антителах к белкам нуклеокапсида и Spike. В случае последнего часто определяют антитела к его индивидуальным фрагментам S1 и S2, которые образуются в процессе протеолиза Spike, а также домену фрагмента S1, отвечающего за взаимодействие с рецептором (receptor binding domain, RBD). Считается, что б?льшая часть антител к RBD и фрагменту S1 является защитной (нейтрализующей), так как они блокируют связывание вируса с ангиотензинпревращающим ферментом 2 (ACE2) и проникновение вируса в клетки, тогда как антитела к белку нуклеокапсида не обладают такой функцией и потому имеют исключительно диагностическое значение (как было четко показано ранее для SARS-CoV [13]).
Настоящий краткий обзор суммирует современные представления о проценте и времени сероконверсии пациентов после болезни и иммунизации и длительности иммунного ответа на вирус и его антигены. Эта информация крайне важна для принятия решений о мониторинге иммунитета у пациентов, определения времени (ре)вакцинации и выявления групп риска.
ГУМОРАЛЬНЫЙ ИММУННЫЙ ОТВЕТ К SARS-COV И MERS-COV: НА ЧТО МЫ МОГЛИ НАДЕЯТЬСЯ
Когда SARS-COV-2 начал активно распространяться и появились первые переболевшие пациенты, тут же возник вопрос о длительности иммунитета к этой инфекции. Для ответа на него были заново систематизированы данные по исследованию иммунного ответа для родственных SARS-CoV и MERS-CoV, показавшие, что уровни антител остаются высокими по крайней мере в течение 1–2 лет [14, 15]. К концу третьего года антитела могут исчезать, по разным данным, в 44% [14, 16] и почти в 100% [17] случаев. Отсюда был сделан вывод о вероятном сохранении иммунитета людей по крайней мере в течение 2–3 лет после болезни. Однако нельзя не заметить, что большинство таких работ не включало определение титров нейтрализующих, т.е. защитных, антител.
СЕРОКОНВЕРСИЯ У ПАЦИЕНТОВ С COVID-19
Считается, что гуморальный иммунный ответ на белки SARS-CoV-2 вносит основной вклад в защиту от инфекции и выздоровление пациента. Именно поэтому в короткий срок наиболее продвинутыми направлениями в исследованиях стали создание различных тест-систем на разные типы иммуноглобулинов, изучение кинетики их появления и исчезновения, а также вклада в нейтрализацию вируса и поиск детерминант легкого/тяжелого течения.
У пациентов с COVID-19 появляются антитела к различным белкам вируса: белку Spike, его доменам S1 и S2, а также рецепторсвязывающему домену (RBD) [18], белку нуклеокапсида, Nsp8 [19], а также рамкам считывания ORF6-10 [20]. Однако большинство исследователей концентрируется на белках N и S и фрагментах последнего.
Данные о времени появления антител различных классов достаточно противоречивы. Так, сероконверсия у многих пациентов часто происходит к концу первой недели от появления симптомов [21], и в среднем к 10–12-му дню детектируются иммуноглобулины (Ig) классов M и G [22]. Другие группы оценивают время появления антител иначе: например, L. Guo и соавт. [23] наблюдали, что медианное время сероконверсии по IgG составляет 18 дней, по иммуноглобулинам других классов — всего пять. Различия в результатах могут быть связаны с разной чувствительностью использованных тест-систем и с тяжестью протекания самой инфекции. Так, имеются данные как о заметно более раннем [24], так и позднем [25] появлении IgG к антигенам вируса у пациентов в тяжелом и критическом состояниях по сравнению с пациентами с более мягким течением болезни. Кроме того, продемонстрировано, что использование высокочувствительных тест-систем позволяет детектировать антитела различных классов у части пациентов уже на 2–4-е сутки от появления симптомов болезни [26]. Считается, что оптимальной является детекция IgG к RBD (чувствительность 89–96%) [27-29] или белку нуклеокапсида (чувствительность 99%) [27], тогда как, по сообщениям ряда групп авторов, чувствительность IgM к этим антигенам может быть существенно ниже, составляя 61 и 15,6%, соответственно (напр., [27]). С одной стороны, эти данные ставят под сомнение целесообразность измерения уровней IgM и IgA при исследовании иммунитета к новой коронавирусной инфекции. С другой стороны, известно, что у единичных пациентов может появляться лишь один тип антител [29].
Диагностика многих острых вирусных инфекций основана на определении IgM и/или IgA, которые образуются заметно раньше, чем IgG, и исчезают почти сразу после выздоровления пациента. Однако в случае COVID-19 они могут появляться практически одновременно с IgG [22, 26]. Хотя их титры через месяц после проявления заболевания начинают заметно снижаться [30], антитела могут сохраняться у заметного числа пациентов в течение продолжительного времени. Например, у пациентов через 30 недель после заболевания IgM исчезали, то у 25% из них сохранялись детектируемые уровни IgA [31]. Детальный анализ A. Iyer и соавт. [32] показал, что среднее время обнаружения IgA к RBD составляет 71 день, а IgM — 49 дней. Иммуноглобулины класса А также достоверно определяются в слюне по крайней мере в течение 2,5 мес [33]. Из этого следует вывод, что человек, у которого обнаружены IgA и/или IgM, не может автоматически считаться больным и тем более заразным.
РОЛЬ АНТИТЕЛ В ПРОТЕКАНИИ COVID-19 И ЗАЩИТЕ ОТ ИНФЕКЦИИ
За последний год накоплено много данных о корреляции уровней определенных иммуноглобулинов к антигенам вируса с течением COVID-19 у пациента. Ряд авторов выявил повышенные уровни IgG к RBD у людей с тяжелым течением болезни по сравнению с болезнью средней/слабой тяжести [34, 35], хотя в других исследованиях таких различий не отмечали [36]. Сходное повышение было опубликовано и для IgA [18] . У пациентов с бессимптомной или мягкой формой COVID-19 также часто наблюдаются более высокие уровни IgG к Spike, чем к белку нуклеокапсида, и наоборот [37]. Кроме того, неблагоприятный прогноз может быть связан не только с нарушенной продукцией антител в целом, но с измененным спектром узнаваемых ими эпитопов. Например, S. Ravichandran и соавт [18] установили, что у погибших пациентов значительная часть антител к белку Spike узнавала C- и N-концевые фрагменты доменов S1 и S2, тогда как к RBD антитела не образовывались. Наконец, процесс выздоровления пациента сопровождается усилением аффинности антител к белку Spike [18, 38], из-за чего изменения титра нейтрализующих антител могут не совпадать с изменениями титра тотальных антител анализируемого класса [37].
Отдельная задача состояла в определении антител, которые являются нейтрализующими. Уже четко понятно, что защитными являются антитела, узнающие RBD, что подтверждается корреляцией титров нейтрализующих и анти-RBD иммуноглобулинов [39]. При этом остается не совсем понятным, какой из типов антител (IgG, IgM, IgA) вносит наибольший вклад в защиту от инфекции и выздоровление пациента. С одной стороны, защита пациента после болезни или вакцинации имеет место в течение долгого времени, т.е. после исчезновения IgA и IgM. С другой стороны, у реконвалесцентов, у которых обнаруживаются лишь IgG, нейтрализующие свойства сыворотки ниже [40]. Корреляция титра нейтрализующей активности плазмы крови не только с IgG, но и с IgM/IgA позволяет сделать вывод о положительном эффекте диверсификации антител на потенциально защитные свойства организма [41, 42]. Показано также, что падение титров IgM сопровождается снижением уровня нейтрализации [43]. В элегантной работе группы Wang и соавт.[44] установлено, что наиболее высокой нейтрализующей активностью обладают димеры IgA, тогда как активность IgG составляет в 7,5 раз ниже. Наконец, ряд исследователей считают сравнимыми активность IgM и IgA [45].
ДЛИТЕЛЬНОСТЬ ГУМОРАЛЬНОГО ИММУННОГО ОТВЕТА
Новая коронавирусная инфекция распространилась в Китае в январе-марте 2020 г., а в Европе и в Северной Америке — лишь с середины весны прошлого года. Соответственно, современные оценки длительности гуморального иммунного ответа ограничены сравнительно небольшим периодом наблюдения пациентов. Однако и данные за эти месяцы достаточно противоречивы: так, показано сохранение антител к белку Spike и его фрагментам в течение 6–8–10 мес с момента заболевания [31, 46-48]. В то же время титры антител к белку нуклеокапсида являются менее стойкими: они часто падают уже за несколько месяцев [49, 50].
Данные о кинетике изменения уровней защитных антител в крови достаточно противоречивы. С одной стороны, группа из Китая показала сохранение нейтрализующей активности в крови в течение 10 мес [51], а авторы из Великобритании наблюдали очень быстрое падение уровня нейтрализующих антител в плазме крови переболевших пациентов [29]. Объяснений этим различиям пока нет.
Наконец, необходимо отметить, что даже при падении уровней самих антител в крови переболевших и привитых пациентов, у них могут сохраняться В-клетки памяти, которые способны быстро вырабатывать защитные иммуноглобулины при новом контакте с патогеном. Такие клетки образуются достаточно быстро после выздоровления [52] и обнаруживаются через 6–8 мес [30].
Т-КЛЕТОЧНЫЙ ОТВЕТ
Т-клеточный иммунитет также является объектом исследования различных групп. К настоящему моменту четко показано, что у переболевших новой коронавирусной инфекцией появляются CD4+ и CD8+ Т-лимфоциты [53], активируемые структурными (Spike, M, S, ORF3a) и неструктурными (ORF7/8, Nsp7, Nsp13) белками [54, 55]. По современным данным, наиболее сильный ответ возникает к мембранному (М) белку вируса [56]. Среди вирусспецифичных клеток можно выделить Ox40+ CD137+ CD4+, CD69+ CD137+ CD8+ и цитокинпродуцирующие CD4+ Т-лимфоциты [57, 58]. Группа М. Погорелого на примере двух пациентов с легкой формой инфекции показала, что специфичные D4+ и CD8+ клоны появляются быстро после инфицирования, и после их кратковременной пролиферации у многих клонов появляется фенотип клеток памяти [53]. Примечательно, что некоторые из них были впоследствии обнаружены и у не болевших. Сходные данные были получены группой Г. Ефимова, исследовавшей репертуар рецепторов Т-клеток и показавшей наличие CD4+ и CD8+ Т-клеток, узнающих белок Spike, у пациентов, не сталкивавшихся с вирусом [59] . Возможным объяснением этому может быть узнавание данными клонами мотивов белков других, сезонных, коронавирусов. Это подтверждается данными об узнавании Т-клетками у 5,4% пациентов, переболевших SARS-CoV-2, антигенов HKU1, 229E, NL63 и OC43 вирусов [60].До сих пор не полностью понятен вклад Т-клеточного иммунитета в защиту от инфекции. Так, имеются наблюдения, что появление Т-клеток, секретирующих IFN-?, у больных коррелирует с более мягким течением COVID-19 и более быстрым исчезновением вируса у пациентов [54, 58, 61]. Показано также, что у пациентов с симптомами COVID-19 уровни CD4+ клеток, специфичных к белкам вируса, выше, чем у пациентов с асимптоматичным течением болезни [62]. Кроме того, на когорте медицинских работников продемонстрировано, что коронавирусная инфекция может протекать без сероконверсии, но с выраженным Т-клеточным ответом [61]. В пользу значительного вклада данного типа иммунитета в защиту от инфекции говорит и случай длительной (более 87 дней) виремии у пациента с иммунодефицитом, у которого был нарушен CD8+ ответ при сохранении нормального гуморального и CD4+ ответа [63]. Нарушенный CD8+ ответ характерен также для пациентов в критическом состоянии [64]. На мышиной модели коронавирусной инфекции подтверждено, что CD4+ и CD8+ ответ защищает животных от тяжелого течения инфекции, причем лимфоциты действительно способны лизировать инфицированные клетки [65, 66]. Еще одним косвенным подтверждением вклада Т-клеточного иммунитета в защиту от инфекции является нарушение CD8+ ответа у пожилых (старше 80 лет) пациентов [67]. В то же время имеются и противоположные данные. Так, C. Thieme и соавт. [56] не нашли корреляции между кинетикой появления вирусспецифичных Т-клеток и их уровнями, с одной стороны, и временем исчезновения инфекции и тяжестью ее протекания — с другой.
Хотя с момента появления инфекции прошло сравнительно мало времени, уже понятно, что Т- клеточный ответ сохраняется в течение по крайней мере 8 мес [57, 58]. Однако, учитывая сходство новой коронавирусной инфекции с SARS-CoV-2, можно надеяться и на сохранение иммунитета минимум до 6 лет — периода, когда могут исчезать В-клетки памяти и антитела [68].
ЗАКЛЮЧЕНИЕ
Как показано в настоящем обзоре, за последний год получено много данных о механизмах гуморального и Т-клеточного иммунного ответа на новую коронавирусную инфекцию, созданы эффективные клинические и лабораторные тест-системы для его мониторирования и внедрены в широкую практику различные типы профилактических вакцин. На примере стран с широким охватом вакцинации (таких как Израиль) уже четко видно, что появление популяционного иммунитета существенно снижает количество новых случаев инфекции и гибели пациентов от нее. В то же время многие важные аспекты остаются невыясненными. Во-первых, нет четкого понимания того, какие уровни антител различных классов к белку Spike и его фрагментам защищают от инфицирования (причем при контакте с различными дозами вируса) и от дальнейшей передачи инфекции. Уже понятно, что само наличие антител класса G не является 100% защитой от инфекции, что ясно видно из динамики инфицирования людей, вакцинированных Спутником V [69]. Имеются и примеры повторного заражения пациентов с нормальным гуморальным иммунным ответом [70].Возможно, ответ на этот вопрос будет получен из сравнения данных о заболеваемости привитых данной вакциной и вакциной Ковивак, основанной на инактивированных вирионах, которая, скорее всего, будет вызывать меньшие уровни антител. Во-вторых, непонятной остается и длительность иммунного ответа на коронавирус, учитывая приведенные выше противоречивые данные различных групп. Таким образом, необходимо продолжать исследования динамики падения уровней антител различных классов к белку Spike у переболевших пациентов и привитых людей, а также оценить вклад в защиту В-клеток памяти, которые могут продуцировать специфические иммуноглобулины при новом контакте с инфекцией. В-третьих, актуальными остаются оценка роли Т-клеточного иммунитета в защите от инфекции и ее тяжелого течения, а также вопросы целесообразности внедрения тест-систем для ее оценки в практику мониторинга пациентов и вакцинированных лиц. В-четвертых, появление новых вариантов вируса ставит вопрос о возможном его ускользании от некоторых компонентов иммунного ответа и о соответственном изменении принципов дизайна вакцин.
Очень быстрый прогресс в области исследования новой коронавирусной инфекции дает основание надеяться на получение в ближайшее время ответов на все поставленные вопросы.
Об авторах
Вячеслав Сергеевич Федоров
Институт молекулярной биологии имени В.А. Энгельгардта Российской академии наук
лаборант-исследователь
Россия, 119991, Москва, ул. Вавилова, д. 32
Ольга Николаевна Иванова
Институт молекулярной биологии имени В.А. Энгельгардта Российской академии наук
к.б.н., н.с.
Россия, 119991, Москва, ул. Вавилова, д. 32
Инна Леонидовна Карпенко
Институт молекулярной биологии имени В.А. Энгельгардта Российской академии наук
к.х.н., с.н.с.
Россия, 119991, Москва, ул. Вавилова, д. 32
Александр Владимирович Иванов
Институт молекулярной биологии имени В.А. Энгельгардта Российской академии наук
Теги: короновирус
234567 Начало активности (дата): 09.03.2022 17:46:00
234567 Кем создан (ID): 989
234567 Ключевые слова: коронавирус, SARS-CoV-2, иммунитет, антитела, Т-клеточный иммунитет
12354567899
Похожие статьи
Лучевая диагностика короновирусной болезни (COVID-19): организация, методология, интерпретация результатовРентген на дому 8 495 22 555 6 8
Цифровая медицина. Москва создала единую электронную платформу здравоохранения. Специальный репортаж
Великое обнуление. О чём проговорились Клаус Шваб и Герман Греф. Андрей Фурсов
Лучевая диагностика короновирусной болезни (COVID-19): организация, методология, интерпретация результатов



