 24.11.2023
24.11.2023
Первый этап двухэтапного ревизионного эндопротезирования при перипротезной инфекции коленного сустава
Наиболее распространенной причиной ревизий является перипротезная инфекция
Актуальность работы
На сегодняшний день эндопротезирование является распространенным и одним из самых эффективных методов лечения дегенеративных, системных и посттравматических заболеваний коленного сустава.
Несмотря на то, что впервые тотальный эндопротез коленного сустава мыщелкового типа был установлен уже в 1972 году данные операции длительное время были сопряжены с большим количеством осложнений, и только в 1990 году данные операции были признаны успешными [Moran, 2000][[Kurtz и др., 2010]. Сегодня такие операции успешно проводятся по всему миру, число их неуклонно растет, в связи с чем эндопротезирование коленного сустава приобретает репутацию «рутинного» оперативного вмешательства. Число выполненных в Российской Федерации операций эндопротезирования коленного сустава выросло с 36 843, зарегистрированного в 2014 г. до 42 904, зарегистрированного в 2017 г., что отражает общемировые тенденции [Cherny и др., 2019]. Так, например, в 2005 году в США было выполнено 450 тысяч первичных операций эндопротезирования коленного сустава, а по прогнозам к 2030 году это число увеличится на 673% и составит 3,48 миллиона [Kurtz и др., 2007].
Хотя с развитием эндопротезирования процент осложнений уменьшается, количество осложнений растет сопоставимо с количеством ежегодно выполняемых операций. В связи, с чем растет и количество ревизионных вмешательств. Так в США за период с 2005 по 2015 год число ревизионных эндопротезирований коленного сустава выросло в 2 раза.
Наиболее распространенной причиной ревизий является перипротезная инфекция. На ее долю, по данным регистра эндопротезирования коленного сустава РНИИТО им. Р.Р. Вредена, приходится 58% всех ревизионных вмешательств [Тихилов и др., 2014]
Инфекция после тотального эндопротезирования коленного сустава является самым тяжелым и угрожающим осложнением данного оперативного вмешательства. В современной литературе частота инфекционных осложнений после первичного эндопротезирования оценивается в 0,5-1,9%, и 8-10% после ревизионного эндопротезирования [Kurtz и др., 2010], [Kurtz и др., 2007]. Исторически сообщалось о частоте возникновения инфекции до 23% процентов случаев [Meehan и др., 2003].
В присутствии инородного тела минимальная абсцесс-продуцирующая доза возбудителя инфекции снижается более чем в 10000 раз, а пациент становится более восприимчив к инфекциям. Исходя из этого, искусственные суставы можно отнести к одной из наиболее уязвимых групп имплантов в отношении пожизненно высокого риска развития инфекции [Osmon и др., 2013].
В связи с образованием на поверхности компонентов эндопротеза колоний микроорганизмов в форме «биопленок» [Winkler и др., 2016], консервативное ведение перипротезной инфекции крайне малоэффективно и применяется только у пациентов, которым противопоказано выполнение хирургического вмешательства, что, как правило, обусловлено старческим возрастом и тяжестью течения сопутствующей патологии [Преображенский и др., 2017].
«Золотым стандартом» лечения перипротезной инфекции в последнее время стал протокол двухэтапного ревизионного вмешательства, разработанный Insall в 1977г и описанный в 1982г. Этот метод дает самые предсказуемые результаты в плане эрадикации инфекции - процент успешного лечения по данным литературы может достигать 92-94% [Castelli, Gotti, Ferrari, 2014; Lichstein и др., 2016], а конечные функциональные результаты, несомненно, лучше по сравнению с артродезом или ампутацией.
Однако, несмотря на это, в лечении перипротезной инфекции коленного сустава остается много нерешенных проблем. Ревизионные операции по-прежнему сопряжены с большим числом интра - и послеоперационных осложнений, функциональные результаты зачастую оставляют желать лучшего, а качество жизни и удовлетворенность пациента оказанной помощью не соответствуют ожиданиям. Смертность у пациентов, перенесших ревизию по поводу перипротезной инфекции в 5 раз выше, чем у пациентов, повторно оперированных по поводу асептического расшатывания [Zmistowski, Casper, 2013]. Нередко трудности возникают уже на этапе диагностики - хроническая вялотекущая инфекция может длительное время не проявляться как рентгенологически, так и по лабораторным показателям, что в свою очередь может привести диагноста на ложный путь^^^ и др., 2016]. Помимо этого существуют Culture-Negative инфекции [Berbari и др., 2007]. Зачастую в результате неполноценной диагностики пациенты длительное время получают неэффективную консервативную терапию, в то время как развивается инфекционный процесс. Прием антибактериальных препаратов без определения чувствительности может приводить к формированию резистентности и затруднять дальнейшее лечение [Bozhkova и др., 2018]. Поздние сроки диагностики и промедление в оказании оперативного лечения также могут приводить к тяжелому дефициту костной ткани на фоне остеолизиса и к патологическим переломам мыщелков, в результате чего значительно увеличивается техническая сложность ревизионных вмешательств и без того осложненная рубцовым процессом и воспалением околосуставных тканей [Cherny и др., 2019; Engh, Ammeen, 1999]. Нередко во время проведения ревизионных операций ортопедам приходится сталкиваться с проблемой неправильного позиционирования компонентов эндопротеза при первичном эндопротезировании, в связи с чем создается порочный круг, который приводит к неправильным ротационным соотношениям временных и окончательных имплантов и, как следствие, к проблемам биомеханики, плохим функциональным результатам и неудовлетворенности пациента конечным результатом[Djahani и др., 2013; Murylev и др., 2019; Robertsson и др., 2000; Schroer и др., 2013; Siqueira и др., 2015; Wilson и др., 2017].
Таким образом, растущее число операций ТЭКС и, как следствие, рост инфекционных осложнений, несовершенство существующих методов диагностики, многообразие причинных микроорганизмов, а также их способности к биоплекообразованию и формированию антибактериальной резистентности, отсутствие общепринятой тактики выбора спейсера при проведении первого этапа двухэтапного ревизионного эндопротезирования и, как следствие, распространенность осложнений, возникающих в ходе такого лечения, свидетельствуют об актуальности данной работы.
Цель исследования - повышение эффективности первого этапа ревизионного эндопротезирования коленного сустава за счет оптимизации диагностики и подбора спейсера на этапе хирургического лечения.
1) Разработать комплексный подход к диагностике болевого синдрома у пациентов после тотального эндопротезирования коленного сустава;
2) Оценить достоверность результатов предоперационного
бактериологического исследования пунктата внутрисуставной жидкости протезированного коленного сустава;
3) Разработать и внедрить в практику алгоритм выбора различных типов спейсеров, основанный на предложенном подходе к предоперационному обследованию пациентов. Оценить результаты применения данного алгоритма;
4) Разработать методику применения 3D спейсеров, позволяющую исправлять ошибки, допущенные при позиционировании первичных компонентов и улучшать функциональные результаты на этапе имплантации спейсера;
5) Сравнить функциональные и клинические результаты первого этапа двухэтапного ревизионного эндопротезирования по группам пациентов с различными видами спейсеров.
Задачи
1) Впервые разработана система обследования пациентов, позволяющая с высокой точностью выявить перипротезную инфекцию и определить микробный «пейзаж»;
2) Создан алгоритм подбора спейсера с учетом общих и локальных индивидуальных особенностей пациента;
Теоретическая и практическая значимость 1) Разработанная система дифференциальной диагностики пациентов с подозрением на перипротезную инфекцию позволяет надежно определить, как наличие перипротезной инфекции, так и определить возможные асептические причины болевого синдрома;
3) Индивидуальный подбор спейсера в соответствии с разработанным алгоритмом позволяет снизить частоту интра - и послеоперационных осложнений при проведении первого этапа двухэтапного ревизионного эндопротезирования, улучшить качество жизни пациента в период ожидания второго этапа и упростить выполнение второго этапа.
Диссертационная работа представляет собой клиническое исследование основанное на проспективном анализе результатов обследования 113 пациентов на предмет наличия перипротезной инфекции и 55 случаев лечения с применением двухэтапного протокола ревизионного эндопротезирования пациентов с подтвержденной перипротезной инфекцией. Таким образом, исследование было разделено на два этапа: I этап - комплексное обследование на предмет перипротезной инфекции и II этап - лечение пациентов с перипротезной инфекцией в рамках первого этапа двухэтапного ревизионного эндопротезирования. По результатам I этапа исследования пациенты были разделены на 2 группы сравнения: 1 группа пациентов с асептическими причинами болевого синдрома (58 пациентов) и 2 группа пациентов с перипротезной инфекцией (55 пациентов).
Также на основании данных проведенного обследования был разработан и внедрен в практику алгоритм выбора спейсера для хирургического лечения перипротезной инфекции коленного сустава. В связи с чем в ходе II этапа исследования было проведено два различных сравнительных анализа (IIa и IIb этапы исследования). В Па этапе были сформированы 4 группы сравнения по типам используемых спейсеров (19, 27, 5 и 4 пациентов по группам соответственно). В IIb этапе исследования проведен сравнительный анализ клинических результатов в 2х группах, сформированных по принципу выбора спейсера - группа пациентов, прооперированных до разработки и внедрения алгоритма выбора спейсера (26 пациентов) и группа пациентов (27 человек), прооперированных после.
Теоретическая и практическая значимость
1) Дифференциальная диагностика болевого синдрома в области эндопротеза коленного сустава требует строгого соблюдения алгоритма обследования;
2) Подбор спейсера при выполнении первого этапа ревизионного эндопротезирования коленного сустава должен осуществляться с учетом данных комплексного общего и локального обследования;
3) Использование 3D спейсеров позволяет устранить, допущенные при первичном эндопротезировании ошибки в позиционировании компонентов эндопротеза, а также замещать выраженные костные дефекты.
Степень достоверности и апробация работы Работа выполнена с использованием современных клинико- инструментально-лабораторных методов обследования и методов статистической обработки полученных результатов с помощью программы MS Excel и программы IBM SPSS Statistics 23 for Windows. Сформулированные в диссертации выводы и положения аргументированы и логически вытекают из результатов многоуровневого анализа.
Основные положения диссертационной работы доложены на всероссийских и международных конференциях - «Медицина чрезвычайных ситуаций. Современные технологии в травматологии и ортопедии» (Москва 2016г), «XI съезд травматологов и ортопедов России» (Санкт-Петербург 2018г), «Травма 2018: мультдисциплинраный подход» (Москва, 2018г), Всероссийская конференция молодых ученых «Актуальные вопросы травматологии и ортопедии» (Санкт- Петербург, 2019г), «Пироговский форум» (Москва,2019г).
Автором самостоятельно разработан дизайн исследования, алгоритм обследования пациентов, с подозрением на наличие перипротезной инфекции коленного сустава, разработан алгоритм выбора спейсера при лечении перипротезной инфекции по двухэтапному протоколу ревизионного эндопротезирования. Также проведено обследование всех пациентов, включенных в исследование. Диссертант принимал участие во всех операциях, включенных в исследование. Автором выполнен анализ результатов диагностики и лечения пациентов, включенных в исследование, на различных этапах лечения и наблюдения, статистическая обработка и интерпретация данных. Автор принимал непосредственное участие в процессе подготовки всех научных публикаций, докладов и технических решений.
Результаты исследования внедрены в практику работы травматологических и ортопедических отделений ГБУЗ ГКБ им. С. П. Боткина ДЗ г. Москвы и УКБ №1 ФГАОУ ВО Первого МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет).
По теме диссертации опубликовано 7 печатных работ. Из них оригинальных научных статей - 4 (в журналах, включенных в международную базу данных Scopus - 1 статья, Web of Science - 3 статьи). Кроме того, 3 статьи в иных изданиях.
Диссертация соответствует шифру специальности 14.01.15 - Травматология и ортопедия. Травматология и ортопедия - область науки, занимающаяся методами диагностики, лечения и профилактики повреждений, их последствий, врожденных и приобретенных заболеваний опорно-двигательной системы (позвоночника, грудной клетки и конечностей).
Диссертация изложена на 162 страницах текста, набранного на компьютере; состоит из введения, трех глав, обсуждения, заключения, выводов, практических рекомендаций, списка сокращений и условных обозначений и списка литературы. Текст иллюстрирован 45 рисунками, 34 таблицами и 25 диаграммами.
Во введении обоснована актуальность темы, определены цель диссертационного исследования, его задачи, указаны научная новизна, практическая значимость работы, основные положения, выносимые на защиту, представлены сведения о реализации и апробации диссертационного исследования, а также об объеме и структуре диссертации.
В первой главе проведен обзор современного состояния вопроса по теме диссертации на основании данных отечественной и зарубежной литературы. Рассмотрены современные методы диагностики и варианты лечения перипротезной инфекции коленного сустава. Аргументированно представлено, что на сегодняшний день двухэтапное ревизионное эндопротезирование является наиболее эффективным методом лечения перипротезной инфекции. Однако, несмотря на статус «золотого стандарта» двухэтапной методики ревизионного эндопротезирования сохраняется риск рецидива инфекции, а также развития различных механических и биомеханических осложнений, ассоциированных с установленным спейсером. Помимо этого, существует и нехирургическая проблема несвоевременной и ненадлежащей диагностики - зачастую пациенты с «низковирулентной» формой инфекции длительное время остаются без диагноза, так как не попадают под существующие критерии диагностики инфекции. В то же время, существуют случаи, когда диагноз перипротезной инфекции невозможно поставить в связи с невозможностью провести исследование аспирата сустава и есть необходимость проводить дифференциальную диагностику с внесуставными причинами повышения сывороточных маркеров воспаления. Помимо этого, существует ряд асептических причин возникновения болевого синдрома в протезированном суставе, которые необходимо строго дифференцировать с воспалительным процессом.
Во второй главе представлены дизайн исследования, критерии включения, исключения и невключения, описаны методы обследования больных, дана характеристика клинического материала.
Материалы и методы исследования Исследование основано на проспективном анализе результатов обследования 113 пациентов на предмет наличия перипротезной инфекции и 55 случаев лечения с применением двухэтапного протокола ревизионного эндопротезирования пациентов с подтвержденной перипротезной инфекцией. Таким образом, исследование было разделено на два этапа: I этап - обследование на предмет перипротезной инфекции и II этап - лечение пациентов с перипротезной инфекцией в рамках первого этапа двухэтапного ревизионного эндопротезирования. По результатам I этапа исследования пациенты были разделены на 2 группы сравнения: 1 группа пациентов с асептическими причинами болевого синдрома (58 пациентов) и 2 группа пациентов с перипротезной инфекцией (55 пациентов). В ходе II этапа исследования были сформированы 4 группы сравнения по типам используемых спейсеров (19, 27, 5 и 4 пациентов по группам соответственно), а также 2 группы по принципу выбора спейсера - группа пациентов, прооперированных до разработки и внедрения алгоритма выбора спейсера (26 пациентов) и группа пациентов (27 человек), прооперированных после, таким образом можно выделить IIa и IIb этапы исследования. Схема дизайна исследования представлена далее (рисунок 1). Средний возраст всех пациентов, которым были установлены спейсеры составил 67,09 лет (±7,66).
Критерии включения пациентов в исследование: наличие эндопротеза коленного сустава, наличие жалоб на боли в области эндопротеза коленного сустава, возраст пациентов от 18 лет, согласие с предложенным планом обследования и лечения.
Критерии невключения пациентов в исследование: наличие свищевого хода в области операции, тяжелое общесоматическое состояние пациента
Из исследования были исключены пациенты, в процессе лечения которых открылся свищевой ход, а также в случаях, когда пациенты отказывались от продолжения лечения и обследования согласно предложенному алгоритму.
Все пациенты, включенные в исследование, проходили обследование по одному плану. Первым этапом проводили клиническое обследование пациентов, включающее объективный осмотр с оценкой различных функциональных тестов, работу с документами, такими как, выписные эпикризы, архив рентгенограмм и анализов, протоколы операции, а также заполняли анкету-опросник. Далее оценивали результаты различных радиологических исследований, рекомендованных пациентам к осмотру. В последующем всем пациентам проводили диагностическую пункцию больного сустава с бактериологическим и цитологическим исследованием полученной жидкости, а также выполняли забор крови на тканевые индикаторы воспаления (Скорость оседания эритроцитов и С- реактивный белок). При необходимости выполняли повторные пункции.
В 3 главе данной работы представлен анализ результатов проведённого обследования в ходе I этапа исследования.
По результатам проведенного обследования 55 пациентам был поставлен диагноз перипротезной инфекции, а также были определены возможные причины болевого синдрома у всех пациентов асептической группы.
При этом у 24 пациентов (21,2%) было выявлено одновременно две и более возможных причины болевого синдрома. Так, у 9и пациентов помимо проблем с инфекцией были обнаружены различные мальпозиции хорошо фиксированных компонентов, у 1 пациента обнаружена несостоятельность внутренней коллатеральной связки. Таким образом, пациенты распределились по основным причинам болевого синдрома следующим образом: 49% пациентов с перипротезной инфекцией, 36% с мальпозицией компонентов, 17% пациентов с асептическим расшатыванием компонентов, по 9% составили пациенты с связочной нестабильностью прооперированного коленного сустава и с внесуставнымипричинами и в 2% случаев был выявлен перипротезный перелом.
Помимо постановки диагноза, все данные полученные в ходе обследования были проанализированы на предмет информативности. В таблице 1 представлены данные по таким индикаторам воспаления как СОЭ и C-реактивный белок.
Полученные данные свидетельствуют о том, что использование сывороточных маркеров воспаления сильно ограничено как в специфичности, так и в чувствительности.
Повышенный уровень этих показателей может быть связан, как с внесуставными причинами (сопутствующая патология, ревматические заболевания), так и с длительной травматизацией костной и параартикулярных тканей у пациентов с асептическим расшатыванием и нестабильностью.
Таблица 1 - Статистический анализ результатов исследования СРБ и СОЭ
I этап исследования
В 3 главе данной работы представлен анализ результатов проведённого обследования в ходе I этапа исследования.
По результатам проведенного обследования 55 пациентам был поставлен диагноз перипротезной инфекции, а также были определены возможные причины болевого синдрома у всех пациентов асептической группы.
При этом у 24 пациентов (21,2%) было выявлено одновременно две и более возможных причины болевого синдрома. Так, у 9и пациентов помимо проблем с инфекцией были обнаружены различные мальпозиции хорошо фиксированных компонентов, у 1 пациента обнаружена несостоятельность внутренней коллатеральной связки. Таким образом, пациенты распределились по основным причинам болевого синдрома следующим образом: 49% пациентов с перипротезной инфекцией, 36% с мальпозицией компонентов, 17% пациентов с асептическим расшатыванием компонентов, по 9% составили пациенты с связочной нестабильностью прооперированного коленного сустава и с внесуставнымипричинами и в 2% случаев был выявлен перипротезный перелом.
Помимо постановки диагноза, все данные полученные в ходе обследования были проанализированы на предмет информативности. В таблице 1 представлены данные по таким индикаторам воспаления как СОЭ и C-реактивный белок.
Полученные данные свидетельствуют о том, что использование сывороточных маркеров воспаления сильно ограничено как в специфичности, так и в чувствительности. Повышенный уровень этих показателей может быть связан, как с внесуставными причинами (сопутствующая патология, ревматические заболевания), так и с длительной травматизацией костной и параартикулярных тканей у пациентов с асептическим расшатыванием и нестабильностью.
Таблица 1 - Статистический анализ результатов исследования СРБ и СОЭ

В связи с вышеуказанными ограничениями использования тканевых индикаторов воспаления, наиболее важную роль в диагностике перипротезной инфекции играет диагностическая пункция сустава с цитологическим и бактериологическим исследованием полученной жидкости.
В нашем исследовании из 113 обследованных пациентов получить пункционный материал удалось у 102 (90,2%). В остальных 11 случаях не удалось получить даже небольшого количества жидкости («dry tap») в связи с выраженными рубцовыми изменениями сустава. Среди этих 102 пациентов было 52 (94,5%) из 55 группы с перипротезной инфекцией и 50 (86,2%) из 58 группы с асептическими причинами. Средние значения показателей числа лейкоцитов на кубический миллиметр в синовиальной жидкости (WBC) и процент содержания полиморфноядерных нейтрофилов (%PMN), их чувствительность и специфичность, и результаты их статистического анализа представлены в таблице 2. При расчёте чувствительности и специфичности данного показателя получены следующие данные: 90,4% и 100% соответственно, что говорит о высокой надежности и эффективности данного исследования в рамках диагностики перипротезной инфекции.
Бактериологический посев полученной жидкости - также надежный способ определения наличия перипротезной инфекции, который, с учетом информации, изложенной выше, должен проводиться всем пациентам, независимо от уровня сывороточных маркеров воспаления.
Однако, бактериологическое исследование пунктата не обладает 100% достоверностью, в связи с возможными случаями микробной контаминации. Так, например, ситуация, когда при бактериологическом посеве синовиальной жидкости получен рост микрофлоры, в анализах крови наблюдается повышение тканевых индикаторов воспаления, но при этом цитологическое исследование соответствует асептическому характеру, согласно всем существующим критериям диагностики перипротезной инфекции, должна быть классифицирована как инфекционное воспаление. Однако, с учетом низкой специфичности СОЭ и СРБ и более высокой чувствительностью и специфичностью цитологического анализа синовиальной жидкости, в таком случае с большой долей вероятности возможна микробная контаминация, которая должна быть лабораторно подтверждена при повторной аспирации, а также должны быть определены возможные причины болей в оперированном суставе, соответствующие клинической картине. В нашем исследовании было выявлено 7 случаев лабораторной микробной контаминации исследуемых образцов синовиальной жидкости, в каждом из которых цитологический состав исследуемой жидкости имел асептический характер, что в очередной раз свидетельствует о наиболее высокой чувствительности метода цитологического анализа синовиальной жидкости на предоперационном этапе.
Таблица 2 - Результаты анализа данных цитологического обследования
|
|
Асептическая |
Ш1И |
|
|
Чувс твит ельн ость |
Спец ифич ность |
|
|
|
M (±SD) |
95% ДИ |
M(±SD) |
95%ДИ |
Р |
||
|
Количество лейкоцитов синовиальной жидкости (клеток/ммЗ) |
1540,46 (±1860,16) |
945,57 2135,38 |
30117, 21 (±1984, 29) |
20551,6 39682,8 1 |
<0,05 |
100 % |
98% |
|
% полиморфноядерных нейтрофилов |
27,0 (±14,29) |
22,43 31,57 |
80,05 (±22,51) |
69,2 - 90,9 |
<0,05 |
90,4 0% |
100% |
С учетом представленной выше информации, был сформирован и применен принцип необходимости проведения повторной пункции коленного сустава. А именно то, что результаты цитологического исследования необходимо принимать во внимание при подозрении на возможную контаминацию материала при проведении бактериологического исследования и у пациентов с возможными системными причинами повышения серологических маркеров воспаления, с целью «ложно-положительных» случаев. А также у пациентов с подозрением на низковирулентную инфекцию с значениями серологических маркеров воспаления ниже пороговых, с целью исключения «ложно-отрицательных» случаев.
В 4 главе представлен разработанный алгоритм выбора спейсера, основывающийся на данных предоперационного обследования, представлены результаты применения данного алгоритма, а также результаты применения различных типов спейсеров.
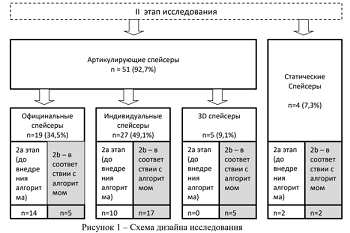
В рамках 11а исследования был проведен анализ результатов операций первого этапа с точки зрения применения различных типов спейсеров. За время проведения исследования всего было проведено 55 операций по установке спейсера. Официнальные спейсеры были установлены в 19 случаях (34,6%), индивидуальные в 27 случаях (49,1%), 3D - спейсеры установлены 5 пациентам (9,1%), неартикулирующиые (статические, блоковидные) спейсеры были установлены в 4 случаях (7,3%).
Пациенты были разделены на группы соответственно типам установленных спейсеров. Перед анализом результатов применения различных типов спейсеров по группам, был произведен анализ исходных данных.
Сравнили лабораторные показатели, ИМТ, возраст, сроки с момента первичной операции, а также риски развития инфекционных осложнений и исходный уровень по функциональной шкале KOOS. При анализе исходных данных не было выявлено статистически - значимых различий ни по одному из сравниваемых критериев, что свидетельствует о целесообразности анализа результатов применения различных типов спейсеров между сравниваемыми группами.
При статистическом анализе данных всех 4х групп по времени проведения операции первого этапа и интраоперационной кровопотери получены статистически значимые отличия (р 0,018 и 0,021) соответственно. По объективным причинам наибольшее среднее время операции и средняя интраоперационная кровопотеря зарегистрированы в группе пациентов, которым были выполнены операции первого этапа с установкой неартикулирующих (статических) спейсеров. Время операции в данной группе составило 133,8 (±27,5) минут в сравнении с 98,9 (±10,35) минут, 113 (±22,31) минут, 98 (±25,88) минут для групп с официнальными, индивидуальными и 3D спейсерами соответсвенно. Объем кровопотери составил 1325 (±150,0) мл в cравнении с 726,3 (±273,0) мл, 731,5 (±417,0) мл и 630 (±97,5) мл в группах с официнальными, индивидуальными и 3D спейсерами соответственно. В связи с чем, дополнительно был проведен анализ среднего времени и кровопотери в группах с использованием только артикулирующих спейсеров. С учетом этой поправки обнаружено, что среди данных групп пациентов существуют статистически значимые различия по среднему времени проведения операции (р 0,027), но при этом различия по среднему объему интраоперационной кровопотери достоверной статистической значимости не показали (р 0,525). Тем не менее, было достоверно получено, что наименьшее время операции и объем интраоперационной кровопотери зарегистрированы в группе пациентов, которым были установлены 3D спейсеры.
Для оценки эффективности купирования инфекционного процесса был проведен статистический анализ показателей СОЭ и C-реактивного белка на до- и послеоперационном периодах по группам. В таблицах 3 и 4 представлены данные по сравнению показателей СОЭ и С-реактивного белка по группам пациентов с различными типами спейсеров.
Таблица 3 - Сравнение показателей СОЭ до и после установки спейсера по группам
|
|
Официнальны е |
Индивидуальны е |
3D |
Статически е |
|
СОЭ до операции |
65,32 (±28,41) |
56, 11 (±32,92) |
58 (±28,32) |
61,5 (±21,12) |
|
СОЭ после операции |
42,58 (±28,06) |
40,11 (±23,25) |
27,20 (±11,78) |
36,60 (±41,14) |
|
р (0,05) |
0,043 |
0,02 |
0,043 |
0,345 |
Таблица 4 - Сравнение показателей СРБ до и после установки спейсера по группам
|
|
Официна льные |
Индивиду альные |
3D |
Статические |
|
СРБ до операции |
49,69 (±31,8) |
31,31 (±21,54) |
57,36 (±33,08) |
38,52 (±12,19) |
|
СРБ после операции |
14,36 (±18,39) |
8,05 (±8,33) |
11,15 (±10,28) |
19,98 (±32,12) |
|
р (0,05) |
<0,005 |
<0,005 |
0,03 |
0,47 |
Таблица 5 - Оценка функциональных шкал между группами пациентов с различными типами спейсеров
|
|
|
ППИ |
Спейсер |
ППИ Спейсер |
ППИ |
Спейсер |
ППИ |
Спейсер |
р 2 |
рз/ р4 |
|
|
|
|
Официнальные |
Индивидуальные |
3D |
Статические |
||||||
|
KOOS |
Боль |
36,4 (±14,6) |
52,78 (±13, 54) |
45,04 (±12,85) |
63,3 (±15,3) |
34,44 (±16, 5) |
68,89 (±17 94) |
40,28 (±5,78) |
49,07 (±28, 57) |
0, 5 9 3 |
0, 33 4 0, 16 7 |
|
Симптомы |
29,91 (±18,8) |
46,43 (±15,5) |
32,4 (±16,48) |
53,32 (±22,1) |
37,14 (±15, 48) |
54,29 (±16, 24) |
34,82 (±9,83) |
28,57 (±22,3) |
0, 2 5 2 |
0, 27 9 0, 65 9 |
|
|
Уровень повседневной активности |
32 (±12, 52) |
47,61 (±6, 8) |
41,26 (±14,29) |
56,57 (±18, 38) |
43,82 (±13, 65) |
65,59 (±12, 46) |
34,93 (±20, 32) |
21,1 (±5,94) |
0, 4 2 9 |
0, 06 2 0, 33 8 |
|
|
Качество жизни |
7,03 (±10, 26) |
14,84 (±12, 91) |
11,76 (±12,08) |
26,47 (±17, 89) |
11,25 (±11, 18) |
40 (±15, 69) |
14,06 (±7, 86) |
10,42 (±13, 01) |
0, 4 5 9 |
0, 63 8 0, 51 8 |
|
|
р 1 |
р (боль) |
0,012 |
0,014 |
0,043 |
1 |
|
|||||
|
р (симптомы) |
0,025 |
0,06 |
0,042 |
1 |
|||||||
|
р (уровень повседневной активности) |
0,017 |
0,052 |
0,043 |
1 |
|||||||
|
р (качество жизни) |
0,024 |
0,09 |
0,042 |
1 |
|||||||
pi - статистическая значимость в группах между этапами до и после установки спейсера
р2 - статистическая значимость между группами пациентов с различными типами спейсеров до
установки спейсеров
р3 - статистическая значимость между всеми группами пациентов с различными типами спейсеров после установки спейсеров
р4 статистическая значимость между группами пациентов с различными типами артикулирующих спейсеров после установки спейсеров
Из представленной в таблице 5 информации видно, что все спейсеры эффективны в плане уменьшения болевого синдрома, а все артикулирующие спейсеры в различной степени позволяют уменьшить функциональные ограничения, увеличить уровень повседневной активности пациентов и улучшить качество жизни даже на время установки самого спейсера. Однако наилучшие результаты по всем категориям оценочной функциональной шкалы KOOS показали спейсеры, изготовленные с применением 3D технологий, а также индивидуальные спейсеры с цемент-металлической парой трения. Полученные данные говорят о лучшей функциональности и анатомичности данных спейсеров перед другими группами.
При анализе осложнений наибольшее их количество и процент выявлены в группе с официнальными спейсерами. Так при сравнении абсолютного числа осложнений всех типов по группам, в группе с официнальными спейсерами было 15 осложнений (78,95%), в группе с индивидуальными спейсерами 6 (22,22%), 0 осложнений в группе с 3D спейсерами, и 1 осложнение (25%) в группе статических спейсеров. При разделении осложнений по типам, также наибольший процент осложнений каждого типа (биомеханические 52,63%, механические (10,53%) и инфекционные (15,8%)) зарегистрирован в группе официнальных спейсеров.
Основываясь на опыте применения различных типов спейсеров, а также проведя анализ возможных причин развития различных осложнений в ходе проведения первого этапа лечения, был разработан алгоритм выбора спейсера (рисунок 2).
С учетом информации, указанной выше, использование разработанного алгоритма целесообразно и оправдано, и позволяет улучшить как клинические, так и функциональные результаты применения спейсеров в ходе первого этапа двухэтапного ревизионного эндопротезирования коленного сустава по поводу перипротезной инфекции.
Выводы
1. Использование комплексного и систематического подхода к диагностике болевого синдрома у пациентов после эндопротезирования коленного сустава, позволило в 100% случаев выявить причину данной проблемы, в том числе достоверно установить диагноз перипротезной инфекции;
2. Результаты предоперационного бактериологического обследования необходимо соотносить с результатами цитологического обследования и уровнем тканевых показателей воспаления с целью исключения «ложноположительных» и «ложноотрицательных» результатов. Было выявлено 11% случаев микробной контаминации и 13% случаев несоответствия с интраоперационными пробами;
3. Применение на практике разработанного алгоритма выбора спейсера, продемонстрировало статистически значимое улучшение результатов при первом этапе двухэтапного ревизионного эндопротезирования. А именно позволило уменьшить количество осложнений в 4,5 раза, понизить необходимость дополнительной внешней фиксации в 2,8 раза и улучшить средние показатели шкалы KOOS в 1,5 раза по болевому синдрому и показатели качества жизни в 1,9 раз;
4. Применение спейсеров, изготовленных с использованием 3D технологий, у пациентов с нарушенным позиционированием стабильных компонентов или у пациентов с дефектами типа AORI F/T 2B позволило снизить встречаемость биомеханических осложнений до 0% в сравнении с 52,6% при применении официнальных спейсеров.
5. Несмотря на лучшие клинические и функциональные результаты в группах с применением 3D и индивидуальных спейсеров, использование каждого типа спейсеров может быть оправдано при определенных показаниях. Так у пациентов с дефектами AORI F/T 3, дефектами мягких тканей и несостоятельностью разгибательного аппарата возможно применение только статических спейсеров, в то время как у пациентов с минимальными костными дефектами и достоверно определенной микрофлорой возможно применение официнальных конструкций.
Практические рекомендации
1. Любые боли в области установленного эндопротеза коленного сустава следует считать следствием наличия перипротезной инфекции до тех пор, пока не будет доказано обратное с применением разработанного подхода к обследованию пациента;
2. Для определения дальнейшей тактики лечения, в том числе выбора типа спейсера, целесообразно включить в обследование дополнительные методы лучевой диагностики:
■ КТ-исследование с целью определения ротационного положения стабильных компонентов и определения степени дефицита костной ткани,
■ Панорамные снимки нижних конечностей для определения положения компонентов во фронтальной плоскости,
■ Тангенциальные снимки надколенника для определения положения надколенника и степени его износа;
3. Применение на практике разработанного подхода к установке 3D спейсеров, а также разработанного алгоритма выбора спейсера позволяет уменьшить риск развития различных осложнений, и, как следствие, улучшить клинические и функциональные результаты;
4. Выбор спейсера должен основываться на тщательном анализе данных анамнеза, локального и общего обследования;
5. При выборе спейсера предпочтение следует отдавать артикулирующим имплантам, так как их установка облегчает активизацию и повышает качество жизни пациента на время ожидания проведения второго этапа;
6. Использование 3D спейсеров целесообразно при ассиметричном дефиците костной ткани AORI F/T 2B, а также при неправильном позиционировании стабильных первичных компонентов, так как позволяет эффективно устранить эти проблемы уже на этапе установленного спейсера, и, как следствие, улучшить функциональные результаты и подготовить пациента к проведению второго этапа ревизионного эндопротезирования.
Список литературы
1. Мурылев В.Ю., Алексеев С.С., Елизаров П.М., Куковенко Г.А., Деринг А.А., Хаптагаев Т.Б. Оценка болевого синдрома у пациентов после эндопротезирования коленного сустава // Травматология и ортопедия России. 2019. Т. 25. № 2. С. 1930. [Web of Science]
2. Куковенко Г.А., Елизаров П.М., Алексеев С.С., Сорокина Г.Л., Иваненко Л.Р., Ерохин Н.Е., Музыченков А.В., Мурылев В.Ю. Важность выполнения алгоритма диагностики поздней глубокой перипротезной инфекции тазобедренного сустава // Травматология и ортопедия России. 2019. Т. 25. № 4. С. 75-87. [Web of Science]
3. Мурылев В.Ю., Елизаров П.М., Музыченков А.В., Рукин Я.А., Деринг А.А., Куковенко Г.А., Алексеев С.С., Рубин Г.Г. Тотальная цементная артропластика коленного сустава у пациентов 85-95-летнего возраста, страдающих терминальной стадией дегенеративных повреждений коленного сустава // Вестник хирургии им. И.И. Грекова. 2018. Т. 177. № 6. С. 49-53. [Scopus]
4. Мурылев В.Ю., Куковенко Г.А., Елизаров П.М., Иваненко Л.Р., Сорокина Г.Л., Рукин Я.А., Алексеев С.С., Германов В.Г. Алгоритм первого этапа лечения поздней глубокой перипротезной инфекции тазобедренного сустава // Травматология и ортопедия России. 2018. Т. 24. №2 4. С. 95-104. [Web of Science]
5. Мурылев В.Ю., Алексеев С.С., Елизаров П.М., Куковенко Г.А. Оценка болевого синдрома у пациентов после эндопротезирования коленного сустава // Московская медицина. 2019. № 6 (34). С. 75
6. Куковенко Г.А., Мурылев В.Ю., Елизаров П.М., Сорокина Г.Л., Рукин Я.А., Иваненко Л.Р., Алексеев С.С. Алгоритм диагностики и особенности выбора спейсера при двухэтапном ревизионном эндопротезировании тазобедренного сустава // В книге: Травма 2018: мультидисциплинарный подход. Сборник тезисов Международной конференции. Российский национальный исследовательский медицинский университет им. Н. И. Пирогова. 2018. С. 159-160.
7. Алексеев С.С., Мурылев В.Ю., Рукин Я.А., Елизаров П.М., Куковенко Г.А.
Работа выполнена в федеральном государственном автономном образовательном учреждении высшего образования Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Научный руководитель:
доктор медицинских наук, профессор - Мурылев Валерий Юрьевич
Официальные оппоненты:
Корнилов Николай Николаевич - доктор медицинских наук, доцент, Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр травматологии и ортопедии им. Р.Р. Вредена» Министерства здравоохранения Российской Федерации, кафедра травматологии и ортопедии, профессор кафедры; отделение №17, заведующий отделением; отделение патологии коленного сустава, ведущий научный сотрудник Каграманов Сергей Владимирович - доктор медицинских наук, Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова» Министерства здравоохранения Российской Федерации, научно-клиническое отделение эндопротезирования крупных суставов, ведущий научный сотрудник отделения
Ведущая организация: Федеральное государственное автономное образовательное учреждение высшего образования Российский национальный исследовательский медицинский университет имени Н.И. Пирогова Министерства здравоохранения Российской Федерации
Теги: коленный сустав
234567 Начало активности (дата): 24.11.2023 23:30:00
234567 Кем создан (ID): 989
234567 Ключевые слова: эндопротезирование, инфекция, коленный сустав
12354567899
Похожие статьи
Лазерные технологии в лечении пациентов с хроническим синовитом коленного суставаКлиническая эффективность и точность выравнивания механической оси при роботизированном тотальном эндопротезировании коленного сустава
Рентген на дому 8 495 22 555 6 8
Робот-ассистированное эндопротезирование коленного сустава. Первый опыт (проспективное рандомизированное исследование)
Экстракорпоральная ударно-волновая терапия тендопериостеопатии связки надколенника



