 28.05.2022
28.05.2022
Высокая вальгизирующая остеотомия большеберцовой кости в комплексном лечении разрывов передней крестообразной связки у пациентов с варусным гонартрозом коленного сустава
Симультанное выполнение ВВОБК и рПКС демонстрирует хорошие клинические и рентгенологические результаты у 93% пациентов в первый год, а по истечении 3 лет после операции они находились в сохранности у 88,4% больных
ГА — гонартроз
ПКС — передняя крестообразная связка
рПКС — реконструкция передней крестообразной связки
ВТВ — костно-сухожильно-костный (аутотрансплантат) шкала
KOOS — The Knee Injury and Osteoartritis Outcome Score шкала
IKDS — International Knee Documentation Committee Score
ВВЕДЕНИЕ
Разрывы передней крестообразной связки коленного сустава (ПКС) продолжают оставаться одной из распространенных травм коленного сустава. Частота этих повреждений неуклонно растет: в 2000 г. специалисты отмечали 30 случаев на 100 000 населения, а в 2016 г. уже 68,6 случая на 100 000 [1, 2]. Большинству этих пациентов (65,8-90,1%) выполняют артроскопи-ческие реконструкции ПКС (рПКС) [3]. В 56% наблюдений хирургическое лечение проводят не ранее 6 месяцев после травмы [4]. Около 66% рПКС осуществляют на фоне уже имеющихся дегенеративных изменений суставного хряща, что часто объясняют длительной хронической передней нестабильностью коленного сустава [5-7]. Также часть пациентов к моменту разрыва ПКС уже имеют отдельные признаки артроза, включая варусную деформацию коленного сустава. В таких случаях механическая ось конечности смещена кнутри и трансплантат ПКС, помещенный в сустав, будет испытывать перегрузки и повреждаться, с риском его последующей несостоятельности [8]. Одним из способов лечения ранних стадий медиального гонартроза (ГА) являются высокие вальгизирующие остеотомии большеберцовой кости (ВВОБК), которые, исправляя ось конечности, перераспределяют нагрузку на наружные отделы сустава [9]. Таким образом можно «защитить» установленный трансплантат ПКС [10, 11].
Однако до настоящего времени остаются неопределенными показания и алгоритмы выбора конкретной методики корригирующей остеотомии при симультанных операциях с рПКС.
Цель исследования: на основании сравнительного анализа клинических и рентгенологических результатов симультанного выполнения операции рПКС и ВВОБК по типу «открытый клин» («open wedge») определить ее эффективность, показания и противопоказания к применению.
МАТЕРИАЛ И МЕТОДЫ
В период с 2013 по 2019 г. на лечении находились 164 пациента, которым выполняли анатомическую антеградную рПКС по поводу клинически значимой передней нестабильности коленного сустава. Возраст оперированных пациентов составил от 36 до 52 лет (в среднем 39,8±5,1 года).
Жалобы пациентов и функцию коленного сустава оценивали по шкалам Lysholm Knee Scoring Scale, 2000 IKDC, KOOS. Проводили стандартное клиническое обследование и лучевую диагностику (рентгенография коленного сустава в стандартных проекциях, телерентгенография нижних конечностей, магнитнорезонансная томография (МРТ) и/или компьютерная томография (КТ)). При этом обращали особое внимание на стабильность и амплитуду движений коленного сустава, динамику развития остеоартроза, механическую ось нижних конечностей, величину заднего наклона суставной поверхности большеберцовой кости. Изучали продолжительность операционного времени, длительность стационарного лечения после операции, общего периода нетрудоспособности, а также сроки возвращения к физическим нагрузкам и спорту.
Критериями отбора в 1-ю и 2-ю группы послужили наличие у пациентов изолированного медиального ГА 2-3-й ст., в том числе на фоне сшитого или парци-ально резецированного внутреннего мениска и/или варусная деформация конечности на угол не менее 5°. В 3-ю группу были отнесены пациенты с нормальным суставным хрящом.
В исследование не включали пациентов с признаками комплексной нестабильности коленного сустава, дегенеративными или посттравматическими изменениями в наружных отделах коленного сустава, надколеннике и блоке бедренной кости, повреждениями наружного мениска и аутоиммунными заболеваниями, сопровождающимися явлениями артрита.
В 1-ю группу были включены 43 пациента (31,1%), которым рПКС дополняли ВВОБК по типу «открытый клин». Пациентам 2-й (48, 29,3%) и 3-й групп (73, 44,5%) выполняли изолированную анатомическую антеградную рПКС.
По полу, возрасту, индексу массы тела, механизму и срокам с момента травмы все группы были сопоставимы между собой (табл. 1).
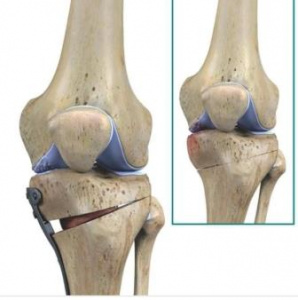
Костные каналы позиционировали с учетом центров прикрепления нативной ПКС. Для канала в бедренной кости эту зону определяли у латерального бифуркационного гребня, ниже латерального межмыщелкового гребня латерального мыщелка бедренной кости, а для большеберцового — напротив задней крестообразной связки и латеральнее основания медиального возвышения большеберцовой кости.
Трансплантат протягивали через канал в бедренной кости, заклинивая в нем трапециевидный костный блок, а дистальный костный блок после натяжения трансплантата фиксировали в канале большеберцовой кости одним интерферентным винтом.
У пациентов 1-й группы после формирования костных каналов выполняли ВВОБК по типу «открытый клин». Остеотомию осуществляли дистальнее большеберцового канала, после отсечения и эпипериостального отделения наружной порции внутренней боковой связки и отведения сухожилий полусухожильной и нежной мышц. Пропил большеберцовой кости проводили в косовосходящем направлении по направляющим спицам, не доходя примерно 1 см до кортикального слоя наружного мыщелка большеберцовой кости. Под рентгеноскопическим контролем голени придавали вальгусное положение так, чтобы механическая ось нижней конечности проходила через точку Fujisawa, соответствующую примерно 67,5% ширины плато большеберцовой кости при расчете от его медиального края. Новое положение конечности фиксировали пластиной с угловой стабильностью винтов, располагая ее в средней или задней части большеберцовой кости для исключения повреждения трансплантата ПКС. Зону костного дефекта большеберцовой кости заполняли аутотрансплантатом из крыла подвздошной кости.
Этапы операции у пациентов 1-й группы приведены на рис. 1.
РЕЗУЛЬТАТЫ
В течение одного года лечения во всех группах функциональные результаты оказались значимо выше, чем перед операцией. Инфекционных осложнений не наблюдали, однако у 4 пациентов 1-й группы в раннем послеоперационном периоде наблюдали отек мягких тканей и подкожную гематому по внутренней и задней поверхностям голени, при этом у одного из этих пациентов развился тромбоз глубоких вен голени, потребовавший специфического консервативного лечения.
У большинства пациентов 1-й группы удалось улучшить механическую ось нижней конечности (р<0,001) и при этом клинически значимо не изменить угол заднего наклона суставной поверхности большеберцовой кости (в среднем не более чем на 2,1°±0,9°), а также сохранить объем активных движений в коленном суставе. При этом зона остеотомии срослась в средние сроки (табл. 2).
При изучении стабильности коленного сустава лишь у 2 пациентов (4,7%) зарегистрировали положительный результат на тест Лахмана и «передний выдвижной ящик», соответствующие условному баллу 2+, и у 3 пациентов (6,9%) наблюдали ротационную нестабильность в виде Pivot Shift-теста 2+ (см. табл. 1).
Во 2-й группе тест Лахмана на уровне 2+ отмечали у 7 пациентов (14,6%), а у одного (2,1%) он соответствовал условному баллу 3+. Pivot Shift-тест на уровне 2+ был зафиксирован у 4 из них (8,3%) и еще у 2 пациентов (4,2%) отмечены хорошие показатели переднезадней стабильности. Средняя величина варусной деформации коленного сустава спустя один год после операции у пациентов 2-й группы составила 6,1±0,4°.
В 3-й группе пациентов с переднезадней или ротационной нестабильностью коленного сустава результатов ниже условного балла 1+ не наблюдали.
Продолжительность хирургического вмешательства у пациентов 1-й группы оказалась на 37,4±8 мин больше, чем у пациентов 2-й и 3-й групп. Длительность пребывания в стационаре, реабилитации, сроки нетрудоспособности и возвращения к спорту в группах не отличались.
Оценка итоговых результатов хирургического лечения пациентов через 36 месяцев показала, что функция коленного сустава в 1-й и 3-й группах была гораздо лучше, чем во 2-й группе. У них реже наблюдали стойкий болевым синдром, синовиты, атрофии мышц бедра и контрактуры (р<0,01). Следует отметить, что в этих группах некоторые нарушения функции сустава (С по шкале 2000 IKDC) наблюдали лишь в 11,6% (р<0,05) и 6,8% (р<0,001) случаев соответственно. Грубых нарушений функции коленного сустава (D по шкале 2000 IKDC) у них не регистрировали (p<0,001). При этом статистически значимых различий между 1- й и 3-й группами по 2000 IKDC, равно как и по Lysholm Knee Scoring Scale, выявлено не было (табл. 3).
Вместе с тем, пациенты 1-й группы в сравнении с 3-й группой чаще жаловались на боль, которая возникала в основном после интенсивной нагрузки на оперированную конечность и носила эпизодический, непродолжительный характер. Боль явилась основным фактором, способствующим снижению спортивной активности у этих пациентов ((р<0,05) по шкале KOSS, см. табл. 3).
Стабильность коленного сустава, как переднезадняя так и ротационная, была выше у пациентов 1-й и 3-й групп (р<0,001). При этом группы статистически значимо не различались между собой.
Во 2-й группе чаще выявляли пациентов с выраженным тестом Лахмана, который соответствовал условному баллу 2+: у 22 (45,8%) против 8 (18,6%) и 7 (9,6%) в 1-й (p<0,037) и 3-й (p<0,001) группах соответственно. Тесты Лахмана и «переднего выдвижного ящика», соответствующие 3+, наблюдали только у пациентов 2-й группы: 9 (18,8%), ((p<0,005), см. табл. 2).
Клинически значимый Pivot Shift-тест (2+ и 3+ условных балла), характеризующий ротационную стабильность коленного сустава, во 2-й группе наблюдали в 21 (43,8%) и в 11 (22,9%) случаях соответственно, ((p<0,005), см. табл. 2).
Наряду со снижением стабильности и ухудшением функционального состояния во 2-й группе чаще наблюдали прогрессирование артрозных изменений коленного сустава до 3-й степени (у 32 пациентов, 66,7%) и 4-й степени (у 14, 29,2%, p<0,05) соответственно. Через 36 месяцев после рПКС лишь у 2 пациентов (4,2%) этой группы была диагностирована 2-я степень ГА (p<0,001). Среднее смещение механической оси конечности кнутри у этих пациентов составило 8,3±2,6° в сравнении с 1-й и 3-й группами (p<0,001), причем в 1-й группе медиализация механической оси конечности не превышала в среднем 3° (см. табл. 2).
По истечении 3 лет после операции 6 пациентам (12,5%) 2-й группы было выполнено тотальное цементное эндопротезирование коленного сустава, а через 5 лет замену коленного сустава на искусственный выполнили еще у 21 пациента (43,8%).
Время, проведенное пациентами 1-й группы в операционной, оказалось в среднем на 32,7±2 минут больше, чем во 2-й и 3-й группах. Длительность стационарного лечения, продолжительность реабилитации, общий срок нетрудоспособности, сроки возвращения к физическим нагрузкам и спорту в группах не различались.
ОБСУЖДЕНИЕ
В ходе исследования удалось установить, что симультанное выполнение ВВОБК по типу «открытый клин» и рПКС позволяют добиться хороших клинических и рентгенологических результатов у 93% (40 пациентов) в первый год после операции, а по истечении трех лет — сохранить его у 88,4% (38 пациентов). Такой подход оправдан у пациентов с признаками или рисками развития варусного ГА [12].В нашем исследовании результаты хирургического лечения пациентов 1-й группы, полученные при использовании основных интегральных шкал, оказались не только выше, чем до операции, но и существенно лучше в сравнении с пациентами 2-й группы (p<0,01). Целесообразность одновременной коррекции оси конечности и восстановление передней стабильности коленного сустава подтверждены и другими авторами [13, 14]. Вместе с тем, по данным рентгенографии у 10 пациентов (23,3%) были диагностированы признаки прогрессирования варусного ГА. Частота таких изменений, по данным современной литературы, достаточно вариабельна и колеблется от 0 до 22% [15, 16]. Похожая ситуация складывается и в отношении оценки стабильности коленного сустава. В нашем исследовании признаки переднезадней и ротационной гипермобильности коленного сустава у пациентов 1-й группы составили 16,3% (7 наблюдений), что приближается к результатам, полученным C. Jin et al. (17%). Таким образом, «анатомическую» пластику ПКС целесообразно дополнять ВВОБК у пациентов с прогнозируемо длительными высокими нагрузками и запросами к функции коленного сустава: у лиц молодого и среднего возраста, у ведущих активный образ жизни и спортсменов, если у них наряду с передней нестабильностью коленного сустава имеются элементы варусного ГА или отдельные предпосылки к его развитию. К таким факторам можно отнести позднее выполнение рПКС (более 12 месяцев с момента ее повреждения), варусное отклонение голени более, чем на 5°, отсутствие или разрушение внутреннего мениска, наличие участков посттравматического повреждения хряща или хондромаляции в нагружаемых зонах мыщелков бедра и большеберцовой кости.
На состояние трансплантата ПКС и стабильность коленного сустава влияет угол заднего наклона плато большеберцовой кости: чем он больше, тем большую нагрузку испытывает трансплантат [19]. Избыточный наклон плато может быть анатомической особенностью человека или иметь приобретенный характер, когда при ВВОБК «открытый клин» формируется больше за счет передних отделов большеберцовой кости [8]. В нашем исследовании остеотомия большеберцовой кости у пациентов 1-й группы не привела к значительным изменениям наклона плато большеберцовой кости. Таким образом, целесообразность ВВОБК необходимо оценивать и при ревизионных реконструкциях ПКС на фоне большого заднего наклона плато большеберцовой кости (>12°).
Вместе с тем, ВВОБК приводит к перераспределению нагрузки на латеральные отделы сустава, поэтому у пациентов с повреждениями наружного мениска или суставных поверхностей наружного отдела коленного сустава, при вальгусном отклонении голени, при несостоятельности задненаружного капсульно-связочного комплекса коленного сустава выполнение ВВОБК симультанно с рПКС нецелесообразно.
Увеличение времени хирургического вмешательства в 1-й группе связано с дополнительными этапами операции. Несмотря на некоторое увеличение экономических затрат (время выполнения операции, расходные материалы и медикаменты) по сравнению со 2-й группой, в первые 5 лет после операции гораздо большее число пациентов смогли полноценно вернуться к своей работе, бытовым и спортивным занятиям (p<0,05).
ВЫВОДЫ
1. Симультанная реконструкция передней крестообразной связки и высокая вальгизирующая остеотомия большеберцовой кости позволяет добиться хороших анатомо-функциональных результатов лечения повреждений передней крестообразной связки на фоне гонартроза, включая коррекцию оси конечности, уменьшение болевого синдрома и синовитов в коленном суставе, как в ближайшем (93%), так и отдаленном послеоперационном периоде у большинства (88,4%) пациентов.2. «Анатомическую» пластику передней крестообразной связки целесообразно дополнять высокой вальгизирующей остеотомией большеберцовой кости у пациентов молодого и среднего возраста, ведущих активный образ жизни, включая спортсменов, у которых наряду с передней нестабильностью коленного сустава выявляются признаки варусного гонартроза или имеются предпосылки к его развитию (сроки с момента повреждения передней крестообразной связки более 12 месяцев, варусное отклонение голени на более, чем 5°, отсутствие или разрушение внутреннего мениска, участки хондромаляции или посттравматического повреждения хряща), а также при ревизионных реконструкциях передней крестообразной связки, особенно на фоне заднего наклона плато большеберцовой кости более, чем на 12°.
3. Выполнение высокой вальгизирующей остеотомии большеберцовой кости симультанно с реконструкцией передней крестообразной связки нецелесообразно пациентам с повреждениями наружного мениска или суставных поверхностей наружного отдела коленного сустава, при вальгусном отклонении голени, несостоятельности задненаружного капсульно-связочного комплекса коленного сустава.
ЛИТЕРАТУРА
1. Sanders TL, Maradit Kremers H, Bryan AJ, Bryan AJ, Larson DR, Dahm DL, et al. Incidence of Anterior Cruciate Ligament Tears and Reconstruction: A 21-Year Population-Based Study. Am J Sports Med. 2016;44(6):1502-1507.
2. Bollen S. Epidemiology of knee injuries: diagnosis and triage. Br J Sports Med. 2000;34(3):227-228. PMCID: PMC1763268
3. Paterno MV. Incidence and Predictors of Second Anterior Cruciate Ligament Injury After Primary Reconstruction and Return to Sport. J Athl Train. 2015;50(10):1097-1099. PMID: 29318172
4. Razi M, Salehi S, Dadgostar H, Cherati AS, Moghaddam AB, Tabatabaiand SM, et al. Timing of Anterior Cruciate Ligament Reconstruction and Incidence of Meniscal and Chondral Injury within the Knee. Int J Prev Med. 2013;4(Suppl 1):S98-S103. PMID: 23717779
5. Ajuied A, Wong F, Smith C, Norris M, Earnshaw P, Back D, et al. Anterior cruciate ligament injury and radiologic progression of knee osteoarthritis: asystematic review and meta-analysis. Am J Sports Med. 2014;42(9):2242-2252.
6. Lohmander LS, Englund PM, Dahl LL, Roos EM. The long-term consequence of anterior cruciate ligament and meniscus injuries: osteoarthritis. Am J Sports Med. 2007;35(10):1756-1769.
7. Magnussen RA, Duthon V, Servien E, Neyret P. Anterior Cruciate Ligament Reconstruction and Osteoarthritis: Evidence from Long-Term Follow-Up and Potential Solutions. Cartilage. 2013;4(3 Suppl):S22-S26.
8. Crawford MD, Diehl LH, Amendola A. Surgical Management and Treatment of the Anterior Cruciate Ligament-Deficient Knee with Malalignment. Clin Sports Med. 2017;36(1):119-133.
9. Loia MC, Vanni S, Rosso F, Bonasia DE, Bruzzone M, Dettoni F, et al. High Tibial Osteotomy in Varus Knees: Indications and Limits. Joints. 2016;4(2):98-110. PMID: 27602350
10. Pongsoipetch B, Tantikul C. Open-wedge high tibial osteotomy in varus knee osteoarthritis: a 5-year prospective cohort study. J Med Assoc Thai. 2009;92(Suppl 6):S109-S114. PMID: 20128075
11. Van de Pol GJ, Arnold MP, Verdonschot N, van Kampen A. Varus alignment leads to increased forces in the anterior cruciate ligament. Am J Sports Med. 2009;37(3):481-487. PMID: 20128075
12. Li Y, Zhang H, Zhang J, Li X, Song G, Feng H. Clinical outcome of simultaneous high tibial osteotomy and anterior cruciate ligament reconstruction for medial compartment osteoarthritis in young patients with anterior cruciate ligament-deficient knees: a systematic review. Arthroscopy. 2015;31(3):507-519. PMID: 25239170
13. Noyes FR, Barber SD, Simon R. High tibial osteotomy and ligament reconstruction in varus angulated, anterior cruciate ligament-deficient knees: a two- to seven-year follow-up study. Am J Sports Med. 1993;21(1):2-12. PMID: 8427363
14. Amendola A. The role of osteotomy in the multiple ligament injured knee. Arthroscopy. 2003;19(1):11-13. PMID: 14673414
15. Zaffagnini S, Bonanzinga T, Grassi A, Marcheggiani Muccioli GM, Musiani C, Raggi F, et al. Combined ACL reconstruction and closing-wedge HTO for varus angulated ACL-deficient knees. Knee Surg Sports Traumatol Arthrosc. 2013;21(4):934-941. PMID: 23354169
16. Dejour H, Neyret P, Boileau P, Donell ST. Anterior cruciate reconstruction combined with valgus tibial osteotomy. Clin Orthop Relat Res. 1994;(299):220-228. PMID: 8119022
17. Lattermann C, Jakob RP. High tibial osteotomy alone or combined with ligament reconstruction in anterior cruciate ligament deficient knees. Knee Surg Sports Traumatol Arthrosc. 1996;4(1):32-38. PMID:8819061
18. Jin C, Song EK, Jin OH, Lee NH, Seon JK. Outcomes of simultaneous high tibial osteotomy and anterior cruciate ligament reconstruction in anterior cruciate ligament deficient knee with osteoarthritis. Musculoskelet Disord. 2018;19(1):228. PMID: 30021642
19. LaPrade RF, Oro FB, Ziegler CG, Wijdicks CA, Walsh MP. Patellar height and tibial slope after opening-wedge proximal tibial osteotomy: a prospective study. Am J Sports Med. 2010;38(1):160
ИНФОРМАЦИЯ ОБ АВТОРЕ
Заяц Виталий Викторович кандидат медицинских наук, доцент кафедры травматологии и ортопедии ФГБОУ ВО ПСПб-ГМУ им. акад. И.П. Павлова МЗ РФ, руководитель травматолого-ортопедического отделения НИИ хирургии и неотложной медицины ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова МЗ РФ
Теги: коленный сустав
234567 Начало активности (дата): 28.05.2022 15:51:00
234567 Кем создан (ID): 989
234567 Ключевые слова: разрыв ПКС, гонартроз и нестабильность коленного сустава, высокая вальгизирующая остеотомия большеберцовой кости
12354567899
Похожие статьи
Реконструкция передней крестообразной связки(ПКС)Рентген на дому 8 495 22 555 6 8
Функциональная симптоматика в отдаленные сроки после тотального эндопротезирования коленного сустава
Способ определения изометричности расположения бедренного и большеберцового тоннелей до их формирования при пластике передней крестообразной связки
Патогенетические особенности лечения хронического остеомиелита



