 04.03.2021
04.03.2021
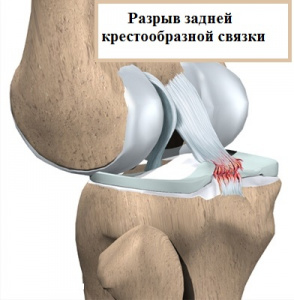
Повреждения задней крестообразной связки: биомеханика, основные направления диагностики, лечения и профилактики вторичного остеоартрита
ЗКС является самой большой внутрисуставной связкой коленного сустава, выдерживающей максимальную нагрузку по сравнению с другими связками. Отмечено, что в целом при повреждениях ЗКС необходимо использование комплекса методов диагностики, проанализированы основные принципы выбора тактики лечения данной категории пострадавших
ВВЕДЕНИЕ
Травмы коленного сустава (КС) выступают в качестве причины обращения за медицинской помощью относительно часто - в 13 % случаев [1-3]. При этом жалобы на боль и нарушения функций сустава в течение жизни предъявляет до 60 % населения [2-4]. Травматическое повреждение связок выступает в качестве ведущей причины профессиональной заболеваемости спортсменов [2, 5, 6]. Известно, что в большинстве случаев при занятиях спортом повреждается связочный аппарат голеностопного или коленного сустава. При этом, несмотря на то, что голеностопный сустав повреждается чаще, чем коленный, именно травмы КС являются причиной большинства оперативных вмешательств и характеризуются наиболее неблагоприятными последствиями [5, 6].
Чаще всего патология КС отмечается у мужчин работоспособного возраста. Двумя основными ее причинами являются травматические повреждения и дистрофические процессы [7-9]. Дорожно-транспортные происшествия (ДТП) выступают в качестве важнейшего этиологического фактора повреждения КС, эти травмы нередко отмечаются как у водителей и пассажиров транспортных средств, так и у пешеходов. Наиболее частыми причинами повреждений ЗКС являются ДТП (приборная травма), а также занятия контактными видами спорта, футболом [4].
Значимым фактором развития дистрофического поражения КС выступает избыточный вес, кроме того, на развитие гонартроза влияют вид профессиональной деятельности и наличие травм КС в анамнезе [9, 10]. В основе механизма развития дистрофических изменений в тканях КС лежит несостоятельность связочного аппарата и посттравматическая нестабильность сустава, что приводит к развитию его варусной деформации. Более чем у 50 % больных с нарушениями функции КС выявляются признаки патологии суставного хряща и костной ткани [11].
На долю разрывов задней крестообразной связки (ЗКС) приходится 3 % повреждений сустава, а также 38 % острых травматических гемартрозов этой области [4, 5]. Эти повреждения редко бывают изолированными, почти в 95 % разрывы ЗКС сочетаются с разрывами других связок. При этом повреждения ЗКС все чаще выступают в качестве причины нарушений функции и стойкой нестабильности, болевых ощущений и развития дегенеративных заболеваний сустава [12].
Цель работы - анализ данных литературы об особенностях патогенеза, диагностики и лечения повреждений задней крестообразной связки коленного сустава.
ЗКС является самой большой внутрисуставной связкой коленного сустава, выдерживающей максимальную по сравнению с другими нагрузку. Она состоит из 2 функциональных пучков: более крупного переднелатерального (ПЛП) и меньшего - заднемедиального пучка (ЗМП). Площадь прикрепления ПЛП к бедренной кости почти в два раза превышает соответствующую величину прикрепления к большеберцовой, значения этого показателя составляют соответственно от 112 до 118 мм2 [13, 14].
Центр бедренной поверхности ПЛП расположен на расстоянии 7,4 мм над трохлеарным выступом, в 11,0 мм от медиальной дуги и 7,9 мм - от дистального суставного хряща.
Центр прикрепления ПЛП к большеберцовой кости расположен на 6,1 мм кзади от белых волокон заднего края мениска, на 4,9 мм от гребня, который разделяет оба пучка [14].
Площадь прикрепления ПЛП к бедренной кости составляет от 60 до 90 мм2, зона локализована между передней и задней менискофеморальными связками. Центр пучка на бедренной кости расположен на расстоянии 11,1 мм от медиальной дуги и 10,8 мм от заднего края суставного хряща. Центр прикрепления ПЛП к большеберцовой кости расположен в 4,4 мм от задней поверхности большеберцовой кости и на 3,1 мм латеральнее медиальной канавки медиальной суставной поверхности большеберцовой кости [14].
Эти аспекты важны с точки зрения лечения повреждений ЗКС, поскольку к настоящему времени общепризнанно, что анатомическая реконструкция пучков способствует лучшему восстановлению кинематики сустава и улучшает результаты лечения повреждений его структур.
Функционально ЗКС выступает в качестве основного ограничителя движений большеберцовой кости при любых углах сгибания в суставе. Эта связка также играет роль основного ограничителя внутренней ротации более 90° и дополнительного ограничивающего фактора внешнего вращения большеберцовой кости при сгибании более чем на 90° [13]. Функции обоих пучков являются синергическими при движениях в коленном суставе [14-16].
Прочность ЗКС усиливают часто выявляющиеся 1 или 2 менискофеморальные связки, известные как связки Humphry и Wrisberg. Эти связки являются непостоянными структурами и отмечаются в 70-80 % КС.
Исторически считалось, что переднелатеральный и заднемедиальный пучки функционируют реципрокно, независимо друг от друга, ПЛП - преимущественно в условиях глубокого сгибания, а ЗМП - при растяжении [15]. В то же время недавние биомеханические исследования продемонстрировали, что как ПЛП, так и ЗМП играют существенную роль в сопротивлении отклонению назад большеберцовой кости при всех углах сгибания. Эта функция предполагает кодоминантную связь между обоими пучками и, следовательно, оба они играют значительную роль в стабильности коленного сустава [17].
ПЛП является основой устойчивости к задне-больще-берцовым движениям в диапазоне между 70° и 105°, в то время как ЗМП - в диапазоне между 0 и 15°. Такое распределение сил между двумя пучками важно с хирургической точки зрения в отношении последствий фиксации трансплантата при осуществлении реконструкции ЗКС с помощью использования двухпучкового метода.
Kennedy N.I. et al. (2013) по результатам биомеханического исследования показали, что при разделении обоих пучков отмечается отклонение на 11,7 мм движений кзади большеберцовой кости на 90°. Эти данные свидетельствуют о том, что при травме ЗКС III степени должен произойти разрыв обоих пучков. Таким образом, было установлено, что ЗКС играет более важную роль в ротационной стабильности КС, чем считалось ранее. Эта структура ограничивает внутреннее вращение при всех углах сгибания, ЗКС является важнейшим фактором регуляции вращения сустава при сгибании конечности более чем на 90° [18].
Диагностика повреждений КС включает изучение жалоб, анамнеза (с акцентом на выявление механизма травмы), клиническое обследование, применение методов неинвазивной визуализации структур сустава, осуществление инвазивных процедур, в том числе интраоперационной ревизии. Одной из причин сложности диагностики и ухудшения прогноза патологии КС выступает задержка обращения пациентов за медицинской помощью, что весьма характерно для спортсменов.
Важнейшим признаком повреждения КС является острое ограничение разгибания в суставе, свидетельствующее о наличии повреждения, разрывов связок или мениска, а также сочетанных поражений суставных структур [18]. Также существенным признаком повреждения связочного аппарата КС является нестабильность. Клинически значимая нестабильность отмечается при повреждениях минимум двух связок. В связи с тем, что ЗКС является основной связкой, укрепляющей зад^-наружные отделы КС, при ее разрывах наблюдается симптом «выдвижного ящика», свидетельствующий о наличии задней нестабильности КС [19].
Гемартроз не является достоверным признаком повреждения связочного аппарата, по данным артроскопии, в 40 % случаев источник кровоизлияния не выявляется, поэтому назначается консервативное лечение. В то же время гемартроз выявляется у трети больных с разрывом ЗКС [20].
Важнейшим методом диагностики повреждений связочного аппарата КС является артроскопия [20]. Проведение эндоскопического исследования при травме ЗКС существенно затруднено, сложным является выполнение осмотра заднебоковых пространств КС.
Разрывы ЗКС обычно обусловлены внешним воздействием на сустав, одним из наиболее частых вариантов является классическая «травма приборной панели», возникающая из-за направленной кзади силы, воздействующей на проксимальную часть большеберцовой кости, сопровождающейся сгибанием в коленном суставе. В легкой атлетике типичный механизм изолированных разрывов ЗКС - прямой удар по передней поверхности голени или падение на область коленного сустава при согнутой стопе. Наиболее травматичные виды спорта в этом отношении - футбол, регби, лыжи [21]. Неконтактный механизм травмы является более редким, в частности, гиперфлексия или гиперэкстензия сустава [22].
Проявления повреждения ЗКС существенно зависят от механизма воздействия (высоко- или низкоэнер-гетичная травма), а также от срока травмы. Ригидность, отек и боль в задней части коленного сустава являются типичными проявлениями этого повреждения, в то время как боль в передней части сустава и проявления нестабильности в нем при спуске по лестнице чаще связаны с длительно сохраняющимися изолированными разрывами [23, 24].
Полноценное физикальное обследование этой области при острых повреждениях сустава может быть затруднено из-за болевых ощущений и развития соответствующих защитных механизмов. При этом важное значение для диагностики нарушений состояния ЗКС играет сочетание положительных результатов специальных клинических тестов, учет механизма травмы и проявлений повреждения. Сначала необходимо осмотреть область контралатерального коленного сустава и сравнить его внешний вид с поврежденным коленом. Тест «заднего ящика» выполняется при сгибании в суставе под углом 90°, его чувствительность составляет примерно 90 %, специфичность - 99 % [25]. При этом результаты теста Лахмана могут быть ложноположительными.
Важным признаком поражения ЗКС является положительный симптом Клэнси, который проявляется нарушением нормального передне-латерального и бокового выступания большеберцового плато под бедренными мыщелками, что определяется пальпацией области сустава при 90-градусном сгибания и нейтральной ротации.
Тест Годфри выполняется при сгибании бедра и коленного сустава до 90° при поддержании ноги осматривающим специалистом. При разрыве ЗКС в передней части голени могут наблюдаться нарушения контура сустава при рассмотрении в боковом положении.
Тест четырехглавой мышцы выполняется в положении пациента лежа на спине, при этом колено сгибается на 90°, а осматривающий врач фиксирует стопу. Положительным этот тест является в тех случаях, когда пострадавший осуществляет равномерное сокращение четырехглавой мышцы.
В исследовании Moulton S.G. et al. (2015) авторы оценивали изменения при внутренней ротации, которая осуществлялась под анестезией, при этом производилась оценка движений бугра передней поверхности большеберцовой кости. Тест с использованием супинации на 60-120° характеризовался 95,5 %-ной чувствительностью и 97,1 %-ной специфичностью в отношении диагностики разрыва ЗКС III класса [26].
Дополнительные тесты применяются для оценки возможных комбинированных повреждений связок и сопутствующих внутрисуставных повреждений. В систематическом обзоре Kopkow C. et al. (2013) сообщили, что активный тест четырехглавой мышцы является наиболее специфическим в отношении выявления повреждений ЗКС [27].
Стандартные рентгенограммы выполняются для выявления наличия переломов, костных отрывов, оценки состояния суставной щели и конгруэнтности суставных поверхностей [28].
Данные наклонной стресс-рентгенографии позволяют сравнить величину смещения кзади большеберцовой кости относительно бедренной в поврежденных и неповрежденных суставах. При этом различие заднего смещения на величину от 0 до 7 мм может быть квалифицировано как частичный разрыв ЗКС, 8-11 мм - изолированный полный разрыв ЗКС, а величина заднего смещения > 12 мм свидетельствует о наличии комбинированных повреждений ЗКС и заднелатерального угла или заднемедиального повреждения коленного сустава [29].
Важным методом диагностики повреждений ЗКС является использование магнитно-резонансной томографии (МРТ), при этом чувствительность, специфичность и точность метода составляют почти 100 % [11, 30, 31]. Менее высока чувствительность МРТ при оценке хронических повреждений ЗКС, при этом может создаваться ложное впечатление восстановления формы ЗКС за счет идущего процесса заживления, несмотря на наличие остаточных повреждений связки. В связи с этим для выявления хронических повреждений коленного сустава рекомендуется использовать стрессрентгенографию [32].
В исследовании Wilson K.L. et al. (2016) были определены количественные характеристики ЗКС при использовании режимов T2 и взвешенного Т2-режима в бессимптомной популяции пациентов. Авторы сообщили о значительных различиях характеристик Т2-изображений дистальной, средней и проксимальной частей ЗКС, тем самым обосновав возможность сравнения признаков острых и хронических повреждений ЗКС. Использование МРТ представляется также важным для диагностики одновременно имеющихся признаков повреждения менисков, хрящей и связочного аппарата коленного сустава [31].
Кроме того, с помощью рентгенограмм важно оценить наклон большеберцовой кости, особенно при хронических повреждениях связок или при проведении ревизии сустава.
Пациенты с изолированными разрывами ЗКС и уменьшенным задним наклоном большеберцовой кости являются кандидатами на выполнение высокой остеотомии большеберцовой кости для увеличения наклона и, тем самым, уменьшения нагрузки на трансплантат с целью снижения вероятности его повреждения. Стресс-рентгенограммы при варусном и вальгусном отклонении также могут дать дополнительную информацию для объективной диагностики при подозрении на наличие повреждений медиальных и/или латеральных структур, выявленных при физи-кальном обследовании [30-32].
В целом при повреждениях ЗКС необходимо использование комплекса методов диагностики - клинических, рентгенологических и других. В то же время, нередко даже применение подобного подхода не позволяет точно поставить диагноз и выработать тактику лечения пострадавших.
Считается, что при изолированной травме ЗКС должно проводиться консервативное лечение в следующих случаях:
- если смещение кзади (симптом «выдвижного ящика») не более 10 мм, и величина его снижается при внутренней ротации бедра;
- если ротация в коленном суставе не более 50;
- при отсутствии видимой варусной или вальгус-ной деформации сустава, то есть I-II степени разрыва.
При отсутствии вышеуказанных признаков, а также при наличии повреждений других связочных либо костных структур КС показано выполнение хирургического вмешательства.
Подходы к лечению полных изолированных разрывов ЗКС в настоящее время активно дискутируются. В некоторых исследованиях продемонстрированы хорошие результаты после консервативного лечения частичных разрывов ЗКС, в то время как другие авторы сообщили о неудовлетворительных результатах при длительном наблюдении, характеризующихся функциональными ограничениями у данного контингента пациентов. Большинство специалистов считают, что частичные изолированные повреждения ЗКС следует лечить консервативно. Однако нарушенная биомеханика движений, перераспределение нагрузок в КС, ротационная и вальгус-варус нестабильность КС на фоне разрыва ЗКС провоцируют дегенеративные изменения суставного хряща и, как следствие, вторичные остеоартрозные изменения в травмированном КС. Наиболее уязвимыми отделами КС при разрывах ЗКС являются пателлофе-моральное сочленение и медиальные отделы. В то же время консервативное лечение полных разрывов ЗКС увеличивает риск дегенеративных изменений медиальных и пателлофеморальных анатомических структур сустава в долгосрочной перспективе, что сочетается с существенными функциональными нарушениями [33].
Тактика преимущественно консервативного лечения изолированных повреждений ЗКС была общепринятой до последнего времени [34]. Trickey E. в 1980 г., назвав ЗКС «the central pivot point of the knee» (центральной точкой опоры коленного сустава), рекомендовал раннее хирургическое лечение ее повреждений [35].
Dandy J. и Pusey R. (1982) изучив 20 пациентов с разрывами ЗКС, получавших консервативное лечение в течение 7 лет, обнаружили у 14 из них болевой синдром во время ходьбы [36]. Keller P.M. et al. (1993) изучили 40 пациентов с изолированными повреждениями ЗКС, пролеченных консервативно в среднем через 6 лет с момента травмы: 90 % продолжали испытывать боли, а 65 % пациентов отметили, что уровень их активности был ограничен, несмотря на хорошую мышечную силу [34]. По данным Parolie J. и Bergfeld J. (1986), более половины из 25 пациентов отмечали наличие болевого синдрома, а в трети случаев было отмечено наличие рентгенологических признаков развития остеоартроза коленного сустава [37].
Еще менее утешительный результат консервативного лечения был получен Fowler PJ. и Messich S.S. (1987), в их исследовании 10 из 13 пациентов после консервативного лечения повреждений ЗКС были субъективно не удовлетворены уровнем своей физической активности [38]. Признаки дегенеративных изменений хряща в медиальном отделе коленного сустава были выявлены Clancy W., Sutherland T. (1994) у 191 пациента с задней нестабильностью [39].
В связи с этим при наличии признаков полных разрывов и комбинированных повреждений ЗКС рекомендуется проведение хирургического лечения для восстановления стабильности суставов и нормализации их функции.
Консервативное лечение используется как один из вариантов лечения изолированных острых разрывов ЗКС. При этом используют динамические скобы, поскольку, как было указано выше, сила, действующая на ЗКС, изменяет свою величину при движениях в суставе, а правильно подобранная скоба обеспечивает соответствующую вариабельность усилий, которая изменяется в соответствии с величиной угла сгибания в суставе [40, 41]. Были разработаны функциональные динамические скобы, которые обеспечивают уровень приложенной силы при угле сгибания 45°, которая увеличивается с углом наклона колена [30, 41].
Тем не менее, необходимы дальнейшие клинические исследования, чтобы определить, может ли применение этих устройств нивелировать заднюю нестабильность коленного сустава после лечения разрывов ЗКС. При этом использование динамической фиксации показано как в рамках консервативного лечения, так и при послеоперационной реабилитации при разрывах ЗКС.
В случае неэффективности консервативного лечения проводится хирургическое лечение. Ранее многие специалисты выступали против оперативного лечения хронической недостаточности ЗКС в связи с неопределённостью результатов и высокой травматичностью доступов к большеберцовой и бедренной зонам прикрепления ЗКС. Другим доводом против открытой реконструкции ЗКС было образование неприемлемых с косметической точки зрения рубцов.
К настоящему времени предложен ряд методов реконструкции ЗКС, различающихся в зависимости от способов фиксации большеберцовых трансплантатов (метод транстибиального туннеля и тибиальной трансплантации), количества используемых пучков - одно-и двухпучковый методы, а также в зависимости от типа применяемого трансплантата [42, 43]. При этом все чаще используется артроскопическая техника операции, для которой характерны следующие преимущества: низкая травматичность, незначительные нарушения проприорецепции, более точное расположение костных каналов, хороший косметический эффект.
Суставной хрящ КС играет роль важного вторичного стабилизатора за счет обеспечения конгруэнтности суставных поверхностей. Его нормальная трофика и анатомия приобретают первостепенное значение у пациентов со связочной патологией. Нарушенная биомеханика движений, перераспределение нагрузок в КС, ротационная и вальгус-варусная нестабильность на фоне разрыва ЗКС провоцируют дегенеративные изменения суставного хряща и, как следствие, вторичные остеоартрозные изменения в травмированном КС. На фоне вышеизложенных тезисов целесообразно применение хондропротективной терапии (SYSADOAs -симптоматические препараты замедленного действия для лечения ОА), в частности комбинированных препаратов хондроитина сульфата и глюкозамина. Хон-дроитин сульфат, являясь основным компонентом хряща и синовиальной жидкости, оказывает хондро-протективный эффект, который реализуется через стимулирующее воздействие на анаболические процессы и ингибирующее на катаболические процессы в метаболизме хрящевой ткани. Сульфаты, содержащиеся в препарате, принимают участие в синтезе гликозамино-гликанов, а сам хондроитин, благодаря отрицательному заряду молекулы, способствует связыванию воды и поддержанию эластичности хрящевой ткани. Глюкоза-мин в хрящевом матриксе используется как субстрат для синтеза протеогликанов, глюкозаминогликанов, хондроитина и гиалуроновой кислоты [44].
По экспериментальным данным, совместное применение хондроитина и глюкозамина увеличивало продукцию гликозаминогликанов хондроцитами на 96,6 % по сравнению с 32 % при использовании каждого вещества в отдельности. Было продемонстрировано, что комбинация хондроитина и глюкозамина увеличивает синтез коллагена в клетках связок на 69 %, хондроцитах - на 56 % и теноцитах более чем на 22 %, что имеет значение для увеличения стабильности сустава [45]. Таким образом, применение комбинации хондроитина и глюко-замина (препараты глюкозамин-хондроитинсульфатов) в качестве базисной терапии у пациентов с повреждениями связок КС показано не только для профилактики сопутствующего разрушения хрящевой ткани, но и для повышения прочности связочного аппарата, в конечном итоге - для стабилизации биомеханики сустава.
В клинических условиях было показано, что комбинированные препараты хондроитина сульфата и глю-козамина тормозят деструкцию хряща, способствуя его регенерации, и уменьшают болевой синдром и ско-ванность движений, одновременно оказывая противовоспалительное действие. При курсовом применении комбинации в адекватных суточных дозах (глюкоза-мин - не менее 1500 мг, хондроитин - не менее 800 мг/ сутки) была подтверждена стабилизация изменений суставной щели (р = 0,046), в отличие от монопрепаратов, показавших результат, сопоставимый с плацебо. Прием препаратов группы глюкозамин-хондроитин-сульфатов в дозировке хондроитина сульфата 400 мг и глюкозамина 500 мг 3 раза в сутки обеспечивает поступление в организм адекватных терапевтических доз для получения структурно-модифицирующего эффекта. Применение препаратов группы глюкозамин-хондро-итинсульфатов на протяжении 9 месяцев приводило к достоверному снижению болевого синдрома и отказу от НПВП у 1/3 пациентов, при этом у 83 % больных сопровождалось значительными положительными изменениями структуры сустава, подверженными данными УЗИ: уменьшением толщины синовиальной оболочки, площади супрапателлярного заворота, размеров подколенной кисты и степени выраженности периартикуляр-ных изменений [45]. Неудивительно, что прием комбинированных препаратов в адекватных дозах способен замедлить разрушение сустава. В ряде исследований было доказано снижение частоты эндопротезирования более чем в 2 раза (р = 0,024) и снижение относительного риска на 57 % при приеме хондропротекторов по результатам 8-летнего наблюдения [46, 47].
ЗАКЛЮЧЕНИЕ
В целом анализ литературных данных показывает, что, несмотря на большое количество методов, применяемых в лечении травматических разрывов ЗКС, до настоящего времени не сформулированы показания к использованию тех или иных вариантов подходов. Длительное время основными являлись консервативные методы лечения повреждений этой связки, в то же время высокая частота неудовлетворительных исходов способствовала поиску новых подходов к лечению. В настоящее время считают, что консервативное лечение повреждений этой связи показано при отсутствии нестабильности, отсутствии боли и смещении большеберцовой кости кзади менее 10 мм. При наличии всех вышеперечисленных признаков рекомендуется выполнять артроскопическую реконструкцию ЗКС.
Суставной хрящ КС играет роль важного вторичного стабилизатора КС за счет обеспечения конгруэнтности суставных поверхностей. Его нормальная трофика и анатомия приобретают первостепенное значение у пациентов со связочной патологией. Нарушенная биомеханика движений, перераспределение нагрузок в КС, ротационная и вальгус-варусная нестабильность КС на фоне разрыва ЗКС провоцируют дегенеративные изменения суставного хряща и, как следствие, вторичные осте-оартрозные изменения в травмированном КС. Наиболее уязвимыми отделами КС при разрывах ЗКС являются пателлофеморальное сочленение и медиальные отделы. На основании вышеизложенных тезисов целесообразно обращать особое внимание на профилактику вторичного остеоартроза у пациентов с разрывами ЗКС. Наиболее эффективным препаратом группы хондропротекторов является комбинация хондроитина и глюкозамина. Прием препаратов из группы глюкозамин-хондроитинсуль-фатов, положительно влияющих на трофику хрящевой и связочной ткани, ускоряет метаболизм суставного хряща и повышает его регенеративные возможности, чем отсрочивает время возникновения и тяжесть остеоартрозных изменений в травмированном КС.
ЛИТЕРАТУРА
1. Lee Y.S., Lee O.S., Lee S.H. Return to Sports After Athletes Undergo Meniscal Surgery: A Systematic Review // Clin. J. Sport Med. 2017. Vol. 29, No 1. P. 29-36. DOI: 10.1097/JSM.0000000000000500.
2. The UEFA injury study: 11-year data concerning 346 MCL injuries and time to return to play / M. Lundblad, M. Walden, H. Magnusson, J. Karlsson,
J. Ekstrand// Br. J. Sports Med. 2013. Vol. 47, No 12. P. 759-762. DOI: 10.1136/bjsports-2013-092305.
3. Acute isolated injury of the posterior cruciate ligament treated by a dynamic anterior drawer brace: a preliminary report / M. Jacobi, N. Reischl,
P. Wahl, E. Gautier, R.P. Jakob // J. Bone Joint Surg. Br. 2010. Vol. 92, No 10. P. 1381-1384. DOI: 10.1302/0301-620X.92B10.24807.
4. Knee Stability and Movement Coordination Impairments: Knee Ligament Sprain Revision 2017 / D.S. Logerstedt, D. Scalzitti, M.A. Risberg, L. Engebretsen, K.E. Webster, J. Feller, L. Snyder-Mackler, M.J. Axe, C.M. McDonoug // J. Orthop. Sports Phys. Ther. 2017. Vol. 47, No 11. P. A1-A47. DOI: 10.2519/jospt.2017.0303.
5. A multisport epidemiologic comparison of anterior cruciate ligament injuries in high school athletics / A.M. Joseph, C.L. Collins, N.M. Henke, E.E. Yard, S.K. Fields, R.D. Comstock // J. Athl. Train. 2013. Vol. 48, No 6. P. 810-817. DOI: 10.4085/1062-6050-48.6.03.
6. Bai X.S., Thomas J.M., Ha A.S. Surgical Correction of Articular Damage in the Knee: Osteoarticular Transplantation to Joint Reconstruction // Semin. Musculoskelet. Radiol. 2017. Vol. 21, No 2. P. 147-164. DOI: 10.1055/s-0037-1599211.
7. Безъязычная О.В. Лечебная физическая культура в комплексной физической реабилитации после артроскопической операции по поводу разрыва связок коленного сустава // Слобожанський науково-спортивний вкник. 2013. № 2 (35). С. 144-146.
8. Современные подходы к хирургическому лечению хронической задней нестабильности коленного сустава (обзор литературы) / И.А Кузнецов, Н.Ф. Фомин, Д.А. Шулепов, М.Р. Салихов // Травматология и ортопедия России. 2015. № 1. С. 95-105.
9. The Posteromedial Corner of the Knee: Anatomy, Pathology, and Management Strategies / A.P. Dold, S. Swensen, E. Strauss, M. Alaia // J. Am. Acad. Orthop. Surg. 2017. Vol. 25, No 11. P. 752-761. DOI: 10.5435/JAAOS-D-16-00020.
10. Changing presentation of knee dislocation and vascular injury from high-energy trauma to low-energy falls in the morbidly obese / A.G. Georgiadis, F.H. Mohammad, K.T. Mizerik, T.J. Nypaver, A.D. Shepard // J. Vasc. Surg. 2013. Vol. 57, No 5. P. 1196-1203. DOI: 10.1016/j.jvs.2012.11.067.
11. Bedi A., Musahl V., Cowan J.B. Management of posterior cruciate ligament injuries: an evidence-based review // J. Am. Acad. Orthop. Surg. 2016. Vol. 24, No 5. P. 277-289. DOI: 10.5435/JAAOS-D-14-00326.
12. The effect of posterior cruciate ligament deficiency on knee kinematics / M. Logan, A. Williams, J. Lavelle, W. Gedroyc, M. Freeman // Am. J. Sports Med. 2004. Vol. 32, No 8. P. 1915-1922.
13. Posterior cruciate ligament graft fixation angles, part 1: biomechanical evaluation for anatomic single-bundler reconstruction / N.I. Kennedy,
R. F. LaPrade, M.T. Goldsmith, S.C. Faucett, M.T. Rasmussen, G.A. Coatney, L. Engebretsen, C.A. Wijdicks // Am. J. Sports Med. 2014. Vol. 42, No 10. P. 2338-2345. DOI: 10.1177/0363546514541225.
14. Arthroscopically pertinent anatomy of the anterolateral and posteromedial bundles of the posterior cruciate ligament / C.J. Anderson, C.G. Ziegler, C.A. Wijdicks, L. Engebretsen, R.F. LaPrade // J. Bone Joint Surg. Am. 2012. Vol. 94, No 21. P. 1936-1945. DOI: 10.2106/JBJS.K.01710.
15. Kinematic analysis of the posterior cruciate ligament, part 1: the individual and collective function of the anterolateral and posteromedial bundles / N.I. Kennedy, C.A. Wijdicks, M.T. Goldsmith, M.P. Michalski, B.M. Devitt, A. Ar0en, L. Engebretsen, R.F. LaPrade // Am. J. Sports Med. 2013. Vol. 41, No 12. P. 2828-2838. DOI: 10.1177/0363546513504287.
16. Long-term outcomes following single-bundle transtibial arthroscopic posterior cruciate ligament reconstruction / T. Boutefnouchet, M. Bentayeb, Q. Qadri, S. Ali // Int. Orthop. 2013. Vol. 37, No 2. P. 337-343. DOI: 10.1007/s00264-012-1609-3.
17. Surgical management of knee dislocations / C.D. Harner, R.L. Waltrip, C.H. Bennett, K.A. Francis, B. Cole, J.J. Irrgang // J. Bone Joint. Surg. Am. 2004. Vol. 86, No 2. P. 262-273.
18. Adolescent patellar instability: current concepts review / D. Clark, A. Metcalfe, C. Wogan, V. Mandalia, J. Eldridge // Bone Joint J. 2017. Vol. 99-B, No 2. P. 159-170. DOI: 10.1302/0301-620X.99B2.BJJ-2016-0256.R1.
19. Femoral positioning influences ipsi- and contralateral anterior cruciate ligament rupture following its reconstruction: Systematic review and metaanalysis / G.C. de Campos, P.E.P. Teixeira, A. Castro, W.M. Alves Junior // World J. Orthop. 2017. Vol. 8, No 8. P. 644-650. DOI: 10.5312/wjo. v8.i8.644.
20. Fanelli G.C., Giannotti B.F., Edson C.J. Arthroscopically assisted combined posterior cruciate ligament/posterior lateral complex reconstruction / Arthroscopy. 1996. Vol. 12, No 5. P. 521-530.
21. Systematic reviews keep arthroscopy up to date / J.H. Lubowitz, J.C. Brand, M.T. Provencher, M.J. Rossi // Arthroscopy. 2016. Vol. 32, No 2. P. 237. DOI: 10.1016/j.arthro.2015.12.002.
22. Strickland J.P., Fester E.W., Noyes F.R. Lateral, posterior, and cruciate knee anatomy. In: Noyes’ Knee Disorders: surgery, rehabilitation, clinical outcomes / Noyes F.R., editor. Philadelphia: Saunders, 2009. P. 20-43.
23. Revision posterior cruciate ligament reconstruction using a modified tibial-inlay double-bundle technique / S.H. Lee, Y.B. Jung, H.J. Lee, H.J. Jung, S. H. Kim // J. Bone Joint Surg. Am. 2012. Vol. 94, No 6. P. 516-522. DOI: 10.2106/JBJS.K.00030.
24. Biomechanical Comparison of Single-Bundle and Double-Bundle Posterior Cruciate Ligament Reconstruction: A Systematic Review and MetaAnalysis / D.Y. Lee, D.H. Kim, H.J. Kim, D.C. Nam, J.S. Park, S.C. Hwang // JBJS Rev. 2017. Vol.5, No 10. P. e6. DOI: 10.2106/JBJS.RVW.17.00008.
25. Changes in knee laxity and ligament force after sectioning the posteromedial bundle of the posterior cruciate ligament / K.L. Markolf, B.T. Feeley, S. G. Tejwani, D.E. Martin, D.R. McAllister // Arthroscopy. 2006. Vol. 22, No 10. P. 1100-1106.
26. The Supine internal rotation test: a pilot study evaluating tibial internal rotation in grade III posterior cruciate ligament tears / S.G. Moulton, T. R. Cram, E.W. James, G.J. Dornan, N.I. Kennedy, R.F. LaPrade // Orthop. J. Sports Med. 2015. Vol. 3, No 2. 2325967115572135. DOI: 10.1177/2325967115572135.
27. Physical examination tests for the diagnosis of posterior cruciate ligament rupture: a systematic review / C. Kopkow, A. Freiberg, S. Kirschner, A. Seidler, J. Schmitt // J. Orthop. Sports Phys. Ther. 2013. Vol. 43, No 11. P. 804-813. DOI: 10.2519/jospt.2013.4906.
28. Spiridonov S.I., Slinkard N.J., LaPrade R.F. Isolated and combined grade-III posterior cruciate ligament tears treated with double-bundle reconstruction with use of endoscopically placed femoral tunnels and grafts: operative technique and clinical outcomes // J. Bone Joint Surg. Am. 2011. Vol. 93, No 19. P. 1773-1780. DOI: 10.2106/JBJS.J.01638.
29. Intraobserver and interobserver reliability of the kneeling technique of stress radiography for the evaluation of posterior knee laxity / T. Jackman, R. F. LaPrade, T. Pontinen, P.A. Lender // Am. J. Sports Med. 2008. Vol. 36, No 8. P. 1571-1576. DOI: 10.1177/0363546508315897.
30. Quantification of functional brace forces for posterior cruciate ligament injuries on the knee joint: an in vivo investigation / R.F. LaPrade, S.D. Smith, K.J. Wilson, C.A. Wijdicks // Knee Surg. Sports Traumatol. Arthrosc. 2015. Vol. 23, No 10. P. 3070-3076. DOI: 10.1007/s00167-014-3238-4.
31. Quantifiable imaging biomarkers for evaluation of the posterior cruciate ligament using 3-T magnetic resonance imaging: a feasibility study / K. J. Wilson, R.K. Surowiec, C.P. Ho, B.M. Devitt, J. Fripp, W.S. Smith, U.J. Spiegl, G.J. Dornan, R.F. LaPrade // Orthop. J. Sports Med. 2016. Vol. 4, No 4. 2325967116639044. DOI: 10.1177/2325967116639044.
32. The reproducibility and repeatability of varus stress radiographs in the assessment of isolated fibular collateral ligament and grade-III posterolateral knee injuries. An in vitro biomechanical study / R.F. LaPrade, C. Heikes, A.J. Bakker, R.B. Jakobsen // J. Bone Joint Surg. Am. 2008. Vol. 90, No 10. P. 2069-2076. DOI: 10.2106/JBJS.G.00979.
33. The effect of posterior cruciate ligament reconstruction on patellofemoral contact pressures in the knee joint under simulated muscle loads / T.J. Gill, L. E. DeFrate, C. Wang, C.T. Carey, S. Zayontz, B. Zarins, G. Li // Am. J. Sports Med. 2004. Vol. 32, No 1. P. 109-115.
34. Nonoperatively treated isolated posterior cruciate ligament injuries / P.M. Keller, K.D. Shelbourne, J.R. McCarroll, A.C. Rettig // Am. J. Sports Med. 1993. Vol. 21, No 1. P. 132-136.
35. Trickey E.L. Injuries to the posterior cruciate ligament: diagnosis and treatment of early injuries and reconstruction of late instability // Clin. Orthop. Relat. Res. 1980. No 147. P. 76-81.
36. Dandy D.J., Pusey R.J. The long-term results of unrepaired tears of the posterior cruciate ligament // J. Bone Joint Surg. Br. 1982. Vol. 64, No 1. P. 92-94.
37. Parolie J.M., Bergfeld J.A. Long-term results of nonoperative treatment of isolated posterior cruciate ligament injuries in the athlete // Am. J. Sports Med. 1986. Vol. 14, No 1. P. 35-38.
38. Fowler P.J., Messieh S.S. Isolated posterior cruciate ligament injuries in athletes // Am. J. Sports Med. 1987. Vol. 15, No 6. P. 553-557.
39. Clancy W.G. Jr., Sutherland T.B. Combined posterior cruciate ligament injuries // Clin. Sports Med. 1994. Vol. 13, No 3. P. 629-647.
40. Shelbourne K.D., Clark M., Gray T. Minimum 10-year follow-up of patients after an acute, isolated posterior cruciate ligament injury treated nonoperatively // Am. J. Sports Med. 2013. Vol. 41, No 7. P. 1526-1533. DOI: 10.1177/0363546513486771.
41. A historical perspective of PCL bracing / K.S. Jansson, K.E. Costello, L. O’Brien, C.A. Wijdicks, R.F. LaPrade // Knee Surg. Sports Traumatol. Arthrosc. 2013. Vol. 21, No 5. P. 1064-1070. DOI: 10.1007/s00167-012-2048-9.
42. Panchal H.B., Sekiya J.K. Open tibial inlay versus arthroscopic transtibial posterior cruciate ligament reconstructions // Arthroscopy. 2011. Vol. 27, No 9. P. 1289-1295. DOI: 10.1016/j.arthro.2011.04.007.
43. Kinematic analysis of the posterior cruciate ligament, part 2: a comparison of anatomic single- versus double-bundle reconstruction / C.A. Wijdicks, N.I. Kennedy, M.T. Goldsmith, B.M. Devitt, M.P. Michalski, A. Ar0en, L. Engebretsen, R.F. LaPrade // Am. J. Sports Med. 2013. Vol. 41, No 12. P. 2839-2848. DOI: 10.1177/0363546513504384.
44. Jerosch J. Effects of Glucosamine and Chondroitin Sulfate on Cartilage Metabolism in OA: Outlook on Other Nutrient Partners Especially Omega-3 Fatty Acids // Int. J. Rheumatol. 2011. Vol. 2011. 969012.
45. Чичасова Н.В. Современные рекомендации по лечению остеоартроза // Consilium Medicum. 2016. Т. 18, № 2. С. 124-133.
46. Total joint replacement after glucosamine sulphate treatment in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year, randomised, placebo-controlled trials / O. Bruyere, K. Pavelka, L.C. Rovati, J. Gatterova, G. Giacovelli, M. Olejarova, R. Deroisy, J.Y. Reginster // Osteoarthritis Cartilage. 2008. Vol. 16, No 2. P. 254-260.
47. Михайлова А.С., Теплякова О.В., Соколова Л.А. Влияние локальной терапии гонартроза препаратами гиалуроновой кислоты различной молекулярной массы на динамику альгофункциональных показателей // Фарматека. 2011. № 19. С. 74-78.
АВТОР
1. Королев Андрей Вадимович, д. м. н., профессор, Европейская клиника спортивной травматологии и ортопедии (ECSTO), г. Москва, Россия; ФБАОУ ВО РУДН, г. Москва, Россия
2. Афанасьев Алексей Павлович, к. м. н., Европейская клиника спортивной травматологии и ортопедии (ECSTO), г. Москва, Россия
3. Герасимов Денис Олегович, к. м. н., Европейская клиника спортивной травматологии и ортопедии (ECSTO), г. Москва, Россия
4. Ильин Дмитрий Олегович, к. м. н., Европейская клиника спортивной травматологии и ортопедии (ECSTO), г. Москва, Россия
5. Рязанцев Михаил Сергеевич, к. м. н., Европейская клиника спортивной травматологии и ортопедии (ECSTO), г. Москва, Россия
6. Каданцев Павел Михайлович, Европейская клиника спортивной травматологии и ортопедии (ECSTO), г. Москва, Россия; ФБАОУ ВО РУДН, г. Москва, Россия,
Теги: коленный сустав
234567 Начало активности (дата): 04.03.2021 14:45:00
234567 Кем создан (ID): 989
234567 Ключевые слова: коленный сустав, повреждения связок, задняя крестообразная связка, разрыв задней крестообразной связки, консервативное лечение, хирургическое лечение, хондропротекторы, вторичный остеоартрит, ортезирование
12354567899
Похожие статьи
Многоуровневый спондилолиз поясничных позвонков: описание клинического наблюдения и обзор литературыРентген на дому 8 495 22 555 6 8
Современные подходы к лечению повреждений ладьевидно-полулунной связки кистевого сустава (обзор литературы)
Консервативное лечение асептического некроза головки бедренной кости у взрослых (обзор литературы)
Возможности применения обратной ходьбы при патологии коленного сустава (обзор литературы)



