 02.07.2020
02.07.2020
Современное состояние вопроса костной пластики при лечении асептического некроза полулунной кости
Лидирующие позиции в лечении болезни Кинбека отводятся методу костной пластики в связи с его наибольшей эффективностью и удовлетворенностью хирургов и пациентов исходами операции. Наилучшие результаты удается достичь при использовании васкуляризированной костной пластики.
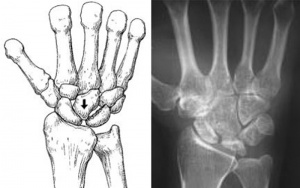
Полулунная кость занимает центральное и наиболее выдвинутое в проксимальном направлении положение среди других костей запястья и, располагаясь по оси максимальной нагрузки между лучевой костью и головчатой, подвергается при физической работе механическому воздействию больше, чем другие кости запястья.
Этим обстоятельством объясняется, почему полулунная кость неизмеримо чаще других костей запястья поражается асептическим некрозом, впервые описанным столетие назад Кинбеком. За этот период времени разработан широкий спектр хирургических и терапевтических мероприятий для лечения заболевания. Конечная цель этих биомеханических концепций состоит в том, чтобы избежать коллапса и остеоартрита запястья.
При этом неоспоримым является факт, что дифференцированная терапия должна быть основана на анатомических условиях и стадии болезни.
Течение и ход процессов в полулунной кости при асептическом некрозе непредсказуемы. В настоящее время известно множество способов лечения болезни Кинбека в зависимости от стадии заболевания, но даже вовремя начатое лечение современными методами не всегда приносит желаемый результат.
Если диагноз установлен на ранней стадии заболевания, предпочтение отдают консервативной терапии в совокупности с физиотерапией и длительной иммобилизацией в лонгете либо в аппарате Илизарова.
В систематическом обзоре, опубликованном в 2010 году и включающем в себя анализ всех тематических публикаций базы данных PubMed, Medline и Кокрейновского сотрудничества за период с 1998 по 2008 год [12], обобщены методы лечения болезни Кинбека в зависимости от стадии заболевания. К ранней стадии были отнесены в соответствии с классификацией Лихтмана стадии I, II и IIIа, а к поздней – IIIб и IV. Для пациентов с легкой степенью заболевания применялись такие методы лечения как васкуляризированная костная пластика (ВКП), метафизиальная декомпрессия, лучевая остеотомия. В свою очередь, в группе пациентов с тяжелой степенью заболевания были представлены методы ВКП, лучевая остеотомия, частичный артродез, удаление проксимального ряда костей запястья, сухожильная артропластика и консервативное лечение.
Авторы обзора оценивали эффективность лечения по сравнению с плацебо или невмешательством в естественный ход течения болезни по четырем признакам: боль в кисти, объем и сила движений в суставе, рентгенологическая картина. Проанализировав эти параметры, составители обзора пришли к выводу, что ни один из хирургических методов лечения не устраняет все их негативные составляющие. Однако статистически достоверное увеличение объема и силы движений в суставе по сравнению с плацебо отмечено при применении метода ВКП и лучевой остеотомии на ранней стадии заболевания и после всех хирургичских вмешательств, исключая частичный артродез, на поздней стадии.
Совершенно очевидно, что для объективной оценки эффективности отдельных действующих методов лечения необходим анализ отдаленных результатов. Так, в обзоре 2010 года [18] рассмотрены 20 исследований с наблюдением исходов лечения более 10 лет.
Авторы оценивали наиболее часто применяемые методы хирургического лечения ВКП, декомпрессионную остеотомию и «паллиативные» операции - частичный артродез, удаление полулунной кости, удаление проксимального ряда костей запястья – на поздней стадии. Декомпрессионная остеотомия обеспечивает улучшение объема движений в 80-87 % случаев, безболевую стадию в 20-67 %, прогрессирование болезни в 20-50 % и остеоартрит– в 25-73 % случаев. В свою очередь, применение ВКП в 68-81 % случаев вызывает улучшение объема движений, безболевую стадию в 35-72 % и остеоартрит– в 32-40 % случаев. Что же касается частичного артродеза, увеличение объема движений отмечено в 61-78% случаев, безболевая стадия в 38-50 %, и остеоартрит – в 24-48 % случаев.
Итак, исходя из приведенных литературных данных, можно с большой уверенностью заявлять, что на сегодняшний день лидирующие позиции в лечении болезни Кинбека остаются за методом костной пластики в связи с его наибольшей эффективностью и удовлетворенностью пациентов результатами лечения. При этом в арсенале травматологии и ортопедии имеется достаточный выбор вариантов устранения костных дефектов с помощью свободных или васкуляризированных аутотрансплантатов.
Многие авторы предлагают сочетать ВКП с другими методами лечения для достижения максимального эффекта, например, с декомпрессионной (лучевой, головчатой) остеотомией [1, 25, 35], частичным межзапястным артродезом (полулунно-ладьевидно-головчатым) [1, 8].
Костная пластика свободными трансплантатами
Свободная костная пластика производится забором трансплантата от его донорского участка кровоснабжения и перемещением в реципиентное ложе с включением в систему местного кровоснабжения. Свободные костные трансплантаты подразделяются на кортикальные и губчатые.
Исторически проводились реконструктивные операции на верхней конечности с применением свободного костного трансплантата после резекции опухоли, инфекций или травмы. Самым известным является свободный костный трансплантат с гребня подвздошной кости, который был разработан Matti-Russe в 1936 году [9, 26].
Отличительной особенностью данного трансплантата является его высокая остеогенная активность, обусловленная губчатым строением подвздошной кости. Это является его основным преимуществом перед другими костными трансплантатами. Так как предложенный метод дает достаточно хорошие результаты лечения, прост в техническом исполнении и относительно малотравматичен, он и по сей день широко применяется в клинической практике. К настоящему времени представлены методики забора свободных костных трансплантатов с медиального мыщелка бедра [15], с нехрящевой части ребра [21], с ипсилатеральной поверхности дистального эпифиза лучевой кости [36], из локтевого отростка локтевой кости [6].
К недостаткам свободных костных трансплантатов можно отнести частичный лизис пересаженной кости; длительные сроки иммобилизации для перестройки костной ткани и приживления трансплантата в реципиентном ложе; высокий риск развития гнойной инфекции в лишенной источника питания кости, причем костный трансплантат нередко может сам становится источником вторичных инфекционных процессов в ране; зависимость положительного исхода лечения от местного кровоснабжения окружающих тканей.
Костная пластика васкуляризированными костными трансплантатами
Наиболее перспективным и оправдывающим себя не одно десятилетие является метод КП трансплантатами, связанными с источником кровоснабжения, в различных вариациях. Участок кости, пересаженный вместе с надкостницей без нарушения ее связи с окружающими мягкими тканями, васкуляризируется за счет мышечно-периостальных сосудов.
Трансплантаты на сосудистой ножке могут быть просто костными, а могут включать кость, мышцу, фасцию и кожу.
Особое место среди других методов лечения ВКП занимает в связи с тем, что несвободные костные аутотрансплантаты в принимающем ложе ведут себя как живая, хорошо васкуляризированная кость.
При этом репаративные процессы идут одновременно как со стороны реципиентного ложа, так и со стороны кровоснабжаемого костного аутотрансплантата, что существенно сокращает сроки консолидации последнего [2, 3]. ВКП является методом выбора для лечения определенных типов патологии запястья и традиционно применяется при несрастающихся переломах ладьевидной кости, асептических некрозах полулунной (болезнь Кинбека) и ладьевидной костей (болезнь Преизера) [31].
При помощи сосудистой ножки поддерживается кровоснабжение костного трансплантата в реципиентном ложе. Следовательно, местоположение донорского участка кости относительно зоны его перемещения регламентируется длиной сосудистой ножки и должно находиться в непосредственной близости от реципиентного ложа. Несмотря на техническую сложность операций, в настоящее время в клинической практике ВКП признается наиболее часто применяемой и эффективной методикой в
лечении асептического некроза полулунной кости.
На сегодняшний день, как показывает клинический опыт, наиболее актуальным является применение метода ВКП для лечения как ранних, так и поздних стадий асептического некроза полулунной кости.
Включение несвободного кровоснабжаемого костного аутотрансплантата в зону деструкции костей запястья проводится для заполнения дефекта костной ткани, фиксации фрагментов поражённой кости между собой и создания оптимальных условий для образования костной мозоли. Кровоснабжаемый костный трансплантант является источником остеобластов и остеоцитов, которые обеспечивают полноценную остеорепарацию в сроки, сопоставимые с неосложненной консолидацией переломов костей запястья. Тем самым создаются условия для своевременного и полноценного восстановления функции кисти и верхней конечности в целом [1].
Анатомия кровоснабжения донорских участков кисти, используемых для ВКП
Кровоснабжение дистального метаэпифиза лучевой и локтевой костей происходит из лучевой, локтевой, передней и задней межкостных артерий. Существуют постоянные анастомозы между передней ветвью передней межкостной артерии и ладонной дугой запястья и также между передней и задней межкостными артериями и тыльной дугой запястья.
Сосуды, питающие ладонную поверхность дистального эпифиза лучевой кости, исходят из лучевой артерии, ладонной дуги запястья и передней ветви передней межкостной артерии. Местами их вхождения в лучевую кость являются шиловидный отросток, дорсальный бугорок и локтевая вырезка.
Более проксимально, в области метафиза, множество периостальных и кортикальных ветвей отходит от передней межкостной артерии в пределах мышцы – квадратного пронатора.
Наиболее крупным и постоянным источником питания тыльно-латеральной поверхности проксимального отдела первой пястной кости являются периостальные ветви тыльной артерии первого пальца кисти и сопутствующие вены. Кровоснабжение тыльной поверхности оснований второй, третьей, четвертой пястных костей осуществляется постоянными надкостничными ветвями, отходящими от первой, второй и третьей тыльных пястных артерий с сопутствующими венами.
Источником кровоснабжения латерального края дистального метаэпифиза лучевой кости являются проксимальная и дистальная питающие надкостничные ветви лучевой артерии с сопутствующими венами. Основным анатомически постоянным источником кровоснабжения медиального края дистального метаэпифиза лучевой кости является надкостничная ветвь передней межкостной артерии с сопутствующими венами [5].
Сосуды, кровоснабжающие тыльную поверхность дистального метаэпифиза лучевой кости, могут быть разделены на две категории: в пределах удерживателя разгибателей и поверхностно от него. Сосуды отходят от лучевой и локтевой передней межкостной и задней межкостной артерии.
Они дают начало трем ладонным дугам: тыльная межзапястная дуга, тыльная лучезапястная дуга и тыльная супраретикулярная дуга. Сосуды удерживателя разгибателей подразделяются на внутриканальные и межканальные, находящиеся на его поверхности – супраретикулярные. Четыре основных сосуда могут использоваться в качестве ножек для ВКП: артерия, проходящая между первым и вторым каналами сухожилий разгибателей (поверхностная по отношению к удерживателю разгибателей); артерия, проходящая между вторым и третьим каналами сухожилий разгибателей; артерия, проходящая в четвертом канале сухожилий разгибателей; артерия, проходящая в пятом канале сухожилий разгибателей.
Артерия, проходящая между первым и вторым каналами сухожилий разгибателей, ответвляется от лучевой артерии на 1,9 мм проксимальнее вершины шиловидного отростка.
Средняя длина ее ножки составляет 22,3 мм. Среднее количество перфорантов из ее ножки – 5,5. Самая лучшая сосудистая пенетрация отмечена на 10,0 мм проксимальнее шиловидного отростка [35].
Артерия, проходящая между вторым и третьим каналами сухожилий разгибателей, отходит от передней межкостной артерии. Преимущества ее использования – длинная сосудистая ножка и возможность забора значительного по объему костного трансплантата.
Артерия, проходящая в четвертом канале сухожилий разгибателей, располагается на лучевой стороне 4 синовиального влагалища разгибателей. Она отходит от передней межкостной артерии самостоятельно или от артерии, проходящей в пятом канале сухожилий разгибателей, и анастомозирует с тыльной межзапястной дугой и лучезапястной дугой.
Артерия, проходящая в пятом канале сухожилий разгибателей, отделяется от передней межкостной артерии и дистально анастомозирует с тыльной межзапястной дугой. Также она дистально соединяется с артерией, проходящей в четвертом канале сухожилий разгибателей, и тыльной лучезапястной дугой [20].
Донорские участки для ВКП
Анатомические аспекты кровоснабжения области лучезапястного сустава позволяют разделить все имеющиеся варианты донорских участков для проведения ВКП на 4 группы:
1. Трансплантаты из эпифиза лучевой кости –наиболее часто встречающиеся трансплантаты в связи со своим близким местоположением относительно костей запястья. Тыльная поверхность лучевой кости (рис. 1).
Для лечения патологии ладьевидной кости удобно забирать трансплантат из области локтевой вырезки на сосудистой ножке с артерий, проходящих в 4 или 5 каналах, которые часто не отделяются друг от друга для удлинения сосудистой ножки [16, 28, 31]. Возможен вариант применения костного трансплантата из области дорсального бугорка на сосудистой ножке артерии между вторым и третьим каналами разгибателей для лечения болезни Киинбека [17, 29, 33, 34]. Следует отметить, что трансплантат лежит одинаково близко как к полулунной, так и к ладьевидной кости, что позволяет использовать его в обоих случаях. Ладонная поверхность лучевой кости (рис. 2).
Васкуляризированные костные трансплантаты с ладонной поверхности лучевой кости достаточно часто применяются при лечении патологии костей запястья, хотя и в значительно меньшей степени, чем трансплантаты с тыльной поверхности. В качестве сосудистой ножки используется ладонная запястная ветвь лучевой артерии.
Трансплантат забирается с переднемедиальной поверхности лучевой кости [13, 19, 24].
Костный трансплантат на артерии мышцы – квадратного пронатора (рис. 2).
В данной группе трансплантатов из лучевой кости, несомненно, необходимо представить трансплантат на сосудистой ножке от мышцы квадратный пронатор. Артерия мышцы квадратный пронатор является постоянной ветвью передней межкостной артерии. Существуют методики забора корково-губчатого трансплантата с передней [22] и тыльной поверхности шиловидного отростка лучевой кости [10] на сосудистой ножке с нижних волокон мышцы квадратный пронатор.
Трансплантаты с ладонной поверхности дистального эпифиза локтевой кости (рис. 2).
Костные трансплантаты из локтевой кости описаны в литературе, но используются достаточно редко. Авторы предлагают забирать донорский участок кости с переднемедиальной поверхности эпифиза локтевой кости на локтевой артерии [11]. Костные трансплантаты из костей запястья (рис. 3).
Кровоснабжение происходит из тыльной ветви передней межкостной артерии. Противники этого метода полагают, что в связи с изменением нормальной анатомии запястья увеличивается вероятность развития симптоматических артритов. Гороховидная кость перемещается на кубито-дорсальной артерии, ветви локтевой артерии [7, 32]. Костные трансплантаты из пястных костей (рис. 4).
В настоящее время для пластики проксимального ряда костей запястья используются донорские участки с I, II, III и IV пястных костей.
На первой пястной кости описаны варианты донорского участка с радиодорсальной или ульнодорсальной стороны, который может быть выделен как комбинированный кожно-костный трансплантат [30]. Этот вариант костной пластики может быть показан в большей мере при патологии ладьевидной кости в связи с относительной близостью расположения донорской и реципиентной областей.
Другими преимуществами трансплантата являются поверхностное расположение всех структур и наличие четких анатомических ориентиров – длинного и короткого разгибателя первого пальца [5].
Удобным с точки зрения анатомии является разработанный нами метод костной пластики на втором тыльном метакарпальном сосудистом пучке путем перемещения костно-мышечного аутотрансплантата из дистального метадиафиза II или III пястной
Трансплантат забирается кортикально-губчатый. Размеры его могут варьировать в длину от 3 до 8 мм. Длина его сосудистой ножки 25-40 мм, диаметр сосудов 0,8-1,5 мм. Недостатком является отсутствие сосудистой ножки в 9 % случаев.
Другим донорским участком II, III пястных костей является проксимальный эпиметафиз, который кровоснабжается тыльной запястной ветвью лучевой артерии. Диаметр сосудов достаточно большой и составляет 1,0-1,4 мм, длина сосудистой ножки 20-30 мм, что позволяет произвести транспозицию костного фрагмента как для реваскуляризации ладьевидной, так и полулунной костей. Трансплантат забирается кортикально-губчатый. Размеры его 8-12 мм в длину и 5-8 мм в ширину. В 3 % случаев, по нашим наблюдениям, отсутствует перфорантная ветвь, являющаяся продолжением тыльной запястной ветви лучевой артерии [4].
Также описаны костные лоскуты с тыльной поверхности проксимального отдела III, IV пястных костей на третьей тыльной пястной артерии, средней части тыльной запястной ветви лучевой артерии и тыльной ветви передней межкостной артерии [5].
Зачастую в качестве сосудистой ножки выделяют вторую тыльную метакарпальную артерию и вену. При этом предлагается первым этапом иссечение патологических тканей полулунной кости с сохранением кортикального слоя. Затем заполнение образовавшегося отверстия губчатым веществом с дистального конца лучевой кости и перемещением сосудистой ножки [27].
ВЫВОДЫ
В обзоре освещено современное состояние вопроса лечения асептического некроза полулунной кости с подробной характеристикой методов костной пластики в качестве основного хирургического мероприятия на всех стадиях заболевания.
Метод СКП имеет право на существование и применяется в клинической практике наряду с ВКП в связи с относительной технической легкостью и вполне удовлетворительными результатами лечения.
Показания к применению того или иного вида ВКП необходимо определять в зависимости от интраоперационно выявленных вариантов ангиоархитектоники кисти, наличия и длины сосудистой ножки, величины диаметра ее сосудов.
Наиболее удобными к применению и анатомически выгодными, по нашему мнению, являются васкуляризированные трансплантаты, получаемые из тыльного доступа, из дистального эпиметафиза лучевой кости на сосудистой ножке с артерий, проходящих в 4 или 5 каналах сухожилий разгибателей кисти, а также из дистального и проксимального эпиметафизов 2-3 пястных костей на второй тыльной метакарпальной артерии.
ЗАКЛЮЧЕНИЕ
За столетний период, прошедший с открытия болезни Кинбека, разработано множество различных методик лечения, что связано с неблагоприятными результатами консервативной терапии и, во многих случаях, крайне неудовлетворительными результатами оперативного вмешательства.На современном этапе развития медицины методы реконструкции костных структур нашли широкое применение в клинике, а успехи, достигнутые в этой области хирургии, привели к значительному сокращению сроков лечения, снижению процентов неудовлетворительных исходов у больных, страдающих асептическим некрозом полулунной кости.
Исключительная роль, как наиболее эффективному и достоверно доказанному методу лечения на любой стадии заболевания, отводится методу васкуляризированной костной пластики. При этом стоит заметить, что первоначально появился метод свободной костной пластики, который в настоящее время также достаточно активно применяется в клинической практике благодаря относительной технической легкости исполнения по сравнению с ВКП. Однако ВКП имеет неоспоримые преимущества перед СКП в результате того, что обеспечивает кровоток в зоне поражения, сохранение остеоцитов и, следовательно, ускоренные темпы заживления. А количество разработанных и апробованных в клинике донорских участков для ВКП подтверждает удовлетворенность практикующих хирургов выбором этого метода лечения.
ЛИТЕРАТУРА
1.Колесникова И.В. Реконструктивно-восстановительные операции на костях запястья с использованием кровоснабжаемого аутотрансплантата: автореф. ... канд. мед. наук Омск, 2010. 18 с.
2.Кудяшев А.Л., Губочкин Н.Г. Оценка кровоснабжения несвободного костного аутотрансплантата при лечении больного с ложным суставом ладьевидной кости запястья (клиническое наблюдение) // Травматология и ортопедия России. 2008. No 1(47). С. 59-61.
3.Кузанов А.И. Реваскуляризация костной ткани васкуляризированными надкостнично-кортикальными аутотрансплантатами: автореф. дис. ... канд. мед. наук. М., 2005. 20 с.
4.Топыркин В.Г. Лечение несросшихся переломов, ложных суставов ладьевидной, асептических некрозов полулунной костей кисти васкуляризированной костной пластикой и аппаратом Илизарова: автореф. дис. ... канд. мед. наук. М.,1996. 20 с.
5.Несвободная костная пластика в лечении больных с нарушениями консолидации переломов ладьевидной кости запястья / В.М. Шаповалов [и др.] // Травматология и ортопедия России. 2009. No 3(53). С. 6-15.
6.Technique of olecranon bone grafting for surgical fixation of scaphoid fractures / H. Chim [et al.] // J. Hand Surg. Am. 2011. Vol. 36, No. 7. P. 1220-1223.
7.Vascularized os pisiform for reinforcement of the lunate in Kienböck's Disease: an average of 12 years of follow-up study / W. Daecke [et al.] // J. Hand Surg. Am. 2005. Vol. 30, No. 5. P. 915-922.
8.Functional outcome of neglected perilunate dislocations treated with open reduction and internal fixation / M. S. Dhillon [et al.] // Indian J. Orthop. 2011. Vol. 45, No. 5. Р. 427–431.
9.Gabl M., Pechlaner S., Zimmermann R. Free vascularized iliac bone graft for the treatment of scaphoid nonunion with avascular proximal fragment // Oper. Orthop. Traumatol. 2009. Vol. 21, NN 4-5. Р. 386-395.
10.Arthroplasty for advanced Kienböck's disease using a radial bone flap with a vascularised wrapping of pronator quadratus / H. S. Gong [et al.] // J. Bone Jt. Surg. 2006. Vol. 88-B, No. 5. Р. 623-628.
11.Guimberteau J. C. Simple and composite ulnar island bone transfers in hand reconstructive surgery // Chir. Main. 2010. Vol. 29, Suppl. 1. Р. S83-92.
12.Innes L., Strauch R. J. Systematic review of the treatment of Kienböck's disease in its early and late stages // J. Hand Surg. Am. 2010. Vol. 35, No. 5. Р. 713-717, 717.E1-4.
13.Scaphoid nonunions treated by Kuhlmann's vascularized bone graft: radiographic outcomes and complications / M. Jessu [et al.] // Chir. Main. 2008. Vol. 27, NN 2-3. Р. 87-96.
14.Jia X. Y., Gong X., Lu L. J. Contact pressures in radiocarpal and triquetrohamate joints after vascularized capitate transposition // Ann. Plast. Surg. 2011. Vol. 67, No. 5. Р. 534-538.
15.Free-vascularized medial femoral condyle bone transfer in the treatment of scaphoid nonunions / D. B. Jones [et al.] // Plast. Reconstr. Surg. 2010. Vol. 125, No. 4. Р. 1176-1184.
16.Kakar S., Giuffre J. L., Shin A. Y. Revascularization procedures for Kienböck disease // Tech. Hand Up. Extrem. Surg. 2011.Vol. 15, No. 1. Р. 55-65.
17.Kakar S., Shin A. Y. Vascularized bone grafting from the dorsal distal radius for Kienböck's disease: technique, indications and review of the literature // Chir. Main. 2010. Vol. 29, Suppl. 1. Р. S104-111.
18.Kaszap B., Daecke W. Kienböck's disease : an actual summary with long-term results of the therapeutic options // Handchir. Mikrochir. Plast. Chir. 2010. Bd. 42, H. 3. S. 177-186.
19.Vascularized bone graft pedicled on the volar carpal artery for non-union of the scaphoid / J. N. Kuhlmann [et al.] // J. Hand Surg. Br. 1987. Vol. 12, No. 2. Р. 203-210.
20.Intraosseous vascularity of the distal radius : anatomy and clinical implications in distal radius fractures / C. Lamas [et al.] // Hand (N. Y.). 2009. Vol. 4, No. 4. Р. 418–423.
21.Lanzetta M. Scaphoid reconstruction by a free vascularized osteochondral graft from the rib: a case report // Microsurgery. 2009. Vol. 29, No. 5. Р. 420-424.
22.Lee J. C., Lim J., Chacha P. B. The anatomical basis of the vascularized pronator quadratus pedicled bone graft // J. Hand Surg. Br. 1997. Vol. 22, No. 5. Р. 644-646.
23.Lu L. J., Gong X., Wang K. L. Vascularized capitate transposition for advanced Kienböck disease: application of 40 cases and their anatomy // Ann. Plast. Surg. 2006. Vol. 57, No. 6. Р. 637-641.
24.Mathoulin C., Gras M., Roukos S. Vascularized bone grafting from the volar distal radius for carpal bones reconstruction // Chir. Main. 2010. Vol. 29, Suppl. 1. Р. S65-76.
25.Mathoulin C., Wahegaonkar A. L. Revascularization of the lunate by a volar vascularized bone graft and an osteotomy of the radius in treatment of the Kienböck's disease // Microsurgery. 2009. Vol. 29, No. 5. Р. 373-378.
26.Non-vascularized bone graft with Herbert-type screw fixation for proximal pole scaphoid nonunion / H. Matsuki [et al.] // J. Orthop. Sci. 2011. Vol. 16, No. 6. Р. 749-755.
27.Moneim M. S., Duncan G. J. Kienbock's disease : treatment by implantation of vascular pedicle and bone grafting // Iowa Orthop. J. 1998. No. 18. Р. 67-73.
28.The use of the 4 + 5 extensor compartmental vascularized bone graft for the treatment of Kienböck's disease / S. L. Moran [et al.] // J. Hand Surg. Am. 2005. Vol. 30, No. 1. Р. 50-58.
29.Ozalp T., Yercan H. S., Okçu G. The treatment of Kienböck disease with vascularized bone graft from dorsal radius // Arch. Orthop. Trauma Surg. 2009. Vol. 129, No. 2. Р. 171-175.
30.Vascularized bone pedicle grafts of the hand and wrist : literature review and new donor sites / V. Pistré [et al.] // Chir. Main. 2001. Vol. 20, No. 4. Р. 263-271.
31.Rizzo M., Moran S. L. Vascularized bone grafts and their applications in the treatment of carpal pathology // Semin. Plast. Surg. 2008. Vol. 22, No. 3. Р. 213–227.
32.Saffar P. Vascularized pisiform transfer in place of lunatum for Kienböck's disease // Chir. Main. 2010. Vol. 29, Suppl. 1. Р. S112-S118.
33.Sauerbier M., Bishop A. T. Possible applications of pedicled vascularized bone transplants of the distal radius // Handchir. Mikrochir. Plast. Chir. 2001. Bd. 33, H. 6. S. 387-400.
34.Shin A. Y., Bishop A. T. Pedicled vascularized bone grafts for disorders of the carpus : scaphoid nonunion and Kienbock's disease // J. Am. Acad. Orthop. Surg. 2002. Vol. 10, No. 3. Р. 210-216.
35.The detailed anatomy of the 1,2 intercompartmental supraretinacular artery for vascularized bone grafting of scaphoid nonunions / T. Waitayawinyu [et al.] // J. Hand Surg. Am. 2008. Vol. 33, No. 2. Р. 168-174.
36.A modified Matti-Russe technique for the treatment of scaphoid waist non-union and pseudarthrosis / A. B. Zoubos // Med. Sci. Monit. 2011. Vol. 17, No. 2. Р. MT7-12.
1.Топыркин Владимир Геннадьевич – ГАУЗ РКБ МЗ РТ, г. Казань, отделение травматологии No 2;
2.Филимонова Антонина Андреевна – ГАУЗ РКБ МЗ РТ, г. Казань, отделение травматологии No 2;
3.Богов Андрей Алексеевич – ГАУЗ РКБ МЗ РТ, г. Казань, отделение травматологии No 2
Теги: костная пластика
234567 Начало активности (дата): 02.07.2020 14:37:00
234567 Кем создан (ID): 989
234567 Ключевые слова: васкуляризированная костная пластика, асептический некроз полулунной кости, болезнь Кинбека
12354567899
Похожие статьи
Ошибки и осложнения в лечении пациентов с открытой травмой кисти с применением чрескостного остеосинтеза по Г.А. ИлизаровуЛечение детей старшего возраста с вторичным коксартрозом 3 стадии, сочетающимся с укорочением нижней конечности свыше 6 см, методом тотального эндопротезирования
Рентген на дому 8 495 22 555 6 8
Наша тактика в диагностике и лечении больных с гигантоклеточными опухолями костей
Результаты и перспективы развития способов оперативного лечения переломов пяточной кости



