 21.06.2020
21.06.2020
Наша тактика в диагностике и лечении больных с гигантоклеточными опухолями костей
Полученные экспериментальные и клинические данные позволяют использовать обработку зоны резекции костной ткани потоком низкотемпературной плазмы для получения зоны некроза, которая может способствовать повышению эффективности хирургического лечения больных с доброкачественным вариантом гигантоклеточной опухоли костей скелета
ВВЕДЕНИЕ
В распознавании и дифференциальной диагностике доброкачественных и злокачественных опухолей, а также опухолеподобных заболеваний костного скелета принимают участие как минимум врачи трех специальностей – хирург, рентгенолог, клинический патолог.
Гигантоклеточная опухоль кости (ГКО, остеобластокластома) – опухоль, состоящая из гигантских многоядерных клеток и одноклеточных образований.
В международной гистологической классификации костных опухолей рассматривается как потенциально злокачественное образование. Чаще всего ГКО поражает метаэпифизы длинных трубчатых костей у взрослых лиц (т.е. у людей с законченными процессами формирования роста скелета) [2, 4].
ГКО выявляется достаточно часто и, по обобщенным данным литературы, среди всех опухолей костного скелета она составляет 8,6 %, а среди злокачественных новообразований костей – 15,8 %. Большинство больных (свыше 70 %) пребывает в возрасте от 20 до 55 лет. Наиболее частой областью поражения остаются кости зоны коленного сустава. ГКО редко встречается в плоских костях и очень редко поражает черепно-лицевой скелет [5, 6].
АКТУАЛЬНОСТЬ
Попытки выделить на основании гистологического строения среди ГКО несколько вариантов степени злокачественности в последующем показали их несостоятель-ность, так как они не обладали никакой предсказательной ценностью. Классическая по микроскопическому строению ГКО часто видоизменяется за счет вторичной реактивной пролиферации фиброгистоцитарной ткани, кровоизлияний, некроза и образования аневризмальных костных кист. В некоторых случаях в связи с этими процессами могут появиться признаки реактивного костеобразования, а также формироваться муаровые структуры, очаги ксантоматоза и кисты [1, 2, 3].
Постановка диагноза ГКО кости зачастую становится весьма затруднительна для многих патологоанатомов из-за концентрации внимания на присутствии в исследуемой ткани многоядерных гигантских клеток.
В то время как главное внимание при диагностике ГКО следует концентрировать на клинико-рентгенологических показателях. А при гистологическом исследовании всегда следует помнить о тенденции ГКО претерпевать реактивные фиброгистиоцитарные изменения, которые иногда трактуются как иные доброкачественные или злокачественные опухоли.
В 1-2 % случаев происходит малигнизация предществующих ГКО типичного строения. Обычно такие изменения наступают после нескольких местных рецидивов ГКО, а иногда признаки озлокачествления могут быть установлены уже в момент первичного диагноза ГКО. Малигнизация может произойти в ГКО типичного строения после предшествующего воздействия ионизирующей радиации. Обычно это наблюдается примерно 5 лет спустя после проведенной лучевой терапии [12].
Гистогенез ГКО кости до настоящего времени неизвестен, и в Международной гистологической классификации опухолей костей (ВОЗ) она отнесена в самостоятельную рубрику – опухоли неясного генеза.
В настоящее время различают типичную и злокачественную формы ГКО костей. На протяжении многих десятилетий предпринимались многочисленные попытки выявить микроскопические критерии, имеющие прогностическое значение. К числу таких критериев исследователи относили повышение количества веретенообразных клеточных элементов, появление в них признаков клеточного и ядерного полиморфизма и наличие значительного числа фигур митоза.
Однако эти гистологические признаки оказались неэффективными, и в настоящее время не существует общепризнанных микроскопических критериев, на основании которых можно было бы с уверенностью судить о возможности злокачественного течения гигинтоклеточной опухоли [2, 11].
Цель исследования – проанализировать результаты лечения больных с ГКО костей, оценить роль иммуногистохимических реакций с использованием индекса пролиферативной активности Ki-67 и применение нового устройства для биопсий опухолей костей.
До сих пор, несмотря на многочисленные исследования, не существует единого критерия для точной дифференцировки доброкачественной формы от злокачественной формы ГКО.
Сотрудниками кафедры травматологии, ортопедиии экстремальной хирургии Самарского государственного медицинского университета и Самарского областного клинического онкологического диспансера, начиная с 2009 года, выработана тактика диагностики и лечения пациентов с различными формами и локализациями остеобластокластом.
МАТЕРИАЛЫ И МЕТОДЫ
Впервые на кафедре травматологии, ортопедии иэкстремальной хирургии Самарского государственного медицинского университета было предложено новое устройство для биопсий опухолей костей [10]. Модель предложенного устройства была разработана совместно сотрудниками НИИ Самарского государственного аэрокосмического университета им. С.П. Королёва. Целью создания нового устройства является получение недеформированного столбика биопсийного материала, без нарушения дифференцировки слоев, что увеличивает достоверность постановки морфологического заключения (рис. 1).
Несомненно, одним из значительных достоинств данного устройства является возможность производить забор материала под местной анестезией, что служит благоприятным фактором для пациента.
Устройство используют следующим образом. После рассечения мягких тканей его режущую часть размещают на поверхности опухолевой ткани в заданном направлении. На корпусе размещают рукоятку и производят удары молотком по торцу. Устройство погружается в опухолевую ткань на заданную глубину под контролем линейной шкалы. Режущая часть отсекает взятый материал цилиндрической формы. После этого устройство наклоняют чуть в сторону и извлекают.
Взятые ткани в виде столбика остаются во внутренней части корпуса и свободно извлекается. Мягкие ткани послойно ушивают. Накладывается асептическая повязка.
Биопсийный материал направляют на гистологическое исследование.
Для определения дальнейшей тактики специального лечения необходима морфологическая верификация в виде гистогенеза новообразования, степени его дифференцировки и оценки биологического потенциала роста опухоли.
Для определения биологического потенциала роста опухоли клинические патологи используют современные морфологические методы обработки биоматериала с применением ультразвукового декальцификатора и иммуногистохимических реакций. А именно, определение индекса пролиферативной активности Ki-67.
Иммуногистохимический анализ проводили на срезах с парафиновых блоков опухолей, предназначенных для стандартного морфологического исследования.
Парафиновые срезы депарафинировали и регидратировали по стандартной методике. Для "демаскировки" антигенов проводили прогревание срезов на водяной бане в предварительно нагретом до 95-99 С в буфере для «демаскировки антигенов» в течение 30 минут. Затем стекла охлаждали при комнатной температуре в течение 15-20 минут и переносили в фосфатный буфер на 5 минут.
Для блокирования эндогенной пероксидазы срезы инкубировали 10 минут в темноте с 3 % перекисью водорода, приготовленной на дистиллированной воде, а затем промывали 5 минут в фосфатном буфере. Для блокирования неспецифического связывания антител срезы инкубировали 15 минут с 1% раствором бычьего сывороточного альбумина. Инкубацию с первичными антителами проводили при 40 С в течение 16 часов.
После первичных антител стекла промывали 2 раза по 5 минут в фосфатном буфере. Инкубацию с проявочной тест-системой [LSAB®+kit или Envision®+kit, все DAKO] проводили при комнатной температуре в течение 20 минут, и затем срезы промывали 2 раза по 5 минут.
Для визуализации иммуногистохимической реакции использовали DAB+ систему [DAKO]. Реакцию проводили в темноте в течение 5-10 минут. Срезы докрашивали гематоксилином Майера и заключали в канадский бальзам.
Оценку результатов окрашивания проводили с применением светового микроскопа «Leica» (Германия) под увеличением 10, 20, 40. Для всех маркеров оценивали локализацию окрашивания в клетке (ядро, цитоплазма, мембрана). Количество положительных клеток оценивали в зонах, содержащих их максимальное количество.
Для оценки пролиферативной активности (ПА) опухоли подсчитывали количество Ki-67-положительных опухолевых клеток, приходящиеся на 200-300 опухолевых клеток. Индекс Ki-67 определяли по формуле:
ПА = число Ki-67 положительных клеток 100/ общее количество клеток.
Стромальный компонент опухоли был единственным типом клеток, окрашивающихся на Ki-67. Гигантские остеокласт-подобные клетки были всегда отрицательными по Ki-67. По количеству положительных клеток опухоли были разделены на 2 группы: с низкой (Ki-67 < 5 %) и высокой (Ki-67 < 5 %) пролиферативной активностью.
Все пациенты были условно поделены на 2 группы.
В первую группу входили пациенты с типичной формой остебластокластомы. Во вторую группу входили больные злокачественной формой ГКО.
При определении тактики лечения для нас принципиальное значение имел индекс пролиферативной активности Ki-67.
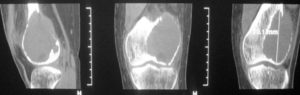
В случае, если показатель пролиферативной активности Ki-67 был менее 5 %, пациент относился к первой группе (рис. 2). В данном случае проводились внутрикостные резекции в пределах здоровых тканей.
Для получения плазмы авторы использовали аргоно-плазменную установку ERBE VIO D 300, производитель – компания ERBE Elektromedizin (Германия).
Суть заключается в следующем: через электрическую дугу постоянного тока путем продувания инертного газа (аргона или гелия) в режиме коагуляции плазменным потоком не более 1 мм образуется плазма. Температура по оси плазменного тока достигает не более 20 тыс. градусов (рис. 3).
При этом для замещения дефекта костной ткани применяли новый способ укладки аллотрансплантата, впервые предложенный на кафедре травматологии, ортопедии и экстремальной хирургии СамГМУ [8].
Данный способ позволяет повысить механическую прочность кости в области оперативного вмешательства и благодаря равномерному распределению нагрузки на суставные поверхности, предотвратить деформацию мыщелков трубчатых костей, нарушение оси и биомеханики конечности.
Одну из пластинок аллотрансплантата кортикального слоя кости, максимально отмоделированную в соответствии с формой суставной поверхности, вводят непосредственно под суставной поверхностью параллельно суставной щели. Вторую пластинку устанавливают в костномозговой канал перпендикулярно первой, одним краем упираясь в диафизарную часть длинной трубчатой кости, другим – в горизонтальную пластинку, создавая опору для нее.
В последнее время завершающим этапом стали выполнять остеосинтез пластинами с угловой стабильностью, что позволило разрешать осевую нагрузку пациентам на конечность после 2-3 недель с момента операции (рис. 5).
Далее назначали лечебную физическую культуру, механотерапию. Осевую нагрузку на конечность разрешали через 3 месяца.
Те больные, показатель пролиферативной активности Ki-67 которых был более 5 % (рис. 6), входили во вторую группу. Этой категории пациентов проводилась неоадъювантная полихимиотерапия, что позволяло воздействовать на отдалённые микрометастазы. Затем выполняли сегментарные резекции с эндопротезированием (рис. 7, 8).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Получение зоны некроза при обработке зоны резекции потоком аргонноплазменной плазмы позволяло сохранить минеральные структуры по составу и форме с потерей всех клеточных элементов, в том числе и элементов опухоли, являющихся причиной рецидивов.
Представленный способ обработки костной ткани плазмой использован при хирургическом лечении 29 больных с гигантоклеточной опухолью костей скелета со сроками наблюдения до 4 лет.Значение индекса пролиферативной активности Ki-67 позволяло определить тактику лечения больных ГКО.
В 2 случаях у пациентов были выявлены рецидивы с мягкотканым компонентом в сроки до 6 месяцев, в связи с которыми были выполнены ампутации конечностей.
ВЫВОДЫ
Полученные экспериментальные и клинические данные позволяют использовать обработку зоны резекции костной ткани потоком низкотемпературной плазмы для получения зоны некроза, которая может способствовать повышению эффективности хирургического лечения больных с доброкачественным вариантом гигантоклеточной опухоли костей скелета:
– значение индекса пролиферативной активности Ki 67 позволяет определить биологический потенциал роста опухоли, степень её злокачественности, что указывает на тактику специального лечения.
– применение нового устройства при выполнении биопсий у больных с ГКО костей позволяет добиться лучшей диагностики и может быть использовано в специализированных онкологических стационарах с целью морфологической верификации не только гистогенеза опухоли, но и степени её дифференцировки.
ЛИТЕРАТУРА
1.Аренберг А. А. Первичная злокачественная остеобластома // Ортопедия, травматология и протезирование. 1962. No 8. С. 76.
Arenberg AA. Pervichnaia zlokachestvennaia osteoblastoma [Primary malignant osteoblastoma]. Ortop travmatol protez. 1962;(8):76.
2.Баранова А. Г., Черкасский Л. А. Гигантоклеточная опухоль костей // Вопр. онкологии. 1962. No 12. С. 81-92.
Baranova AG, Cherkasskii LA. Gigantokletochnaia opukhol' kostei [Bone giant-cell tumor]. Vopr. onkologii. 1962;(12):81-92.
3.Гигантоклеточные опухоли : обзор лит. / Н. В. Васильев, М. Р. Мухамедов, Е. Л. Чойнзонов, Д. Е. Кульбакин, П. Г. Байдала, Г. С. Жамгарян // Сибир. онколог. журн. 2011. No 5 (47). С. 64-69.
Vasil'ev NV, Mukhamedov MR, Choinzonov EL, Kul'bakin DE, Baidala PG, Zhamgarian GS. Gigantokletochnye opukholi : obzor lit [Giant celltumors: review of literature]. Sibir. onkolog. zhurn. 2011;5 (47): 64-69.
4.Давыдов М. И., Чиссов В. И. Национальное руководство по онкологии. М.: ГЕОТАР-Медиа, 2008. С. 863-866.
Davydov M I, Chissov VI. Natsional'noe rukovodstvo po onkologii. [National guidelines in oncology]. M: GEOTAR-Media. 2008. s. 863-866.
5.Демичев А. Н., Тарасов А. Н. Диагностика и криохирургия костных кист : монография. М., 2005. С. 3-5.
Demichev AN, Tarasov AN. Diagnostika i kriokhirurgiia kostnykh kist : monografiia [Diagnostics and cryosurgery of bone cysts: monograph]. M.2005. s. 3-5.
6.Нейштадт Э. Л., Маркочев А. Б. Опухоли и опухолеподобные заболевания костей. СПб.: Фолиант, 2007. С. 233-237.
Neishtadt EL, Markochev AB. Opukholi i opukholepodobnye zabolevaniia kostei [Tumors and tumor-like diseases of bones]. SPb: Foliant. 2007.s. 233-237.
7.Некачалов В. В. Гигантоклеточная опухоль (остокластома) // Патология костей и суставов. СПб.: Сотис, 2000. С. 240-245.
Nekachalov VV. Gigantokletochnaia opukhol' (ostoklastoma) [Giant cell tumor (ostoclastoma)]. Patologiia kostei i sustavov. SPb: Sotis. 2000. s.240-245.
8.Новый способ пластики дефекта костной ткани метаэпифизарной зоны длинных трубчатых костей при хирургическом лечении доброкачественных опухолей скелета : пат. 2388423 Рос. Федерация. No 2008127893/14 ; заявл. 08.07.2008 ; опубл. 10.05.2010, Бюл. No 13.
9.Способ обработки костной ткани при хирургическом лечении доброкачественных опухолей скелета : пат. 2416367 Рос. Федерация. No
2008148684 ; заявл. 09.12.2008 ; опубл. 20.04.2011, Бюл. No 17.Pat. 2416367 RF.
Sposob obrabotki kostnoi tkani pri khirurgicheskom lechenii dobrokachestvennykh opukholei skeletal [A technique for bone tissuepreparation in surgical treatment of benign skeletal tumors]. No 2008148684 ; zaiavl. 09.12.2008 ; opubl. 20.04.2011, Biul. No 17.
10.Устройство забора биопсий опухолей костей : а.с. 109395 Рос. Федерация. No 2011113101 ; заявл. 05.04.2011 ; опубл. 20.10.2011, Бюл. No 29.
Certificate of authorship 109395 RF. Ustroistvo zabora biopsii opukholei kostei [A device to take biopsies for bone tumors]. No 2011113101 ; zaiavl.05.04.2011 ; opubl. 20.10.2011, Biul. No 29.
11.Проценко В. В. Тактика лечения больных злокачественной гигантоклеточной опухолью кости // Вiсн. ортопедii, травматол. протезування.
2004. No 1. С. 42-45.
Protsenko VV. Taktika lecheniia bol'nykh zlokachestvennoi gigantokletochnoi opukhol'iu kosti [Treatment tactics for patients with malignant giant-cell bone tumor]. Visn. ortopedii, travmatol. Protezuvannia. 2004;(1): 42-45.
12.Ernest U. Conrad III. Orthopaedic Oncology. Diagnosis and Treantment. 2008. P. 7-11.
Сведения об авторах:
1.Терсков Александр Юрьевич – ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсозразвития России, докторант кафедры травматологии, ортопедии и экстремальной хирургии;
2.Иванов Виктор Вячеславович – ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсозразвития России, аспирант кафедры травматологии, ортопедии и экстремальной хирургии;
3.Николаенко Андрей Николаевич – ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсозразвития России, заочный аспирант кафедры травматологии, ортопедии и экстремальной хирургии;
Теги: опухоли
234567 Начало активности (дата): 21.06.2020 15:41:00
234567 Кем создан (ID): 989
234567 Ключевые слова: стеобластокластома, гигантоклеточная опухоль, Ki 67
12354567899
Похожие статьи
Применение навигационных технологий в лечении остеоидной остеомы и остеобластомы позвоночника у детейРедкое клиническое наблюдение эхинококкового поражения диафиза плечевой кости
Рентген на дому 8 495 22 555 6 8
Клинический случай эндопротезирования коленного сустава у пациента с гигантской кистой медиального мениска
Проект исследования анатомии и биологии головного мозга при помощи компьютерной и магнитно-резонансной томографии.



