 03.01.2026
03.01.2026
Отдаленные результаты коррекции тяжелого аортального стеноза с использованием кардиохирургических и эндоваскулярных методов по данным контроля лучевыми методами
Биопротезы аортального клапана (АоК) можно разделить на каркасные и бескаркасные, а также имплантируемые хирургическим и эндоваскулярным методами
Введение
Пороки клапанов сердца занимают одно из лидирующих мест в структуре сердечно-сосудистых заболеваний. Среди данной патологии преобладает аортальный стеноз (АС) [1].
Хирургическая замена аортального клапана (ХЗАК) является “золотым стандартом” лечения тяжелого АС, обеспечивает радикальную коррекцию и нацелена на хороший клинико-функциональный прогноз [2]. На сегодняшний день нет общего мнения по поводу объема оперативного вмешательства, и, главным образом, это касается выбора типов клапанов сердца при оперативном лечении аортальных пороков у лиц пожилого и старческого возраста.
Биологические протезы характеризуются ламинарным током крови, большей эффективной площадью, меньшим транспротезным градиентом, бесшумностью, низкой тромбогенностью и возможным отказом от антикоагулянтной терапии, следовательно, являются более подходящими для использования в данной группе пациентов [3]
Цель исследования - оценить объективными лучевыми методами исследования гемодинамические параметры и динамику обратного структурно-функционального ремоделирования сердца в отдаленном периоде после коррекции дегенеративного порока АоК с использованием кардиохирургических и эндоваскулярных методик.
В свою очередь, хирургическое протезирование с использованием метода имплантации биологических клапанов быстрого развертывания (бесшовных) сочетает в себе преимущества ХЗАК и возможности ТИАК [4]. Изучение гемодинамических критериев функционирования вшиваемых, бесшовных и транскатетерных биологических протезов, в том числе динамики обратного структурно-функционального ремоделирования сердца в отдаленном периоде, необходимо для выбора наиболее правильной и эффективной тактики лечения.
Материал и методы
На базе государственных учреждений “Республиканский клинический медицинский центр” Управления делами Президента Республики Беларусь, “Минский научно-практический центр хирургии, трансплантологии и гематологии” и “Республиканский научно-практический центр «Кардиология»” проведено сравнительное нерандомизированное продольное исследование 89 пациентов с тяжелым АС, которым в 2019-2023 гг. была выполнена изолированная хирургическая или эндоваскулярная замена клапана. Они были разделены на 3 группы: группа с протезированием АоК методом имплантации бесшовного биологического протеза (n = 23); группа с использованием вшиваемого биологического протеза (n = 45); группа с транскатетерной техникой имплантации биологического протеза (n = 21).
Всемирной медицинской ассоциации “Этические принципы проведения научных медицинских исследований с участием человека” с поправками 2000 г и “Правилами клинической практики в Российской Федерации”, утвержденными Приказом Минздрава РФ от 19.06.2003 № 266. Пациенты, участвующие в исследовании, дали письменное информированное согласие на участие в исследовании. Номер протокола заседания этического комитета №7 от 06.03.2024.
Критериями включения в исследование были возраст пациентов старше 60 лет, синусовый ритм, тяжелый АС различной этиологии.
Критериями невключения являлись стенозы и умеренная/тяжелая регургитация на митральном, трикуспидальном клапанах, клапане легочной артерии, врожденные пороки сердца, снижение фракции выброса левого желудочка (ЛЖ) менее 50%, стенозирование коронарных артерий, требующее реваскуляризации, перенесенный в прошлом инфаркт миокарда, заболевания щитовидной железы с изменением нормальных показателей уровня гормонов, хроническая почечная недостаточность, требующая проведения гемодиализа, железодефицитная анемия средней и тяжелой степени, хронические болезни дыхательной системы с дыхательной недостаточностью, наличие “протез-пациент несоответствия”, диагностированного в отдаленном периоде, отказ пациента от участия в исследовании.
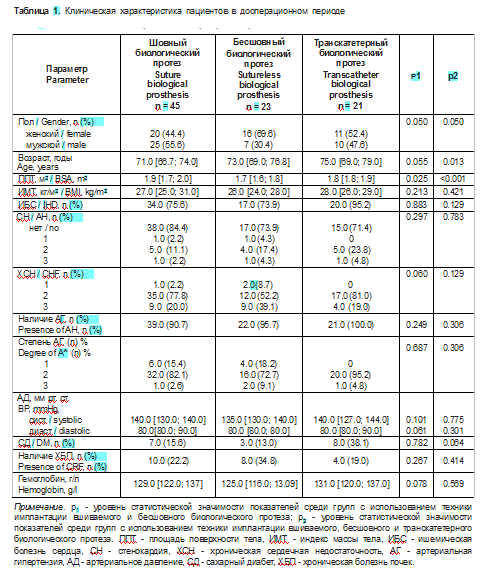
В качестве сопутствующей патологии наиболее часто встречалась ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ), хроническая сердечная недостаточность (ХСН). Полная клиническая характеристика пациентов представлена в табл. 1, 2. Включенные в исследование группы пациентов не имели статистически значимых отличий по распространенности коморбид- ных заболеваний: хронической ИБС, АГ и ее степени, сахарного диабета (СД), функциональным классам (ФК) ХСН по классификации Нью- Йоркской ассоциации сердца. Однако группа с транскатетерной техникой имплантации биологического протеза статистически значимо отличалась по возрасту, поэтому в дальнейшем сравнительная оценка проводилась между группами с применением вшиваемого и бесшовного протезов.
Для протезирования АоК использовались перикардиальные шовные биологические протезы - Carpentier-Edwards PERIMOUNT MAGNA (48,0%), Carpentier-Edwards PERIMOUNT MAGNA EASE (52,0%), бесшовные протезы - Perceval S (100%), транскатетерные - Edwards SAPIEN 3 (45,5%), Medical Portico Transcatheter Heart Valve R (27,3%), Medtronic CoreValve Evolut R (22,7%), Meril Myval (4,5%).
Эхокардиография (ЭхоКГ) выполнялась трансторакальным доступом на ультразвуковых системах Vivid Е 9 и Vivid Е 95 (GE Healthcare) датчиками с частотой 2,5-5,0 МГц. Методика оценки функции протезов с помощью импульсноволнового, непрерывноволнового и цветового допплера была аналогична тем, которые используются при оценке нативного клапана. Стандартно исследовались такие параметры, как максимальная систолическая скорость (макс. сист. скорость, м/с), максимальный и средний трансклапанные градиенты давления (МГД и СГД, мм рт.ст.), эффективная площадь отверстия АоК (ЭПО, см2), рассчитанная по уравнению непрерывности потока, индексированная к площади поверхности тела (ППТ) (и ЭПО, см2/м2), время ускорения (АТ, мс), время изгнания (ЕТ, мс) и их отношение (АТ / ЕТ, мс).
Индекс потерь энергии (ИПЭ, см2/м2) определяли по формуле
ИПЭ = {(ЭПО х Ао) / (Ао-ЭПО)} / ППТ,
где Ао - площадь поперечного сечения аорты на уровне синотубулярного соединения.
Для оценки нормального функционирования протезов в аортальной позиции использовали безразмерный индекс или индекс допплеровской скорости (DVI, см), который представляет собой отношение интеграла линейной скорости кровотока проксимальнее протеза (VTI^, см), определенного с помощью импульсноволнового допплера, к интегралу транспротезной линейной скорости кровотока (VTI^, см), установленного в режиме непрерывноволнового допплера, в пятикамерной апикальной позиции.
Для оценки состояния ЛЖ исследовались следующие переменные: толщина миокарда межжелудочковой перегородки (МЖП, мм) и задней стенки ЛЖ (ЗСЛЖ, мм) во время диастолы в В-режиме. Конечный диастолический (КДО, мл), конечный систолический объемы (КСО, мл) ЛЖ, фракцию выброса ЛЖ (ФВ, %), объемы левого (ЛП, мл) и правого (ПП, мл) предсердий определяли на основании биплановой методики дисков Симпсона. Ударный объем (УО, мл) рассчитывали как разницу между КДО и КСО ЛЖ. Массу миокарда ЛЖ (ММЛЖ, г) вычисляли в В-режиме по формуле площадь-длина и далее индексировали к площади поверхности тела (индекс массы миокарда (ИММ), г/м2) и к росту (м), возведенному в степень 2,7 (ИММ, г/м27).
Для определения геометрии ЛЖ рассчитывали относительную толщину стенки (ОТС) по формуле ОТС = [ТЗС * 2] / КДР, где КДР - конечный диастолический размер ЛЖ (мм), ТЗС - толщина задней стенки ЛЖ в конце диастолы (мм) в В-режиме и индекс геометрии ЛЖ (ММЛЖ / КДО, г/мл).
Сократительная функция миокарда ЛЖ анализировалась с помощью тканевой допплерографии в импульсноволновом режиме по скоростям движения латерального (З’лат, см/с), септального (Б’септ, см/с) краев фиброзного кольца митрального клапана (МК) и недопплеровской методики оценки движения миокарда - “спекл-слежения” (GLPS, %).
Систолическую экскурсию кольца МК (MAPSE, мм) рассчитывали как амплитуду систолической экскурсии кольца в продольном направлении из апикальной четырехкамерной позиции.
Для оценки состояния правого желудочка (ПЖ) использовались стандартные методы ЭхоКГ: конечная диастолическая (КДП, см2) и конечная систолическая (КСП, см2) площади ПЖ, рассчитанные путем трассировки ПЖ по эндокарду. Систолическая функция ПЖ оценивалась по систолической скорости движения латеральной части трикуспидального кольца в режиме тканевой
импульсноволновой допплерографии (S’TK, см/с), систолической экскурсии латеральной части кольца трикуспидального клапана (TAPSE, мм), фракции изменения площади (ФИП, %) по формуле (КДП - КСП)/КДП, соотношению TAPSE/ДЛЛ^, мм рт.ст. По стандартной методике проводили измерение систолического давления в легочной артерии (ДЛАсист, мм рт.ст.). Тяжелый АС устанавливали на основании следующих критериев: пиковая трансклапанная скорость > 4 м/с, средний градиент > 40 мм рт.ст., площадь АоК < 1 см2, индекс площади АоК < 0,6 см2/м2. В случае низкопотокового низкоградиентного тяжелого АС с сохраненной ФВ (более 50%) площадь отверстия составляет < 1 см2, средний градиент давления < 40 мм рт.ст., индекс УО < 35 мл/м2 [1,4, 6].
Субпороговая (латентная) систолическая дисфункция ЛЖ определялась на основании результатов выполнения 2D-speckle-tracking-ЭхоКГ, пороговым значением которой при сохраненной ФВ ЛЖ является уровень GLS менее 16% [5].
ЭхоКГ выполнялась перед операцией и затем не ранее года после оперативного вмешательства. Медиана периода наблюдения составила в группе с использованием вшиваемых биологических протезов 1,0 год 9,0 мес [1,0 год 3,0 мес; года 6,0 мес], бесшовных биологических протезов 1,0 год 6,0 мес [1,0 год 3 дня; 2,0 года], с ТИАК 1,0 год 9,0 мес [1,0 год 5,0 мес; 3,0 года мес] (р = 0,116). Перед ЭхоКГ по стандартной методике пациенту измерялось артериальное давление (АД). Все гемодинамические транспротезные показатели проанализированы после снижения цифр АД менее 150/90 мм рт.ст.
Оценка глобальной систолической продольной деформации ЛЖ (GLPS, %) по данным 2D-speckle- tracking-ЭхоКГ перед хирургическим вмешательством была выполнена у 11 пациентов с последующей имплантацией бесшовного биологического протеза, у 16 лиц с вшиваемым биологическим протезом. Пациентам с транскатетерной техникой имплантации биологического протеза исследование продольной деформации ЛЖ перед операцией не проводилось. В отдаленном периоде глобальная систолическая продольная деформация ЛЖ определялась у всех пациентов.
Статистическую обработку полученных данных осуществляли с помощью пакетов прикладных программ SAS (Statistic Analysis System), IBM SPSS Statistics.
Для большинства количественных переменных распределение отличалось от нормального, поэтому полученные результаты оценивали непараметрическими методами. Количественные значения изучаемых параметров по результатам описательной статистической обработки данных представляли в виде медианы, 25% нижнего и 75% верхнего квартильных размахов - Ме [LQ; UQ].
Для независимых выборок применяли знаковоранговый критерий Манна-Уитни, для зависимых данных - одновыборочный критерий Вилкоксона с указанием уровня статистической значимости (р). Для сопоставления номинальных данных использовался критерий %2 Пирсона. Значение p < 0,05 считали статистически значимым.
Объем выборки не рассчитывался, так как исследование продолжается и будет дополнено.
Результаты исследования
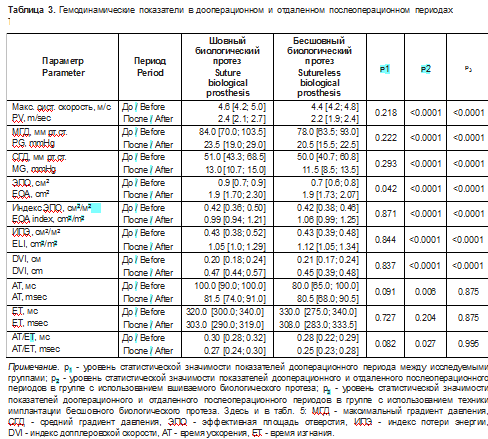
Всем пациентам выполнялось первичное изолированное плановое хирургическое или эндоваскулярное вмешательство в связи с тяжелым АС. Подробное описание эхокардиографических данных в группах с применением бесшовного и вшиваемого биологических протезов, характеризующих структурно-функциональные параметры сердца и гемодинамические свойства АоК, представлено в табл. 2, 3.
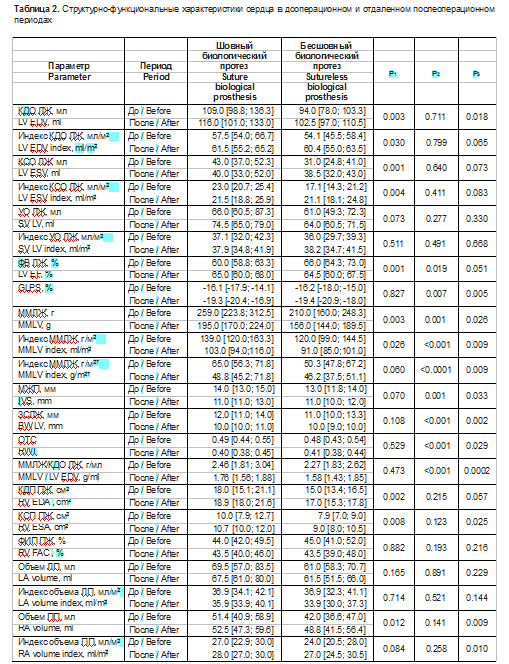
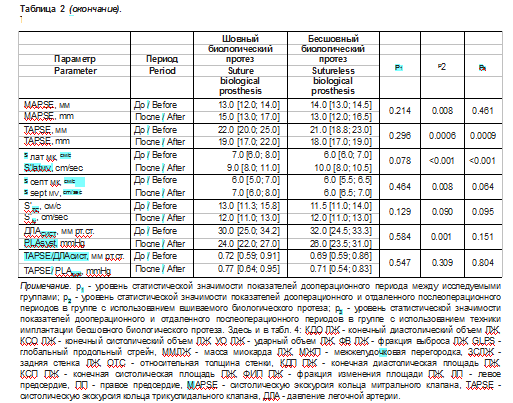
Из табл. 2, 3 видно, что группы сопоставимы по гемодинамическим показателям и большинству структурно-функциональных характеристик сердца в дооперационном периоде, за исключением КДО, КСО ЛЖ и их индексов, ФВ ЛЖ, ММЛЖ, индекса ММЛЖ на ППТ, КДП и КСП ПЖ, объема ПП. В связи с этим в дальнейшем группы не сравнивались между собой.
Далее была проведена оценка относительного изменения рассматриваемых показателей, выраженного в процентах.
При сопоставлении дооперационного и послеоперационного периодов в группе с использованием вшиваемого биологического протеза отмечается статистически значимое увеличение ФВ ЛЖ на 5,8 [1,6; 9,9]% (р = 0,008), абсолютной величины глобальной продольной деформации миокарда ЛЖ на 19,3 [7,5; 54,0]% (р = 0,032), уменьшение массы миокарда на -22,0 [-28,0; -17,0]% (р = 0,0002), индекса ММЛЖ по отношению к площади тела на -23,0 [-28,0; -18,0]% (р < 0,0001), индекса ММЛЖ к росту на -22,0 [-28,0; -17,0]% (р < 0,0001), концентричности ЛЖ на -21,0 [-29,0; -14,0]% (р < 0,0001), толщины МЖП на -10,5 [-16,7; -4,3]% (р = 0,002) и ЗСЛЖ на -14,4 [-19,6,0; -9,3]% (р = 0,0001), увеличение S’^ мк на 36,7 [22,1; 51,3]% (р < 0,0001) и S^ мк на 26,3 [12,0; 40,6]% (р = 0,0009), MAPSE на 18,2 [7,2; 31,9]% (р = 0,005), снижение ДЛАсист на -13,1 [-23,1; -3,2]% (р = 0,005), TAPSE на -11,0 [-16,8; -5,2]% (р = 0,0009).
При сопоставлении дооперационного и послеоперационного периодов в группе с применением бесшовного биологического протеза отмечается статистически значимое увеличение абсолютной величины глобальной продольной деформации миокарда ЛЖ на 18,4 [3,3; 42,8]% (р = 0,027), уменьшение массы миокарда на -20,0 [-27,0; -13,0]% (р = 0,01), индекса ММЛЖ по отношению к площади тела на -21,0 [-29,0; -13,0]% (р = 0,016), индекса массы миокарда к росту на -18,9 [-25,2; -7,7]% (р = 0,01), концентричности ЛЖ на -24,0 [-31,0; -15,0]% (р = 0,0002), толщины МЖП на -12,1 [-21,9; -8,3]% (р = 0,011) и ЗСЛЖ на -10,0 [-20,6; -0,6]% (р = 0,042), увеличение S’rai. мк на 42,8 [17,5; 57,1]% (р = 0,0005), снижение TAPSE на -16,2 [-23,9; -2,9]% (р = 0,001), увеличение КСП ПЖ на 18,3 [14,1; 27,6]% (р = 0,011), объема ПП на 21,7 [-3,5; 26,1]% (р = 0,003) и индекса объема ПП на 17,9 [-4,2; 26,4]% (р = 0,032), КДО ЛЖ на 11,1 [4,1; 18,4]% (р = 0,015).
Диаметры вшиваемых биологических протезов по данным ЭхоКГ составили 23,0 [23,0; 25,0] мм, бесшовных биологических протезов - 23,0 [23,0; 25,0] мм соответственно.
В соответствии с полученными данными ЭхоКГ максимальная систолическая скорость, максимальный и средний транспротезные градиенты статистически значимо уменьшились, площадь эффективного отверстия, индекс потерь энергии увеличились. Время ускорения систолического транспротезного потока уменьшилось на вшиваемых протезах, время изгнания и их отношение не претерпели статистически значимых изменений в исследуемых группах.Следовательно, эхокардиографическое исследование, выполненное в отдаленном послеоперационном периоде, позволило определить, что шовные и бесшовные биологические протезы обладают хорошими гемодинамическими характеристиками и приводят к статистически значимому уменьшению ММЛЖ, индекса ММЛЖ по отношению к площади тела, индекса ММЛЖ к росту, толщины МЖП и ЗСЛЖ, уменьшению концентричности ЛЖ. В отдаленном послеоперационном периоде у пациентов с шовными биологическими протезами абсолютные величины GLPS, значения MAPSE, S’rai. мк, S’^ мк, у лиц с бесшовными биологическими протезами GLPS, S’лат мк были статистически значимо выше по сравнению с дооперационным периодом, что свидетельствует об улучшении продольной сократительной способности ЛЖ. Однако показатель TAPSE, характеризующий систолическую функцию ПЖ, статистически значимо снизился в исследуемых группах, что соответствует ухудшению его функции.
Перед оперативным лечением субпороговая (латентная) систолическая дисфункция ЛЖ, диагностированная по результатам выполнения 2D-speckle-tracking-ЭхоКГ, была установлена у 20 (74,0%) пациентов с тяжелым стенозом АоК. Восстановление систолической функции ЛЖ в отдаленном периоде определено у 12 (60,0%) человек, из них у 7 (58%) с шовными биологическими протезами, у 5 (42%) с бесшовными биологическими протезами.
Описание эхокардиографических данных, характеризующих структурно-функциональные и гемодинамические параметры, в группе с транскатетерной техникой имплантации биологического протеза представлены в табл. 4, 5.
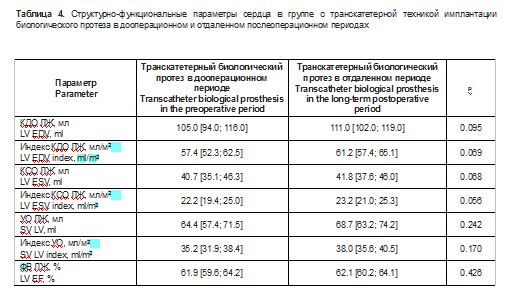
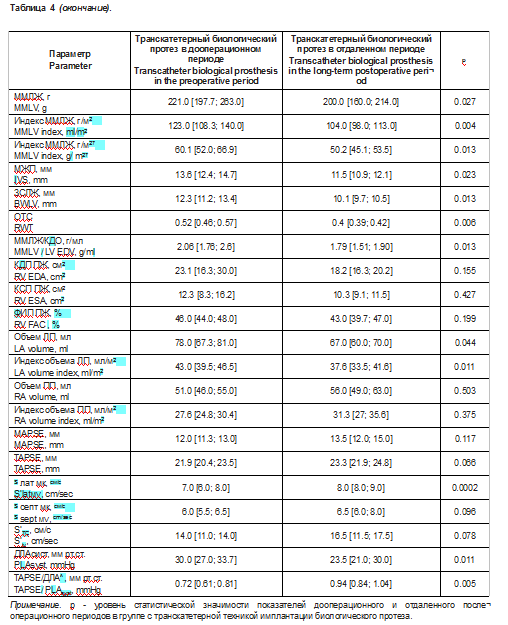
При изучении дооперационного и послеоперационного периодов в исследуемой группе отмечается статистически значимое уменьшение массы миокарда на -16,0 [-22,0; -10,0]% (р = 0,0001), индекса ММЛЖ по отношению к площади тела на -17,5 [-22,6; -5,3]% (р = 0,0003), индекса ММЛЖ к росту на -20,3 [-25,2; -4,0]% (р < 0,0001), толщины МЖП на -8,3 [-20,0; -0,13]% (р < 0,0001) и ЗСЛЖ на -9,1 [-25,0; -5,4]% (р = 0,003), концентричности ЛЖ на -24,2 [-35,6; -1,1]% (р = 0,002), увеличение S’rai. мк на 25,0 [14,3; 55,3]% (р = 0,005), снижение ДЛАсист на -14,8 [-21,9; 7,1]% (р = 0,02),
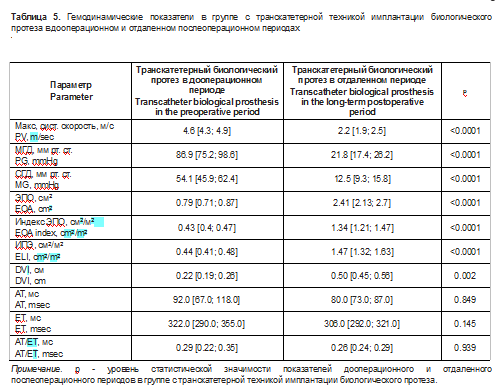
Диаметры протезов, согласно эхокардиографическим данным, составили 25,0 [24,7; 26,0] мм. В отдаленном послеоперационном периоде максимальная систолическая скорость, максимальный и средний транспротезные градиенты статистически значимо уменьшились, площадь эффективного отверстия, индекс потерь энергии увеличились. Время ускорения, время изгнания и их отношение не подверглись статистически значимым изменениям.
Постоянные электрокардиостимуляторы в раннем послеоперационном периоде были имплантированы 11 (12,3%) пациентам: 3 - (3,3%) с бесшовными биопротезами, 4 - (4,5%) с ТИАК, 4 - (4,5%) с шовными биологическими протезами.
Парапротезная регургитация присутствовала у 8 (8,9%) пациентов: у 6 (6,7%) пациентов с ТИАК диагностирована легкая (83,4% случаев) и умеренная (16,6%) регургитация; у 2 (2,2%) - с бесшовными биологическими протезами имела место умеренная парапротезная регургитация. Во всех наблюдениях парапротезная регургитация была стабильной с течением времени.
Обсуждение
Как представлено в разделе “Результаты исследования”, после имплантации биологических протезов в аортальную позицию в отдаленном периоде в трех исследуемых группах статистически значимо уменьшились масса миокарда, толщина МЖП и ЗСЛЖ, индекс ММЛЖ по отношению к площади тела и к росту, что указывает на обратное структурное ремоделирование ЛЖ у пациентов с тяжелым АС, очевидно, вследствие нормализации постнагрузки ЛЖ [4]. ОТС и отношение массы миокарда к КДО ЛЖ уменьшились в трех группах, что свидетельствует в пользу уменьшения концентричности гипертрофии. Также во всех исследуемых группах статистически значимо улучшилась скорость продольного движения латерального края фиброзного кольца МК, оцененная в режиме тканевой допплерографии, что демонстрирует восстановление продольной сократительной способности ЛЖ в ходе обратного ремоделирования. КДО, КСО ЛЖ, УО и их индексы не претерпели статистически значимых изменений.
В отдаленном периоде в группе ТИАК отмечается функциональное ремоделирование ПЖ в виде увеличения показателей S^ и TAPSE/ДЛА^, наоборот, значения TAPSE снижаются в группах пациентов с использованием кардиохирургических методик, однако не выходят за пределы нижней границы нормы для данного параметра. Полученные результаты согласуются с разными эффектами кардиохирургических и эндоваскулярных вмешательств при замене АоК на функцию ПЖ. Существует несколько вероятных механизмов нарушения структурно-функциональных свойств ПЖ после кардиохирургической коррекции стеноза АоК: ишемически-реперфузионное повреждение, длительное время ишемии, вид кардиопле- гии, установка дренажей, повреждение ПЖ (отек стенки, механическая травма) при канюлирова- нии для искусственного кровообращения (ИК), характеристики отлучения от ИК, чувствительность к гипотермии во время выполнения вмешательства, образование послеоперационных спаек. Поэтому детальные патофизиологические механизмы, лежащие в основе постхирургической дисфункции ПЖ, остаются дискутабельными, а их прогностическое значение до сих пор однозначно не установлено [6, 7].
Вышеперечисленные факты свидетельствуют в пользу того, что биологические протезы с использованием как кардиохирургических, так и транскатетерных методов должным образом корригируют внутрисердечную гемодинамику и снятие патологической постнагрузки с ЛЖ [7], обеспечивают обратное структурно-функциональное ремоделирование сердца независимо от того факта, что в группе ТИАК пациенты были статистически значимо старше по возрасту. Кроме того, наличие парапротезных фистул легкой и умеренной степени со стабильным регургитирующим объемом не повлияло на динамику обратного ремоделирования ЛЖ.
Обратное структурно-функциональное ремоделирование сердца после замены АоК снижает риск аритмий, сердечной недостаточности, внезапной коронарной смерти и указывает на эффективность хирургического лечения [8]. Понимание структурных и функциональных изменений до и после хирургического вмешательства имеет важное значение для оптимизации ведения и лечения пациентов.
Появление новых методов и технологий в ультразвуке позволяет существенно расширить объем получаемой информации, в большинстве случаев заменяя инвазивные дорогостоящие методы диагностики. Важное значение имеет изучение дополнительных маркеров систолической функции камер сердца. Необходимы дальнейшие исследования в этом направлении. Также целесообразно выполнить многофакторный анализ с построением модели прогнозирования обратного ремоделирования сердца для выявления предикторов, позволяющих определять наиболее эффективную и безопасную тактику лечения.
Ограничения исследования
В данной работе была продемонстрирована динамика обратного структурно-функционального ремоделирования сердца в отдаленном периоде после коррекции дегенеративного порока аортального клапана. Ввиду того, что исследование проводилось на базе государственных учреждений “Республиканский клинический медицинский центр” Управления делами Президента Республики Беларусь, “Минский научно-практический центр хирургии, трансплантологии и гематологии” и “Республиканский научно-практический центр «Кардиология»”, в дооперационном периоде ЭхоКГ выполнялась врачами ультразвуковой диагностики соответствующих центров. В отдаленном послеоперационном периоде эхокардиографическая оценка проводилась одним врачом ультразвуковой диагностики. Учитывая, что ультразвуковая диагностика является операторозависимым методом, нельзя исключить некоторую межисследовательскую разнородность.
Межгрупповое сравнение выполнялось среди групп хирургической коррекции с использованием шовных и бесшовных биопротезов. Следует отметить, что пациенты имели статистически значимое различие по ППТ, при этом ИМТ не отличался. В дальнейшем все же было принято решение не сравнивать данные группы между собой.
Необходимо заметить, что пациенты в группе TAVI не разделялись в зависимости от конкретной марки протеза.
Заключение
После коррекции АС с использованием как кардиохирургических, так и транскатетерных методов в отдаленном периоде наблюдается обратное структурно-функциональное ремоделирование сердца: статистически значимо снизились ММЛЖ и концентричность гипертрофии ЛЖ.
Данный анализ дает основание для проведения дальнейших исследований с целью сравнения отдаленных результатов эндоваскулярного лечения с таковыми в сопоставимых группах пациентов с хирургическим лечением АС.
В группах пациентов с применением кардиохирургических методов в отдаленном периоде наблюдения отмечается улучшение продольной систолической функции ЛЖ, определяемой на основании абсолютных величин глобальной систолической продольной деформации. Показатель 8’лат мк тканевой допплерографии статистически значимо улучшился у пациентов как с вшиваемыми и бесшовными биологическими протезами, так и с ТИАК
Восстановление систолической функции ЛЖ в отдаленном периоде, установленное на основании результатов выполнения 2D-speckle-tracking- ЭхоКГ, было диагностировано у 12 (60,0%) пациентов с шовными и бесшовными биологическими протезами.
Таким образом, коррекция тяжелого АС с использованием кардиохирургических и эндоваскулярных методов ассоциирована с благоприятными показателями внутрисердечной гемодинамики и обратным структурно-функциональным ремоделированием ЛЖ в отдаленном периоде послеоперационного наблюдения.
Список литературыVahanian A., Beyersdorf F, Praz F et al.; ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur. Heart J. 2022; 43 (7): 561-632.
Baumgartner H., Falk V., Bax J.J. et al; ESC Scientific Document Group. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur. Heart J. 2017; 38 (36): 2739-2791.
Астапов Д.А., Железнев С.И., Исаян М.В., Слепе- нок Е.В. Результаты протезирования аортального клапана биологическим протезом БиоЛАБ КА/ПТ у больных пожилого и старческого возраста. Кардиология и сердечно-сосудистая хирургия. 2014; 7 (1): 54-55. А
Cribier A. The development of transcatheter aortic valve replacement (TAVR). Glob. Cardiol. Sci. Pract. 2016; 2016 (4): e201632.
Pieske B., Tschope C., de Boer R.A. et al. How to diagnose heart failure with preserved ejection fraction: the HFA- PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur. Heart J. 2019;
Тарасевич С.В., Жерко О.М., Галицкая С.С., Крачак Д.И., Комаровская Е.Г. Структурно-функциональное ремоделирование левого и правого желудочков после биопротезирования аортального клапана по поводу аортального стеноза. Медицинские новости. 2024; 9: 44-48.
Tarasevich S.V., Zherko O.M., Galitskaya S.S. et al. Structural and functional remodeling of the left and right ventricles after bioprosthetic replacement of the aortic valve for aortic stenosis. Medical News. 2024; 9: 44-48. (In Russian)
Тарасевич С.В., Жерко О.М., Крачак Д.И., Галицкая С.С. Отдаленные результаты применения вшиваемых биологических протезов у пациентов с аортальным стенозом. БГМУ в авангарде медицинской науки и практики: рецензируемый ежегодный сборник научных трудов: в 2-х томах. 2024; Вып. 14. Т. 1: Клиническая медицина: 208-214.
Marsan N.A., Delgado V., Shah D.J. et al. Valvular heart disease: shifting the focus to the myocardium. Eur. Heart J. 2023; 44 (1): 28-40.
Авторы:
Тарасевич Светлана Владимировна - врач ультразвуковой диагностики отделения функциональной диагностики ГУ “Республиканский клинический медицинский центр” Управления делами Президента Республики Беларусь, Минск.
Жерко Ольга Михайловна - доктор мед. наук, доцент, заведующая кафедрой ультразвуковой диагностики УО “Белорусский государственный медицинский университет”, Минск.
Крачак Дмитрий Иосифович - канд. мед. наук, заведующий отделом перспективных направлений высокотехнологичной медицинской помощи ГУ “Минский научно-практический центр хирургии, трансплантологии и гематологии”, Минск.
Галицкая Светлана Сергеевна - канд. мед. наук, заместитель главного врача по лечебной части ГУ “Республиканский клинический медицинский центр” Управления делами Президента Республики Беларусь, Минск.
Теги: лучевые методы
234567 Начало активности (дата): 03.01.2026
234567 Кем создан (ID): 989
234567 Ключевые слова: вшиваемые биологические протезы; обратное структурно-функциональное ремоделирование; бесшовные биологические протезы; транскатетерная имплантация аортального клапана
12354567899
Похожие статьи
Коронавирусная инфекция COVID-19. Лучевые методы исследования при COVID-19 и вирусных пневмонияхРентген на дому 8 495 22 555 6 8
Неотложная, военная и экстремальная лучевая диагностика
Септическая эмбологенная пневмония при инфекционном эндокардите правых отделов сердца: лучевая диагностика
Лучевая диагностика травм различных отделов позвоночника и спинного мозга



