 18.11.2025
18.11.2025
Адъювантная терапия ALK-позитивного рака легких: клинический случай
Немелкоклеточный рак легких (НМРЛ) является вторым по распространенности злокачественным новообразованием (ЗНО) и основной причиной смертности, связанной с опухолями, во всем мире
ВВЕДЕНИЕ
Рак легких по-прежнему остается основной причиной смерти от ЗНО во всем мире [1]. На долю пациентов с немелкоклеточным вариантом заболевания приходится порядка 80-85% случаев [2, 3]. На протяжении долгих лет проведение послеоперационной платиносодержащей химиотерапии у пациентов с локализованной IB-II стадией и местнораспространенной IIIA стадией НМРЛ оставалось единственным вариантом системного противоопухолевого лекарственного лечения с доказанным преимуществом в отношении общей выживаемости (ОВ). Тем не менее у большинства пациентов в последующем регистрируется прогрессирование заболевания, что снижает 5-летнюю выживаемость с 90 до 24% по мере увеличения стадии заболевания [4]. С развитием таргетной терапии (ТТ) и терапии ингибиторами контрольных точек иммунного ответа, эффективность которых была продемонстрирована у пациентов с распространенным или метастатическим процессом, целесообразность данных вариантов лечения была подтверждена и одобрена регулирующими органами и для лечения локализованного резектабельного НМРЛ. Стоит отметить, у пациентов с драйверными мутациями в генах EGFR и ALK проведение иммунотерапии, как правило, демонстрирует ограниченную пользу или ее отсутствие даже по сравнению с химиотерапией (ХТ) [5-8], а применение в последующем ТТ увеличивает риск развития токсичности [9].
Киназа анапластической лимфомы (ALK) является рецепторной тирозинкиназой из семейства инсулинзависимых рецепторов.
Существует три основных типа перестройки гена ALK: перегруппировка (слияние), амплификация и точечная мутация [10]. Пациентов с ALK-позитивным НМРЛ, как правило, отличают более молодой возраст, отсутствие в анамнезе курения [11] и, к сожалению, более агрессивное течение заболевания с высокой частотой прогрессирования на послеоперационном этапе, что приводит к снижению показателей выживаемости, особенно при III стадии [12]. Таким образом, неудовлетворенная потребность в высокоэффективной противоопухолевой терапии резектабельного ALK-позитивного НМРЛ и беспрецедентные успехи ТТ при распространенных стадиях заболевания послужили основанием для изучения эффективности применения ингибитора тирозинкиназы ALK в качестве адъювантной терапии после радикального хирургического лечения.
В многоцентровом рандомизированном исследовании III фазы ALINA оценивалась эффективность и безопасность адъювантной терапии алектинибом по сравнению с химиотерапией на основе препаратов платины после радикального хирургического лечения у пациентов с ALK-положительным НМРЛ стадий IB (£4 см) - IIIA. Участники были рандомизированы в группу алектиниба (600 мг 2 раза в сутки в течение двух лет, n = 130) либо в группу платиносодержащей химиотерапии по выбору исследователя (4 курса, n = 127). Первичной конечной точкой исследования являлась безрецидивная выживаемость (БРВ) [13], которая была проверена иерархически. Вторичными конечными точками исследования были ОВ, БРВ без признаков интракраниального прогрессирования и безопасность.
Средний возраст пациентов, включенных в исследование, составил 54 года в исследовательской группе и 57 лет в группе ХТ. В зависимости от клинической стадии заболевания и статуса вовлечения лимфатических узлов в экспериментальной и контрольной группах пациенты распределились следующим образом: IB - 11 и 9%; II - 36 и 35%; IIIA - 53 и 55%; N0 - 16 и 14%; N1 - 35 и 34% и N2 - 49 и 52% соответственно.
При медиане наблюдения 28 мес. у пациентов с II-IIIA стадиями заболевания медиана БРВ в группе алектиниба не достигнута, тогда как в контрольной группе она составила 44,4 мес. (ОР 0,24; p < 0,0001), а трехлетняя БРВ - 88,3 и 53,3%. Преимущество в пользу алектиниба наблюдалось во всех заранее определенных подгруппах, включая стадию заболевания и статус регионарных лимфатических узлов.
Безрецидивная выживаемость без признаков интракраниального прогрессирования, являвшаяся важной исследовательской конечной точкой, через 36 мес. составила 95,5% в группе алектиниба и 79,7% в группе ХТ, что соответствовало снижению риска рецидива на 78% (ОР 0,22).
Адъювантная терапия алектинибом привела к снижению доли пациентов с местным или локо-регионарным рецидивом (n = 9 против 22), а также с отдаленным метастазированием (3 против 22). Уменьшение частоты отдаленного метастазирования оказалось особенно значимым в отношении поражения головного мозга (4 против 14).
Терапия алектинибом, несмотря на ее продолжительность, была хорошо переносима, а профиль нежелательных явлений (НЯ), возникших в процессе лечения, соответствовал изученным данным. Наиболее частыми (£20%) НЯ у пациентов, принимавших алектиниб, были гепатотоксичность, запор, миалгия, COVID-19, усталость, сыпь и кашель. Связанные с лечением НЯ 3-4-й степени были зарегистрированы у 18,0% пациентов в группе алектиниба и 27,5% - в группе ХТ. При этом частота прекращения лечения по причине токсичности составила 5,5 и 12,5% в исследовательской и контрольной группах соответственно [14]. Таким образом, результаты исследования ALINA кардинальным образом меняют тактику лечения пациентов с ALK-положительным резектабельным НМРЛ.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Женщина, 41 год, никогда не курила. В мае 2023 г. при обследовании перед проведением ЭКО было выявлено очаговое образование в нижней доле правого легкого. Пациентка была направлена на компьютерную томографию (КТ) органов грудной клетки, выполненную в сентябре 2023 г., по результатам которой был заподозрен рак легких. В связи с этим 19.10.2023 г. проведено хирургическое лечения в объеме: нижняя лобэктомия справа с медиастинальной лимфаденэктомией. По результатам планового патоморфологического исследования: недифференцированная (G3) аденокарцинома легкого смешанного строения (солидный и микропапиллярный паттерн), размер опухоли в наибольшем измерении 25 мм, с признаками лимфоваскулярной инвазии без периневральной инвазии, с прорастанием через весь эластический слой висцеральной плевры - PL1. В двух лимфатических узлах - метастазы с субтотальным замещением лимфоидной ткани и экстракапсулярной инвазией.
Пациентка обратилась в МНИОИ им. П.А. Герцена, где после дообследования и пересмотра стекол гистопрепаратов морфологический диагноз был подтвержден. Исследование 02.11.2023 г.: низкодифференцированная аденокарцинома легкого, солидного, криброзного, ацинарного строения с очагами микропапиллярного типа строения, полями некроза, отложением кальцинатов, лимфоваскулярной инвазией, врастание в висцеральную плевру (PL1). В краях резекции по сосудам и бронху опухолевый рост не выявлен. В 8 из 20 исследованных лимфатических узлах - метастазы карциномы преимущественно микропапиллярного типа строения с выраженным отложением кальцинатов. Выполнено ИГХ от 07.11.2023 г. с использованием антител: CA125 - положительная экспрессия в части клеток, WT1 - отрицательная экспрессия, P53 - экспрессия не выявлена, TTF1 - положительная экспрессия, что соответствует умеренно дифференцированной аденокарциноме легкого, преимущественно микропапиллярного типа строения.
ИГХ 08.11.2023 г. с использованием набора PD-L1 SP263 (Ventana): TPS - 0%, экспрессия PD-L1 не выявлена.
С учетом гистологической структуры опухоли, молодого возраста пациентки было выполнено молекулярно-генетическое исследование: в 18, 19, 20 и 21-м экзонах гена EGFR соматических мутаций T790M, L858R, DeL19ex, Ins19ex, G719X, Ins20ex, L861Q, S768I не выявлено. Однако при проведении FISH с использованием набора ALK Gene Probe Detection Kit (Wuhan Health Care) была обнаружена перестройка гена ALK.
Таким образом, у молодой женщины диагностирован периферический рак нижней доли бронхов или легкого, pT2aN2M0, IIIA стадии, по поводу которого было выполнено радикальное хирургическое лечение. С учетом возраста пациентки, стадии заболевания, морфологической структуры опухоли и выявленной транслокации ALK, а также результатов исследования ALINA, которые были представлены в октябре 2023 г., больной с 22.11.2023 г. начато проведение адъювантной таргетной терапии алектини- бом в дозе 1200 мг/сут. До начала лечения выполнено контрольное обследование в объеме КТ органов грудной клетки, брюшной полости и малого таза с контрастированием с целью исключения прогрессирования заболевания и полноценного стартового обследования для дальнейшего контроля, по данным которого данных за рецидив или прогрессирование не выявлено.
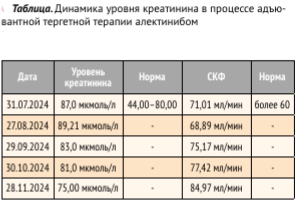
Пациентка продолжает адъювантную терапию алектинибом по настоящее время без признаков прогрессирования заболевания согласно результатам контрольных обследований, которые проводятся каждые 3 мес. Следует отметить удовлетворительный профиль безопасности проводимого лечения, на протяжении всего периода лечения состояние пациентки остается удовлетворительным, она продолжает заниматься привычной профессиональной и повседневной деятельностью, спортом. По данным лабораторных исследований отмечено незначительное повышение уровня креатинина без снижения скорости клубочковой фильтрации, которое разрешилось самостоятельно (таблица).
Динамика уровня креатинина в процессе адъювантной тергетной терапии алектинибом
ОБСУЖДЕНИЕ
Ожидается, что более раннее использование алектини- ба в алгоритме лечения пациентов с ALK-положительным НМРЛ позитивно повлияет на течение и прогноз заболевания у пациентов после радикального хирургического лечения. Безусловно, говоря о проведении адъювантной терапии, наиболее надежным и ценным показателем для одобрения препарата является общая выживаемость1 [15]. Однако, когда речь идет о проведении адъювантной терапии, получение зрелых данных в отношении ОВ часто требует длительного времени, в связи с чем в подобных исследованиях используются такие суррогатные конечные точки, как выживаемость без рецидива, что способствует ускоренному, хотя иногда и временному одобрению препаратов до момента получения данных по ОВ [16]. Подобный подход требует использования пороговых значений для суррогатных конечных точек, который, как ожидается, будет коррелировать с потенциальным преимуществом в отношении ОВ.
Аналогичная неопределенность имеется и в отношении оптимальной продолжительности таргетной адъювантной терапии при НМРЛ. В исследовании ALINA длительность лечения составила 2 года с целью соблюдения баланса эффективности и токсичности. В то же время в исследовании ADAURA продолжительность терапии осимертинибом после радикального хирургического лечения составила 3 года. Следует отметить, что, несмотря на значимое улучшение БРВ и ОВ, продолжающееся наблюдение за пациентами показало, что кривые БРВ и БРВ без поражения ЦНС демонстрируют более резкое снижение после завершения приема осимертиниба [17, 18]. Завершение таргетной терапии алектинибом также может быть сопряжено с увеличением частоты рецидивов, что требует дополнительного уточнения влияния различных факторов риска, таких как молекулярно-генетический профиль опухоли, минимальный остаточный объем болезни для идентификации подгруппы пациентов, которые могут получить пользу от продленной терапии. В свете этого крайне актуальны результаты анализа биомаркеров, проведенного в исследовании ALINA. Напомним, что выборка, в которой удалось оценить биомаркеры, представляла собой часть общей выборки исследования ALINA и включала пациентов из обеих групп, у которых было достаточно исходной опухолевой ткани для анализа, на основании чего был получен результат отчета FoundationOne® CDx [19]. Исходные характеристики и БРВ пациентам, которым был проведен биомаркерный анализ (n = 193), были сопоставимы с общей популяцией (n = 257). В когорте пациентов, которым был проведен биомаркерный анализ, у 81% (n = 157) выявлены транслокации EML4-ALK. Наиболее распространенными вариантами были V1 (37%) и V3 (33%). Независимо от варианта слияния EML4-ALK алектиниб продемонстрировал преимущество в БРВ по сравнению с химиотерапией.
Сопутствующие мутации чаще всего выявлялись в генах CDKN2A, CDKN2B, TP53 и MTAP, но не были ассоциированы с влиянием на БРВ.
Частота мутаций TP53 у пациентов с резектабельным ALK- позитивным НМРЛ в исследовании ALINA оказалась значительно ниже - 24% по сравнению с метастатическим ALK-позитивным НМРЛ в исследовании ALEX - 41%. При этом в группе алектиниба у пациентов с мутациями в гене TP53 была отмечена тенденция к снижению БРВ по сравнению с пациентами с диким типом TP53 (ОР = 2,73). Аналогичной закономерности в группе химиотерапии не наблюдалось. При анализе рецидивов не было выявлено механизмов резистентности к ALK-ингибиторам. В свете полученных результатов крайне актуальным становится вопрос в отношении целесообразности последовательного назначения послеоперационной ХТ и ТТ, в частности у пациентов с мутациями в гене TP53. Обладая широким механизмом действия, ХТ потенциально может воздействовать на различные клеточные популяции внутри опухоли, потенциально снижая риск рецидива в тех случаях, когда таргетная терапия может пропустить определенные субклоны опухолевых клеток. Все сказанное выше, безусловно, требует дальнейших исследований, что позволит персонализировать подход к выбору варианта и длительности адъювантной терапии.
ЗАКЛЮЧЕНИЕ
Данный клинический пример наглядно демонстрирует изменение парадигмы лечения пациентов с резектабельным ALK-позитивным НМРЛ. Наряду с высокой эффективностью и значительным снижением токсичности алектиниба по сравнению с ХТ в адъювантных условиях, дальнейшие наблюдения и исследования должны быть нацелены на оценку ОВ и поиск дополнительных предиктивных маркеров.
Список литературыSung H, FerLay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence
and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 ;71(3):209-249
Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin. 2021;71(1):7-33
Vansteenkiste J, Wauters E, Reymen B, Ackermann CJ, Peters S, De Ruysscher D. Current status of immune checkpoint inhibition in early- stage NSCLC. Ann Oncol. 2019;30(8):1244-1253.
Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WE et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39-51
Gainor JF, Shaw AT, Sequist LV, Fu X, Azzoli CG, Piotrowska Z et al. EGFR Mutations and ALK Rearrangements Are Associated with Low Response Rates to PD-1 Pathway Blockade in Non-Small Cell Lung Cancer:
A Retrospective Analysis. Clin Cancer Res. 2016;22(18):4585-4593
Mazieres J, Drilon A, Lusque A, Mhanna L, Cortot AB, Mezquita L et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019;30(8):1321 -1328
Yang JC, Lee DH, Lee JS, Fan Y, de Marinis F, Iwama E et al. Pemetrexed and platinum with or without pembrolizumab for tyrosine kinase inhibitor (TKI)-resistant, EGFR-mutant, metastatic nonsquamous NSCLC: phase 3 KEYNOTE-789 study. J Clin Oncol. 2023;41(17 Suppl.):LBA9000-LBA9000
Mok TSK, Nakagawa K, Park K, Ohe Y, Girard N, Kim HR et al. LBA1568: nivolumab (NIVO) + chemotherapy (chemo) vs chemo in patients (pts) with EGFR-mutated metastatic non-small cell lung cancer (mNSCLC) with disease progression after EGFR tyrosine kinase inhibitors (TKIs) in CheckMate 722. Ann Oncol. 2022;33:S1561-S1562. https//doi.org/ 10.1016/j.annonc.2022.10.350.
Tsao MS, Kerr KM, Kockx M, Beasley MB, Borczuk AC, Botling J et al. PD-L1 Immunohistochemistry Comparability Study in Real-Life Clinical Samples: Results of Blueprint Phase 2 Project. J Thorac Oncol. 2018;13(9):1302-1311
Zito Marino F, Botti G, Aquino G, Ferrero S, Gaudioso G, Palleschi A et al. Unproductive Effects of ALK Gene Amplification and Copy Number Gain in Non-Small-Cell Lung Cancer. ALK Gene Amplification and Copy Gain in NSCLC. Int J Mol Sci. 2020;21(14):4927
Remon J, Pignataro D, Novello S, Passiglia F. Current treatment and future challenges in ROS1- and ALK-rearranged advanced non-small cell lung cancer. Cancer Treat Rev. 2021 ;95:102178. https//doi.org/10.1016/j.ctrv. 2021.102178.
Chaft JE, Dagogo-Jack I, Santini FC, Eng J, Yeap BY, Izar B et al. Clinical outcomes of patients with resected, early-stage ALK-positive lung cancer. Lung Cancer.2018;122:67-71
Solomon B, Ahn J, Dziadziuszko R, Barlesi F, Nishio M, Lee D et al. LBA2 ALINA: efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+ non-small cell lung cancer (NSCLC).
Ann Oncol. 2023;34(Suppl. 2):S1295-S1296
Wu YL, Dziadziuszko R, Ahn JS, Barlesi F, Nishio M, Lee DH et al. Alectinib in Resected ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2024;390(14):1265-1276
Cherny NI, Dafni U, Bogaerts J, Latino NJ, Pentheroudakis G, Douillard JY et al. ESMO-Magnitude of Clinical Benefit Scale version 1.1. Ann Oncol. 2017;28(10):2340-2366
Gyawali B, Hwang TJ, Vokinger KN, Booth CM, Amir E, Tibau A. Patient- Centered Cancer Drug Development: Clinical Trials, Regulatory Approval, and Value Assessment. Am Soc Clin Oncol Educ Book. 2019;39:374-387.
Wu YL, Tsuboi M, He J, John T, Grohe C, Majem M et al.; ADAURA Investigators. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med. 2020;383(18):1711-1723
Herbst RS, Wu YL, John T, Grohe C, Majem M, Wang J et al. Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial.
J Clin Oncol.2023;41(10):1830-1840
Solomon B, Wu Y, Dziadziuszko R, Barlesi F, Nishio M, Ahn J et al. 1206MO ALINA: Exploratory biomarker analyses in patients (pts) with resected ALK+ non-small cell lung cancer (NSCLC) treated with adjuvant alectinib vs chemotherapy (chemo). Ann Oncol. 2024;35(2):S775
Информация об авторах:
Корниецкая Анна Леонидовна, к.м.н., ведущий научный сотрудник отдела лекарственного лечения опухолей, Московский научно-исследовательский онкологический институт имени П.А. Герцена - филиал Национального медицинского исследовательского центра радиологии; 125834, Россия, Москва, 2-й Боткинский проезд, д. 3; SPIN-код: 2651-7158
Евдокимова Сэвиндж Физулиевна, к.м.н., врач-онколог отделения химиотерапии, Московский научно-исследовательский онкологический институт имени П.А. Герцена - филиал Национального медицинского исследовательского центра радиологии; 125834, Россия, Москва, 2-й Боткинский проезд, д. 3; SPIN-код: 2449-5866
Болотина Лариса Владимировна, д.м.н., заведующая отделением химиотерапии, Московский научно-исследовательский онкологический институт имени П.А. Герцена - филиал Национального медицинского исследовательского центра радиологии; 125834, Россия, Москва, 2-й Боткинский проезд, д. 3; SPIN-код: 2787-5414
Теги: рак легких
234567 Начало активности (дата): 18.11.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: немелкоклеточный рак легких, алектиниб, ALK-позитивный рак легкого, ингибиторы тирозинкиназы, клинический случай
12354567899
Похожие статьи
Как выглядит рак легких на рентгене: камчатские медики информируютРентген на дому 8 495 22 555 6 8
Трудности диагностики метастатического поражения легких
Проблемы и достижения в лечении рака легких
Факторы риска нестабильности имплантатов после спондилэктомии у пациентов с опухолями позвоночника



