 04.11.2025
04.11.2025
Трудности диагностики метастатического поражения легких
Рентгенологические признаки изменений в легких не соответствовали обычным характеристикам метастатического поражения при РМЖ и имитировали течение пневмонии без ответа на антибактериальную терапию
Введение
Рак молочной железы (РМЖ) - наиболее распространенное онкологическое заболевание среди женщин в мире, он составляет примерно 30% всех новых случаев злокачественных новообразований (ЗНО) у женщин и занимает 2-е место в структуре смертности женщин от ЗНО. У 20-30% пациентов с РМЖ метастазы выявляются в первые 5 лет после постановки диагноза и первичного лечения опухоли [1, 2].
В России по данным на 2023 г. диагностировано 81 784 случая РМЖ в год (19,1% от всех случаев ЗНО и 20,8% от всех пациентов с ЗНО, наблюдающихся более 5 лет) [3].
Рак молочной железы чаще всего метастазирует в кости (75% случаев); легкие занимают 2-е место по частоте развития метастазов (до 32%) с 5-летней выживаемостью до 16,8% случаев.
Развитие отдаленных метастазов снижает общую 5-летнюю выживаемость пациентов с РМЖ до 25%, тогда как у пациентов без метастазов этот показатель превышает 80% [1, 4]
Клиническое наблюдение
Пациентка, 68 лет, индекс массы тела 25,6 кг/м2, поступила в стационар в июле 2022 г. с жалобами на непродуктивный кашель, одышку при подъеме на 2-й этаж, общую слабость.
Из анамнеза заболевания известно, что в сентябре 2021 г. был эпизод острого респираторного заболевания с частым непродуктивным кашлем. После симптоматического лечения кашель сохранялся, в связи с чем в ноябре 2021 г. принимала амоксициллин без выраженного эффекта.
В феврале 2022 г. кашель усилился, появились фебрильная температура тела, одышка, пациентка была госпитализирована с диагнозом “новая коронавирусная инфекция COVID-19 (вирус идентифицирован), двусторонняя полисегментарная пневмония (КТ-2)”; проводилась терапия левилимабом согласно клиническим рекомендациям.
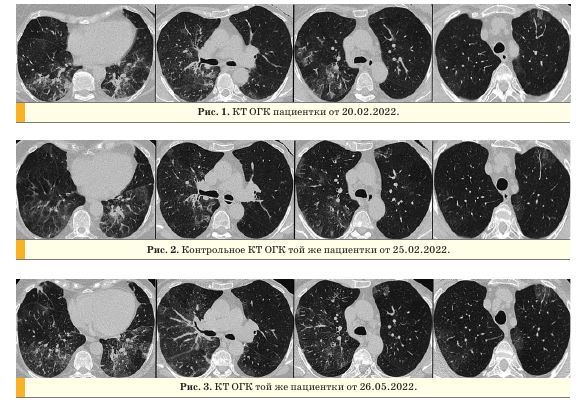
На компьютерных томограммах (КТ) органов грудной клетки (ОГК) от 20.02.2022 в обоих легких визуализировались участки по типу “матового стекла”, ретикулярные изменения, зоны консолидации, с поражением 45-50% в правом легком, 35% - в левом легком (рис. 1).
При контрольном обследовании через 4 дня отмечалась положительная динамика в виде уменьшения площади поражения и организации в линейные структуры, в правом легком - до 30%, в левом легком - до 20% (рис. 2).
После выписки из инфекционного стационара у пациентки сохранялся непродуктивный кашель. Амбулаторно выполнена КТ ОГК (26.05.2022), на которой на фоне ретикулярных изменений определялись двусторонние, преимущественно периферические, полисегментарные уплотнения по типу “матового стекла” с зонами консолидации, дисковидными ателектазами, в правом легком - единичные солидные узелки до 4,5 мм (рис. 3).
При исследовании функции внешнего дыхания на амбулаторном этапе форсированная жизненная емкость легких составила 85% от должной, объем форсированного выдоха за 1-ю секунду - 76% от должного, индекс Тиффно - 97%. Пациентка была консультирована и обследована фтизиатром, данных в пользу туберкулеза не выявлено.
Выполнена сцинтиграфия скелета, данных в пользу метастазов не выявлено.
В анализах крови отмечалось незначительное повышение уровня лейкоцитов - до 9,22 х 109/л и увеличение скорости оседания эритроцитов до 31 мм/ч, повышение уровня С-реактивного белка до 16,7 мг/л; остальные показатели, в том числе общий и ионизированный кальций, в пределах референсных значений.
У пациентки отягощенный онкологический анамнез. В 2004 г. было проведено комбиниро
ванное лечение по поводу рака левой молочной железы 3Б стадии (люминальный подтип В, НЕИ2-отрицательный (HER2 - human epidermal growth factor receptor 2 (рецептор к человеческому эпидермальному фактору роста 2-го типа))), 3 курса неадъювантной химиотерапии, радикальная мастэктомия слева; 6 курсов адъювантной химиотерапии; гормонотерапия анастрозо- лом в течение 5 лет.
Аллергические реакции, лекарственную непереносимость, отягощенный наследственный анамнез по бронхолегочной патологии, профессиональную вредность пациентка отрицала, бытовые условия - без особенностей. Сопутствующие заболевания представлены гипертонической болезнью, хроническим вирусным гепатитом В без дельта-агента, минимальной степени активности, нетоксическим узловым зобом, эутиреозом. Пациентка бывший курильщик, индекс курения составил 5 пачек/лет, не курила с 1994 г.
При поступлении состояние пациентки расценивалось как средней степени тяжести. Правая молочная железа без особенностей. Кожный покров и видимые слизистые обычной влажности, чистые, периферические лимфатические узлы мелкие, подвижные, безболезненные, кожа над ними не изменена. Грудная клетка нормостеническая. Одышка по шкале mMRC (modified Medical Research Council - модифицированная шкала одышки Британского медицинского исследовательского совета) 2 балла, по шкале Борга-2 балла, частота дыхательных движений 16 в 1 мин, сатурация, измеренная методом пульсоксиметрии, 94% на воздухе в покое.
Отмечалось укорочение перкуторного звука в нижних отделах легких, аускультативно выслушивалось ослабленное везикулярное дыхание, крепитация в нижних отделах с обеих сторон. Артериальное давление 120/70 мм рт. ст., пульс 78 уд/мин. По остальным органам и системам очевидной патологии при физикальном осмотре не выявлено.
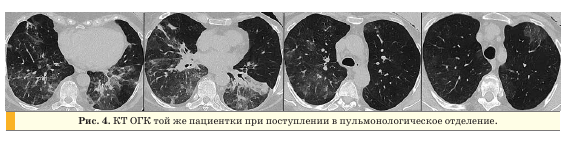
При обследовании в пульмонологическом отделении на КТ ОГК в нижних и средних отделах легких с обеих сторон сохранялись участки по типу “матового стекла” (объем измененной паренхимы остался прежним), утолщение междольковых и внутридольковых перегородок, внутригрудные лимфоузлы были увеличены до 8 мм, подмышечные лимфоузлы не увеличены (рис. 4).
Лабораторные показатели, включая газы артериальной крови, были в пределах референс- ных значений. При исследовании функции внешнего дыхания выявлены нормальные значения объемных показателей, снижение диффузионной способности легких по оксиду углерода (DLco) до 67% от должной, отношение DL к альвеолярному объему 88% от должного.
Проведена трансбронхиальная криобиопсия легкого из VI сегмента слева, взят бронхоальвеолярный лаваж (БАЛ) из среднедолевого бронха правого легкого; при обзоре бронхиального дерева эндоскопическая картина соответствовала хроническому бронхиту II степени интенсивности воспаления. В БАЛ был незначительный лимфоцитоз (до 15%); при исследовании методом полимеразной цепной реакции выделена ДНК Herpes simplex virus 1-го типа; галактоман- нан и роста микрофлоры не выявлено.
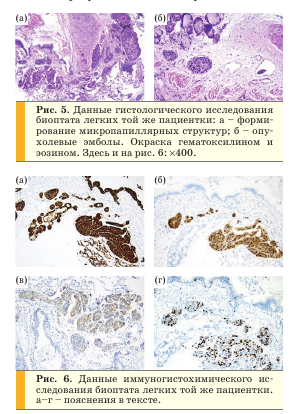
При гистологическом исследовании биоптата легкого в стенке бронха обнаружено скопление опухолевых клеток, часть из которых были с формированием микропапиллярных структур (рис. 5а), в некоторых сосудах определялись опухолевые эмболы (рис. 5б).
При иммуногистохимическом исследовании определялась положительная реакция с панцитокератиновыми антигенами (рис. 6а), с рецепторами эстрогена (ER) (80%), рецепторами прогестерона (PR) (20%) (рис. 6б) и отрицательная реакция с TTF-1 (тиреоидный фактор транскрипции-1), с Р40; реакция с антителами к HER2 (HER2/neu) была различной интенсивности, отмечалось неполное мембранное окрашивание менее 10% опухолевых клеток (1+) (рис. 6в); индекс пролиферативной активности Ki-67 составил 35% (рис. 6г).
Таким образом, у пациентки верифицировано метастатическое поражение легких через 18 лет ремиссии после комплексного лечения РМЖ.
Проведен онкоконсилиум, определена тактика лечения. С июля 2022 г. по август 2023 г. пациентка находилась на схеме терапии палбо- циклиб + летрозол + золедроновая кислота, на фоне которой отмечалось исчезновение кашля и одышки. По данным позитронно-эмиссионной
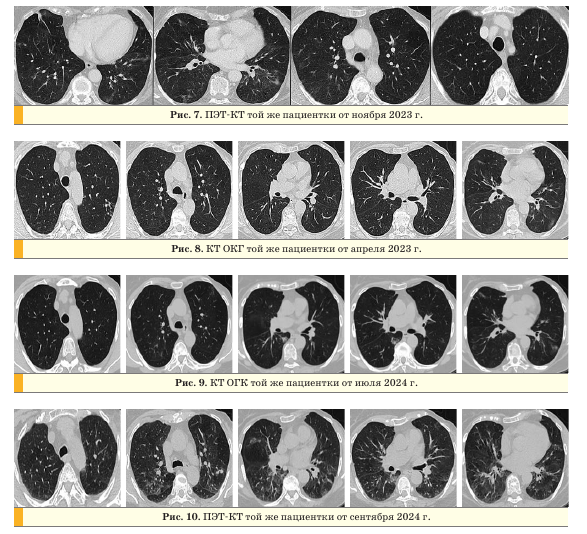
томографии (ПЭТ) с КТ от ноября 2023 г. отмечалась значительная положительная динамика в виде регресса ранее выявляемых изменений в легких (рис. 7).
В апреле 2023 г. пациентка перенесла острое респираторное заболевание с явлениями брон- хиолита в I—II сегменте левого легкого, антибактериальную терапию не принимала. В апреле 2024 г. находилась на стационарном лечении в связи с новой коронавирусной инфекцией COVID-19. При контрольном обследовании на КТ ОГК и ПЭТ-КТ определялись признаки прогрессирования в виде роста очагов и появления новых очагов в легких и костях.
У пациентки пересмотрена терапия, она переведена на схему фулвестрант + деносумаб, на фоне проведения которой состояние пациентки стабилизировалось, признаков прогрессирования заболевания не наблюдалось.
Динамика данных рентгенологических исследований представлена на рис. 8-10.
Обсуждение
Рак молочной железы имеет отчетливую метастатическую картину, обычно затрагивающую кости, печень, легкие и мозг. Развитие метастазов РМЖ в том или ином органе представляет собой сложный процесс, зависящий от множества факторов, основным из которых является молекулярный подтип опухоли. Выделяют 4 подтипа РМЖ, зависящих от экспрессии генов, статуса ER, PR, HER2 и статуса пролиферации, который определяют по индексу пролиферативной активности Ki-67. По мере нарастания агрессивности опухоли выделяют люминальный подтип A (ER+/PR+), люминальный подтип B (ER+/PR+/HER2-/+/Ki-67+), сверхэкспрессирую- щий подтип HER2 (ER/PR/HER+) и базально- подобный/трижды негативный (TN) подтип (ER/PR/HER2). Наибольшую склонность к метастазированию в легкие имеет РМЖ подтипа TN (32%), меньшую - люминальный A/B (21%) и HER2+ (25%) подтипы [4]. Первой линией метастазирования РМЖ являются подмышечные лимфоузлы, поражение считается регионарным. У нашей пациентки был РМЖ, люминальный подтип В, HЕR2-отрицательный, без метастазов в региональные лимфоузлы на момент верификации диагноза. Последний факт является важным обстоятельством, так как это определяло степень риска отдаленного метаста- зирования. H. Pan et al. представили метаанализ 88 клинических исследований (n = 62 923, ER+, адъювантная эндокринотерапия). Риск развития отдаленных метастазов в течение 20 лет (5-20 лет) после первичного лечения составил 22 и 52% при N0 и наличии 4-9 пораженных лимфоузлов соответственно. Пациенты с отдаленными метастазами имели лучший прогноз, чем при ранних рецидивах, медиана выживаемости составляла 52 против 40 мес [2].
При рентгенологической визуализации метастазы РМЖ в легкие преимущественно солитарные (до 38,7%), могут быть единичными, но чаще встречаются множественные очаги (52-82%) [1, 2]. В представленном клиническом наблюдении имела место неоднозначная КТ-картина метастазов РМЖ в легкие, похожая на пневмонию, что затруднило своевременную диагностику.
Интересны патогенез метастазирования РМЖ в легкие, другие органы и поиск причин или факторов риска непосредственно у нашей пациентки. Метастазирование опухоли, как правило, состоит из нескольких последовательных этапов, включающих выход из окружающих тканей первичной опухоли, интравазацию в кровеносные и/или лимфатические сосуды с образованием циркулирующих опухолевых клеток, экстравазацию с последующей диссеминацией и трансформацией опухолевых клеток с формированием метастаза.
Возникновение метастазов РМЖ в легких обусловлено множеством факторов. Выделен ряд генов, способствующих образованию микро- и макрометастазов в легких. К ним относятся ингибитор BMP (bone morphogenetic protein - костный морфогенетический белок) Coco, белки ингибиторов дифференцировки, связывания ДНК ID1 и ID3; ген, кодирующий белок внеклеточного матрикса тенасцин С, CXCL1 (chemokine (C-X-C motif) ligand 1 - хемокиноый (C-X-C-мотив) лиганд 1), молекула адгезии сосудистой клетки 1 (vascular cell adhesion molecule 1, VCAM-1), а также ген тонких настроек эпителиально-мезенхимального перехода и циркулирующих биомаркеров рака микроРНК (miR-200) [5]. Так, например, Coco, избыточно экспрессируемый метастатическими клетками антагонист лигандов трансформирующего фактора роста b (transforming growth factor b, TGF-b), активирует спящие клетки РМЖ с образованием повторных колоний в легочной ткани [6].
Метастатические клетки РМЖ инициируют экспрессию TGF-b с последующим выделением периостина, белка экстрацеллюлярного матрикса, и активацией сигнального пути Wnt, который способствует развитию метастазов в легких.
Гликопротеин тенасцин C способствует активации пути Notch и поддерживает клеточный рост РМЖ. VCAM-1 способствует защите клеток РМЖ от апоптоза [5]. ID1 способствует колонизации и устойчивой пролиферации метастатических клеток в легких у пациентов с TN-подтипом РМЖ [7].
Процессам развития метастазов в тканях легкого способствует формирование так называемых преметастатических ниш (ПМН). Большую роль в этих процессах играют внешние факторы, к которым относятся курение и длительное воздействие загрязняющих веществ окружающей среды. Длительное воздействие поллютантов, сигаретного дыма негативно влияет как на врожденную, так и на адаптивную иммунную систему. Никотин стимулирует прогрессирование метастазов, хотя не является онкогеном. Хроническое воздействие никотина способствует формированию ПМН в легких посредством активации сигнального трансдуктора и активатора транскрипции-3 (signal transducer and activator of transcription-3, STAT3), серин/треониновой протеинкиназы В (Akt) и NF-kB (nuclear factor кВ - ядерный фактор кВ). При этом высвобождаются проопухолевые N2-нейтрофилы с секрецией STAT3-активируемого липокалина 2 (LCN2), что стимулирует колонизацию и рост метастазов. Доказано, что LCN2 может длительно сохраняться в легких крыс, подвергнувшихся воздействию сигаретного дыма, и плазме курящих пациентов. В исследованиях также подтверждается влияние сигаретного дыма на иммуносупрессию за счет снижения активности естественных клеток-кил- леров (natural killer, NK), антигенной активности макрофагов, уменьшения количества дендритных клеток и пролиферации Т-клеток [8]. Курение сигарет повышает риск развития метастазов на 18% и снижает выживаемость при постановке диагноза на 33% [9].
Помимо воздействия внешних факторов в формировании ПМН участвуют фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF), фактор некроза опухоли (ФНО) и TGF-p. Показана роль CSF3 (colony-stimulating factor 3 - колониестимулирующий фактор 3), выделяемого клетками опухоли, и CCL2 (chemokine (C-C motif) ligand 2 - хемокиновый (C-C-мотив) лиганд 2) в формировании ПМН путем привлечения воспалительных моноцитов и макрофагов, которые облегчают процесс выхода циркулирующих опухолевых клеток из сосудистого русла, либо посредством ингибирования созревания NK-клеток [10, 11].
Гипоксия также стимулирует быстрый рост опухолевых клеток. Описаны преметастатические эффекты препаратов химиотерапии, таких как таксаны и антрациклины, несмотря на их эффективность в лечении РМЖ [1].
Интересна роль нейтрофилов в онкогенезе. В ряде исследований установлено, что нейтрофилы способны поддерживать возникновение метастазов, а экспрессия лейкотриенов способствует колонизации отдаленных органов и тканей. В исследовании J. Park et al. продемонстрирована зависимость нейтрофилов от лейкотриенов и арахидонат-5-липоксигеназы, что поддерживает активные метастатические клетки [12]. Это важно для разработки новых противоопухолевых препаратов. Способность нейтрофилов образовывать ловушки влияет на метастазирование опухолей путем стимуляции инвазии и миграции опухолевых клеток [13].
На развитие метастазов РМЖ в легких значительно влияет активация сигнального пути ФНО -a. В исследовании J. Berthelet et al. уровень ФНО-a был выше в метастазах в легких, чем в печени. Интерлейкин-11 и VEGF-D также способствуют поликлональному росту метастазов в легочной ткани. В экспериментальной модели оценивались эффективность ингибитора ФНО-a этанерцепта и ингибитора белков апоптоза бири- напанта в лечении метастазов РМЖ. Этанерцепт значительно снижал индекс разнообразия Шеннона в метастазах РМЖ в легких, не влияя на выживаемость субклонов. Биринапант, действие которого также зависит от ФНО-a, ликвидировал метастазы РМЖ в легких и печени, т.е. оказался высокоэффективным средством для снижения метастатической нагрузки [13]. Такие результаты предполагают в будущем высокий клинический потенциал этих препаратов в лечении пациентов с метастатическим РМЖ [14].
Заключение
В представленном нами клиническом наблюдении продемонстрировано развитие метастазов РМЖ в легких через 18 лет после радикальной терапии и исходно с отсутствием диагностированного поражения регионарных лимфоузлов. Клинические симптомы на разных этапах обследования пациентки были неспецифичными. Рентгенологические признаки изменений в легких не соответствовали обычным характеристикам метастатического поражения при РМЖ, имитировали течение пневмонии без ответа на антибактериальную терапию. В обсуждении мы затронули различные сложные пути возникновения метастазов РМЖ в легкие, которые имеют место и в данном случае. Кроме того, мы предполагаем значительное влияние на прогрессирование заболевания перенесенных инфекционных воспалительных заболеваний легких и анамнеза курения. Срок постановки диагноза у пациентки после первоначальной КТ ОГК составил около 4 мес ввиду неоднозначности данных. Следовательно, у пациентов с анамнезом онкологического заболевания, рецидивирующими и/или сохраняющимися изменениями в легких необходимо придерживаться активной стратегии их морфологической диагностики.
Список литературы
Liang Y, Zhang H, Song X, Yang Q. Metastatic heterogeneity of breast cancer: molecular mechanism and potential therapeutic targets. Seminars in Cancer Biology 2020 Feb;60:14-27.
Pan H, Gray R, Braybrooke J, Davies C, Taylor C, McGale P, Peto R, Pritchard KI, Bergh J, Dowsett M, Hayes DF; EBCTCG. 20-Year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. The New England Journal of Medicine 2017 Nov;377(19):1836-46.
Состояние онкологической помощи населению России в 2023 году. Под ред. Каприна А.Д., Старинского В.В., Шах- задовой А.О. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ “НМИЦ радиологии” Минздрава России; 2024. 262 с.
Medeiros B, Allan AL. Molecular mechanisms of breast cancer metastasis to the lung: clinical and experimental perspectives. International Journal of Molecular Sciences 2019 May;20(9):2272.
Kim MY. Breast cancer metastasis. Advances in Experimental Medicine and Biology 2021;1187:183-204.
Gao H, Chakraborty G, Lee-Lim AP, Mo Q, Decker M, Voni- ca A, Shen R, Brogi E, Brivanlou AH, Giancotti FG. The BMP inhibitor Coco reactivates breast cancer cells at lung metastatic sites. Cell 2012 Aug 17;150(4):764-79.
Gupta GP, Perk J, Acharyya S, de Candia P, Mittal V, Todo- rova-Manova K, Gerald WL, Brogi E, Benezra R, Massague J. ID genes mediate tumor reinitiation during breast cancer lung metastasis. Proceedings of the National Academy of Sciences of the USA 2007 Dec;104(49):19506-11.
Ferson M, Edwards A, Lind A, Milton GW, Hersey P. Low natural killer-cell activity and immunoglobulin levels associated with smoking in human subjects. International Journal of Cancer 1979 May;23(5):603-9.
Tyagi A, Sharma S, Wu K, Wu SY, Xing F, Liu Y, Zhao D, Deshpande RP, D’Agostino RB Jr, Watabe K. Nicotine promotes breast cancer metastasis by stimulating N2 neutrophils and generating pre-metastatic niche in lung. Nature Communications 2021 Jan;12(1):474.
Del Pozo Martin Y, Park D, Ramachandran A, Ombrato L, Cal- vo F, Chakravarty P, Spencer-Dene B, Derzsi S, Hill CS, Sa- hai E, Malanchi I. Mesenchymal cancer cell-stroma crosstalk promotes niche activation, epithelial reversion, and metastatic colonization. Cell Reports 2015 Dec;13(11):2456-69.
Chen WJ, Ho CC, Chang YL, Chen HY, Lin CA, Ling TY, Yu SL, Yuan SS, Chen YJ, Lin CY, Pan SH, Chou HY, Chen YJ, Chang GC, Chu WC, Lee YM, Lee JY, Lee PJ, Li KC, Chen HW, Yang PC. Cancer-associated fibroblasts regulate the plasticity of lung cancer stemness via paracrine signalling. Nature Communications 2014 Mar;5:3472.
Park J, Wysocki RW, Amoozgar Z, Maiorino L, Fein MR, Jorns J, Schott AF, Kinugasa-Katayama Y, Lee Y, Won NH, Nakasone ES, Hearn SA, Kuttner V, Qiu J, Almeida AS, Pe- rurena N, Kessenbrock K, Goldberg MS, Egeblad M. Cancer cells induce metastasis-supporting neutrophil extracellular DNA traps. Science Translational Medicine 2016 Oct;8(361):361ra138.
Berthelet J, Wimmer VC, Whitfield HJ, Serrano A, Boudi- er T, Mangiola S, Merdas M, El-Saafin F, Baloyan D, Wilcox J, Wilcox S, Parslow AC, Papenfuss AT, Yeo B, Ernst M, Pal B, Anderson RL, Davis MJ, Rogers KL, Hollande F, Merino D. The site of breast cancer metastases dictates their clonal composition and reversible transcriptomic profile. Science Advances 2021 Jul;7(28):eabf4408.
Montfort A, Colacios C, Levade T, Andrieu-Abadie N, Meyer N, Segui B. The TNF paradox in cancer progression and immunotherapy. Frontiers in Immunology 2019 Jul 31;10:1818.
Diagnostic Challenges of Lung Metastases G.E. Baimakanova, N.D. Kirichenko, and E.M. Kolyago The article presents a clinical case of metastatic breast cancer in lungs after 18 years from radical treatment, manifesting with nonspecific symptoms at different stages of patient examination. Radiological signs of lung lesions had atypical characteristics for breast cancer metastases and mimicked the course of antibiotic-resistant pneumonia. Various complicated pathways of breast cancer metastases to lungs that were also relevant in described case.
Авторы:ГБУЗ “Московский клинический научно-практический центр им. А.С. Логинова” Департамента здравоохранения города Москвы.
Гульсара Есенгельдиевна Баймаканова - докт. мед. наук, зав. отделом пульмонологии.
Наталья Дмитриевна Кириченко - врач-пульмонолог отдела пульмонологии.
Елена Максимовна Коляго - зав. химиотерапевтическим отделением № 4 Центра амбулаторной онкологической помощи.
Теги: метастатическое поражение легких
234567 Начало активности (дата): 04.11.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: рак молочной железы, метастатическое поражение легких, трансбронхиальная криобиопсия, гистологическое и иммуногистохимическое исследование, компьютерная томография, химиотерапия
12354567899
Похожие статьи
Факторы риска нестабильности имплантатов после спондилэктомии у пациентов с опухолями позвоночникаРентген на дому 8 495 22 555 6 8
Кисты челюстно-лицевой области и шеи
Юношеский артрит с системным началом
Дискогенная пояснично-крестцовая радикулопатия



