 22.07.2025
22.07.2025
Зависимость уровня сывороточного прокальцитонина от микрофлоры в очаге инфекции при хроническом остеомиелите
Исследование уровня прокальцитонина (ПКТ) одновременно с посевами крови на стерильность является важным дополнением в диагностическом алгоритме хронического остеомиелита
ВВЕДЕНИЕ
Хронический остеомиелит — сложная и трудно поддающаяся лечению костная бактериальная или грибковая инфекция, характеризующаяся прогрессирующей воспалительной деструкцией, некрозом и пролиферацией в области поражения кости, развивающаяся в результате осложнения раневого процесса при его сообщении с костью, оперативных вмешательств или бактериемии [1-3]. Как правило, остеомиелит имеет экзогенное происхождение, вызванное микробной инвазией, часто с образованием биопленки [4-8].
Лечение больных хроническим остеомиелитом требует длительной и интенсивной антимикробной терапии, вследствие чего возникает риск развития резистентности. Кроме того, остеомиелит опасен осложнениями (сепсис, бактериемия и др.).
В последние годы вновь возрос интерес к изучению роли различных биомаркеров (С-реактивный белок, интерлейкины 6 и 8, лактат, пресепсин, прокальцитонин и другие) в диагностике и оценке риска возникновения воспалительных синдромов [9-11]. Среди них выделяется прокальцитонин (ПКТ), который считается специфическим маркером бактериальной инфекции [12-16]. Известно, что уровни ПКТ в сыворотке крови у здоровых людей меньше 0,1 нг/мл. При тяжелых бактериальных и генерализованной грибковой инфекциях концентрация ПКТ быстро повышается, но остаётся низкой при вирусных инфекциях и неспецифических воспалительных заболеваниях [17].
Изолированный анализ ПКТ недостаточно информативен, поскольку его уровень может быть повышен не только при острых и хронических инфекционных процессах, включая остеомиелит, но и при различных неинфекционных состояниях, таких как аутоиммунные заболевания, тяжелые операции, травмы, ожоги, длительный кардиогенный шок, стресс [12, 13, 18].
Положительный посев культуры крови считается золотым стандартом диагностики бактериемии, тем не менее, отрицательные результаты не всегда исключают её отсутствие [14, 19, 20]. Для микробиологического исследования крови требуется время, что не позволяет использовать его в качестве экспресс-теста [21]. Высокие значения ПКТ при отрицательных результатах посева крови могут указывать на наличие местного воспаления, тогда как его повышенный уровень и положительный результат посева подтверждают системный инфекционный процесс.
Исследованию уровня ПКТ и результатов посевов крови на стерильность у пациентов с хроническим остеомиелитом посвящены единичные работы. По данным литературы, ПКТ играет роль чувствительного и специфического маркера в диагностике инфекций костей и суставов [22]. Положительные результаты посевов крови отмечены у 53 % пациентов с остеомиелитом позвонков, у 19 % с костной инфекцией и 7 % с параимплантной инфекцией [7].
Цель работы — выявить связь сывороточного ПКТ с микрофлорой, выделенной из крови, ран и свищей у пациентов с хроническим остеомиелитом.
Диагностика остеомиелита требует совокупности клинических признаков и симптомов, инструментальных и лабораторных исследований, в том числе и анализ на микрофлору с определением чувствительности к антибиотикам [23]. Исследование сывороточного ПКТ одновременно с посевами крови на стерильность может дать дополнительную информацию врачам, позволяя им прогнозировать течение и исход заболевания у пациентов с хроническим остеомиелитом.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены пациенты (п = 123) с хроническим остеомиелитом вне зависимости от локализации и механизма его возникновения, проходившие лечение в клинике гнойной остеологии НМИЦ ТО имени академика Г.А. Илизарова в период с 2021 по 2023 гг. Средний возраст пациентов составил 55 лет (IQR 43-66), на долю мужчин приходилось 70,3 % (71/101). Отсутствовали значимые различия между группами мужчин и женщин по возрасту (p = 0,32).
Проведен ретроспективный анализ микробиологических посевов (п = 294), в том числе крови на стерильность. Прокальцитониновый тест выполняли одновременно с забором крови на стерильность и на третьи сутки после операции. В случае неудовлетворительного результата, тест повторяли на 5-9 сут. по назначению врача.
Для быстрого культивирования патогенных микроорганизмов в крови использовали автоматический анализатор серии Юнона® Labstar 100. Микробные культуры идентифицировали до вида на бактериологическом анализаторе BactoScreen, ООО НПФ «Литех», определение чувствительности бактерий к антибактериальным препаратам диско-диффузионным методом на среде Мюллера - Хинтона. В зависимости от вида микроорганизма использовали различные наборы антибиотиков:
для неферментирующих грамотрицательных бактерий: 1 — тетрациклин (30 мкг), 2 — амикацин (30 мкг), 3 — гентамицин (10 мкг), 4 — тобрамицин (10 мкг), 5 — ципрофлоксацин (5 мкг), 6 — левоф- локсацин (5 мкг), 8 — меропенем (10 мкг), 9 — имипенем (10 мкг), 15 — пиперациллин/тазобактам (30/60 мкг), 23 — цефепим (30 мкг);
для энтеробактерий: 1 — тетрациклин (30 мкг), 2 — амикацин (30 мкг), 3 — гентамицин (10 мкг), 5 — ципрофлоксацин (5 мкг), 6 — левофлоксацин (5 мкг), 8 — меропенем (10 мкг), 9 — имипенем (10 мкг), 13 — цефтазидим (10 мкг), 14 — цефотаксим (5 мкг), 15 — пиперациллин/тазобактам (30/60 мкг);
для стафилококков: 1 — тетрациклин (30 мкг), 3 — гентамицин (10 мкг), 5 — ципрофлоксацин (5 мкг), 10 — ванкомицин (5 мкг), 12 — цефокситин (30 мкг), 16 — клиндамицин (2 мкг), 17 — эритромицин (15 мкг), 18 — фузидин (10 мкг), 19 — линезолид (10 мкг); 21 — рифампицин (5 мкг);
для энтерококков: 3 — гентамицин (30 мкг), 10 — ванкомицин (5 мкг), 11 — ампициллин (2 мкг), 27 — норфлоксацин (10 мкг), 19 — линезолид (10 мкг);
для стрептококков: 11 — ампициллин (2 мкг); 14 — цефотаксим (5 мкг), 16 — клиндамицин (2 мкг), 20 — бензилпенициллин (1 мкг).
Оценку результатов проводили, используя критерии EUCAST (англ.: European Committee on Antimicrobial Susceptibility Testing, Version 9.0, valid from 2019-01-01). Умеренно-резистентные штаммы относили к резистентным.
Концентрацию ПКТ в сыворотке крови определяли полуколичественным методом с помощью ИХА- прокальцитонин-теста (Россия). Интерпретацию результатов проводили в соответствии с рекомендациями производителя:
< 0,5 нг/мл — системная инфекция маловероятна, хотя возможна локализованная инфекция;
0,5 - < 2 нг/мл — системная инфекция возможна, но другие состояния (например, серьезная травма, недавняя операция, тяжелый кардиогенный шок) также могут вызывать значительное повышение уровня ПКТ;
2 - < 10 нг/мл — вероятна системная инфекция;
> 10 нг/мл — высокая вероятность тяжелого бактериального сепсиса или септического шока.
Полученные результаты исследования разделены на две группы: положительные и отрицательные. Положительные результаты в зависимости от выделенных микроорганизмов в культуре крови или очаге разделены на две категории: грамположительные и грамотрицательные бактерии.
Для обработки и статистического анализа полученных результатов использовали программу Gnumeric 1.12.17. Количественные переменные представлены в виде медианы и интерквартильного размаха (IQR), а качественные — в виде процентов. Непараметрический критерий Вилкоксона использовали для определения различий между группами. Для изучения взаимосвязи между значениями прокальцитонина и видовым составом бактерий, выделенных из ран, рассчитывали коэффициент ранговой корреляции Спирмена. Интерпретацию полученных данных проводили по шкале Чеддока. Различия считали значимыми при р < 0,05.
На клиническое исследование получено разрешение комитета по этике НМИЦ ТО имени академика Г.А. Илизарова, оно проведено в соответствии с этическими стандартами, изложенными в Хельсинской декларации.
РЕЗУЛЬТАТЫ
Концентрация ПКТ в крови ниже 0,5 нг/мл отмечена у 52,0 % обследуемых пациентов, от 0,5 до 2,0 нг/мл — у 19,5 % (р = 0,13), от 2,0-10,0 нг/мл — у 12,3 % (р = 0,049) и более 10 нг/мл — у 16,2 % (р = 0,049) человек.
Грамотрицательная микрофлора в крови выделена только у пациентов со значениями ПКТ более 10 нг/мл (табл. 1).
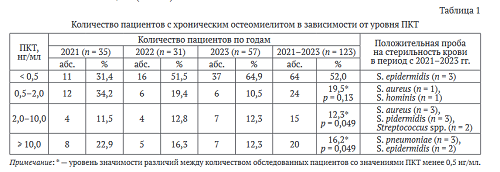
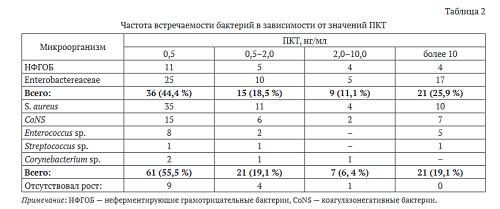
В микробном пейзаже из патологического очага у пациентов с ПКТ менее 0,5 нг/мл и 0,5-2,0 нг/мл преобладали грамположительные микроорганизмы (табл. 2). У пациентов с ПКТ от 2,0-10,0 нг/мл и выше 10 нг/мл выделялись как грамположительные, так и грамотрицательные бактерии. Среди грамотрица- тельных бактерий из ран и свищей чаще всего выделялись энтеробактерии, преимущественно штаммы K. pneumoniae, среди грамположительных бактерий — штаммы S. aureus. У пяти пациентов отсутствовал рост микроорганизмов в очаге, при этом уровень ПКТ был 0,5-2,0 нг/мл (n = 4), 2,0-10,0 нг/мл (n = 1). У одного пациента при бактериологическом исследовании посева из раны не обнаружено роста патогенных бактерий, а при исследовании крови на стерильность выявлен возбудитель Streptococcus spp., при этом ПКТ был в интервале от 2,0-10,0 нг/мл. У 10 пациентов микрофлора ран и свищей не совпадала с результатами посевов крови на стерильность. Доля пациентов со значениями ПКТ > 2 нг/мл и грамотрицательными бактериями в очаге была выше в сравнении с пациентами с грамположитель- ной микрофлорой.
Коэффициенты корреляции между микробиоценозом ран пациентов и значениями прокальцитони- на свидетельствуют об обратной связи между изучаемыми признаками. Теснота этих связей была заметной (г = -0,57 для грамотрицательной микрофлоры) и высокой (г = -0,74 для грамположительной микрофлоры) по шкале Чеддока.
Положительная проба на стерильность крови получена у 17 пациентов. У двух пациентов при первичном исследовании крови выделены штаммы K. pneumoniae, при этом значения сывороточного ПКТ превышали 10 нг/мл (табл. 3). При повторном исследовании в крови наблюдали смену микрофлоры на грамположительную с одновременным снижением ПКТ до 0,5 нг/мл (пациенты № 1 и № 2, табл. 3).
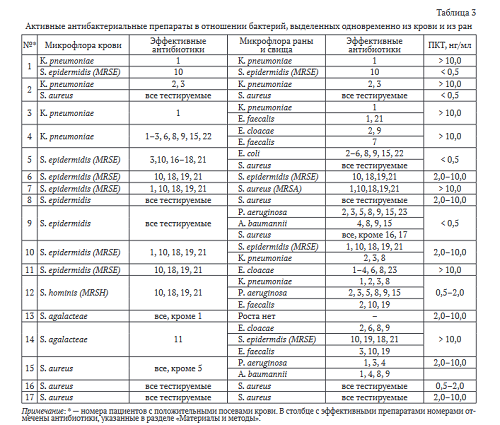
Среди положительных культур крови (n = 19) на первом месте по частоте выделения штаммы S. epidermidis (n = 8, из них 6 — MRSE), далее следовали изоляты S. aureus (n = 4), K. pneumoniae (n = 4), S. agalacteae (n = 2), метициллин-резистентный S. hominis (n = 1).
ПКТ в крови у семи человек был выше 10 нг/мл, у шести — 2,0-10,0 нг/мл. У двух человек отмечен низкий уровень ПКТ, и при этом в крови обнаружен инфекционный возбудитель. У шести пациентов микрофлора крови и чувствительность бактерий к тестируемым антибактериальным препаратам совпадала с микрофлорой ран. Грамположительные бактерии, выделенные из крови, были чувствительны к большинству из тестируемых препаратов. У шести пациентов из крови были выделены штаммы MRSE, при этом у двух из них ПКТ был выше 10 нг/мл.
Штаммы бактерий, принадлежащих к одному таксону, выделенные одновременно из крови и из ран, характеризовались одинаковой чувствительностью к антибактериальным препаратам. Среди наиболее эффективных антибактериальных препаратов в отношении K. pneumoniae были тетрациклины и аминогликозиды, в отношении бактерий рода Staphylococcus — гликопептиды, линезолид, рифампи- цин и фузидин.
У восьми пациентов с ПКТ выше 10 нг/мл снижение показателя до нормальных значений происходило в течение 7-9 дней. У семи пациентов (у трех из которых из крови были выделены микроорганизмы) ПКТ не снижался. У 13 из 15 пациентов с первоначальными значениями ПКТ от 2,0 до 10,0 нг/мл снижение показателя до нормальных отмечалось в течение 5-6 дней.
ОБСУЖДЕНИЕ
Согласно результатам проведенного исследования у пациентов с ПКТ менее 0,5 нг/мл, как правило, из очага высевались грамположительные микроорганизмы, преимущественно S. aureus. Частота встречаемости грамотрицательных бактерий была в 1,7 раза ниже. В то же время у пациентов со значениями ПКТ выше 10 нг/мл из очага (раны, свищи, кровь) в равной степени выделялись как грамотрицательные, так и грамположительные микроорганизмы. При этом у всех пациентов, у которых выделены штаммы K. pneumoniae из крови, уровень ПКТ был выше 10 нг/мл. Бактерии K. pneumoniae и MRSE, выделенные одновременно из крови и из ран, характеризовались высоким уровнем резистентности к большинству тестируемых антимикробных препаратов.
Во многих исследованиях описана корреляция между высоким уровнем сывороточного ПКТ и грамо- трицательной инфекцией кровотока [24]. Концентрации ПКТ были значительно выше у пациентов с положительными посевами крови [25]. На высокий уровень ПКТ в крови существенное влияние оказывает эндотоксин грамотрицательных бактерий, являющийся облигатным липополисахаридом бактериальной стенки.
Исследования показали, что инфекция кровотока, вызванная грамотрицательными бактериями, приводит к значительно более высокому уровню ПКТ, чем грамположительными бактериями. Это связано с тем, что грамотрицательные и грамположительные бактерии распознают Toll-подобный рецептор 4 и Toll-подобный рецептор 2 на поверхности клетки с помощью липополисахарида и липотейхоевой кислоты соответственно и впоследствии индуцируют высвобождение различных цитокинов и разные уровни ПКТ [26].
Имеются сообщения и об одинаковых значениях ПКТ при грамотрицательной и грамположительной бактериемии [27]. L. Oksuz et al. не смогли продемонстрировать статистически значимую разницу между грамотрицательной и грамположительной бактериями с точки зрения уровней ПКТ [28]. Установлена корреляция между значением ПКТ и микрофлорой при условии, что очаг инфекции и инфекция кровотока вызваны одним и тем же возбудителем [29].
Согласно литературным данным, у 40-90 % пациентов с предполагаемой системной инфекцией результаты посевов крови отрицательные [30]. В нашем исследовании в пяти случаях отсутствовал рост микроорганизмов, при этом уровень ПКТ был выше 0,5 нг/мл, но ниже 10 нг/мл. Уровень ПКТ выше 2 нг/мл отмечен у 35 человек, при этом лишь у 13 пациентов в крови обнаружен возбудитель. В то же время у двух человек с низким значением ПКТ (менее 0,5 нг/мл) из крови выделена микрофлора.
На сегодняшний день ПКТ является одним из наиболее изученных биомаркеров рационального использования антибиотиков [31]. Пороговые значения ПКТ < 0,5 мкг/л или снижение на 80-90 % от пикового уровня считаются признаком выздоровления, что служит основанием для завершения курса антибиотикотерапии. В нашем исследовании снижение ПКТ до пороговых значений происходило в течение 5-9 дней. В трех случаях снижения ПКТ не наблюдали. Мы предполагаем, что динамика концентрации ПКТ при проведении антибактериальной терапии может служить критерием эффективности применения антибиотика [31-32].
ЗАКЛЮЧЕНИЕ
У пациентов с ПКТ менее 0,5 нг/мл в микрофлоре ран и свищей чаще всего встречались грамполо- жительные микроорганизмы. Доля пациентов со значениями ПКТ > 2 нг/мл и грамотрицательны- ми бактериями в очаге была выше в сравнении с пациентами с грамположительной микрофлорой. Тем не менее, обнаруженная высокая корреляционная взаимосвязь между микробиоценозом ран пациентов и значениями прокальцитонина подтверждает ведущую роль грамположительных бактерий в развитии остеомиелита.
При положительных посевах крови уровень сывороточного ПКТ, в большинстве случаев, был выше 2,0 нг/мл. Наличие грамотрицательных бактерий в крови, также как и в ране, сопровождалось значениями ПКТ выше 10 нг/мл. При выделении одного и того же возбудителя из ран и крови отмечена высокая резистентность бактерий к большинству тестируемых препаратов.
СПИСОК ИСТОЧНИКОВ
Миронов С.П., Цискарашвили А.В., Горбатюк Д.С. Хронический посттравматический остеомиелит как проблема современной травматологии и ортопедии (обзор литературы). Гений ортопедии. 2019;25(4):610-621. doi: 10.18019/1028-4427-2019-25- 4-610-621.
Судницын А.С., Клюшин Н.М., Мигалкин Н.С. и др. Диагностика хронического остеомиелита, осложненного микозной инфекцией. Гений ортопедии. 2019;25(4):528-534. doi: 10.18019/1028-4427-2019-25-4-528-534.
Ma X, Han S, Ma J, et al. Epidemiology, microbiology and therapeutic consequences of chronic osteomyelitis in northern China: A retrospective analysis of 255 Patients. SciRep. 2018;8(1):14895. doi: 10.1038/s41598-018-33106-6.
Zhang K, Bai YZ, Liu C, et al. Composition of pathogenic microorganism in chronic osteomyelitis based on metagenomic sequencing and its application value in etiological diagnosis. BMC Microbiol. 2023;23(1):313. doi: 10.1186/s12866-023-03046-.x
Шипицына И.В., Осипова Е.В. Эффективность амикацина в комбинации с трипсином в отношении биоплёночных форм бактерий P. aeruginosa. Экспериментальная и клиническая фармакология. 2023;86(6):25-29. doi: 10.30906/0869-2092-2023-86-6-25- 29.
Besal R, Adamic P, Beovic B, Papst L. Systemic Antimicrobial Treatment of Chronic Osteomyelitis in Adults: A Narrative Review. Antibiotics (Basel). 2023;12(6):944. doi: 10.3390/antibiotics12060944.
Glaudemans AWJM, Jutte PC, Cataldo MA, et al. Consensus document for the diagnosis of peripheral bone infection in adults: a joint paper by the EANM, EBJIS, and ESR (with ESCMID endorsement). Eur J Nucl Med Mol Imaging. 2019;46(4):957-970. doi: 10.1007/ s00259-019-4262-x.
Шипицына И. В., Осипова Е. В., Леончук Д. С., Судницын А. С. Мониторинг ведущей грамотрицательной микрофлоры и антибиотикорезистентности при остеомиелите. Гений ортопедии. 2020;26(4):544-547. doi: 10.18019/1028-4427-2020-26-4-544-547.
Rubio-Diaz R, Julian-Jimenez A, Gonzalez Del Castillo J, et al. Ability of lactate, procalcitonin, and criteria defining sepsis to predict 30-day mortality, bacteremia, and microbiologically confirmed infection in patients with infection suspicion treated in emergency departments. Emergencias. 2022;34(3):181-189.
Velly L, Freund Y. Biomarkers of sepsis: An old story or an exciting future? Emergencias. 2022;34(6):474-475.
El Haddad H, Chaftari AM, Hachem R, et al. Biomarkers of Sepsis and Bloodstream Infections: The Role of Procalcitonin and Proadrenomedullin With Emphasis in Patients With Cancer. Clin InfectDis. 2018;67(6):971-977. doi: 10.1093/cid/ciy331.
Samsudin I, Vasikaran SD. Clinical Utility and Measurement of Procalcitonin. Clin Biochem Rev. 2017;38(2):59-68.
Шипицына И.В., Осипова Е.В., Люлин С.В., Свириденко А.С. Диагностическая ценность прокальцитонина в постравматиче- ском периоде у пациентов с политравмой. Политравма. 2018;(1):47-51.
Sato H, Tanabe N, Murasawa A, et al. Procalcitonin is a specific marker for detecting bacterial infection in patients with rheumatoid arthritis. JRheumatol. 2012;39(8):1517-1523. doi: 10.3899/jrheum.111601.
Zafar Iqbal-Mirza S, Serrano Romero de Avila V, Estevez-Gonzalez R, et al. Ability of procalcitonin to differentiate true bacteraemia from contaminated blood cultures in an emergency department. Enferm Infecc Microbiol Clin (Engl Ed). 2019;37(9):560-568. doi: 10.1016/j.eimc.2019.01.012.
Wei TT, Hu ZD, Oin BD, Ma N, Tang QQ, Wang LL, Zhou L, Zhong RO. Diagnostic Accuracy of Procalcitonin in Bacterial Meningitis Versus Nonbacterial Meningitis: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016;95(11):e3079. doi: 10.1097/ MD.0000000000003079.
Balakrishnan B, Kulkarni UP, Pai AA, et al. Biomarkers for early complications post hematopoietic cell transplantation: Insights and challenges. Front Immunol. 2023;14:1100306. doi: 10.3389/fimmu.2023.1100306.
Kennis B, Ali A, Lasoff D, et al. The diagnostic utility of procalcitonin is limited in the setting of methamphetamine toxicity. Am JEmergMed. 2022;54:36-40. doi: 10.1016/j.ajem.2022.01.049.
Oksuz L, Somer A, Salman N, et al. Procalcitonin and C-reactive protein in differantiating to contamination from bacteremia. Braz J Microbiol. 2015;45(4):1415-1421. doi: 10.1590/s1517-83822014000400036.
Berthezene C, Aissa N, Manteaux AE, et al. Accuracy of procalcitonin for diagnosing peripheral blood culture contamination among patients with positive blood culture for potential contaminants. Infection. 2021;49(6):1249-1255.
Banerjee R, Humphries R. Rapid Antimicrobial Susceptibility Testing Methods for Blood Cultures and Their Clinical Impact. Front Med (Lausanne). 2021;8:635831. doi: 10.3389/fmed.2021.635831.
Nolan J, Meregawa PF. The role of serum procalcitonin in establishing diagnosis of bone and joint infections. J Clin Orthop. 2020;5(1):3-7.
Lima AL, Oliveira PR, Carvalho VC, et al. Recommendations for the treatment of osteomyelitis. Braz J Infect Dis. 2014;18(5):526-534. doi: 10.1016/j.bjid.2013.12.005.
He C, Wang B, Wang YF, Shen YC. Can procalcitonin be used to diagnose Gram-negative bloodstream infection? Evidence based on a meta-analysis. Eur Rev Med Pharmacol Sci. 2017;21(14):3253-3261.
Watanabe Y, Oikawa N, Hariu M, et al. Ability of procalcitonin to diagnose bacterial infection and bacteria types compared with blood culture findings. Int J Gen Med. 2016;9:325-331. doi: 10.2147/IJGM.S115277.
Hawkey PM. Multidrug-resistant Gram-negative bacteria: a product of globalization. JHosp Infect. 2015;89(4):241-247. doi: 10.1016/j. jhin.2015.01.008.
Julian-Jimenez A, Rubio-Diaz R, Gonzalez Del Castillo J, et al. New predictive models of bacteremia in the emergency department: a step forward. RevEsp Ouimioter. 2022;35(4):344-356. (In Span.) doi: 10.37201/req/015.2022.
Oksuz L, Somer A, Salman N, et al. Procalcitonin and C-reactive protein in differantiating to contamination from bacteremia. Braz J Microbiol. 2015;45(4):1415-21. doi: 10.1590/s1517-83822014000400036.
Leng Y, Chen C, Zhang Y, et al. Ability of serum procalcitonin to distinguish focus of infection and pathogen types in patients with bloodstream infection. Ann TranslMed. 2019;7(7):135. doi: 10.21037/atm.2019.03.24.
Laukemann S, Kasper N, Kulkarni P, et al. Can We Reduce Negative Blood Cultures With Clinical Scores and Blood Markers? Results From an Observational Cohort Study. Medicine (Baltimore). 2015;94(49):e2264. doi: 10.1097/MD.0000000000002264.
Gregoriano C, Heilmann E, Molitor A, Schuetz P. Role of procalcitonin use in the management of sepsis. J Thorac Dis. 2020;12(Suppl 1):S5-S15. doi: 10.21037/jtd.2019.11.63.
El Haddad H, Chaftari AM, Hachem R, et al. Biomarkers of Sepsis and Bloodstream Infections: The Role of Procalcitonin and Proadrenomedullin With Emphasis in Patients With Cancer. Clin Infect Dis. 2018;67(6):971-977. doi: 10.1093/cid/ciy331.
Информация об авторах:
Ирина Владимировна Шипицына — кандидат биологических наук, ведущий научный сотрудник
Елена Владимировна Осипова — кандидат биологических наук, старший научный сотрудник,
Александр Леонидович Шастов — кандидат медицинских наук, старший научный сотрудник
Теги: хронический остеомиелит
234567 Начало активности (дата): 22.07.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: хронический остеомиелит, прокальцитонин, микрофлора, резистентность
12354567899
Похожие статьи
Клинико-статистический анализ состояния культей как элемент выявления противопоказаний к протезированиюРентген на дому 8 495 22 555 6 8
Серия клинических наблюдений лечения пациентов с гипотрофическими псевдоартрозами и дефектами диафиза ключицы с применением свободной аутопластики трансплантатом малоберцовой кости, минификсатора Илизарова и интрамедуллярного армирования
Лечение ложных суставов трубчатых костей внеочагового остеосинтеза новым стержневым аппаратом
Высвобождение антибиотиков из материалов для замещения постостеомиелитических дефектов кости



