 01.12.2024
01.12.2024
Комплексное периоперационное обеспечение тотального эндопротезирования коленного сустава на основе сочетания регионарной анестезии и применение высоких и ультравысоких доз транексамовой кислоты
эффективности и безопасности превосходят группу контроля. Применение транексамовой кислоты обладает доказанным дозозависимым эффектом, при этом наибольшую эффективность показали ультравысокие дозировки.
Введение
Тотальное эндопротезирование коленного сустава (ТЭКС) в настоящее время является наиболее эффективным и действенным способом лечения гонартроза при отсутствии эффекта от консервативного лечения [1]. Выбор метода обезболивания при ТЭКС остается дискутабельным вопросом, однако, бесспорно, без регионарной анестезии (РА) невозможно ускоренное восстановление в травматологии и ортопедии [2]. В арсенале современного врача- анестезиолога, владеющего ультразвуковыми методиками, присутствуют наиболее перспективные методики РА, такие как блокада приводящего канала (БПК, Adductor canal block), инфильтрация местного анестетика между подколенной артерией и мыщелком бедренной кости (айПАК-блок, iPACK-block), а также местная инфильтрационная анестезия (МИА, Local infiltration analgesia) [3]. Все эти методики успели себя успешно зарекомендовать [3; 4], но консенсус относительно целесообразности использования данных методик не достигнут.
Кроме нивелирования выраженного болевого синдрома, операционную бригаду волнует объем кровопотери и способы ее уменьшения. Многие исследования показывают, что транексамовая кислота (ТК) может эффективно снижать кровопотерю и частоту переливания крови, при этом ее можно вводить перорально, внутривенно и местно [5; 6].
Интраартикулярное (внутрисуставное) введение может быть сопряжено с повышением давления в коленном суставе, увеличивать отек, а также значительно усиливать болевой синдром и замедлять реабилитацию [7]. Одним из новых способов локального введения транексамовой кислоты, лишенных недостатков интраартикулярного введения, является периартикулярное введение по технологии МИА [8]. Наряду с существованием МИА раствором местного анестетика возникают вопросы: можно ли комбинировать анестезию с локальным введением транексамовой кислоты, оказывает ли транексамовая кислота эффект на болевой синдром и каким образом оптимизировать столь сложный процесс анестезиологического обеспечения при ТЭКС? Противоречивые результаты показывают исследования, занимающиеся и определением оптимальной дозировки ТК [6]. Таким образом, проблемы обезболивания и уменьшения кровопотери при операциях эндопротезирования коленного сустава были и остаются актуальными до настоящего времени, требующими комплексного изучения и оптимизации анестезиологического обеспечения.
Цель исследования - оптимизация периоперационного обеспечения тотального эндопротезирования коленного сустава на основе сочетания регионарной анестезии и применения высоких и ультравысоких доз транексамовой кислоты для достижения условий ранней реабилитации.
Материалы и методы исследования
На проведение проспективного одноцентрового двойного слепого рандомизированного исследования было получено разрешение Локального этического комитета ФГБОУ ВО «ПИМУ» Минздрава России. Для проведения исследования были отобраны 120 пациентов, соответствующих следующим критериям включения: возраст от 18 лет, операция первичного эндопротезирования коленного сустава, подписанное добровольное информированное согласие. Критериями исключения являлись: отказ от участия в исследовании, оценка состояния по шкале ASA>IV, противопоказания к проведению регионарной анестезии, врожденные и приобретенные коагулопатии, венозные тромбозы или тромбоэмболии легочной артерии в анамнезе, прием аспирина или нестероидных противовоспалительных препаратов в течение 3 дней перед операцией, Hb<110 г/л, наличие противопоказаний к применению транексамовой кислоты и/или местных анестетиков, нарушение протокола исследования.
Все пациенты были рандомизированы третьим лицом методом конвертов на 4 группы в соотношении 1:1:1:1 (рис. 1). Пациентам группы 1 выполняли инфильтрацию раствора местного анестетика между подколенной артерией и мыщелком бедренной кости (айПАК- блок) и вводили внутривенно транексамовую кислоту. В группах 2A и 2B выполняли периартикулярную инфильтрацию растворами ропивакаина (местная инфильтрационная анестезия, МИА) и транексамовой кислоты, причем в группе 2B дополнительно вводили раствор транексамовой кислоты внутривенно. Группа 3 была контрольной - и внутривенно, и местно (айПАК-блок) вводили физиологический раствор хлорида натрия. Таким образом, по способу проведения регионарной анестезии все пациенты были разделены на 3 группы: айПАК-блок (1), МИА (2) и контрольная группа (3); а по способу введения транексамовой кислоты на 4 группы: внутривенное (1), местное (2A), внутривенное+местное (2B) и контрольная группа (3).
Всем пациентам в операционной после катетеризации периферической вены и обеспечения стандартного интраоперационного мониторинга с целью седации внутривенно вводили 5-10 мг мидазолама (ФГУП «Московский эндокринный завод», Россия), а затем приступали к выполнению блокады приводящего канала 10 мл 0,5% раствора ропивакаина (Fresenius Kabi, Норвегия) по стандартной методике. Пациентам группы 1 дополнительно делали айПАК-блок 20 мл 0,5% ропивакаина (Fresenius Kabi, Норвегия), в группе 3 (контроль) физиологическим раствором, по методике, разработанной авторами [9]. Спинномозговую анестезию во всех группах выполняли на уровне Liii-Liv иглой B. Braun Spinocan 25G-88
(B. Braun, Германия), вводили 0,5% раствор изобарического бупивакаина (AstraZeneca, Великобритания) для достижения уровня блокады Thx-xii. В группах 1 и 2B перед началом операции внутривенно капельно вводили 20 мг/кг транексамовой кислоты («Сотекс», Россия) в разведении 250 мл 0,9% раствора натрия хлорида (B. Braun Melsungen, Германия), в группах 2A и 3 (контроль) - только физиологический раствор. Операции эндопротезирования выполнялись одной бригадой хирургов без использования пневматического жгута, с установкой дренажа на одни сутки. В группе 2 после подготовки костной площадки и перед установкой компонентов протеза хирург выполнял периартикулярную МИА по общепринятой методике коктейлем из 30 мл 0,5% раствора ропивакаина (Fresenius Kabi, Норвегия) и 20 мг/кг транексамовой кислоты («Сотекс», Россия).
В качестве послеоперационного обезболивания использовали стандарты мультимодальной аналгезии: 200 мг/сут. кетопрофена (Sandoz, Словения), 3000 мг/сут. парацетамола («Ист- Фарм», Россия) с дополнительным назначением наркотических анальгетиков по требованию: трамадола (ФГУП «Московский эндокринный завод», Россия) при наличии умеренной боли и тримеперидина (ФГУП «Московский эндокринный завод», Россия) при сильной. Также все пациенты получали стандартную профилактику венозных тромбоэмболических осложнений в виде подкожных инъекций эноксапарина натрия («Санофи-Авентис Франс», Франция) через 12 часов после окончания операции и ношения чулок дозированной компрессии в течение всего периода пребывания в медучреждении. Выписка пациентов производилась на пятый день.
В предоперационный день (Пре-ОД) оценивали исходный болевой синдром по визуальной аналоговой шкале (ВАШ), исходные лабораторные показатели общего анализа крови и коагулограммы. Интраоперационно оценивали кровопотерю. В день операции (ПОД 0) и 1 -й послеоперационный день (ПОД 1) оценивали объем дренажной кровопотери.
Болевой синдром оценивался по ВАШ через 6, 12, 24 и 48 часов после операции. Фиксировалось время требования первого наркотического анальгетика (НА) и его дозировка.
Показатели красной крови (гемоглобин, эритроциты, тромбоциты) контролировали на ПОД 1, ПОД 3 и ПОД 5; показатели коагулограммы (АЧТВ, ПТВ, ТВ, МНО, антитромбин III, РФМК, фибриноген, плазминоген, D-димер, XIIa-зависимый фибринолиз, фактор Виллебранда) - на ПОД 1 и ПОД 5. Для контроля признаков развития венозных тромбоэмболических осложнений на ПОД 7 амбулаторно выполняли УЗИ вен нижних конечностей. Кроме того, проводили оценку необходимости в трансфузионной терапии, наличие тошноты и рвоты по шкале ПОТР, наличие нежелательных явлений и осложнений.
Статистическую обработку данных проводили с помощью пакетов программ Microsoft Excel 2016 (Microsoft Corp., США), IBM SPSS Statistics (IBM, США). Качественные данные представлены в виде p±op (где p - процентная доля, op - стандартное отклонение процентной доли). Для анализа различий качественных данных использовали критерий х2 Пирсона с поправкой на правдоподобие и точный критерий Фишера. Количественные данные проверяли на принадлежность к нормальному распределению с помощью критерия Шапиро - Уилка. Нормально распределенные данные представлены в виде M±SD (где M - среднее значение, SD - стандартное отклонение). Оценку различий между группами нормально распределенных данных выполняли при помощи однофакторного дисперсионного анализа (ANOVA) с последующим проведением апостериорных тестов.
Количественные ненормально распределенные данные представлены в виде Ме[МКИ] (где Me - медиана, МКИ - межквартильный интервал). Для сравнения групп в данном случае использовали критерий Краскела - Уоллиса и критерия Манна - Уитни. Различия считали статистически значимыми при р<0,05 при пересчете на количество сравнений в подгруппах. Корреляцию измеряли с помощью критерия Спирмена и считали значимой при p<0,01.
Результаты исследования и их обсуждение
В исследование были включены 120 пациентов от 50 до 76 лет (средний возраст 63,09±5,69 года). В связи с нарушением протокола исследования из группы 1 и группы 2B были исключены 1 и 2 человека соответственно (у одного пациента некорректно проведен контроль послеоперационных лабораторных показателей, у двух пациентов установленный в конце операции дренаж оказался несостоятельным). Таким образом, до конца исследования наблюдались 117 пациентов, сопоставимых по клинико-демографическим характеристикам (табл. 1). Среди групп не было различий в выраженности предоперационного болевого синдрома, длительности операции, длительности анестезии, кровопотери. Показатели общего анализа крови и коагулограммы также были сопоставимы по всем показателям. Оценка боли по ВАШ показала статистически значимые различия в пользу айПАК и МИА как в покое, так и при движениях на всех временных промежутках наблюдения по сравнению с контрольной группой, при этом различий между группами айПАК и МИА не наблюдалось (рис. 2). Интересно отметить, что в группе 2B (МИА+ в/в ТК) с дополнительным введением транексамовой кислоты боль в покое через 6 и 12 часов была ниже, чем в группе 2 A без дополнительного введения в/в ТК (рбч=0,0001 и рпч=0,0011 соответственно). Кроме того, отмечено наличие прорывной боли у 26,67±8,07% (n=8) пациентов группы контроля. Напротив, минимальный болевой синдром без требования наркотических анальгетиков наблюдался у 48,28±9,28% (n=14) и 46,55±6,55% (n=27) пациентов групп 1 (айПАК) и 2 (МИА) соответственно.
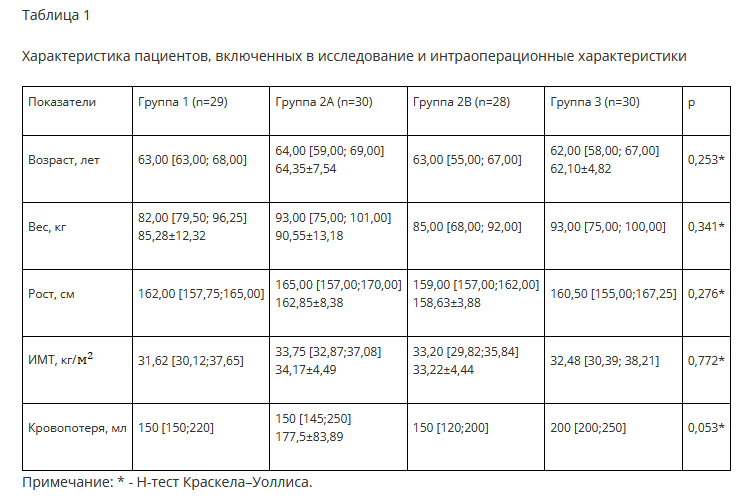
Анализ дренажной кровопотери показал статистически значимое снижение ее на ПОД 0 в группе 2B (с комбинированным внутривенным и местным введением транексамовой кислоты) по сравнению с группой 3 (контроль) (р=0,0000), а также на ПОД 1 - в группах 1 и 2B по сравнению с группой 3 (контроль) (pi;3=0,0000 и р2в,3=0,0000 соответственно) (рис. 3). Между объемом введенной транексамовой кислоты и объемом дренажной кровопотери обнаружена средняя обратная корреляционная связь (rs= -0,414, p=0,000).
Уровень гемоглобина на ПОД 1 и ПОД 5 статистически значимо выше в группе 2B сочетанного введения транексама по сравнению с контрольной группой 3 (рпод1:2в,3=0,047 и Рпод5:2в,3=0,0081 соответственно), на ПОД 3 - по сравнению с группой 1 внутривенного введения (рподз:1,2в=0,004). Темп снижения показателей гемоглобина к первым суткам значимо меньше в группе 2B по сравнению с группами 1 и 3 (pi,2B=0,0003 ир2в,3=0,0002) и составляет 11,70±4,66%, 18,01±3,97% и 18,80±5,58% соответственно. К ПОД 5 темп в группе 2B (18,60±7,74%) также ниже, чем в группе 1 внутривенного введения (27,07±5,15%, pi,2B=0,0061). На пятые сутки снижение уровня гемоглобина по сравнению с исходным было также ниже в группе 2B сочетанного введения (24,09±4,11%) по сравнению с группами 1 и 3 (31,29±5,30% и 30,65±6,86%, pi,2B=0,003 и р2в,з=0,014) (рис. 4). Кроме того, обнаружена прямая корреляционная связь средней силы между объемом введенной транексамовой кислоты и показателями гемоглобина (rs= 0,376, p=0,0008), а также обратная средней силы между темпом снижения показателей гемоглобина и объемом введенной кислоты (rs= -0,486, p=0,000).
При анализе количества эритроцитов обнаружена статистически значимая разница в группах на ПОД 5: в подгруппе 2B количество эритроцитов было больше, чем во всех остальных группах (pi,2B=0,0000, р2А,2в=0,0010 и р2в,з=0,0000) и составило 3,43 [3,28;3,70], 3,06 [2,89;3,11], 3,00 [2,78;3,36] и 3,17 [2,99;3,24]*1012/л соответственно. Разницы в количестве тромбоцитов между подгруппами во все дни наблюдения не обнаружено.
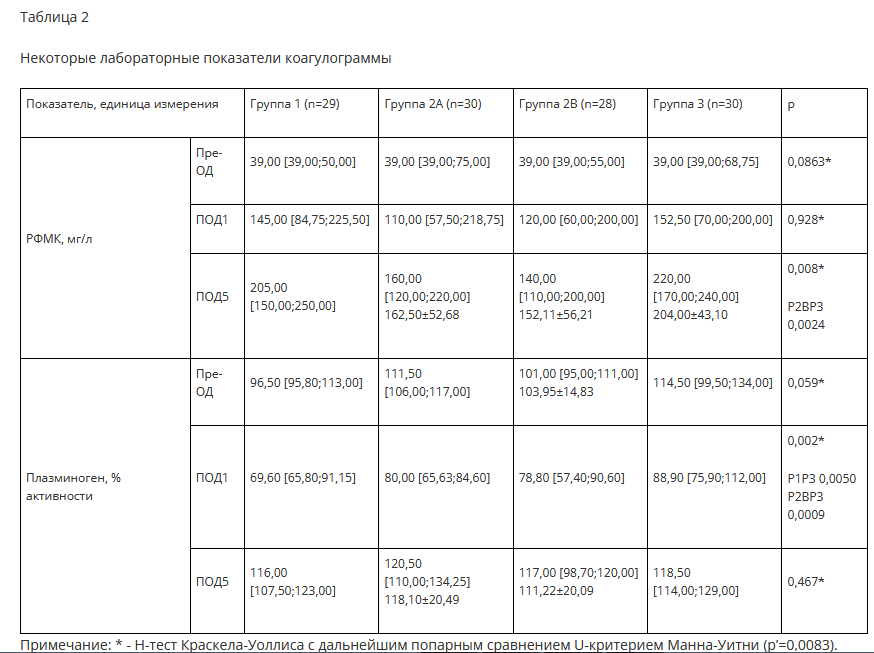
Не были обнаружены статистически значимые межгрупповые различия на всех этапах при оценке следующих лабораторных показателей коагулограммы: АЧТВ, ПТВ, ТВ, МНО, антитромбин III, фибриноген, D-димер, XIIa-зависимый фибринолиз, фактор Виллебранда. На ПОД 3 уровень плазминогена достоверно больше снижается в группе 2B по сравнению с группами 1 и 3 (на 38,45±21,84%, 24,12±11,93% и 17,34±17,43% соответственно, pi,2B=0,0032, р2в,з=0,0041). Также установлена обратная корреляционная связь средней силы между объемом введенной транексамовой кислоты и уровнем плазминогена крови (rs=-0,421, p=0,0001). К пятым суткам исследования уровень плазминогена возвращался к прежним значениям и статистически не отличался между группами. В то же время наблюдалась статистически значимая разница в повышении растворимых фибрин-мономерных комплексов (РФМК) на ПОД 5 в группе 2B (сочетанного введения транексама) по сравнению с группой 3 (контроль) (табл. 2).
При проведении УЗИ вен нижних конечностей на ПОД 7 у всех пациентов была сохранена проходимость венозного русла, не было обнаружено венозных тромбоэмболических осложнений. Аллогенная гемотрансфузия и реинфузия крови не потребовалась никому из пациентов в группах исследования. Среди других нежелательных явлений (НЯ) оценка послеоперационной тошноты и рвоты не показала статистически значимых различий между группами и подгруппами. Других НЯ, в том числе связанных с проведением регионарной анестезии и токсичностью местных анестетиков, зарегистрировано не было.
Данное исследование показало аналогичную эффективность блокад айПАК и МИА в отношении уменьшения послеоперационного болевого синдрома, однако при дополнительном введении транексамовой кислоты внутривенно боль в покое группе 2B (МИА+в/вТК) была еще ниже через 6 и 12 часов, чем в группе 2 A (МИА). Возможно, это объясняется системным противовоспалительным действием транексамовой кислоты за счет уменьшения образования плазмина, который сам по себе является «неразборчивым» ферментом [10]. Схожие результаты получили авторы иного исследования, где в группе внутривенного введения транексама в ультравысоких дозах болевой синдром при движениях был выражен меньше на ПОД 1, 2 и 3 по сравнению с группой низких доз (ВАШ 5,10±0,47, 4,48±0,33 и 3,88±0,43 против 5,71±0,73, 4,80 ± 0,59 и 4,12±0.44; p=0,002, p<0,001, p<0,001 соответственно) [11].
Что касается непосредственно сравнения групп 1 (айПАК) и 2 (МИА), в известных рандомизированных клинических исследованиях (РКИ) показаны достаточно противоречивые результаты. Так, авторы работы получили преимущества при использовании МИА по сравнению с айПАК как в отношении боли (все p<0,05), так и потребности в опиоидах (28,9 мг морфина против 47,8 мг соответственно, p<0,05) [12]. В то же время другие авторы в своем исследовании получили противоположные результаты - боль через 4 часа в группе айПАК была значительно меньше, чем в группе МИА (3,32 против 4,75, p=0,0046), в последующие периоды оценки болевого синдрома разницы между группами не было отмечено [13]. Таким образом, до сих пор отсутствует единое мнение исследователей в отношении регионарных методов обезболивания на коленном суставе, таких как МИА и айПАК-блок, и поиск идеальной блокады и микстуры продолжается.
В данном исследовании авторы получили уменьшение активности плазминогена, причем выявлена средняя обратная зависимость между объемом введенной ТК и снижением процента активного плазминогена. Это можно объяснить её непосредственным прямым действием. Известно, что ТК обладает антифибринолитическим действием путем связывания с плазминогеном, тем самым уменьшает распад сформированного фибрина. Растворимые фибрин-мономерные комплексы, являясь продуктом распада фибрина, в группе с ультравысокими дозами ТК нарастали в разы меньше, чем в группе 3 (контроль), в результате процесса ингибирования фибринолиза.
Авторы данной работы не получили достоверных отличий между группами внутривенного и местного введения транексамовой кислоты, где общая дозировка составляла по 20 мг/кг. Исходя из этого, можно сделать вывод, что нет разницы в способе введения транексамовой кислоты. К такому же выводу пришли другие авторы в своем метаанализе: группы внутривенного и местного введения ТК не отличались по объему кровопотери, уровню гемоглобина и количеству перелитых компонентов крови [14]. Однако группа комбинированного введения, где дозировка составила в общей сложности 40 мг/кг, показала в данном исследовании наилучшие результаты по уменьшению дренажной кровопотери и сохранению послеоперационного гемоглобина. Кроме того, авторами получена средняя обратная корреляционная связь между количеством введенной транексамовой кислоты и снижением уровня гемоглобина, а также активности плазминогена, что позволяет сделать вывод о дозозависимом эффекте ТК. В одном из метаанализов исследователей проводятся поиски оптимальной дозировки ТК [6]. Авторы пришли к выводу, что высокие дозы ТК (30 мг/кг) являются наиболее оптимальными при ТЭКС.
По результатам данного исследования, наименьшая дренажная кровопотеря и наименьшее снижение гемоглобина наблюдались в группе 2B - комбинированного введения транексамовой кислоты - внутривенно и периартикулярно. Схожие данные были получены авторами в работе, где в группе комбинированного введения ТК наблюдалась меньшая дренажная кровопотеря (стандартизированная разница средних, СРС -0,50; ДИ от -0,71 до - 0,29; p=0,009), а также наименьшее падение уровня гемоглобина (СРС -0,47; ДИ от -0,60 до - 0,33; p<0,001) [15], что также подтверждает и дозозависимый эффект.
Отсутствие межгрупповых различий выбранных авторами показателей на каждом этапе контроля говорит о том, что транексамовая кислота оказывает гемостатическое действие, но мало влияет на системный гемостаз. Данный факт в сочетании с отсутствием каких-либо тромбоэмболических осложнений в послеоперационном периоде позволяет сделать вывод о безопасности внутривенного и местного инфильтративного введения транексамовой кислоты.
Выводы
Обе методики регионарной анестезии (айПАК-блок и МИА) в комбинации с БПК по клинической эффективности и безопасности сравнимы между собой, но при этом значительно превосходят группу контроля (использование самостоятельной БПК).
Применение ТК обладает доказанным дозозависимым эффектом, при этом наибольшую эффективность и безопасность показали ультравысокие дозировки, однако убедительных данных о влиянии способа ее введения на фармакологическую эффективность нет.
Необходимы дальнейшие исследования для определения более оптимальных путей введения ТК и возможного безопасного повышения дозы.
Список литературы
Hsu H., Siwiec R.M. Knee Arthroplasty. // Treasure Island (FL): StatPearls Publishing; 2023.
Крылов С.В., Пасечник И.Н. Программа ускоренного восстановления в ортопедии суставов нижних конечностей // Медицинский вестник МВД. 2023. № 5(126). С.23-27. DOI: 10.52341/20738080_2023_126_5_23.
O'Donnell R., Dolan J. Anaesthesia and analgesia for knee joint arthroplasty. // BJA Educ. 2018. Vol.18. Is.1. P.8-15. DOI: 10.1016/j.bjae.2017.11.003.
Restrepo-Holguin M., Kopp S.L., Johnson R.L. Motor-sparing peripheral nerve blocks for hip and knee surgery // Curr Opin Anaesthesiol. 2023. Vol.36. Is.5. P.541-546. DOI: 10.1097/ACO.0000000000001287.
Lu Q., Peng H., Zhou G.J., Yin D. Perioperative Blood Management Strategies for Total Knee Arthroplasty. // Orthop Surg. 2018. Vol.10. Is.1. P.8-16. DOI: 10.1111/os.12361.
Zheng C., Ma J., Xu J., Li M., Wu L., Wu Y., Liu Y., Shen B. The Optimal Dose, Efficacy and Safety of Tranexamic Acid and Epsilon-Aminocaproic Acid to Reduce Bleeding in TKA: A Systematic Review and Bayesian Network Meta-analysis. // Orthop Surg. 2023. Vol.15. Is.4. P.930946. DOI: 10.1111/os.13678.
Wei W., Dang S., Duan D., Wei L. Comparison of intravenous and topical tranexamic acid in total knee arthroplasty // BMC Musculoskelet Disord. 2018. Vol.19. Is.1. P.191. DOI: 10.1186/s12891-018-2122-7.
Fan D., Ma J., Liu X., Zhang L. Peri-articular administration of tranexamic acid is an alternative route in total knee arthroplasty: a systematic review and meta-analysis // J Orthop Surg Res. 2022. Vol.17. Is.1. P.211. DOI: 10.1186/s13018-022-03095-4.
Андрианова Т.О., Ежевская А.А., Герасимов С.А., Загреков В.И., Военнов О.В. Оптимальный метод послеоперационного обезболивания при эндопротезировании коленного сустава: двойное слепое рандомизированное исследование // Анестезиология и реаниматология. 2023. № 2. С.34-43. DOI: 10.17116/anaesthesiology202302134.
Levy J.H., Koster A., Quinones Q.J., Milling T.J., Key N.S. Antifibrinolytic Therapy and Perioperative Considerations // Anesthesiology. 2018. Vol.128. Is.3. P.657-670.
Tang X., Wang D., Mou P., Lei L., Ning N., Chen J., Zhou Z. Addition of Infiltration Between the Popliteal Artery and the Capsule of the Posterior Knee (IPACK) to Local Infiltration Analgesia for Total Knee Arthroplasty: A Prospective Randomized Controlled Trial. // J Arthroplasty. 2023. Vol.38. Is.8. P.1484-1492. DOI: 10.1016/j.arth.2023.01.010.
Narejo A.S., Abdulwahab F., Aqil M., Alsubaie A.T., Hazazy H.Y., Alzahrani T., Aljurayyan A., Thallaj A. Efficacy of interspace between the popliteal artery and the capsule of the posterior knee (iPACK) block versus periarticular local infiltration analgesia after unilateral total knee arthroplasty: Prospective randomized control trial // Saudi Med J. 2021. Vol.42. Is.10. P.10651071. DOI: 10.15537/smj.2021.42.10.20210504.
Sun Q., Li J., Chen J., Zheng C., Liu C., Jia Y. Comparison of intravenous, topical or combined routes of tranexamic acid administration in patients undergoing total knee and hip arthroplasty: a meta-analysis of randomised controlled trials // BMJ Open. 2019. Vol.9. Is.1. P.e024350. DOI: 10.1136/bmjopen-2018-024350.
Ling T., Zhang L., Huang L. The efficacy and safety of combined administration of intravenous and intra-articular tranexamic acid in total knee arthroplasty: An update meta-analysis // J Clin Pharm Ther. 2022. Vol.47. Is.9. P.1312-1321.
Авторы:
Ежевская А.А., Андрианова Т.О., Пшеницына Е.В., Куликова М.Н., Федоров М.Е. - ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России, Нижний
Теги: эндопротезирование коленного сустава
234567 Начало активности (дата): 01.12.2024
234567 Кем создан (ID): 989
234567 Ключевые слова: тотальное эндопротезирование коленного сустава, регионарная анестезия, местная инфильтрационная анестезия, айПАК-блок, блокада приводящего канала, транексамовая кислота
12354567899
Похожие статьи
Пациент-связанные факторы риска осложнений после первичных эндопротезирований тазобедренного сустава и ревизионных вмешательствРентген на дому 8 495 22 555 6 8
Клинико-функциональный и нейропсихологический статус пациентов, поступивших на эндопротезирование суставов
Оценка среднесрочных результатов релиза латерального ретинакулума надколенника при тотальном эндопротезировании коленного сустава
Замещение общирного дефекта костей, образующих коленный сустав, с использованием комбинации внешней и внутренней фиксации



