 08.11.2024
08.11.2024
Прогностическая значимость маркеров эндотелиальной дисфункции при тяжелой сочетанной закрытой травме живота
При политравме возникает дисбаланс между продуцируемыми эндотелием веществами, происходит нарушение реологических свойств крови, увеличивается содержание прокоагулянтов, повышается проницаемость сосудистой стенки, что способствует тромбообразованию и усилению гипоксии тканей, а в последующем развитию полиорганной недостаточности, и, конечно, сказывается на течении травматической болезни, развитии осложнений и летальности
ВВЕДЕНИЕ
Эндотелий — самый большой в организме эндокринный орган [1], диффузно рассеянный вместе с сосудами по всем тканям. Гистологически он состоит из одного слоя клеток на границе циркулирующей крови и сосудистой стенки [1] общим весом от 1,5 до 1,8 кг и площадью от 4000 до 7000 м2 [2, 3]. Эндотелий выполняет свои основные функции за счет биологически активных веществ, вырабатываемых эндотелио- цитами, которые в норме обеспечивают регуляцию параметров гемодинамики, тромборезистентность, участвуют в процессах гемостаза, в воспалении и ангиогенезе [4]. «Маэстро кровообращения», — так назвал эндотелий нобелевский лауреат британский фармаколог Дж. Вейн [2].
При нарушении функции или структуры эндотелия резко меняется спектр выделяемых им биологически активных веществ [1], возникает эндотелиальная дисфункция (ЭД) — нарушение баланса между продукцией вазодилатирующих, антитромбогенных, антипролиферирующих факторов с одной стороны и вазоконст- рикторных, протромботических, пролиферативных продуцентов эндотелия — с другой [1, 5], начинается повышенная секреция агрегантов, коагулянтов, вазоконстрикторов [1]. Эндотелиальная дисфункция лежит в основе формирования синдрома полиорганных нарушений при критических состояниях, в том числе и при травмах [3, 6, 7].
Увеличение активности симпатоадреналовой системы, пропорциональное тяжести травмы и травматического шока, приводит к активации и повреждению эндотелия. Данный процесс реализуется путем экзоцитоза катехоламинов (прежде всего норадреналина) и ферментативно активного тканевого активатора плазминогена из nervi vasorum, как в сосудистую стенку, так и непосредственно в микроциркуляторное русло [1, 3, 6, 7].
Выброс катехоламинов (в частности, сосудосуживающее действие норадреналина) вызывает повреждение эндотелия, отщепление гликокаликса и деэндотелизацию перфузируемых сосудов. Активированный/поврежденный эндотелий способствует тромбозу, вызывая окклюзию микроциркуляторного русла. Вместе с повышением проницаемости капилляров, периваску- лярным отеком и вазоконстрикцией эти сосудистые реакции провоцируют прогрессирующую гипоперфузию тканей, гиповолемию, гипоксическое повреждение органов и, замыкая порочный круг, усиление симпатоадреналовой активации. Повышение тонуса гипоталамо-гипофизарно-надпочечниковой системы также увеличивает уровень циркулирующих катехоламинов в плазме [2, 3, 6, 7].
Соответствующие эндотелиальные и гемостатические изменения зависят от тяжести травмы и травматического шока: от физиологического гемостаза до гиперкоагуляции при легкой травме, до гипокоагуляции при травме средней степени тяжести и, наконец, до гиперфибринолиза при тяжелой травме [3, 6, 7].
Биологически активные вещества, вырабатываемые эндотелием, служат диагностическими критериями различных заболеваний [6, 8]. Но четких биомаркеров ЭД, позволяющих выявить поражение эндотелия на ранних стадиях травматической болезни, пока нет. Нам представлялось целесообразным исследование уровня С-реактивного белка (СРБ), фактора фон Виллебранда (vWF; von Willebrand Factor), количества десквамированных (циркулирующих) эндотелиоцитов (ДЭ) в крови как маркеров ЭД при тяжелой сочетанной закрытой травме живота (ТСЗТЖ), определить ее роль в исходе сочетанной травмы и выявить диагностическую и прогностическую значимость вышеперечисленных маркеров.
Выбор данных маркеров продиктован высокой информативностью и возможностью их исследования практически в любом лечебном учреждении [5, 6, 9-12].
Целью исследования является определение значимости некоторых маркеров ЭД (СРБ, vWF, ДЭ в крови) при ТСЗТЖ для прогнозирования вероятности развития осложнений и неблагоприятного исхода.
МАТЕРИАЛ И МЕТОДЫ
Проведено обследование 31 пациента, поступившего в стационар с ТСЗТЖ. Соотношение мужчин и женщин составило 2,1:1. Средний возраст пострадавших был 36,2±2,06 года.
Механизм травмы: дорожно-транспортное происшествие — 71%, кататравма — 13%, бытовая — 9,6%, сдавление тяжелым предметом — 6,4%.
Всем пациентам выполняли исследование крови на СРБ, vWF, ДЭ. Забор крови осуществляли из центральной или периферической вены в противошоковой операционной в момент поступления пациента, у оперированных пациентов до хирургического вмешательства, далее на 3-и и 5-е сутки пребывания в стационаре в 8 часов утра натощак. Они составили основную группу. Выбор таких сроков проведения исследований объяснялся тем, что, согласно концепции травматической болезни, временной интервал до 6-х суток (период травматического шока, период относительной стабилизации жизненно важных функций, период максимальной вероятности развития осложнений) оказывается наиболее опасным по риску развития осложнений и смертельного исхода [7]. Согласно концепции Е.К. Гуманенко и соавт., (2008): «...В динамике развития травматическая болезнь характеризуется последовательной сменой ведущей роли тех или иных типовых патологических процессов, которые включают как адаптивные, так и патологические реакции.
Именно это и обусловливает ее периодизацию, а также возможный исход» [7].
Группу сравнения составили пациенты, оперированные по поводу больших вентральных грыж различной локализации в плановом порядке (n=5). Выбор таких пациентов был обусловленминимальной микробной контаминацией (I класс — чистая операция), что предполагает невыраженный воспалительный ответ на операционную травму и незначительную ЭД в послеоперационном периоде. Группы были сопоставимы по возрасту. Забор крови осуществлялся из периферической вены перед оперативным вмешательством в 8 часов утра натощак, на 3-и и 5-е сутки после него в такое же время.
Выраженность воспалительной реакции выявляли по уровню СРБ методом количественного твердофазного иммуноферментного анализа с использованием тест-системы фирмы «Вектор-Бест» («Вектор-Бест»; Новосибирск) [4, 6].
Содержание фактора Виллебранда (рассчитывали в процентах от стандартной пробы с помощью калибровочной кривой; за 100% содержания vWF принимали такое его количество, которое содержалось в разведении плазменного стандарта 1:100) оценивали с помощью непрямого твердофазного иммуноферментного анализа тест-системы "Technoclone" [4, 8].
С целью выявления некробиотических процессов в эндотелии сосудов определяли количество циркулирующих в крови ДЭ по методике J. Hladovec в модификации Н.Н. Петрищева с применением фазовоконтрастной микроскопии, учитывая соотношение между количеством клеток в сетке и объемом камеры Горяева, при подсчете количества эндотелиальных клеток результат умножали на 104/л [6, 8].
Статистическую обработку осуществляли с использованием пакета прикладных статистических программ Statistica v10.0 (StatSoft, США). Данные выражали в виде M±m, где М — среднее значение, m — стандартная ошибка среднего. Статистическую значимость различий определяли с помощью U-критерия Манна- Уитни (Mann-Whitney U-test). Критерием статистической значимости статистического различия средних величин считали величину p<0,05.
РЕЗУЛЬТАТЫ
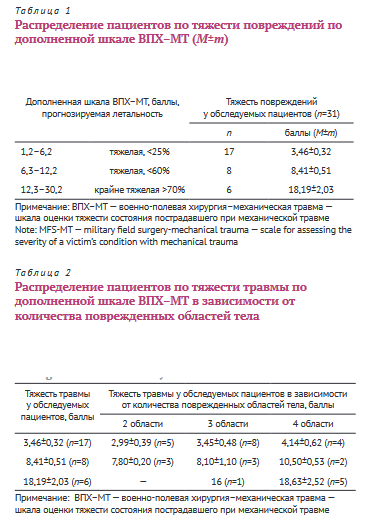
Тяжесть травмы у 54,8% пациентов (n=17) составила 3,46±0,32 балла по шкале ВПХ-МТ (ВПХ-МТ — военно-полевая хирургия-механическая травма — шкала оценки тяжести состояния пострадавшего при механической травме) с возможным смертельным исходом менее 25%; у 25,8% (n=8) в 8,41±0,51 балла с возможным смертельным исходом менее 60% и у 19,4% (n=6) в 18,19±2,03 балла с возможной летальностью более 70% (табл. 1).
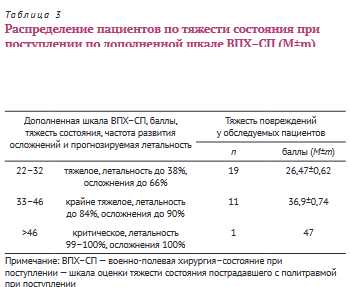
Все пострадавшие имели повреждения нескольких областей тела: 2 области — 8 пациентов, 3 области — 12 и 4 области — 11 (табл. 2).
При повреждении 2 областей тела травма живота в 4 случаях сочеталась с черепно-мозговой травмой (ЧМТ), в 2 случаях — с травмой опорно-двигательного аппарата и в 2 — с травмой грудной клетки.
При повреждении 3 областей тела травма живота сочеталась в 6 случаях с травмой опорно-двигательного аппарата и грудной клетки; в 4 случаях — с травмой опорно-двигательного аппарата и ЧМТ и в 2 случаях — с травмой грудной клетки и ЧМТ.
Повреждения 4 областей тела имели место у 11 пациентов, травма живота сочеталась с травмой опорно-двигательного аппарата, грудной клетки и ЧМТ.
Тяжесть состояния пациентов при поступлении оценивалась по дополненной шкале ВПХ-СП [7] (военно-полевая хирургия-состояние при поступлении — шкала оценки тяжести состояния пострадавшего при политравме, разработанная Е.К. Гуманенко и др., 1997) (табл. 3).
Состояние при поступлении у 61,3% пациентов (n=19) оценивалось как тяжелое и составляло 26,47±0,62 балла, крайне тяжелое — у 35,5% (n=11), что соответствовало 36,9±0,74 баллам и критическое у 3,2% (1 пациент) — 47 баллов.
Повреждения органов брюшной полости имели 27 пациентов (87,1%), из них оперированы 25. У 2 пациентов выявлены гематомы селезенки — проводилось консервативное лечение. У 4 пациентов повреждения органов брюшной полости при обследовании были исключены, диагностирован ушиб брюшной стенки.
Мы провели анализ динамики маркеров ЭД у пациентов, поступивших в стационар с ТСЗТЖ в зависимости от тяжести полученных повреждений (табл. 4); наличия повреждений органов брюшной полости или ушиба брюшной стенки и в зависимости от исхода травмы.
Проведен анализ динамики СРБ, vWF, ДЭ у пациентов с различной степенью тяжести повреждений.
С-реактивный белок обладает наибольшей нейтрализующей и опсонизирующей способностью по отношению к антигенам, активирует систему комплемента по классическому пути. Его концентрация в системной циркуляции при реализации генерализованной воспалительной реакции многократно увеличивается [7].
Кроме того, СРБ нейтрализует бактериальные токсины, ингибирует фосфолипазы, связывает хемокин IL-8 и нейтрализует его биологическую активность как хемоаттрактанта. Таким образом, СРБ может регулировать выраженность СВО, а также ограничивать неспецифическую регуляторную иммуносупрессию [7].
В нашем исследовании определена динамика изменения уровня провоспалительного фактора — СРБ в зависимости от тяжести полученных повреждений как неспецифического защитного механизма при ТСЗТЖ.
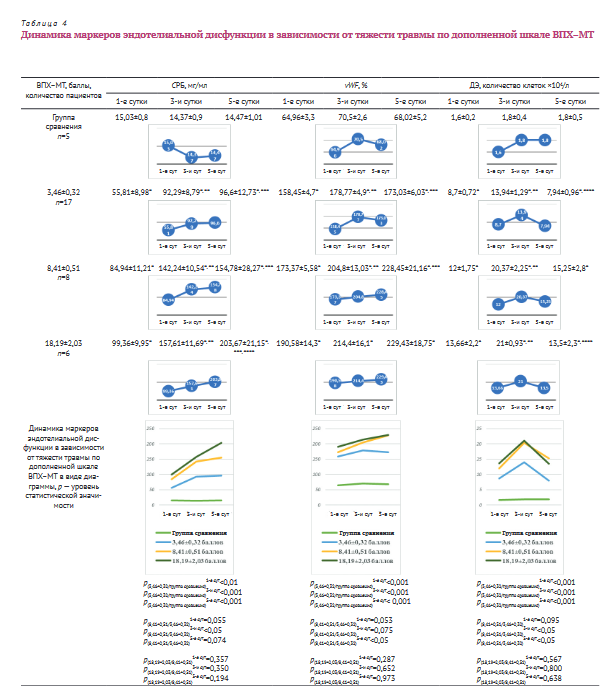
У пациентов с тяжестью повреждений 3,46±0,32 балла по шкале ВПХ-МТ было отмечено повышение уровня СРБ уже в 1-е сутки после травмы в 3,7 раза, к 3-м и 5-м суткам уровень СРБ продолжал расти, превысил значения у пациентов группы сравнения в 6,4 и 6,7 раза и составил 55,81±8,98 мг/мл; 92,29±8,79 мг/мл; 96,6±12,73 мг/мл (р<0,05 по сравнению с группой сравнения) соответственно. На 3-и сутки после травмы прирост СРБ составил 65,3%, на 5-е сутки — 73,1% по отношению к первым суткам (р<0,05). Прирост СРБ на 5-е сутки относительно 3-х был несущественным и статистически недостоверным — на 4,7% (p>0,05).
При тяжести повреждений 8,41±0,51 балла уровень СРБ в сравнении с показателями у пациентов группы сравнения был выше в 5,7; 9,9; 10,7 раза на 1-е, 3-и и 5-е сутки соответственно и составил 84,94±11,21 мг/ мл; 142,24±10,54 мг/мл; 154,78±28,27 мг/мл (р<0,05 по сравнению с группой сравнения). Прирост уровня СРБ к 3-м суткам относительно первых у этой категории пациентов равнялся 67,45%, к 5-м — 82,2% (р<0,05). На 5-е сутки наблюдения уровень СРБ по отношению к 3-м практически не изменился, был выше всего на 8,8% (p>0,05).
У пациентов с крайне тяжелой травмой в 18,19±2,03 балла уровень СРБ в сравнении с показателями у пациентов группы сравнения был в 6,6; 11; 14 раз выше на 1-е, 3-и и 5-е сутки соответственно и составил 99,36±9,95 мг/мл, 157,61±11,69 мг/мл, 203,67±21,15 мг/мл (р<0,05 по сравнению с группой сравнения). Прирост уровня СРБ к 3-м суткам относительно 1-х у этой категории пациентов равнялся 58,6%, к 5-м — 105% (р<0,05). На 5-е сутки уровень СРБ повысился относительно 3-х суток на 29,2% (p<0,05).
Эндотелий, вырабатывая биологически активные вещества, в норме участвует в процессах гемостаза, который осуществляется с вовлечением в процесс трех основных компонентов: клеток крови, плазменных ферментативных систем и самого эндотелия сосудистой стенки. Поврежденный эндотелий обладает способностью менять свой антитромбогенный потенциал на тромбогенный в сочетании с депрессией антитромбогенных механизмов [7].
Для тяжелой сочетанной травмы характерна одновременная активация свертывающей системы крови и снижение антитромбинового потенциала сосудистой стенки, что является основным патогенетическим механизмом нарушения физиологического равновесия между свертывающей и противосвертывающей системами крови с активацией первой, истощением и депрессией второй [7].
При повреждении сосудистой стенки в эндотелио- цитах активируются процессы синтеза и выброса в сосудистое русло субстанций, активирующих процессы гемокоагуляции. Фактор фон Виллебранда (vWF) — гликопротеид, играющий основную роль в процессе адгезии тромбоцитов к сосудистой стенке. При гибели эндотелиальных клеток обнажается субэндотелий, содержащий большое количество коллагена, в контакте с которым происходит адгезия и агрегация тромбоцитов, при этом vWF образует своеобразный мост между коллагеном и тромбоцитарными рецепторами в присутствии ионов Са2+. Системное повреждение сосудистого эндотелия, приобретение им тромбогенных свойств запускает коагуляционный каскад по внешнему и внутреннему пути. Следствием этих процессов является блокада микроциркуляторного русла клеточными агрегантами, нитями фибрина и микротромбами, что при условии системного повреждения сосудистого эндотелия и снижения его антитромбогенных свойств лежит в основе нарушения микроциркуляции и формирования синдрома полиорганной недостаточности [7].
У пациентов с тяжестью повреждений в 3,46±0,32 балла уровень vWF был повышен в 2,43; 2,52; 2,54 раза (p<0,05) на 1-е, 3-и и 5-е сутки соответственно в сравнении с показателем группы сравнения и составлял 158,45±4,7%, 178,77±4,9% и 173,03±6,03%. Прирост концентрации vWF к 3-м суткам относительно 1-х у этой категории пациентов равнялся 12,82%, к 5-м — 9,2% (p<0,05). На 5-е сутки наблюдения уровень vWF по отношению к 3-м суткам практически не изменялся.
При тяжести повреждений в 8,41±0,51 балла уровень vWF в сравнении с показателем пациентов группы сравнения был повышен в 2,67; 2,9; 3,36 раза (p<0,05) на 1-е, 3-и и 5-е сутки соответственно и составил 173,37±5,58%, 204,8±13,03% и 228,45±21,16%. Прирост концентрации vWF к 3-м суткам относительно 1-х у этой категории пациентов равнялся 18,12%, к 5м — 31,77% (p<0,05). На 5-е сутки наблюдения не было отмечено существенного увеличения уровня vWF по отношению к показателю, полученному на 3-и сутки.
При крайне тяжелой травме в 18,19±2,03 балла уровень vWF в сравнении с показателем пациентов группы сравнения был повышен в 2,93; 3,04; 3,37 раза (p<0,05) в 1-е, 3-и и 5-е сутки соответственно и составил 190,58±14,3%, 214,4±16,01% и 229,43±18,76%. Прирост концентрации vWF к 3-м суткам относительно 1-х у этой категории пациентов равнялся 12,49%, к 5-м — 20,38% (p>0,05). На 5-е сутки наблюдения уровень vWF по отношению к 3-м суткам практически не изменялся.
Повреждение сосудистого эндотелия при сочетанной травме носит неспецифический характер и проявляется в виде реактивных, дистрофических и некро- биотических изменений эндотелиоцитов. Изменения сопровождаются очаговой или тотальной деструкцией клеток, что значительно затрудняет микроциркуляцию и способствует агрегации форменных элементов крови [7].
При тяжести травмы в 3,46±0,32 балла количество ДЭ по отношению к показателю пациентов группы сравнения на 1-е, 3-и и 5-е сутки было повышено в 5,4; 7,7; 4,4 раза (р<0,05) соответственно. В 1-е сутки количество ДЭ было 8,7±0,72*104/л. Прирост к 3-м суткам составил 60,2% (р<0,05) (13,9±1,29*104/л), к 5-м суткам по отношению к 1-м их количество уменьшилось на 8,7% (p>0,05) (7,94±0,96*104/л). На 5-е сутки количество ДЭ снизилось на 43% (р<0,05) в сравнении с показателем, полученным на 3-и сутки.
У больных с тяжестью травмы, оцененной в 8,41±0,51 балла, количество ДЭ в сравнении со значениями пациентов группы сравнения на 1-е, 3-и и 5-е сутки было выше в 7,5; 11,3; 8,47 раза соответственно (р<0,05). В 1-е сутки количество ДЭ было повышено до 12±1,75*104/л. Прирост к 3-м суткам по отношению к первым составил 69,75%, что равнялось 20,37±2,25*104/ л (р<0,05), на 5-е сутки — 27,08% (p>0,05) (15,25±2,8*104/ л). На 5-е сутки количество ДЭ относительно 3-х снизилось на 25,2% (р>0,05), но оставалось выше показателей в 1-е сутки.
При крайне тяжелой травме в 18,19±2,03 балла количество ДЭ по отношению к показателям группы сравнения на 1-е, 3-и и 5-е сутки было выше в 8,5; 11,7; 7,5 раза (р<0,05). В 1-е сутки после травмы количество ДЭ у этой категории пациентов было 13,66±2,2*104/л, на 3-и увеличилось до 21±0,93*104/л, прирост составил 53,73% (р<0,05), к 5-м суткам показатель не отличался от значений, полученных в 1-е сутки (13,5±2,3*104/л), но был существенно выше таковых физиологической нормы. На 5-е сутки количество ДЭ в сравнении с 3-ми снизилось на 35,71% (р<0,05).
При сочетанной травме повреждения органов живота диагностированы у 27 пострадавших. У 19 имели место изолированные повреждения органов брюшной полости: разрывы печени, селезенки, бры
жейки и в 1 наблюдении — разрыв прямой кишки, из них у 7 пациентов было внутрибрюшное кровотечение: объемом 1000 мл — у 3 пациентов, 1500 мл — у 1, 2000 мл — у 3. Множественные повреждения паренхиматозных органов, брыжейки выявлены у 8 пациентов, из них у 1 был разрыв тонкой кишки, в одном случае разрыв диафрагмы и печени. Кровотечение объемом более 1000 мл было в 1 наблюдении.
У пациентов с сочетанной травмой и ушибом брюшной стенки повышение уровня СРБ в 1-е сутки после травмы относительно показателей группы сравнения не было статистически значимым и составило 40,1±15,11 мг/мл (p>0,05) (табл. 5). К 3-м и 5-м суткам уровень СРБ увеличился, превысил значения у пациентов группы сравнения в 5 и 6,4 раза и составил
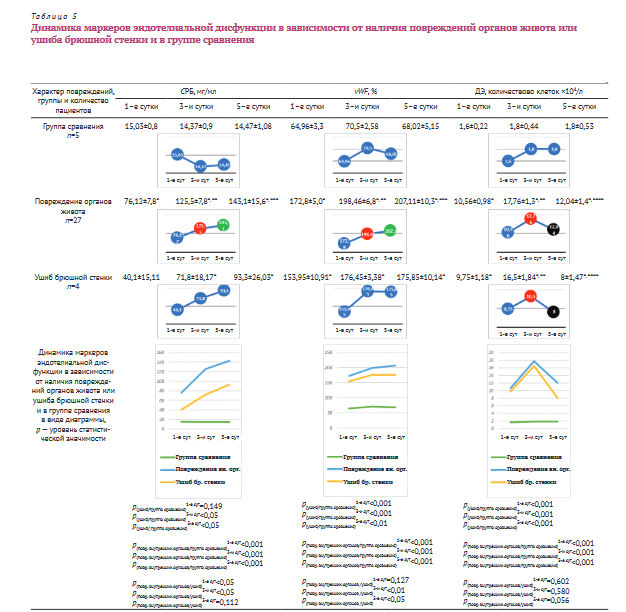
У пациентов с сочетанной травмой и ушибом брюшной стенки количество ДЭ по отношению к показателю группы сравнения на 1-е, 3-и и 5-е сутки было повышено в 6,0; 9,1; 4,4 раза (р<0,05) соответственно и составляло 9,75±1,18*104/л; 16,5±1,84*104/л; 8,0±1,47*104/л. Прирост к 3-м суткам составил 69,2% (р<0,05), к 5-м суткам по отношению к 1-м их количество уменьшилось на 18% (p>0,05). На 5-е сутки количество ДЭ снизилось на 51,5% (р<0,05) в сравнении с 3-и сутками.
У больных с сочетанной травмой и повреждением органов брюшной полости отмечено повышение уровня СРБ уже в 1-е сутки после травмы в 5 раз, к 3-м и 5-м суткам уровень СРБ продолжал расти и превысил значения у пациентов группы сравнения в 8,7 и 9,89 раза и составил 76,19±7,8 мг/мл; 125,5±7,8 мг/мл; 143,1±15,6 мг/мл (р<0,05). На 3-и сутки после травмы прирост СРБ составил 64,9%, на 5-е сутки — 88% по отношению к 1-м суткам (р<0,05). Прирост СРБ на 5-е сутки относительно 3-х был несущественным и статистически недостоверным — на 14% (p>0,05).
У пациентов с сочетанной травмой и повреждением органов брюшной полости уровень vWF был повышен в 2,66; 2,8; 3,04 раза (p<0,05) на 1-е, 3-и и 5-е сутки соответственно в сравнении с показателем группы сравнения и составлял 172,8±5,0%, 198,46±6,8% и 207,11±10,3%. Прирост концентрации vWF к 3-м суткам относительно первых у этой категории больных равнялся 14,85%, к 5-м — 19,85% (p<0,05). На 5-е сутки наблюдения уровень vWF по отношению к 3-м суткам практически не изменялся.
У больных с сочетанной травмой и повреждением органов брюшной полости количество ДЭ по отношению к показателю пациентов группы сравнения на 1-е, 3-и и 5-е сутки было повышено в 6,6; 9,9; 6,7 раза (р<0,05) соответственно. В 1-е сутки количество ДЭ равнялось 10,96±0,98*104/л. Прирост к 3-м суткам составил 68,2% (р<0,05) (17,76±1,3*104/л), к 5-м суткам по отношению к 1-м их количество практически не изменилось (p>0,05) и составило 12,04±1,4*104/л. На 5-е сутки количество ДЭ снизилось на 32,31% (р<0,05) в сравнении с показателем, полученным на 3-и сутки.
Неосложненное течение травматической болезни у пациентов с повреждением органов брюшной полости было у 14 человек. Трое имели множественные повреждения органов брюшной полости: печень+тонкая кишка; селезенка+брыжейка тонкой кишки; диафрагма+печень; девять — изолированные повреждения: печень — 4, селезенка — 4, брыжейка тонкой кишки — 1; ушиб брюшной стенки — 2, Объем внутрибрюшного кровотечения от 0,3 до 1,0 л. Реинфузия крови выполнена в 3 случаях.
У больных с сочетанной травмой живота без осложнений в течение травматической болезни уровень СРБ в сравнении с показателями пациентов группы сравнения был выше в 3,6; 6,6; 4,8 раза на 1-е, 3-и и 5-е сутки и составил 54,77±10,2 мг/мл, 94,33±8,92 мг/ мл, 69,78±11,29 мг/мл (p<0,05 по сравнению с группой сравнения) соответственно (табл. 6). Прирост СРБ к 3-м суткам относительно 1-х у этой категории пострадавших — 72% (p<0,05), на 5-е сутки наблюдения уровень СРБ по отношению к 1-м (на 27%) и 3-м (на 26%) изменялся статистически не значимо (p>0,05).
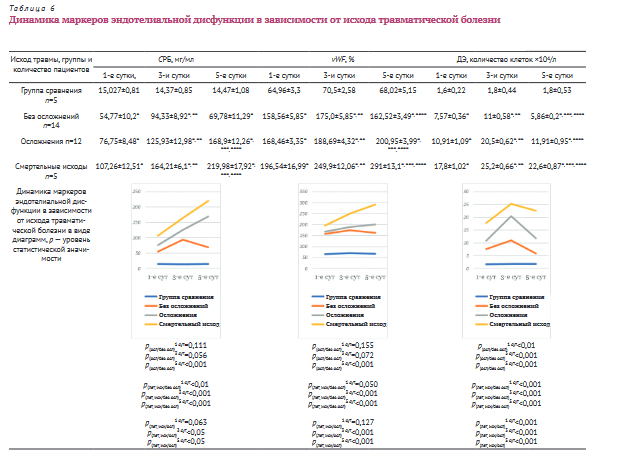
У пациентов с сочетанной травмой живота при отсутствии осложнений уровень vWF был повышен в 2,44; 2,48; 2,38 раза (p<0,05) на 1-е, 3-и и 5-е сутки соответственно в сравнении с показателями группы сравнения и составлял 158,56±5,85%, 175,0±5,85% и 162,52±3,49% соответственно. Прирост концентрации vWF к 3-м суткам относительно первых у этой категории больных равнялся 10,37% (p<0,05). На 5-е сутки наблюдения уровень vWF по отношению к 1-м практически не изменялся. К 5-м суткам относительно 3-х уровень vWF снижался на 7,14% (p<0,05).
У больных с сочетанной травмой живота при отсутствии осложнений количество ДЭ по отношению к показателю пациентов группы сравнения на 1-е, 3-и и 5-е сутки было повышено в 4,7; 6,1; 3,25 раза (р<0,05) соответственно. В
1-е сутки количество ДЭ равнялось 7,57±0,36*104/л. Прирост к 3-м суткам составил 45,3% (р<0,05) (11,0±0,58*104/л), к 5-м суткам по отношению к 1-м их количество уменьшилось на 22,6% (p<0,05) и составило 5,86±0,2*104/л. На 5-е сутки количество ДЭ снизилось на 46,73% (р<0,05) в сравнении с показателем, полученным на 3-и сутки.
У 12 пациентов наблюдалось осложненное течение травматической болезни. Они имели следующие инт- раабдоминальные повреждения: 2 — разрыв диафрагмы, 1 — разрыв селезенки, 3 — разрыв печени, 2 — ушиб брюшной стенки, 4 — множественные повреждения — печень+тонкая кишка; печень+селезенка; печень+бры- жейка; печень+поджелудочная железа. У 2 пациентов объем гемоперитонеума составил 1,5 и 2,0 л. На 5-6-е сутки у 9 человек развились легочные осложнения: гнойный эндобронхит — у 4, пневмония — у 4 и у 1 — респираторный дистресс-синдром; повреждения грудной клетки имели место в 7 случаях. У одного пациента развился реактивный гепатит на 5-е сутки после травмы; у одного — острая спаечная тонкокишечная непроходимость на 6-е сутки и у одного — абсцесс печени, выявленный к 10-м суткам послеоперационного периода с формированием в последующем желчного свища.
В группе пациентов с осложненным течением травматической болезни уровень СРБ в сравнении с показателями группы сравнения был выше в 5,1; 8,76; 11,67 раза на 1-е, 3-и и 5-е сутки соответственно и составил 76,75±8,48 мг/мл; 125,93±12,98 мг/мл; 168,9±12,26 мг/мл (р<0,05). Прирост уровня СРБ к 3-м суткам относительно 1-х у этой категории больных равнялся 64%, к 5-м — 120% (р<0,05). На 5-е сутки наблюдения также отмечен прирост уровня СРБ по отношению к 3-м на 34,1% (р<0,05).
У пациентов с осложненным течением травматической болезни уровень vWF был повышен в 2,59; 2,67; 2,95 раза (p<0,05) на 1-е, 3-и и 5-е сутки соответственно в сравнении с показателем группы сравнения и составлял 168,46±3,35%, 188,69±4,32% и 200,95±3,99%. Прирост концентрации vWF к 3-м суткам относительно 1-х у этой категории пациентов равнялся 12,0% (p<0,05), к 5-м относительно первых 19,28% (p<0,05) и к 5-м относительно 3-х 6,49% (p<0,05).
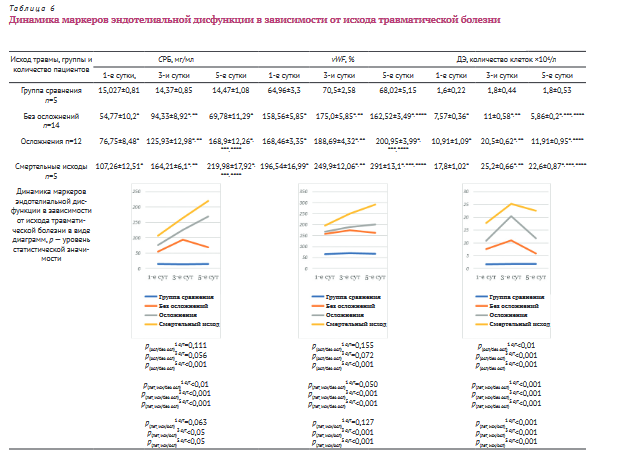
У пациентов с осложненным течением травматической болезни количество ДЭ по отношению к показателю группы сравнения на 1-е, 3-и и 5-е сутки было повышено в 6,8; 11,38; 6,6 раза (р<0,05) соответственно и составляло 10,91±1,09*104/л, 20,5±0,62*104/л, 11,91±0,95*104/л. Прирост к 3-м суткам составил 87,9% (р<0,05), к 5-м суткам по отношению к 1-м их количество практически не изменилось (p>0,05). На 5-е сутки количество ДЭ снизилось на 41,9% (р<0,05) в сравнении с показателем, полученным на 3-и сутки.
У 5 пациентов течение травматической болезни завершилось смертельным исходом. Они имели следующие интраабдоминальные повреждения: двое — разрыв брыжейки тонкой кишки, один — разрыв прямой кишки+гематомы подкожные объемом 2 л, один — разрыв селезенки+гемоперитонеум объемом 2 л, один — разрыв печени+гемоперитонеум объемом 1,5 л. Двое пациентов имели повреждения трех областей тела, трое — четырех областей.
Смерть наступила на 7-, 12-, 15-, 24-, 90-е сутки. Причина смерти — полиорганная недостаточность (ПОН).
В группе пациентов со сметельными исходами были отмечены самые высокие показатели СРБ, vWF, ДЭ в день поступления: уровень СРБ в сравнении с показателями группы сравнения был выше в 7,14; 11,43; 15,2 раза на 1-е, 3-и и 5-е сутки соответственно и составил 107,26±12,51 мг/мл; 164,21±6,1 мг/мл;
219,98±17,92 мг/мл (р<0,05). Прирост уровня СРБ к 3-м суткам относительно 1-х у этой категории пациентов — 53,09%, к 5-м — 105% (р<0,05), к 5-м суткам относительно 3-х — 33,9% (р<0,05).
У пациентов со смертельным исходом концентрация vWF была повышена в 3,02; 3,54; 4,28 раза (p<0,05) на 1-е, 3-и и 5-е сутки соответственно в сравнении с показателем группы сравнения (196,54±16,99%, 249,9±12,06% и 291,0±13,1%). Прирост концентрации vWF к 3-м суткам относительно 1-х у этой категории пациентов — 27,14% (p<0,05), к 5-м относительно 1- х — 48,0% (p<0,05), к 5-м относительно 3-х — 16,4% (p<0,05).
У пациентов со смертельным исходом количество ДЭ по отношению к показателю пациентов группы сравнения на 1-е, 3-и и 5-е сутки было повышено в 11,1; 14,0; 12,55 раза (р<0,05) соответственно. В 1- е сутки количество ДЭ было 17,8±1,02*104/л. Прирост к 3-м суткам составил 41,57% (р<0,05) (25,2±0,66*104/л); к 5-м суткам по отношению к 1-м прирост 26,96% (р<0,05), число ДЭ — 22,6±0,87*104/л. К 5-м суткам относительно 3-х количество ДЭ уменьшилось на 10,32% (р<0,05).
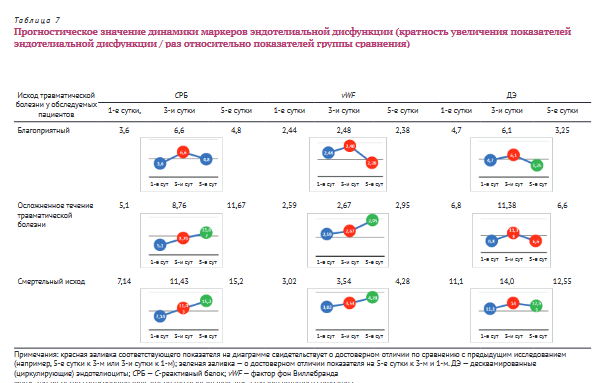
Таким образом, при благоприятном течении травматической болезни уровень СРБ в первые сутки после травмы повышается в 3,6 раза относительно показателей группы сравнения (табл. 7), достигая максимальных цифр к 3-м суткам (p<0,05), к 5-м суткам его уровень снижается, не достигая статистической значимости по сравнению с предыдущими измерениями. Уровень vWF в первые сутки после травмы повышается в 2,44 раза относительно показателей группы сравнения, нарастает к 3-м суткам относительно показателей 1-х суток (p<0,05) и снижается к 5-м относительно показателей 3-х суток (p<0,05). Количество ДЭ в 1-е сутки после травмы увеличивается в 4,7 раза в сравнении с группой сравнения, нарастает к 3-м суткам (p<0,05) и снижается к 5-м (p<0,05).
При осложненном течении травматической болезни уровень СРБ в 1-е сутки после травмы повышается в 5,1 раза в сравнении с показателем группы сравнения и сохраняет тенденцию к увеличению — к 5-м суткам относительно 1-х уровень СРБ возрастает в 2,3 раза (p<0,05). Концентрация vWF в 1-е сутки после травмы повышается в 2,59 раза относительно показателей группы сравнения, к 5-м суткам относительно 1-х уровень vWF возрастает в 1,14 раза (p<0,05). Количество ДЭ на 1-е сутки после травмы увеличивается в 6,8 раза в сравнении с показателем группы сравнения, нарастает к 3-м суткам (p<0,05) и снижается к 5-м (p<0,05).
При сочетанной травме со смертельным исходом уровень СРБ в 1-е сутки возрастает в 7,14 раза относительно показателей группы сравнения и сохраняет тенденцию к повышению — к 5-м суткам относительно 1-х уровень СРБ увеличивается в 2,13 раза (p<0,05). Концентрация vWF в 1-е сутки после травмы возрастает в 3 раза относительно показателей группы сравнения и продолжает расти и к 5-м суткам превышает показатели 1-х суток в 1,41 раза (p<0,05). Количество ДЭ увеличивается в 1-е сутки в 11,1 раза, к 5-м — превышает показатели 1-х суток в 1,13 раза.
ОБСУЖДЕНИЕ
Ключевая роль эндотелия состоит в регуляции гомеостаза и гемостаза, тонуса сосудов, пролиферации их гладких мышц, участии в иммунных процессах и т.п. [1, 9]. Эндотелиальные факторы можно разделить на:
Вызывающие сокращение и расслабление мышечного слоя сосудистой стенки:
а) констрикторы — эндотелины, ангиотензин-I, II (АТ-I, II), тромбоксан А2 (ТхА2), простагландин Н2 (PgH2) и др. [4, 5, 9];
б) дилататоры — оксид азота (NO; nitric oxide), про- стациклин (простагландин Pgl2), эндотелиальный фактор деполяризации (эндотелиальный гиперполяризую- щий фактор (EDHF; Endothelium-Derived Hyperpolarizing Factor)), оксид углерода (СО), ангиотензин-I, адреноме- дулин и др. [1, 4, 5, 9].
Факторы прокоагуляционные и антикоагуляционные:
а) протромбогенные — тромбоцитарный фактор роста (PDGF; Platelet-derived growth factor), ингибитор тканевого активатора плазминогена, ТхА2, vWF, ангиотензин-ГУ, эндотелин-1, фибронектин, тромбоспондин, фактор активации тромбоцитов и др. [3, 5, 9];
б) антитромбогенные — NO, тканевой активатор плазминогена (tPA; Tissue plasminogen activator), Pgl2, тромбомодулин и др. [1, 5, 9].
Факторы, влияющие на рост сосудов и гладкомышечных клеток:
а) стимуляторы — эндотелин-1, АТ-II, супероксидные радикалы, эндотелиальный фактор роста и др. [5];
б) ингибиторы — Pgl2, натриуретический пептид С, гепариноподобные ингибиторы роста и др. NO стимулирует ангиогенез, но тормозит разрастание гладких мышц в сосудах [1, 3].
а) провоспалительные — фактор некроза опухоли а (ФНО-а), супероксидные радикалы, СРБ и др.;
б) противовоспалительные — NO и др. [1, 4, 7].
При различных тяжелых критических состояниях, в том числе при травмах, возникает дисфункция эндотелия, дисбаланс между продуцируемыми им веществами, нарушение реологических свойств крови, увеличивается содержание прокоагулянтов, повышается проницаемость сосудистой стенки, что способствует тромбообразованию и усилению гипоксии тканей, а в последующем и ПОН [1, 6, 9].
Согласно концепции Е.К. Гуманенко и соавт., 2008 [7]: «.. .в ранние сроки после тяжелой травмы формируется критическое для организма состояние, при котором факторы и механизмы естественной резистентности не могут обеспечить эффективную адаптацию организма к повреждающим эффектам травмы и СВО, а система адаптивного иммунитета еще не включилась в процессы немедленной компенсации. Из показателей иммунной природы, вероятно, наибольшую диагностическую ценность для прогнозирования риска развития ПОН на протяжении первого (острого) периода травматической болезни и периода относительной стабилизации жизненно важных функций имеют <...> динамика возрастания концентраций в периферической крови <...> белков-адаптогенов (С-реактивный белок)». СРБ — провоспалительный фактор, вырабатывается в печени и относится к белкам острой фазы воспаления, стимулирует защитные реакции, активирует иммунитет [7].
При неосложненном течении послеоперационного периода у нетравмированных пациентов происходит снижение концентрации СРБ с 1-х на 3-и сутки и затем стабилизация уровня.
В основной группе происходит увеличение средней концентрации СРБ с увеличением сроков от момента получения травмы, эти отличия достоверны по сравнению с группой сравнения во всех исследуемых временных промежутках (1-е, 3-и и 5-е сутки), нарастание концентрации статистически значимо при любой тяжести травмы между 1-ми и 3-ми и 1-ми и 5-ми сутками в соответствующих подгруппах, при крайне тяжелой травме отличия статистически значимы и между 3-ми и 5-ми сутками. Несмотря на рост средних концентраций СРБ при утяжелении травмы, следует констатировать отсутствие достоверных отличий между ними в большинстве исследований. То есть при ТСЗТЖ происходит увеличение концентрации СРБ с 1-х по 5-е сутки, но его концентрации статистически значимо не коррелируют с тяжестью травмы. По всей видимости, СРБ в зависимости от тяжести повреждений регулирует выраженность СВО на травму. Как фактор естественной резистентности, СРБ препятствует нарастанию гиперантигенемии, которая возникает в ответ на повреждение тканей организма и является фактором неспецифической защиты [7].
Уровень СРБ статистически значимо выше у травмированных пациентов в сравнении с нетравмированными.
И при повреждении органов живота, и при ушибе передней брюшной стенки с увеличением сроков от момента травмы происходит рост средних концентраций СРБ, эти отличия статистически значимы в сравнении с нетравмированными пациентами, но в случае травмы внутренних органов имеются статистически значимые отличия между 1-ми и 3-ми сутками и 1-ми и 5-ми сутками, что не наблюдается при ушибе передней брюшной стенки. У больных с ТСЗТЖ при средних значениях СРБ 76,12±7,8, 125,5±7,8 мг/мл на 1е и 3-и сутки соответственно при сложности в дифференциальной диагностике с ушибом брюшной стенки следует предполагать наличие повреждений органов живота.
И при осложненном течении травматической болезни, и при неблагоприятном (смертельном) исходе происходит статистически значимый по отношению к группе сравнения и во временном отношении в подгруппах рост показателей СРБ, в последнем случае различия статистически значимы также и с группой пациентов с неосложненным течением травматической болезни; при средних значениях СРБ 107,26±12,51, 164,21±6,1, 219,98±17,92 мг/мл на 1-е, 3-и и 5-е сутки соответственно следует предполагать крайне неблагоприятное течение травматической болезни и высокую вероятность развития смертельного исхода. При неосложненном течении травматической болезни у пациентов с ТСЗТЖ происходит рост показателей СРБ к 3-м суткам, а затем снижение к 5-м. Выявленное в нашем исследовании многократное увеличение уровня СРБ в крови, продуцируемого активированными эндотелио- цитами, свидетельствует о реализации генерализованной воспалительной реакции, что предопределяет возникновение органной дисфункции. Наши результаты согласуются с литературными данными [7].
По данным Е.К. Гуманенко и соавт., 2008 [7]: « При больших скоростях сдвига в потоке крови, которые наиболее характерны именно в микроциркуляторном русле, резко возрастает активность фактора Виллебранда ... Описанные процессы одновременно развиваются в различных микроциркуляторных регионах, представленных практически во всех органах, что предопределяет формирование и углубление полиорганной дисфункции». vWF — протромбогенный фактор, синтезируется в эндотелии и мегакариоцитах; стимулирует начало тромбообразования: способствует прикреплению рецепторов тромбоцитов к коллагену и фибронектину сосудов, усиливает их адгезию и агрегацию [1, 4, 9].
При неосложненном течении послеоперационного периода у нетравмированных пациентов происходит увеличение концентрации vWF с 1-х на 3-и сутки и затем стабилизация уровня.
В основной группе происходит увеличение средней концентрации vWF с увеличением сроков от момента получения травмы, за исключением подгруппы с прогнозируемой летальностью до 25%, где происходит незначительное снижение с 3-х на 5-е сутки, эти отличия достоверны по сравнению с группой сравнения во всех исследуемых временных промежутках (1-е, 3-и и 5-е сутки). Несмотря на рост средних концентраций vWF при утяжелении травмы следует констатировать отсутствие статистически значимых отличий между ними в большинстве исследований. При ТСЗТЖ с прогнозируемой летальностью более 25% происходит увеличение концентрации vWF с 1-х по 5-е сутки, но его концентрации достоверно не коррелируют с тяжестью травмы.
Уровень vWF статистически значимо выше у травмированных пациентов в сравнении с нетравмированными.
И при повреждении органов живота, и при ушибе передней брюшной стенки с увеличением сроков от момента травмы происходит рост средних концентраций vWF, эти отличия статистически значимы в сравнении с нетравмированными пациентами, но в случае травмы внутренних органов имеются статистически значимые отличия между 1-ми и 3-ми сутками и 1-ми и 5-ми сутками, что не наблюдается при ушибе. У больных с ТСЗТЖ при средних значениях vWF 198,46±6,8%, 207,11±10,3% на 3-и и 5-е сутки соответственно при сложности в дифференциальной диагностике с ушибом передней брюшной стенки следует предполагать наличие повреждений органов живота.
И при осложненном течении травматической болезни, и при неблагоприятном (смертельном) исходе происходит статистически значимый по отношению к группе сравнения и во временном отношении в подгруппах рост показателей vWF, при средних значениях vWF 249,9±12,06%, 291±13,1% на 3-и и 5-е сутки соответственно следует предполагать крайне неблагоприятное течение травматической болезни и высокую вероятность развития смертельного исхода. При неосложненном течении травматической болезни у пациентов с сочетанной закрытой травмой живота происходит рост показателей vWF к 3-м суткам, а затем снижение к 5-м, практически достигая уровня 1-х суток.
На основании исследования можно сделать вывод, что высокие по отношению к группе сравнения концентрации vWF с 1-х суток посттравматического периода, сохраняющиеся к 3-м и 5-м суткам, свидетельствуют о системном повреждении сосудистого эндотелия в ответ на крайне тяжелую травму.
К клеточным маркерам ЭД относят количество циркулирующих ДЭ, свидетельствующих о повреждении сосудистого эндотелия и нарушении проницаемости сосудистой стенки [6, 8].
При неосложненном течении послеоперационного периода у нетравмированных пациентов происходит повышение концентрации ДЭ с 1-х на 3-и сутки и затем стабилизация уровня.
В основной группе происходит увеличение средней концентрации ДЭ с 1-х на 3-и сутки от момента получения травмы, а затем снижение на 5-е сутки, эти отличия достоверны по сравнению с группой сравнения во всех исследуемых временных промежутках (1-е, 3-и и 5-е сутки). Несмотря на более высокие показатели концентраций ДЭ при утяжелении травмы, отличия оказались статистически значимы только при сравнении подгрупп с прогнозируемой летальностью до 25% и до 60% на 3-и и 5-е сутки. То есть при ТСЗТЖ происходит увеличение концентрации ДЭ с 1-х по 3-и сутки, затем снижение к 5-м, но их концентрации не всегда коррелируют с тяжестью травмы.
Уровень ДЭ статистически значимо выше у травмированных пациентов в сравнении с нетравмированными.
И при повреждении органов живота, и при ушибе передней брюшной стенки с 1-х на 3-и сутки от момента получения травмы происходит рост средних концентраций ДЭ, а затем снижение на 5-е сутки, эти отличия статистически значимы в сравнении с нетравмированными пациентами и в каждой подгруппе с течением времени, но статистически значимых отличий в уровне ДЭ при ушибе брюшной стенки и повреждении органов живота нами не обнаружено.
И при осложненном течении травматической болезни, и при неблагоприятном (смертельном) исходе происходит статистически значимый по отношению к группе сравнения и по подгруппам рост показателей ДЭ с 1-х по 3-и сутки, затем снижение к 5-м, при средних значениях ДЭ 10,91±1,09*104/л, 20,5±0,62*104/ л, 11,91±0,95*10Ул на 1-е, 3-и и 5-е сутки соответственно следует ожидать развитие осложнений, а при средних значениях ДЭ 17,8±1,02*104/л, 25,2±0,66*104/л, 22,6±0,87*104/л на 1-е, 3-и и 5-е сутки соответственно — предполагать крайне неблагоприятное течение травматической болезни и высокую вероятность развития смертельного исхода. Этот показатель наиболее достоверен в для диагностики риска развития осложнений и смертельного исхода во всех исследуемых временных промежутках. При неосложненном течении травматической болезни у пациентов с ТСЗТЖ отмечен рост показателей ДЭ к 3-м суткам, а затем снижение к 5-м, ниже уровня 1-х суток.
Можно сделать заключение, что усиление дес- квамации эндотелиальных клеток в крови свидетельствует о повреждении эндотелия в ответ на травму. Количество циркулирующих в крови эндотелиоцитов находится в прямой зависимости от тяжести травмы при сравнении подгрупп с прогнозируемой летальностью до 25% и до 60% на 3-и и 5-е сутки.
Высокие показатели уровня СРБ, vWF, ДЭ при сочетанной травме с повреждением органов брюшной полости в 1-е сутки говорят о системной реакции организма на травму, о значительном повреждении сосудистого эндотелия и включении неспецифических защитных механизмов в ответ на имеющиеся повреждения. Рост показателей свидетельствует об углублении ЭД в ответ на тяжелые повреждения и реализации СВО. Повышение уровней СРБ, vWF, ДЭ свидетельствует о вовлечении в процессы сосудистого эндотелия, при этом в ответ на травму отмечается усиленная десквамация поврежденных эндотелиоцитов и избыточная продукция провоспалительных и протромботических факторов, что является неспецифическим защитным механизмом, развивающимся при травме независимо от ее тяжести и локализации. При благоприятном течении уровни СРБ, vWF, ДЭ имеют тенденцию к снижению к 5-м суткам, что свидетельствует о регрессии СВО и является положительным прогностическим фактором.
При осложненном течении травматической болезни, в условиях нарастающей антигенемии, источником которой являются поврежденные ткани организма, уровень СРБ многократно повышается, так как обладает наибольшей нейтрализующей способностью по отношению к антигенам. Системное повреждение сосудистого эндотелия, приобретение им тромбогенных свойств сопровождается увеличением концентрации vWF и количества ДЭ.
Столь высокие показатели уровня СРБ, vWF, ДЭ свидетельствуют о реализации генерализованной воспалительной реакции организма на травму, прогрессировании ЭД с развитием ПОН, которая и явилась причиной смерти.
Исходя из нашего исследования видно, что кратность увеличения показателей ЭД является прогностическим признаком течения и исхода сочетанной травмы.
ЗАКЛЮЧЕНИЕ
Все три рассматриваемых маркера эндотелиальной дисфункции имеют важное прогностическое значение при тяжелой сочетанной закрытой травме живота. Их уровень при тяжелой абдоминальной травме достоверно отличается от такового у оперированных нетравмированных пациентов. Уровни С-реакгивного белка и фактора фон Виллебранда позволяют проводить дифференциальную диагностику между ушибом брюшной стенки и повреждением внутренних органов, их крайне высокие показатели предполагают неблагоприятное течение травматической болезни и высокую вероятность развития смертельного исхода. Уровень десквамированных эндотелиоцитов оказался наиболее достоверным в диагностике риска развития осложнений и смертельного исхода с 1-х по 5-е сутки от момента получения травмы. Некротические процессы в эндотелии, отражаемые содержанием в крови десквамированных эндотелиоцитов, являются ведущими в патогенезе полиорганной недостаточности.
ВЫВОДЫ
Объективная оценка эндотелиальной дисфункции в хирургии повреждений может иметь прогностическое значение. Принимая во внимание, что в основе развития травматической болезни лежит повреждение сосудистого эндотелия, необходимо рассматривать в качестве прогностических показателей
СПИСОК ИСТОЧНИКОВ
Лупинская З.А., Зарифьян А.Г., Гурович Т.Ц., Шлейфер С.Г. Эндотелий. Функция и дисфункция. Бишкек: КРСУ; 2008.
Малкова О.Г., Медведева С.Ю., Лейдерман И.Н. Взаимосвязь нарушений липидного обмена и эндотелиальной дисфункции у пациентов с тяжелым сепсисом. Вестник Уральской медицинской академической науки. 2011;(3):17-22.
Фирсов С.А., Матвеев Р.П. Эндотелиальная дисфункция и ее прогностическое значение при критических состояниях в результате дорожно-транспортного травматизма. Современные проблемы науки и образования. 2014;(6):1171.
Борщикова Т.И., Епифанцева Н.Н., Кан С.Л., Лызлов А.Н. Дисфункция сосудистого эндотелия при тяжелой черепно-мозговой травме. Медицина в Кузбассе. 2019;18(2):5-11.
Шабров А.В., Апресян А.Г., Добкес А.Л., Ермолов С.Ю., Ермолова Т. В., Манасян С.Г., и др. Современные методы оценки эндотелиальной дисфункции и возможности их применения в практической медицине. Рациональная фармакотерапия в кардиологии. 2016;12(6):733-742
Моррисон В.В., Божедомов А.Ю., Моррисон А.В. Эндотелиальная дисфункция при термической травме. Саратовский научно-медицинский журнал. 2019;15(2):377-379.
Александров Василий Владимирович - кандидат медицинских наук, доцент, доцент кафедры госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ;
Маскин Сергей Сергеевич - доктор медицинских наук, профессор, заведующий кафедрой госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ;
Ермолаева Надежда Константиновна - кандидат медицинских наук, докторант кафедры госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ
Перфилова Валентина Николаевна - доктор биологических наук, профессор кафедры фармакологии и фармации Института непрерывного медицинского и фармацевтического образования ФГБОУ ВО ВолгГМУ МЗ РФ
Алимов Максим Николаевич - соискатель кафедры госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ;
Бирюлев Дмитрий Сергеевич - соискатель кафедры госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ;
Рашид Азад - соискатель кафедры госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ;
Сигаев Сергей Михайлович - соискатель кафедры госпитальной хирургии ФГБОУ ВО ВолгГМУ МЗ РФ;
Теги: С-реактивный белок
234567 Начало активности (дата): 08.11.2024
234567 Кем создан (ID): 989
234567 Ключевые слова: С-реактивный белок, фактор фон Виллебранда, десквамированный эндотелиоцитов, закрытая травма живота, эндотелий, эндотелиальные маркеры, эндотелиальная дисфункция, сочетанная закрытая травма живота, смертельный исход, послеоперационные осложнения, полиорганная недостаточность
12354567899
Похожие статьи
Послеоперационная вентральная грыжаРентген на дому 8 495 22 555 6 8
Паховая и бедренная грыжа
Кишечная и нутритивная недостаточноть при осложненной травме шейного отдела позвоночника
Восстанавливающее питание при сочетанной травме



