 23.07.2024
23.07.2024
Системные особенности клеточного иммунитета и процессы ремоделирования субхондральной кости при ранних проявлениях идиопатического гонартроза, сопровождающегося синовитом
Процессы субхондрального ремоделирования у пациентов с ранними проявлениями первичного гонартроза и синовитом характеризуются усилением деструкции коллагеновых структур экстрацеллюлярного матрикса костной ткани, дифференцировки и синтетической активности остеобластов
Остеоартрит является группой заболеваний опорно-двигательной системы, широко распространенных среди лиц старше 40 лет [1]. По прогнозам, к 2040 году число пациентов с остеоартритом составит 78 миллионов человек [2], что внесет существенный вклад в общее бремя инвалидности и будет способствовать прогрессирующему снижению качества жизни многочисленной группы тяжелых хронических пациентов. Основным клиническим проявлением остеоартрита является выраженный болевой синдром, однако возникновение симптомов остеоартрита, как правило, ассоциировано с уже сформированными необратимыми структурно-функциональными нарушениями в системе сустава, в то время как ранние стадии заболевания протекают бессимптомно [3]. Результатом поздней обращаемости, а также недостаточной чувствительности и специфичности используемых диагностических алгоритмов при остеоартрите становится снижение эффективности применяемых симптом-ориентированных консервативных методов лечения, быстрое прогрессирование заболевания и появление потребности в проведении высокотехнологичных хирургических вмешательств по поводу первичной артропластики [4].
Сложность и многофакторность патогенетических механизмов прогрессирования процессов воспалительно-дегенеративной перестройки соединительнотканных сустав ных элементов требует детального изучения, что позволит существенно повысить эффективность существующих диагностических стратегий и вывести терапевтические подходы, разрабатываемые в отношении остеоартрита крупных суставов, на болезнь-модифицирующие позиции.
Следует отметить, что в результате получения новых знаний, касающихся патогенетических механизмов развития процессов воспалительной деструкции суставов, за последние годы первоначальная парадигма представлений об остеоартрите как о механическом возрастном износе и деструкции суставного хряща претерпела существенные изменения [5]. Общепризнано, что диагноз «Остеоартроз» объединяет большую полиэтиологическую группу заболеваний с общими патогенетическими механизмами прогрессирования процессов воспалительной деструкции, которые охватывают суставной хрящ, субхондральную кость, синовиальную оболочку, связочный аппарат и окружающие мышечные ткани.
Система пораженного сустава представляет собой единый орган, реагирующий на изменения гомеостаза всеми своими компонентами. [6]. Согласно сформированным на сегодняшний день взглядам, остеоартрит является многофакторным заболеванием с выраженным иммунным ответом, гипертрофией субхондральной кости с возникновением склерозированных участков и образованием остеофитов, гиперплазией синовиальной оболочки, развитием фиброза связочного аппарата в условиях повышенной выработки цитокинов, хемокинов и других медиаторов воспаления [7]. Решающее значение в патогенезе ранних проявлений остеоартрита отводят изменениям в костных структурах, обусловленным перераспределением механических нагрузок на границе взаимодействия твердой (субхондральной кости) и мягких тканей (суставного хряща) [8].
Результатом аномальных биомеханических соотношений становится возникновение микротрещин в субхондральной кости, вовлечение в патологический процесс костного мозга, формирование синдрома венозного выхода, снижение перфузии и возникновение хронической тканевой гипоксии [9]. Неблагоприятные механо-ме- таболические события в суставных компонентах сопровождаются нарушением цитокиновых профилей остеобластов, которые наряду с остеокластами и макрофагами обеспечивают процессы субхондрального ремоделирования при остеоартрите [10, 11].
К основным критическим молекулярным медиаторам патологической перестройки субхондральной кости относят прорезорбтивные цитокины интерлейкина-6 (IL-6), интерлейкина-1 бета (IL-113) и фактора некроза опухоли-альфа (TNF-a), воздействие которых реализуется через синергичное сти мулирование остеокласт-опосре- дованной костной резорбции [12]. В активации дифференцировки и пролиферации остеобластов немаловажная роль принадлежит морфогенетическим белкам (ВМР-2 и -4), а также трансформирующим факторам роста (TGF-bl), которые синтезируются моноцитами и макрофагами, мигрирующими в зону возникающих повреждений субхондральной кости.
Особенности стимуляции адаптивной иммунной системы при остеоартрите идентичны с медленно срастающимися переломами [13]. При остеоартрите происходит активация как остеобластов, так и остеокластов, а образование остеоидной ткани, формирование участков склероза и возникновение остеофитов связаны с репаративными процессами, сопровождающимися усилением ангиогенеза и нарушениями процессов минерализации. Следствием локального воспалительного процесса может становиться функциональная недостаточность остеобластов, демонстрирующих аномально медленную пролиферацию и низкую способность к минерализации [14].
Изменения в субхондральной кости неразрывно связаны с ремоделированием суставного хряща, неоваскулярная инвазия которого при остеоартрите сопровождается гипертрофической дифференци- ровкой хондроцитов и остеоцитов, гиперэкспрессией матриксных металлопротеиназ (ММР-1, -3, -9, -13) и провоспалительных цитокинов, способствующих усилению катаболических процессов в суставных тканях [15]. Повышаются концентрации прорезорбтивных факторов, присутствующих как локально в синовиальной среде, так и системно — в сыворотке крови, что может свидетельствовать о признаках функциональной несостоятельности факторов иммунной защиты [16].
Основные катаболические цитокины II-1 [3 и TNF-a накапливаются вследствие активации мононукле- аров и синовиоцитов и негативно влияют на функциональную активность остеобластов, хондроцитов, остеобластов, клеток синовиальной оболочки, остеокластов [17], угнетая синтез основных высокомолекулярных компонентов экстрацел- люлярного матрикса суставного хряща и коллагена II типа, а также способствуя апоптозу хондроцитов [18].
Патофизиологическая значимость IL-1 при остеоартрите связана с повышением экскреции кальция, активацией остеобластов и снижением выработки остеокальцина, что способствует преобладанию катаболических процессов в субхондральной кости [19]. Немаловажная роль в воспалительной перестройке субхондральной кости, дегенерации суставного хряща, гиперплазии и гипертрофии синовиальной оболочки при остеоартрите принадлежит также IL-8, -15, -17, -18, -20 [20].
Ключевое значение в патогенезе остеоартрита имеют нарушения в системе гуморального и клеточного иммунитета. Так, Rosshirt N. et al. (2021) представили доказательства вовлечения иммунной системы в поддержание воспалительного статуса суставных тканей в дебюте первичного остеоартрита [21]. Expand N., Trout R. (2020) установили ведущее значение синовиальной инфильтрации активированными Т-лимфоцитами (CD4+), сопровождающейся экспрессией IL-6 и IL-4, избыточно стимулирующими катаболические ферментные системы [22]. Известно также, что особенности иммунологического статуса пациентов находятся в определенной зависимости от этиологии заболевания [23].
Решающая роль в обеспечении процессов иммунной регуляции ремоделирования костной ткани принадлежит системе, представленной активатором остеопротеге- рина/рецептором системы лиганда ядерного фактора каппа-В (OPG /RANK/ RANKL) [24]. Синтез RANKL Т-клетками и образование OPG влияют на костную резорбцию через активацию и дифферен- цировку остеокластов, обеспечивая динамические взаимосвязи между костной и иммунной системами [25, 26].
Таким образом, научным сообществом поддержана гипотеза об участии иммуноопосредованных процессов субхондрального ремоделирования в реализации ведущих патогенетических паттернов при остеоартрите. Однако взаимосвязи между воспалительно-деструктивной перестройки костной ткани и клеточным иммунным ответом при ранних стадиях заболевания остаются спорными, что диктует необходимость проведения дополнительных исследований.
Цель — изучить системные особенности клеточного иммунитета, процессы субхондрального ремоделирования и уровень экспрессии прорезорбтивных цитокинов при ранних проявлениях первичного гонартроза с признаками синовита.
МАТЕРИАЛ И МЕТОДЫ
В исследовании, проведенном на базе НИИТОН ФЕБОУ ВО «Саратовский ЕМУ им. В.И. Разумовского» Минздрава России, приняли участие 74 пациента основной группы (53 женщины и 21 мужчина) в возрасте 33-52 лет с ранними (малосимптомными) проявлениями идиопатического остеоартрита с преимущественным поражением коленных суставов — гонартрозом, у которых отмечали признаки синовита по данным ультразвукового исследования (УЗИ). В контрольную группу вошли 41 женщина и 20 мужчин без заболеваний опорно-двигательнои системы того же возраста. Критерием включения в исследование стало добровольное информированное согласие участ ников.
Критериями исключения из исследования явились травматические повреждения коленных суставов, наличие соматических заболеваний, влияющих на результаты обследования, индекс массы тела (ИМТ) более 28,9, состояние менопаузы, недавние хирургические вмешательства, прием препаратов, способных изменить значения исследуемых лабораторных маркеров, а также наличие онкологических заболеваний.
Проведенное исследование было одобрено локальным этическим комитетом ФЕБОУ ВО «Саратовский ЕМУ им В.И. Разумовского» Минздрава России (протокол № 2 от 02.02.2022 г.), соответствовало этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинский исследований с участием человека» с поправками 2013 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. Все лица, участвовавшие в исследовании, дали на это свое информированное согласие.
Болевой синдром оценен по десятибалльной визуально-аналоговой шкале (ВАШ), проведено анкетирование KOSS (Knee Injury and Osteoarthritis Outcome Score) и WOMAC (Western Ontario and McMaster University Osteoarthritis Index).
Рентгенография коленных суставов была выполнена в двух проекциях на аппарате «Opera Swing» («GMM Group», Италия) с оценкой по шкале Kellgren J.H., Lawrence J.S. (1957) [27], с учетом критериев Altman R. (1986) [28]. При выявлении ранних стадий остеоартрита учитывали рекомендации американской Коллегии ревматологов и Клинические рекомендации по диагностике и лечению гонартроза, разработанные Ассоциациями травматологов-ортопедов России и ревматологов России и утвержденные Минздравом России в сентябре 2021 г. [29].
С целью выявления пациентов с нарушениями минеральной плотности костной ткани (остеопороз, остеопения) проводили двухэнергетическую рентгеновскую абсор- бциометрию на денситометре «GE LUNAR PRODIGY» («General Electric», США), исключая из дальнейшего исследования пациентов со значениями, превышающими ± 1 SD. УЗИ проводили на аппарате Siemens Acusion S-2000 («Siemens AG», Германия).
Оценка состояния субхондрального ремоделирования проведена на основании показателей биохимических маркеров в сыворотке крови, отражающих метаболические процессы в костной ткани. Методом твердофазного иммуноферментного анализа (ИФА) изучали концентрации остеокальцина (ОС), лиганд рецептора-активатора ядерного фактора каппа В (RANKL), С-терминальных фрагментов молекул коллагена I типа, образующихся при его деградации коллагена I типа (Beta CrossLaps), остеопро- тегерина (OPG) и активности костного изофермента щелочной фосфатазы (ВАР) при помощи коммерческих наборов реактивов: «Enzyme- linked Immunosorbent Assay Kit for Osteocalcin (OC)» («Cloud-Clone Corp.», Китай); «Receptor Activator of Nuclear Factor Kappa В Ligand (RANKL)» («Cloud-Clone Corp.», Китай); «Enzime-Enzyme-linked Immunosorbent Assay Kit for Beta CrossLaps (bCTx)» («Cloud-Clone Corp.», Китай); «OPG» («Bio- medica Medizinprodukte GmbH», Австрия); «An Enzyme Immunoassay For the Quantitation of Bone-Specific Alkaline Phosphatase (BAP) in Human Serum» («Ouidel Corporation Products», США). Результаты считаны на анализаторе «Anthos 2020» («Biohrom Ltd.», Великобритания). Концентрации в сыворотке крови TNF-a, IL 1 [3 и IL-6 также определяли методом твердофазного ИФА, применяя наборы реактивов производства «Вектор Бест», Новосибирск, Россия.
Оценка клеточного иммунитета была осуществлена на основании изучения количественного состава основных популяций лимфоцитов (CD3+CD4+ CD8+, измеренных в образцах венозной крови методом проточной цито- флуориметрии на аппарате «BD Facs Canto™ II» («Becton Dickinson», США). Применяли наборы «BD Multitest™ 6-Color TBNK» («Becton Dickinson», США), позволяющие дифференцировать T-, В- и NK-клетки.
Статистическая обработка полученных результатов проведена с вычислением критериев Колмогорова-Смирнова и Шапиро—Уилка. При сравнении данных, распределение которых отличалось от нормального, использовали непараметрический критерий Манна—Уитни, представляя результаты в виде медианы (Me) и итерквартильного размаха (Q1 и 03) Результаты учитывали при уровне р < 0,05.
РЕЗУЛЬТАТЫ
При опросе пациенты основной группы не отмечали каких-либо затруднений, связанных с коленными суставами при выполнении обычных трудовых или бытовых функций.
Суммарный итог по опроснику KOSS составлял в основной группе 85,2 (80,4; 93,9) балла, порядка 20 % пациентов отмечали эпизоды утренней скованности в коленных суставах, при пальпации у них выявляли отечность мягких тканей и крепитацию. Индекс ВАШ в покое составил 1,7 (0,8; 2,0) мм, при движении — 2,2 (1,5; 2,7) мм, что соответствовало слабой боли; WOMAC - 7,6 (5,9; 9,6) балла.
Стандартная рентгенография подтверждала наличие 0-1 стадии остеоартрита у пациентов основной группы согласно критериям Kellgren J.H., Lawrence J.S., что демонстрировало достаточно низкую информативность метода при выявлении ранних признаков ремоделирования участков субхондральной кости. Кабалык М.А. и соавт. в 2017 г. предложили применять шкалу количественного учета текстурных изменений субхондральной кости, что позволит повысить информативность методов оценки ее структурных изменений [31].
При проведении УЗИ у пациентов основной группы выявляли синовит, что свидетельствовало о локальной воспалительной активности. Кроме того, отмечали неоднородную поверхность суставного хряща, дегенеративные изменения менисков, повышение параметров эхогенности связочного аппарата. При ранних проявлениях гонар- троза толщина суставного хряща в области пателло-феморального сочленения составляла 2,5 (2,0; 2,9) мм; в группе контроля — 2,6 (2,1; 3,0) мм.
В зарубежной клинической практике распространены диагностические алгоритмы, отражающие метаболические процессы в суставных тканях [32]. Для оценки состояния субхондральной кости исследуют фрагменты коллагена I типа, отражающие катаболический статус субхондральной кости при остеоартрите, ассоциированного с хроническим воспалением [33]. Проведенные нами измерения маркеров костного ремоделирования демонстрировали изменения их значений у пациентов с остеоартритом (табл. 1).
Нарастание в 2,07 раза Beta- Cross Laps (ЬСТх) у пациентов основной группы по сравнению с контрольными значениями свидетельствовало об интенсификации дезорганизации молекул коллагена I типа, сопровождающей усиленную резорбцию костной ткани с участием системы матриксных металлопротеиназ, что было ранее доказано в отношении поздних проявлений остеоартрита [34]. Известно, что изомеризованные телопептиды являются специфичными продуктами деструкции коллагена I типа и позволяют судить о состоянии субхондральной кости [35].
О нарастании синтетической активности остеобластов и усилении процессов костного ремоделирования при остеоартрите свидетельствовало увеличение концентрации полипептидных N-MID фрагментов молекул О К в сыворотке крови пациентов основной группы в 1,1 раза против контрольных значений. Повышение уровней данного белка в биологических средах отмечается при усилении костного обмена [36]. Об интенсификации дифференцировки остеобластов, усилении процессов костеобразования свидетельствовало также увеличение активности BAP, превышавшее в 1,34 раза контрольные значения. Принимая во внимание участие данного фермента в процессах минерализации субхондральной кости, а также в реорганизации суставного хряща, в том числе через механизм микрокристаллического стресса хондроцитов [31], можно предположить существование единых паттернов ремоделирования субхондральной кости и суставного хряща в патогенезе ранних стадий остеоартрита.
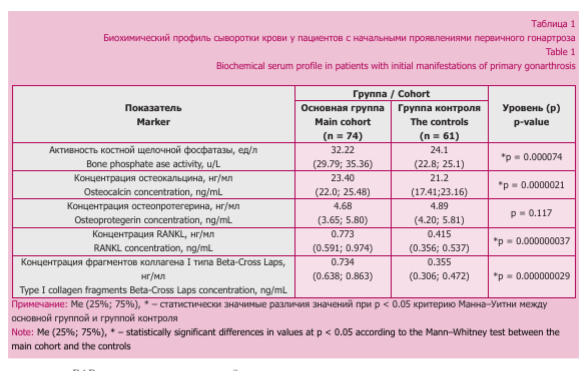
Выявленные нами изменения подтверждают нарушения в системе субхондральной кости в дебюте гонартроза, что отражено в других работах [37]. Ведущим механизмом регуляции ремоделирования субхондральной кости при симптоматическом остеоартрите является усиление синтеза остеоцита- ми молекул RANKL, приводящее к изменениям процессов минерализации стержневых и пластинчатых структур в трабекулярной кости и сопровождающееся микропереломами [23]. Нарушения в системе OPG-RANKL-RANK сопровождают аномальную дифферен- цировку остеокластов [24], способствующую разобщению остеосинтетических и резорбтивных процессов в субхондральной кости. В основной группе констатировали существенное увеличение RANKL в 1,86 раза, что значимо снижало индекс OPG/RANKL в 1,95 раза: до 6,05 против 11,78 (табл. 1). Гиперпродукция RANKL стимулирует остеокластную дифференциров- ку и активность, приводя к преобладанию резорбтивных процессов. Известно, что RANKL преимущественно экспрессируется на Т-хелперах, при активации которых наблюдается индукция белка с повышением остеокластогенеза и усугублением костной резорбции с последующей потерей костной массы [38].
Нами выявлены признаки количественных изменений лимфоцитов в крови пациентов основной группы (табл. 2).
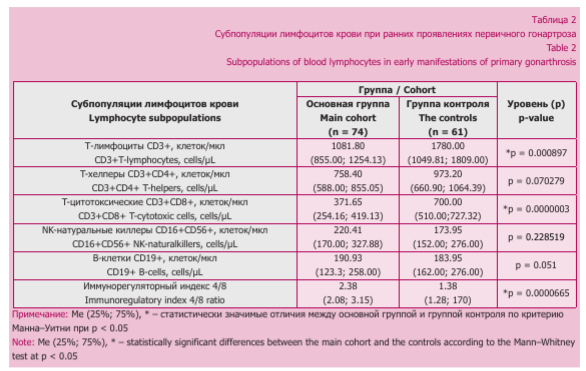
Согласно данным таблицы 2, в основной группе было снижено количество Т-клеток в 1,65 раза за счет популяции цитотоксических (CD3+CD8+) лимфоцитов, количество которых уменьшалось в 1,88 раза, что может быть обусловлено их миграцией в очаги локального воспаления [43]. Известно, что в синовиальной среде пациентов с остеоартритом преобладают активированные CDS-клетки воспалительного фенотипа, экспрессирующие II-ip и IL-17A, поддерживающие катаболический статус суставного хряща через механизмы активации протеолитических ферментов и угнетения спитетическои активности хондроцитов [44]. Также у пациентов основной группы повышалось соотношение в 1,72 раза CD4+/CD8+, что может быть обусловлено аутоиммунными процессами [45].
Провоспалительный статус пациентов с гонартрозом поддерживался высокими уровнями концентрации прорезорбтивных цитокинов в сыворотке крови (табл. 3).
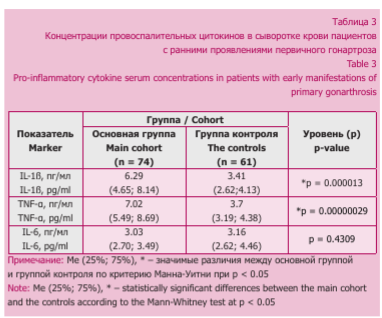
Согласно данным, представленным в таблице 3, основная роль в реализации процессов субхондрального ремоделирования в дебюте первичного гонартроза принадлежит избыточной экспрессии IL-1B и TNF-a, концентрации которых против контрольных значений увеличивались в 1,85 и 1,9 раза соответственно.
Значимая регуляторная роль в разобщении процессов ремоделирования субхондральной кости в патогенезе остеоартрита принадлежит системе цитокиновой регуляции.
Гиперпродукция медиаторов, участвующих в прогрессировании остеоартрита связана с воспалительно-клеточной инфильтрацией суставных тканей и избыточным выбросом продуктов деструкции суставного хряща и субхондральную кость [18, 23]. Синовит характеризуется усиленной пролиферацией клеток-резидентов синовиальной среды и иммунокомпетентных клеток, мигрирующих в очаг локальной деструкции суставных тканей и способствующих ремоделированию субхондральной кости [22].
ОБСУЖДЕНИЕ
В результате проведенного исследования установлены биохимические признаки ремоделирования субхондральной кости при ранних (0-1) рентгенологических стадиях первичного гонартроза с признаками синовита, которое может быть охарактеризовано усилением процессов костеобразования и костной резорбции.
Известна иммуномодулирующая роль лиагнд-рецепторной системы OPG-RANKL-RANK в регуляции уровня костной резорбции у пациентов с симптоматическими формами остеоартрита [23]. Полученные в ходе проведения исследования результаты подтвердили усиление действия RANKL, ведущее к существенному снижению индекса OPG RANKL при ранних проявлениях гонартроза с признаками синовита.
Костная ткань и иммунная система демонстрируют тесные взаимосвязи, обусловленные общностью происхождения и сходством регуляторных молекулярно-клеточных механизмов [40]. Нами установлено, что ранние проявления субхондрального ремоделирования в дебюте остеоартрита сопровождаются системными нарушениями в клеточном звене иммунитета, заключающимися в существенном снижении количества циркулирующих Т-клеток — преимущественно за счет популяции цитотоксических лимфоцитов, экспрессирующих маркеры детерминации CD3+CD8+, а также повышении иммунорегуляторного индекса Ratio 4/8. Предположительно данные изменения могут быть обусловлены миграцией иммунокомпетентных клеток в область воспалительной деструкции экстрацеллюлярного матрикса суставного хряща и субхондральной кости, сопровождающейся повышением антигенной нагрузки и фенотипической модификацией клеточных элементов [42, 45].
Об усилении иммунного ответа с участием Т-лимфоцитов, моноцитов и макрофагов свидетельствовало также повышение концентрации провоспалительного цитокина TNF-a, стимулирующего пролиферацию и дифференцировку ряда иммунокомпетентных клеток п усиливающего их миграцию в очаг воспаления. Известно, что IL- 1В играет важную роль в развитии как местного, так и системного воспалительного процесса [17].
Выявленная гиперпродукция IL-1B, вероятно, является одним из ключевых медиаторов, ответственных за поддержание катаболического статуса скелетных соединительных тканей при раннем остеоартрите. Таким образом, нельзя исключить участие IL-1B, TNF-a в реализации как локальных прорезорбтив- ных эффектов данных цитокинов в отношении глубоких нарушений ремоделирования субхондральной кости при начальных проявлениях остеоартрита, так и их системных провоспалительных эффектов, связанных с модуляцией дисбаланса клеточного и гуморального ответа в условиях возрастания антигенной нагрузки, обусловленной процессами деструкции суставных тканей.
ВЫВОДЫ
Процессы субхондрального ремоделирования у пациентов с ранними проявлениями первичного гонартроза и синовитом характеризуются статистически значимым повышением концентрации в сыворотке крови фрагментов коллагена I типа Beta-Cross Laps в 2,07 раза, остеокальцина — в 1,1 раза и активности костного изофермента щелочной фосфатазы — в 1,34 раза по сравнению с контрольными значениями, что свидетельствует об интенсификации деструкции матрикса костной ткани на фоне усиления дифференцировки и синтетической активности остеобластов.
Ремоделирование костной ткани при ранних проявлениях первичного гонартроза на фоне синовита характеризуется усилением поступления в 1,86 раза RANKL в сыворотку крови, что сопровождается снижением в 1,95 раза соотношения OPG RANKL.
Дисбаланс в системе Т-клеточного иммунитета при ранних проявлениях первичного гонартроза отличается снижением количества CD3+лимфоцитов в 1,65 раза, цитотоксических лимфоцитов CD3+CD8+ — в 1,88 раза, что сопровождается повышением регуляторного индекса Ratio 4/8.
Нарушения метаболических процессов в субхондральной кости в дебюте первичного гонартроза ассоциированы с гиперпродукцией прорезорбтивных цитокинов IL-1B и TNF-a, концентрация которых превышает нормальные значения в 1,85 и 1,9 раза.
ЛИТЕРАТУРА
Alekseeva LI, Taskina EA, Kashevarova NG. Osteoarthritis: epidemiology, classification, risk factors, and progression, clinical presentation, diagnosis, and treatment. Modern Rheumatology Journal. 2019; 13(2): 9-21. Russian (Алексеева Л.И., Таскина E.A., Кашеварова Н.Г. Остеоартрит: эпидемиология, классификация, факторы риска и прогрессирования, клиника, диагностика, лечение //Современная ревматология. 2019. Т. 13, №. 2. С. 9-21.)
Sumnaya DB, Manaeva N1, Gurova NE, Bykov EV, Kinzersky AA, Sadova VA, et al. Comparative efficacy of autoplasma and hyaluronicacid in young patients with osteoarthritis of the knee joints against the background of chondropathy of tibial tuberosity. Deutsche Internationale Zeitschrift fur zeitgenossische Wissenschaft. 2021; 9(1):26-30. Russian (Сумная Д.Б., Манаева Н.И., Гурова H.E., Быков Е.В.,Кинзерский А.А., Садова В.А. и др. Сравнительная эффективность применения аутоплазмы и гиалуронатов у молодых пациентов при остеоартрите коленных суставов на фоне перенесенной хондропатии бугристости большеберцовой кости //Deutsche Internationale Zeitschrift fur zeitgenossische Wissenschaft. 2021. T. 9, № 1. C. 26-30.)
Baranovsky AA, Urazovskaya IL, Mansurov DSh, Saiganov SA, Mazurov VI, Tkachenko AN, et al. Organization of treatment of osteoarthritis of the knee joint. Uzbek Journal of Case Reports. 2022; 2(3): 37-45. Russian (Барановский A.A., Уразовская И.Л., Мансуров Д.Ш., Сайганов С.А., Мазуров В.И., Ткаченко А.Н. и др. Организация лечения остеоартрита коленного сустава //Uzbek journal of case reports. 2022. T. 2, № 3.C. 37-45.) DOI: 10.55620/ujcr.2.3.2022.5
Lana JFSD, Rodrigues BL. Osteoarthritis as a chronic inflammatory disease: a review of the inflammatory markers. Osteoarthritis biomarkers and treatments. 2019. DOI: 10.5772/intechopen.82565
NasonovaVA. Osteoarthritis-the polymorbidity problem. Consilium Medicum. 2009; 11(2): 5-8. Russian (Насонова B.A. Остеоартроз - проблема полиморбидности //Consilium Medicum. 2009. T. 11, № 2. C. 5-8.)
Aspden RM, Saunders FR. Osteoarthritis as an organ disease: from the cradle to the grave. Eur Cell Mate. 2021; (37): 74-87. DOI: 10.22203/eCM.v037a06
Zhen G, GuoQ, Li Y, Wu C, Zhu S, Wang R, et al. Mechanical stress determines the configuration of TGF(3 activation in articular cartilage. NatCommun. 2021; 12(1): 1706. DOI: 10.1038M1467-021-21948-0
Gune§ S, Jehim K, Cuneyt K, Gokmen D, Ku^ukdeveci AA. Is there a connection between venous insufficiency and osteoarthritis of the knee joint? Turkish Journal of Physical Medicine and Rehabilitation. 2022; 66(1): 40-46. DOI: 10.5606/tftrd.2020.5110
Donell S. Subchondral bone remodelling in osteoarthritis. EFORT Open Rev. 2019; 4(6): 221-229. DOI: 10.1302/2058-5241.4.180102
Zhu S, Zhu J, Zhen G, Hu Y, An S, Li Y, et al. Subchondral bone osteoclasts induce sensory innervation and osteoarthritis pain. J Clin Invest. 2019; 129(3): 1076-1093. DOI: 10.1172/JCI121561
Jrad AIS,Trad M, Bzeih W, El Hasbani G, Uthman I. Role of pro-inflammatory interleukins in osteoarthritis: a narrative review. Connect Tissue Res. 2022; (21): 1 -10. DOI: 10.1080/03008207.2022.2157270
Loi F, Cordova LA, Pajarinen J, Lin TH, Yao Z, Goodman SB. Inflammation, fracture and bone repair. Bone. 2016; (86): 119-130. DOI: 10.1016/j.bone.2016.02.020
Jiang A, Xu P, Sun S, Zhao Z,Tan Q, Li W, et al. Cellular alterations and crosstalk in the osteochondral joint in osteoarthritis and promising therapeutic strategies. Connect Tissue Res. 2021; 62(6): 709-719. DOI: 10.1080/03008207.2020.1870969
Mehana EE, Khafaga AF, El-Blehi SS. The role of matrix metallopro- teinases in osteoarthritis pathogenesis: an updated review. LifeSci. 2019; (234): 116786. DOI: 10.1016/j.lfs.2019.116786
Mamonova IA, Gladkova EV, Ulyanov VYu, Babushkina IV, Belova SV, Puchinyan DM, et al. The characteristics of cellular element of immunity before and after endoprosthesis of large joints. Saratov Journal of Medical Scientific Research. 2016; 12(2): 182-185. Russian (Мамонова И.А., Гладкова E.B., Ульянов В.Ю., Бабушкина И.В., Белова С.В., Пучиньян Д.М. и др. Особенности состояния клеточного звена иммунитета до и после эндопротезирования крупных суставов //Саратовский научно-медицинский журнал. 2016. Т. 12, №2. С. 182-185.)
Balabanova RM. Osteoarthrosis or osteoarthritis? A current view of the disease and its treatment. Modern Rheumatology Journal. 2013; 7(3): 67-70. Russian (Балабанова P.M. Остеоартроз или остеоартрит? Современное представление о болезни и ее лечении //Современная ревматология. 2013. Т. 7, № 3. С. 67-70.) DOI: 10.14412/1996-7012-2013-276
Raymuev KV, Ishenko AM, Malyshev ME. Pro-inflammatory and anti-inflammatory cytokines in the pathogenesis of osteoarthritis. Elerald of North-Western State Medical University named after /./. Mechnikov. 2018; 10(3): 19-27. Russian (Раймуев K.B., Ищенко A.M., Малышев M.E. Провоспалительные и противовоспалительные цитокины в патогенезе остеоартрита //Вестник СевероЗападного государственного медицинского университета им. И.И. Мечникова. 2018. Т. 10, № 3. С. 19-27.) DOI: 10.17816/mech- nikov201810319-27
Zhang G, Yin C, Wu R, Wang R, Qin Y, Lyu S. A gene expression analysis and immune infiltration between lesioned and preserved subchondral bone in osteoarthritis. BioRxiv. 2022.09.12.507705. DOI: 10.1101/2022.09.12.507705
Koh SM, Chan CK,Teo SH, Singh S, Merican A, Ng WM, et al. Elevated plasma and synovial fluid interleukin-8 and interleukin-18 may be associated with the pathogenesis of knee osteoarthritis. Knee. 2020; 27(1): 26-35. DOI:
10.1016/j.knee.2019.10.028
Rosshirt N, Trauth R, Platzer H, Tripel E, Nees ТА, Lorenz HM, et al. Proinflammatory T cell polarization is already present in patients with early knee osteoarthritis. Arthritis Res Ther. 2021; 23(1): 37. DOI: 10.1186/sl 3075-020-02410-w
Yu D, Hu J, Sheng Z, Fu G,Wang Y, Chen Y, etal. Dual roles of misshap- en/NIK-related kinase (MINK1) in osteoarthritis subtypes through the activation ofTGF(3 signaling. Osteoarthritis Cartilage. 2020; 28(1): 112-121. DOI: 10.1016/j.joca.2019.09.009
Chepeleva MV, Shved NS. Immunological special features of large joint osteoarthrosis of different etiology. Genius of Ortopedics. 2012; (2): 107-111. Russian (Чепелева M.B., Швед H.C. Иммунологические особенности остеоартроза крупных суставов различной этиологии //Гений ортопедии. 2012. № 2. С. 107-111.)
Harrell CR, Markovic BS, Fellabaum C, Arsenijevic A,VolarevicV. Mesenchymal stem cell-based therapy of osteoarthritis: current knowledge and future perspectives. Biomed Pharmacother. 2019; (109): 2318-2326. DOI: 10.1016/j.biopha.2018.11.099
Mirzaii-Dizgah MR, Mirzaii-Dizgah MH, Mirzaii-Dizgah I, Karami M, Forogh B. Osteoprotegerin changes in saliva and serum of patients with knee osteoarthritis. Rev Esp Cir Ortop Traumatol. 2022; 66(1): 47-51. DOI: 10.1016/j.recot.2021.02.003
Tateiwa D, Yoshikawa H, Kaito T. Cartilage and Bone Destruction in Arthritis: pathogenesis and treatment strategy: a literature review. Cells. 2019; 8(8): 818. DOI: 10.3390/celIS8080818
Kellgren JH, Lawrence JS. Radiologcal assessment of osteoarthritis. Ann Rheum Dis. 1957; (16): 494-502. DOI: 10.1136/ard.16.4.49420
Altman R, Asch E, Bloch D, Bole G, Borenstein D, Brandt K, et al. Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Diagnostic and therapeutic criteria committee of the American Rheumatism Association. Arthritis Rheum. 1986; 29(8): 1039-1049. DOI: 10.1002/ art.1780290816
Gonarthrosis. Clinical guidelines. 2021-2022-2023 (Sept. 03, 2021). Approved by the Ministry of Health of the Russian Federation. Russian (Гонартроз. Клинические рекомендации. 2021-2022-2023 (03.09.2021) / Минздрав РФ
Kabalyk МА. Assessment of subchondral bone changes in osteoarthritis. Medical Almanac. 2017; 5(50): 181-184. Russian (Кабалык M.A. Оценка изменений субхондральной кости при остеоартрите //Медицинский альманах. 2017. № 5 (50). С. 181-184.)
Hu N, Zhang J, Wang J, Wang P, Wang J, Qiang Y, et al. Biomarkers of joint metabolism and bone mineral density are associated with early knee osteoarthritis in premenopausal females. Clin Rheumatol. 2022; 41 (3): 819-829. DOI: 10.1007/sl0067-021 -05885-3
Tschaikowsky M, Brander S, Barth V, Thomann R, Rolauffs B, Bal- zer BN, et al. The articular cartilage surface is impaired by a loss of thick collagen fibers and formation of type I collagen in early osteoarthritis. Acta Biomaterialia. 2022; 146: 274-283. DOI: 10.1016/j. actbio.2022.04.036
Rogova LN, Lipov DS. The role of matrix metalloproteinases in the pathogenesis of osteoarthrosis (review). Volgograd Scientific Medical Journal. 2018; (1): 12-16. Russian (Рогова Л.Н., Липов Д.С. Роль матриксных металлопротеиназ в патогенезе остеоартроза (обзор литературы) //Волгоградский научно-медицинский журнал. 2018. № 1. С. 12-16.)
Tush EV, Eliseeva Tl, Khaletskaya OV, Krasilnikova SV, Ovsyannikov DYu, PoteminaTE, et al. Extracellular matrix markers and methods for their study (review). Modern Technologies in Medicine. 2019; 11(2): 133-149. Russian (Туш E.B., Елисеева Т.И., Халецкая O.B., Красильникова С.В., Овсянников Д.Ю., Потемина Т.Е. и др. Маркеры состояния экстрацеллюлярного матрикса и методы их исследования (обзор) //Современные технологии в медицине. 2019. Т. 11, № 2. С. 133-149). DOI: 10.17691/stm2019.11.2.20
Fan X, Wu X, Crawford R, Xiao Y, Prasadam I. Macro, et al. Changes of the Osteochondral Interface in Osteoarthritis Development. Front Cell Dev Biol. 2021; (9): 659654. DOI: 10.3389/fcell.2021.659654
Munjal A, Bapat S, Elubbard D, Elunter M, Kolhe R, Fulzele S. Advances in molecular biomarker for early diagnosis of osteoarthritis. Bio- mol Concepts. 2019; 10(1): 111-119. DOI: 10.1515/bmc-2019-0014
Weber A, Chan PMB, Wen C. Do immune cells lead the way in subchondral bone disturbance in osteoarthritis? Prog Biophys Mol Biol. 2019; (148): 21-31. DOI: 10.1016/j.pbiomolbio.2017.12.004
Kim GM, Park El, Lee SY. Roles of osteoclast-associated receptor in rheumatoid arthritis and osteoarthritis. Joint Bone Spine. 2022; 89(5): 105400. DOI: 10.1016/j.jbspin.2022.105400
Ono T, Takayanagi El. Osteoimmunology in bone fracture healing. Curr Osteoporos Rep. 2017; 15(4): 367-375. DOI: 10.1007/ si 1914-017-0381-0
Chepeleva MV, Kuznetsova El, Chegurov OK. Congenital immunity values in patients with knee deforming osteoarthrosis depending on the size of tibial medial condyle. Siberian Scientific Medical Journal. 2017; 37(6): 55-60. Russian (Чепелева M.B., Кузнецова Е.И., Чегуров O.K. Показатели врожденного иммунитета у пациентов с деформирующим остеоартрозом коленного сустава в зависимости от величины дефекта внутреннего мыщелка большеберцовой кости //Сибирский научный медицинский журнал. 2017.Т. 37, № 6. С. 55-60.)
Harrell CR, Markovic BS, Fellabaum C, Arsenijevic A,VolarevicV. Mesenchymal stem cell-based therapy of osteoarthritis: current knowledge and future perspectives. Biomed Pharmacother. 2019; (109): 2318-2326. DOI: 10.1016/j.biopha.2018.11.099
Culemann S, Gruneboom A, Kronke G. Origin and function of synovial macrophage subsets during inflammatory joint disease. Adv Immunol. 2019; (143): 75-98. DOI: 10.1016/bs.ai.2019.08.006
Platzer El, Trauth R, Nees ТА, Tripel E, Gantz S, Schiltenwolf M, et al. CD8+ T Cells in OA Knee Joints Are Differentiated into Subsets Depending on OA Stage and Compartment. J Clin Med. 2022; 11(10): 2814. DOI: 10.3390/jcm11102814
Zhu W, Zhang X, Jiang Y, Liu X, Eluang L, Wei Q, et al. Alterations in peripheral T cell and В cell subsets in patients with osteoarthritis. Clin Rheumatol. 2020; 39(2): 523-532. DOI: 10.1007/ si 0067-019-04768-y
Сведения об авторах:
Гладкова Е.В., к.б.н., начальник отдела фундаментальных и клинико-экспериментальных исследований, НИИТОН СГМУ, г. Саратов, Россия
Ульянов В.Ю., д.м.н., доцент, заместитель директора по научной и инновационной деятельности, НИИТОН СГМУ, г. Саратов, Россия
Норкин И.А., д.м.н., профессор, начальник отдела инновационных проектов в травматологии и ортопедии, НИИТОН СГМУ, г. Саратов, Россия
Теги: первичный гонатроз
234567 Начало активности (дата): 23.07.2024 18:21:00
234567 Кем создан (ID): 989
234567 Ключевые слова: первичный гонатроз; ранние стадии; синовит; Т-клеточный иммунитет; субхондральное ремоделирование; прорезорбтивные цитокины
12354567899
Похожие статьи
Левая стопаРентген на дому 8 495 22 555 6 8
Результаты лечения адгезивного капсулита плечевого сустава с применением обогащенной тромбоцитами плазмы и нуклеотидных препаратов: сравнительное исследование
Место ударно-волновой терапии в структуре современной реабилитационной стратегии
Экспериментальная РНК-вакцина от рака кожи привела к ремиссии у 77,6% пациентов



