 11.08.2023
11.08.2023
Отдаленные результаты лечения многоуровневого стеноза позвоночного канала в шейном отделе позвоночника методом билатеральной костно-пластической декомпрессивной ламинопластики с одномоментной фораминотомией
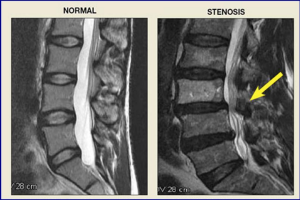
Стеноз шейного отдела позвоночника может привести к возникновению серьезных осложнений в результате нарушения функций спинного мозга
ВВЕДЕНИЕ
Многоуровневый стеноз шейного отдела позвоночника с миелопатией является причиной возникновения неврологических проявлений и сопровождается снижением качества жизни пациентов с возможной инвалидизацией [1].
Как правило, у пациентов с шейным стенозом позвоночного
канала наблюдается смешанная клиническая картина миелорадикулопатии
В правильной стратегии лечения при шейном стенозе до сих пор обсуждается в литературе [1-10]. В предотвращении необратимых изменений в спинном мозге и регрессировании неврологической симптоматики ключевую роль играет своевременное хирургическое лечение [10, 11]. Одним из методов выбора хирургического лечения протяженных стенозов является ламинопластика. Впервые цервикальную ламинопластику описал M. Оyama в 1973 г. [4]. С тех пор в истории нейрохирургии была представлена целая палитра модификаций ламинопластики, но наибольшего внимания заслужили техники по Hirabayashi (по типу «открытой двери») и Kurokawa (по типу «французской двери») [12]. Преимуществом ламинопластики как альтернативного варианта задней декомпрессии спинного мозга являются отсутствие послеоперационного кифоза, сохранение объема движений в шейном отделе позвоночника с минимальным риском развития нестабильности позвоночно-двигательных сегментов [13]. В условиях «Федерального центра нейрохирургии» (г. Тюмень) выполнялась билатеральная ламинопластика с одномоментной фораминотомией. Применяемая нами техника лечения многоуровневого стеноза в шейном отделе позвоночника явилась побудительным моментом для изучения отдаленных результатов у прооперированных пациентов в период от 2 до 5 лет.
Цель - оценка отдаленных результатов и клинических исходов в период от 2 до 5 лет после проведенной билатеральной декомпрессивной ламинопластики с одномоментной фораминотомией.
МАТЕРИАЛЫ И МЕТОДЫ
В условиях Федерального центра нейрохирургии нами ретроспективно проанализированы результаты хирургического лечения 27 пациентов - 22 мужчин и 5 женщин в возрасте от 46 до 80 лет (средний возраст - 61,7 года), прооперированных в период 20172022 гг. Критериями отбора пациентов для выполнения ламинопластики являлись протяженный многоуровневый стеноз (от 3-х уровней и выше), клиника миело- радикулопатии, наличие оссифицированной задней продольной связки, невозможность передней декомпрессии, сохранение лордоза или его незначительное выпрямление. Все пациенты прооперированы одной нейрохирургической бригадой. После получения письменного добровольного информированного согласия на проведение необходимых диагностических мероприятий пациенты были обследованы в условиях стационара. Оценка отдаленных результатов проводилась по субъективным, объективным и инструментальным данным. Полное клиническое обследование включало сбор жалоб, катамнеза, независимый клинико-неврологический осмотр смежных специалистов (нейрохи- рург/невролог), а также заполнение шкал: ВАШ - с целью определения выраженности болевого синдрома в верхних конечностях, японской ассоциации ортопедов (JOA) и Nurick для оценки функционального состояния пациентов и динамического контроля симптомов миелорадикулопатии. Всем пациентам были произведены нейровизуализационные исследования: МРТ шейного отдела позвоночника на аппарате МРТ Discovery MR750w 1,5 Тл, КТ шейного отдела позвоночника на аппарате Aguilion Prime SP TSX-303B. Используя стандартные измерительные инструменты программы RadiAnt DICOM Viewer, проводили объективную оценку степени стеноза. Средние линейные размеры и площадь поперечного сечения дурального мешка измеряли на поперечных МРТ-срезах. Рассчитывали переднезаднее сечение позвоночного канала в качестве линейной характеристики выраженности стеноза в дооперационном, раннем и позднем послеоперационных периодах. Непараметрические Т-критерий Вилкоксона и U-критерий Манна-Уитни использовали для оценки статистической значимости полученных результатов. Различия считали значимыми при p < 0,05. Результаты представлены в виде M ± m, где M - среднее арифметическое, а m - стандартная ошибка средней.
Положение пациента лежа на животе с фиксированными вдоль тела руками. Туловище фиксировали ремнем (рис. 1). Перед полной фиксацией пациента устанавливали электроды для нейромониторинга. Остистые отростки служили анатомическим ориентиром для выполнения срединного разреза кожи. Подкожную клетчатку и мышцы рассекали по средней линии (бессосудистой области). Проводилось скелети- рование остистых отростков и дужек, частично - дуго- отростчатых суставов позвонков.
Следующим этапом выполнялось сквозное пропиливание дуг в месте их перехода в дугоотростча- тые суставы с помощью костного скальпеля Misonix с обеих сторон (рис. 2). Осторожно рассекая желтую связку, выполнили временное извлечение костного лоскута. С помощью высокоскоростной дрели и кусачек типа Керрисон выполнили фораминотомию на интересующих уровнях (рис. 3). Следующим этапом выполнялось моделирование мини-пластин с последующей фиксацией их к лоскуту с помощью винтов диаметром 6 мм (рис. 4, 5). Готовый комплекс укладывали в исходное положение и фиксировали к суставам так, чтобы между суставами и дужками для увеличения пространства образовался диастаз (рис. 5). Фиксация лоскута выполнялась за дугоотростчатые суставы винтами диаметром 8 мм (рис. 5, рис. 6, а). В месте пропила, вдоль мини-пластин укладывался остеоиндуктивный материал (рис. 6, б). Послойное ушивание раны, мышцы шеи ушивались тремя слоями.
РЕЗУЛЬТАТЫ
При госпитализации в дооперационном периоде у всех пациентов визуализировалась характерная клиническая симптоматика в виде неврологического дефицита, проявляющаяся миелорадикулопатией, что и обусловливало выполнение комбинации ламинопластики и фораминотомии. Степень выраженности неврологических проявлений коррелировала с величиной сужения средней площади позвоночного канала и протяженностью многоуровневого стеноза. Согласно данным нейровизуализации МРТ шейного отдела позвоночника среди 27 пациентов у семнадцати наблюдался четырехуровневый стеноз ШОП, у четырех - трехуровневый стеноз и у пяти пациентов двухуровневый стеноз. Среднее количество стенозированных уровней составляло 3,4. Пациенты отмечали положительную динамику в виде регресса корешкового болевого синдрома, улучшения моторных функций, частичного восстановления чувствительных нарушений. Среднее значение болевого радикулярного синдрома в верхних конечностях в дооперационном периоде в сравнении с ранним и поздним послеоперационным периодом по шкале ВАШ составляло 6 ± 2,3, p < 0,05; по шкале моторных нарушений Nurick 2 ± 1,3, p < 0,05; по шкале JOA - 11,6 ± 2,8, p < 0,05. Среднее значение болевого синдрома по шкале ВАШ в раннем послеоперационном периоде в сравнении с дооперационным составило 3,9 ± 1,8, p < 0,05; по шкале Nurick 1,8 ± 1,1, p < 0,05; по шкале JOA - 12,6 ± 2,0, p < 0,05 (рис. 7). Из 27 прооперированных пациентов у 2-х наблюдались осложнения. В первом случае в раннем послеоперационном периоде возникло усиление болевого синдрома по ходу пораженного дерматома, слабость в правой верхней конечности, нарушение походки. Во втором случае в раннем послеоперационном периоде развилась эпидуральная гематома. После ревизионного вмешательства удаление гематомы способствовало благоприятному исходу. В отдаленном послеоперационном периоде (период от двух до пяти лет), в сравнении с дооперационным, среднее значение болевого радикулярного синдрома по шкале ВАШ составляло 2,9 ± 1,97, p < 0,01, функциональное состояние по шкале миелопатии Nurick в среднем составило 1,1 ± 0,97 балла, p < 0,05. При использовании модифицированной шкалы JOA средний балл составил 13,7 ± 1,9, p < 0,05.
Важными критериями при проведении сравнительного анализа отдаленных результатов являются данные инструментальных исследований, в частности, мы провели измерение средней площади поперечного сечения позвоночного канала с помощью вышеупомянутой программы RadiAnt DICOM Viewer. По данным нейровизуализации в раннем послеоперационном периоде у всех пациентов выявлялось значительное увеличение средней площади поперечного размера позвоночного канала с 0,79 ± 0,20 см2 до 1,74 ± 0,43 см2 при p < 0,01 (рис. 8). В отдаленном послеоперационном периоде наблюдалось незначительное увеличение средней площади поперечного сечения, равное 1,9 ± 0,44 см2, p < 0,05.
Клинический пример 1. Пациент Ф., 57 лет, поступил с жалобами на боль в шейном отделе позвоночника с иррадиацией в правую верхнюю конечность, слабость в нижних конечностях, чувство онемения в теле ниже уровня линии груди, в кистях обеих рук, нарушение функций тазовых органов. В неврологическом статусе доминировала симптоматика радикулопа- тии по С5 дерматому справа, проводниковый тип нарушения чувствительности с Th5 сегмента, спастический тетрапарез: легкий в верхних конечностях, умеренный в нижних. При осмотре были получены следующие данные по шкалам: ВАШ - 7 баллов, JOA - 13 баллов, Nurick - 1 балл.
По данным нейровизуализации - МР-картина стеноза позвоночного канала на уровне С4-С7 позвонков с миелопатией. На уровне С4-С5 позвонков - парамедианная грыжа межпозвонкового диска. При измерении средней площади поперечного сечения дурального мешка с помощью программы Radiant Dicom Viewer показатель составил 0,8182 см2 (рис. 9).
Пациенту было проведено оперативное вмешательство: костно-пластическая билатеральная декомпрессивная ламинопластика на уровне С3-С7 с одномоментной фораминотомией С4-С5 справа и слева под нейрофизиологическим контролем. Удаление грыжи межпозвонкового диска на уровне С4-С5 справа. Фиксация пластинами для ламинопластики.
В первые сутки после оперативного вмешательства у пациента наблюдалась положительная динамика в виде регресса болевого синдрома в правой верхней конечности по ВАШ до 4 баллов. В позднем операционном периоде (2 года после проведения оперативного вмешательства) до 2 баллов.
Функциональное состояние по шкале миелопатии Nurick не изменилось по сравнению с дооперационным периодом, постоянное значение 1.
По данным МРТ-исследования, используя стандартные вычислительные инструменты, выяснили, что в раннем послеоперационном периоде средняя площадь поперечного сечения дурального мешка увеличилась до 1,741 см2 (рис. 10).
В послеоперационном периоде пациенту была рекомендована фиксация шейного отдела позвоночника воротником Шанца в течение 3-4 недель. На 1-2 сутки пациент активизирован, швы сняли на 14 сутки.
Клинический случай 2. Пациентка К., 47 лет, поступила с жалобами на боль в шейном отделе позвоночника, с иррадиацией в левую верхнюю конечность, чувство онемения в обеих верхних и нижних конечностях, а также в области груди и живота, в области спины, на постепенно нарастающую слабость, нарушение мелкой моторики. В дооперационном периоде при госпитализации доминировала симптоматика радикулопатии по С7 дерматому слева, проводниковый тип нарушения чувствительности с С5 сегмента. При осмотре были получены следующие данные по шкалам: ВАШ - 6 баллов, JOA - 12 баллов, Nurick - 1 балл. По данным МРТ до операции: МР-картина стеноза позвоночного канала на уровне С3-С7 (рис. 11). Миелопатия на уровне С4-С6 позвонков. Средняя площадь поперечного сечения дурального мешка при измерении составила 1,355 см2.
Пациенту была проведена декомпрессивная ламинопластика на уровне С3-С6 с одномоментной фораминотомией на уровне С4-С5 справа и слева под нейрофизиологическим контролем. Фиксация пластинами для ламинопластики. Болевой синдром регрессировал в левой верхней конечности по ВАШ до 3-х баллов. В позднем операционном периоде - до 2-х баллов.
Функциональное состояние по шкале миелопатии Nurick не изменилось по сравнению с дооперационным периодом, постоянное значение 1.
Средняя площадь поперечного сечения дурального мешка в позднем послеоперационном периоде увеличилась до 3,319 см2 (рис. 12).
ОБСУЖДЕНИЕ
В литературе до сих пор не существует единого мнения об оптимальной тактике хирургического лечения многоуровневого стеноза. Известно, что большинство стабилизирующих операций как из переднего, так и из заднего доступа достаточно травматичны [14-16]. Основной задачей хирургического лечения при стенозах шейного отдела позвоночника является декомпрессия позвоночного канала и корешков с максимальным сохранением и восстановлением опороспособности позвоночника. Вначале использовали ламинэктомию. Данный метод лечения позволяет отлично визуализировать нейрососудистые структуры, безопасно выполнить гемостаз и фораминотомию. Однако имеет ряд недостатков, прежде всего, развитие постламинэкто- мического синдрома, включающего в себя формирование сегментарной нестабильности и послеоперационного кифоза [17]. В связи с этим ламинопластика является одним из методов выбора хирургического лечения протяженных стенозов. В настоящее время существует множество модификаций ламинопластики. Наибольшее распространение получили методики по Hirabayashi по типу «открытой двери» и Kurokawa по типу «французской двери» [12]. Одностворчатая ламинопластика, описанная Hirabayashi в 1976 году, заключается в расширении позвоночного канала путем фиксации задней дуги с одной стороны в месте соединения пластинки и фасеточного сустава и выполнении полной остеотомии на контралатеральной стороне. Этими приемами обеспечивается возможность полного смещения пластинки без удаления при этом задней части дуги позвонка. Данная техника, благодаря простоте выполнения и долгосрочным результатам, стала широко применяться в практике, была множество раз модифицирована и дополнена, что позволило Kurokawa в 1982 году предложить метод альтернативной двухстворчатой ламинопластики, при которой рассекают остистые отростки по срединной линии, формируют прорези с обеих сторон в местах соединения пластинки дуги с межпозвонковыми суставами. Хотя со временем хирурги усовершенствовали способ выполнения ламинопластики, общие принципы этой техники по-прежнему включают сохранение дорсальных элементов, сохранение сегментарного движения и расширение позвоночного канала. После проведения ламинопластики, по данным K. Tomita, из 25 больных, наблюдаемых в течение 2,9 года, у 72 % отмечены положительные результаты в отдаленном послеоперационном периоде [18]. C.C. Edwardsописал клиническую картину у 18 пациентов, наблюдаемых в течение 2-х лет, которые были прооперированы методом ламинопластики по T. Kurokawa, из них в 67 % случаев отмечено увеличение силы в верхних конечностях, у 83 % - регресс болевого синдрома, у 67 % - улучшение походки [19]. По данным отечественных авторов, в отдаленном послеоперационном периоде результаты оценивались по шкалам ВАШ, Nurick, JOA. Пациенты отмечали положительную динамику [17, 20]. Однако, по данным литературы, среди часто описываемых осложнений встречаются рестеноз, миграция надломленной дуги и аллотрансплантантов [17, 21].
Методика билатеральной костно-пластической ламинопластики является одним из вариантов хирургического лечения. Данный метод оперативного лечения как в случае с ламинэктомией позволяет полностью визуализировать нейрососудистые структуры, а также безопасно выполнить гемостаз и фораминотомию на интересующих уровнях. Всем пациентам фораминотомия производилась на уровне С4-С5 сегментов шейного отдела позвоночника. Так, по данным литературы и по клиническим наблюдениям, встречаемость пареза мышц, иннервируемых С5 корешком на уровне С4-С5, достигает 8 % [22].
По мнению авторов, данный метод ламинопластики является эффективным способом лечения протяженных стенозов в шейном отделе позвоночника [17, 20, 23].
В данной клинической работе был проведен анализ отдаленных результатов после проведения билатеральной костно-пластической ламинопластики с одномоментной фораминотомией. Оценивая результаты в отдаленном периоде от 2 до 5 лет, мы выяснили, что при данной оперативной технике достоверно регрессирует корешковый болевой синдром, уменьшаются признаки миелопатии, сохраняется увеличенный объем позвоночного канала (рис. 7, 8).
Так, болевой синдром по шкале ВАШ в раннем послеоперационном периоде уменьшился в среднем на 35 %; симптомы миелопатии по шкале Nurick - на 10 %; по шкале JOA - на 7,2 %. Об эффективности проведенной ламинопластики также свидетельствует увеличение площади поперечного сечения позвоночного канала [15, 16]. В раннем послеоперационном периоде, по данным стандартных измерительных инструментов, площадь поперечного сечения увеличилась на 50 %.
Анализ результатов нейровизуализационных исследований показал, что в позднем послеоперационном периоде у всех пациентов выявлялось несущественное увеличение линейных характеристик в сравнении с ранним периодом. Известно, что при декомпрессии спинного мозга и стабилизации шейного отдела позвоночника во всех случаях прогрессирует развитие отека спинного мозга [24]. Вероятно, это объясняет незначительное увеличение по данным нейровизуализации площади поперечного сечения позвоночного канала в катамнезе в сравнении с ранним периодом. Так, средняя площадь поперечного сечения позвоночного канала в отдаленном послеоперационном периоде увеличилась на 15,8 %.
Выраженность болевого синдрома по шкале ВАШ в отдаленном послеоперационном периоде снизилась в среднем на 25,7 %; функциональное состояние пациентов улучшилось по шкале Nurick на 38,9 %; по шкале японской ассоциации ортопедов (JOA) - на 8,8 %. В позднем послеоперационном периоде от 2 до 5 лет, по нашим данным, в сравнении с ранним периодом пациенты отмечали положительную динамику, по данным нейровизуализации отмечалось незначительное увеличение площади поперечного сечения позвоночного канала. По данным клинических шкал и нейровизуализации выявлена значительная эффективность проведенного лечения.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования убедительно свидетельствуют об эффективности данной методики. Описанная методика, способствуя благоприятным долгосрочным результатам, может быть рекомендована для пациентов с многоуровневыми стенозами, клинически проявляющимися миелорадикулопатией.
СПИСОК ИСТОЧНИКОВ
1. Motosuneya T, Maruyama T, Yamada H, Tsuzuki N, Sakai H. Long-term results of tension-band laminoplasty for cervical stenotic myelopathy: a ten-year follow-up. J Bone Joint Surg Br. 2011;93-B(1):68-72. doi: 10.1302/0301-620X.93B1.24532
2. Truumees E, Herkowitz HN. Cervical spondylotic myelopathy and radiculopathy. Instr Course Lect. 2000;49:339-60.
3. Ma L, Liu FY, Huo LS, Zhao ZQ, Sun XZ, Li F, Ding WY. Comparison of laminoplasty versus laminectomy and fusion in the treatment of multilevel cervical ossification of the posterior longitudinal ligament: A systematic review and meta-analysis. Medicine (Baltimore). 2018;97(29):e11542. doi: 10.1097/MD.0000000000011542
4. Lin X, Cai J, Qin C, Yang Q, Xiao Z. Comparison of clinical outcomes and safety between laminectomy with instrumented fusion versus laminoplasty for the treatment of multilevel cervical spondylotic myelopathy. Medicine (Baltimore). 2019;98(8):e14651. doi: 10.1097/MD.0000000000014651
5. Gibson J, Nouri A, Krueger B, Lakomkin N, Nasser R, Gimbel D, Cheng J. Degenerative Cervical Myelopathy: A Clinical Review. Yale J Biol Med. 2018;91(1):43-48.
6. Fehlings MG, Wilson JR, Kopjar B, Yoon ST, Arnold PM, Massicotte EM, и др. Efficacy and Safety of Surgical Decompression in Patients with Cervical Spondylotic Myelopathy: Results of the AOSpine North America Prospective Multi-Center Study. J Bone Joint Surg Am. 2013;95(18):1651- 1658. doi: 10.2106/JBJS.L.00589
7. Sherman BP, Lindley EM, Turner AS, Seim HB 3rd, Benedict J, Burger EL, Patel VV. Evaluation of ABM/P-15 versus autogenous bone in an ovine lumbar interbody fusion model. Eur Spine J. 2010;19(12):2156-2163. doi: 10.1007/s00586-010-1546-z
8. Blizzard DJ, Caputo AM, Sheets CZ, Klement MR, Michael KW, Isaacs RE, Brown CR. Laminoplasty versus laminectomy with fusion for the treatment of spondylotic cervical myelopathy: short-term follow-up. Eur Spine J. 2017;26(1):85-93. doi: 10.1007/s00586-016-4746-3
9. Boogaarts HD, Bartels RHMA. Prevalence of cervical spondylotic myelopathy. Eur Spine J. 2015;24(S2):139-141. doi: 10.1007/s00586-013-2781-x
10. Lauweryns P, Raskin Y. Prospective Analysis of a New Bone Graft in Lumbar Interbody Fusion: Results of a 2- Year Prospective Clinical and Radiological Study. Int J Spine Surg. 2015;9:2. doi: 10.14444/2002
11. Boogaarts HD, Bartels RHMA. Prevalence of cervical spondylotic myelopathy. Eur Spine J. 2015;24(Suppl 2):139-141. doi: 10.1007/s00586-013- 2781-x
12. Nasto LA, Muquit S, Perez-Romera AB, Mehdian H. Clinical outcome and safety study of a newly developed instrumented French-door cervical laminoplasty technique. J Orthop Traumatol. 2017;18(2):135-143. doi: 10.1007/s10195-016-0440-9
13. Roselli R, Pompucci A, Formica F, Restuccia D, Di Lazzaro V, Valeriani M, Scerrati M. Open-door laminoplasty for cervical stenotic myelopathy: surgical technique and neurophysiological monitoring. J Neurosurg. 2000;92(1 Suppl):38-43. doi: 10.3171/spi.2000.92.1.0038
14. Yoon ST, Hashimoto RE, RaichA, Shaffrey CI, Rhee JM, Riew KD. Outcomes After Laminoplasty Compared With Laminectomy and Fusion in Patients With Cervical Myelopathy: A Systematic Review. Spine (Phila Pa 1976). 2013;38:(22 Suppl 1):S183-S194. doi: 10.1097/BRS.0b013e3182a7eb7c
15. Lau D, Winkler EA, Than KD, Chou D, Mummaneni PV. Laminoplasty versus laminectomy with posterior spinal fusion for multilevel cervical spondylotic myelopathy: influence of cervical alignment on outcomes. J Neurosurg Spine. 2017;27(5):508-517. doi: 10.3171/2017.4.SPINE16831
16. Hitchon PW, Woodroffe RW, Noeller JA, Helland L, Hramakova N, Nourski KV. Anterior and Posterior Approaches for Cervical Myelopathy: Clinical and Radiographic Outcomes. Spine (Phila Pa 1976). 2019;44(9):615-623. doi: 10.1097/BRS.0000000000002912
17. Dreval’ M.D., Gushcha A.O., Arestov S.O., Korepina O.S. Surgical treatment of severe spondylogenic cervical myelopathy by laminoplasty. Zh Vopr Neirokhir im N N Burdenko. 2015;79(6):77-84. doi: 10.17116/neiro201579677-84
18. Kimura I, Shingu H, Nasu Y. Long-term follow-up of cervical spondylotic myelopathy treated by canal-expansive laminoplasty. J Bone Joint Surg Br. 1995;77-B(6):956-61.
19. Edwards CC, Heller JG, Hal Silcox D. T-Saw Laminoplasty for the Management of Cervical Spondylotic Myelopathy: Clinical and Radiographic Outcome. Spine (Phila Pa 1976). 2000;25(14):1788-1794. doi: 10.1097/00007632-200007150-00009
20. Крутько А.В., Симонович А.Е., Зайдман А.М., Гладков А.В. Декомпрессивная ламинопластика с использованием пористого никели- да титана при дегенератив-ных стенозах позвоночного канала: экспериментально-клиническое исследование. Хирургия позвоночника. 2004;(4):47-56.
21. Kurokawa R, Kim P. Cervical Laminoplasty: The History and the Future. Neurol Med Chir (Tokyo). 2015;55(7):529-539. doi: 10.2176/nmc.ra.2014- 0387
22. Ratliff JK, Cooper PR. Cervical laminoplasty: a critical review. J Neurosurg. 2003;98(3 Suppl):230-238. doi: 10.3171/spi.2003.98.3.0230
23. Суфианов А.А., Набиев Д.Н., Калинин И.В., Суфианов Р.А., Шапкин А.Г., Зайцев М.К., Черкасов А.В., Сагдиев Р.Х. Билатеральная костнопластическая декомпрессивная ламинопластика с одномоментной фораминотомией как способ лечения многоуровневого стеноза позвоночного канала в шейном отделе позвоночника. Хирургия позвоночника. 2021;18(2):54-63. doi: 10.14531/ss2021.2.54-63
24. Hellenbrand DJ, Quinn CM, Piper ZJ, Morehouse CN, Fixel JA, Hanna AS. Inflammation after spinal cord injury: a review of the critical timeline of signaling cues and cellular infiltration. J Neuroinflammation. 2021;18(1):284. doi: 10.1186/s12974-021-02337-2
Информаций об авторах:
1. Альберт Акрамович Суфианов - доктор медицинских наук, профессор, заведующий кафедрой
2. Александр Владимирович Бурцев - доктор медицинских наук, директор
3. Давид Нодарович Набиев - врач-нейрохирург высшей категории, заведующий отделением
4. Асият Шамиловна Магомедова - врач-ординатор, врач-нейрохирург
5. Ринат Альбертович Суфианов - ассистент кафедры, врач-нейрохирург,
6. Мария Темболатовна Карсанова - врач-нейрохирург
7. Владислав Владимирович Питеров - врач-нейрохирург.
Теги: шейный стеноз
234567 Начало активности (дата): 11.08.2023 08:48:00
234567 Кем создан (ID): 989
234567 Ключевые слова: шейный стеноз, миелорадикулопатия, ламинопластика
12354567899
Похожие статьи
Сакрализация позвонка LV (синдром Бертолотти): обзор литературыРентген на дому 8 495 22 555 6 8
В Склифе разработали новый стент для пациентов с дыхательной недостаточностью
Хабаровские кардиохирурги впервые в России имплантировали биопротез аортального клапана
Рак поджелудочной железы



