 16.03.2023
16.03.2023
Рак яичников / рак маточной трубы / первичный рак брюшины
В качестве факторов риска развития данной патологии рассматриваются: отсутствие беременностей, курение, избыточный вес, частое использование препаратов от бесплодия (исследования не дают четкого суждения по этому фактору риска), использование гормональной заместительной терапии, содержащей только эстрогены, в течение не менее чем 10 лет
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИКлинические рекомендации
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: С48.0, С48.1, С48.2, С56, С57
Год утверждения (частота пересмотра): 2020
Возрастная категория: Взрослые
Год окончания действия: 2022
ГО: 547
Разработчик клинической рекомендации
• • Общероссийский национальный союз «Ассоциация онкологов России»
• • Общероссийская общественная организация «Российское общество клинической онкологии»
• • Общероссийская общественная организация "Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АФП - альфа-фетопротеин
ВОЗ - Всемирная Организация Здравоохранения
ЖКТ - желудочно-кишечный тракт
ЗНО—злокачественные новообразования
КТ - компьютерная томография
МКБ-10 - Международная классификация болезней 10-го пересмотра
МРТ - магнитно-резонансная томография
ПЭТ - позитронно-эмиссионная томография
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией
РЭА - раковый эмбриональный антиген
РЯ - рак яичников
УЗИ - ультразвуковое исследование
XT - химиотерапия
ЭГДС - эзофагогастродуоденоскопия
ЭКГ - электрокардиография
BRCA - опухоль-супрессорный ген BRCA
СА19.9 - опухолевый антиген 19.9
СА125 - опухолевый антиген 125
СТСАЕ - Common Terminology Criteria for Adverse Events (шкала оценки выраженности нежелательных явлений)
ECOG - Eastern Cooperative Oncology Group (Восточная объединенная группа онкологов)
НЕ4 - человеческий эпидермальный протеин 4 PARP - поли(АДФ-рибоза)полимераза
RECIST - Response Evaluation Criteria In Solid Tumors (критерии оценки эффекта при солидных опухолях)
ROMA - Risk of Ovarian Malignancy Algorithm (индекс расчета риска наличия злокачественной опухоли яичника)
TRG -Tumor Regression Grade (шкала оценки регресса опухоли)
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Полная циторедуктивная операция - выполнение экстирпации матки с придатками, удаление большого сальника, а также всех видимых проявлений опухолевого процесса без макроскопически определяемых остаточных опухолевых масс.
Оптимальная циторедуктивная операция - выполнение экстирпации матки с придатками, удаление большого сальника, а также видимых проявлений опухолевого процесса с макроскопически определяемыми остаточными опухолевыми узлами, каждый из которых имеет диаметр не более 10 мм.
Неоптимальная циторедуктивная операция - экстирпации матки с придатками, удаление большого сальника, проявлений опухолевого процесса с макроскопически определяемыми остаточными узлами, из которых хотя бы один более 10 мм в диаметре.
Пререабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторно-курортных организаций).
1. Краткая информация
1.1. Определение заболевания или состояния (группы заболеваний или состояний1)
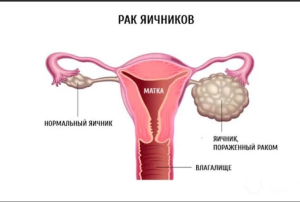
Рак яичников, маточной трубы и первичный рак брюшины - группа злокачественных опухолей, исходящая из эпителия соответствующих органов. Клиническое течение и методы лечения первичного рака брюшины и маточных труб практически аналогичны раку яичников, поэтому нозологии рассматриваются в данных рекомендациях вместе. Далее по тексту будет использоваться термин «рак яичников» (РЯ).
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний1)
У 10 % пациенток с диагнозом РЯ развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространённый синдром наследования рака молочной железы и РЯ связан с мутациями генов BRCA [1]. У большинства пациенток РЯ имеет спорадический характер. В качестве факторов риска развития данной патологии рассматриваются: отсутствие беременностей, курение, избыточный вес, частое использование препаратов от бесплодия (исследования не дают четкого суждения по этому фактору риска), использование гормональной заместительной терапии, содержащей только эстрогены, в течение не менее чем 10 лет (исследования не дают четкого суждения по этому фактору риска) [2].
1.5. Эпидемиология заболевания или состояния (группы заболеваний или состояний1)
В структуре онкологических заболеваний среди женского населения России РЯ занимает 9-е место, что соответствовало 4,2 % в 2018 году. «Грубый» показатель заболеваемости РЯ в России в 2018 году составил 18,19 на 100 тысяч женского населения, что в абсолютном выражении составило 14 318 новых случаев заболевания. Средний возраст женщин на момент установления диагноза - 59,3 года. Стандартизированный по возрасту показатель заболеваемости РЯ составил 11,14 случаев на 100 тысяч женского населения. Прирост показателя заболеваемости РЯ за предшествующие 10 лет (с 2008 года) составил 4,66 % [3].
В 2018 году в России от РЯ умерли 7616 женщин. В структуре причин онкологической смертности среди женщин РЯ в Росссии занимает 8-е место ( 5,5 %). «Грубый» показатель смертности от РЯ в России в 2018 году составил 9,48 на 100 тысяч женского населения. Стандартизированный по возрасту показатель смертности от РЯ в России в 2018 году составили 4,92 на 100 тысяч населения [3].
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний1) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Рак брюшины, рак яичников, рак маточной трубы имеют гистологически одинаковую природу. Лечение данных патологических процессов идентично, в связи с чем эти нозологии объединены в один раздел.
Злокачественное новообразование забрюшинного пространства и брюшины (С48): С48.0 - забрюшинного пространства;
С48.1 - уточненных частей брюшины;
С48.2 - брюшины неуточненной части.
Злокачественное новообразование яичника (С56).
Злокачественное новообразование других и неуточненных женских половых органов (С57):
С57.0 - фаллопиевой трубы;
С57.1 - широкой связки;
С57.2 - круглой связки;
С57.3 - параметрия;
С57.4 - придатков матки неуточненных;
С57.7 - других уточненных женских половых органов;
С57.8 - поражение женских половых органов, выходящее за пределы одной и более вышеуказанных локализаций;
С57.9 - женских половых органов неугочненной локализации.
1.5. Классификация заболевания или состояния (группы заболеваний или состоянии).
1.5.1. Международная гистологическая классификация (классификация ВОЗ, 4-е издание, 2013 г.):
• 8441/3 серозная карцинома:
• 8460/3 низкой степени злокачественности (low grade),
• 8461/3 высокой степени злокачественности (high grade);
• 8380/3 эндометриоидная карцинома;
• 8480/3 муцинозная карцинома;
• 8310/3 светлоклеточная карцинома;
• 9000/3 злокачественная опухоль Бреннера;
• 8474/3 серозно-муцинозная карцинома;
• 8020/3 недифференцированная карцинома;
• 8323/3 смешанная эпителиальная карцинома.
1.5.2. Стадирование
В настоящее время определение стадии производится на основании классификации FIGO (2014) и TNM (8-е издание, 2017) (табл. 1).
На ранних стадиях болезнь может протекать бессимптомно или с незначительными явлениями дискомфорта. При распространенном процессе заболевание манифестирует неспецифическими симптомами: увеличение живота в объеме, диспепсические явления, потеря веса, аппетита, болевой синдром в животе или области таза, одышка, общая слабость.
2. Диагностика
Критерии установления диагноза заболевания или состояния:
1. данные анамнеза;
2. данные физикального обследования;
3. данные методов лучевой диагностики;
4. морфологическая верификация.
Морфологическая верификация новообразования является обязательной для установления клинического диагноза. При невозможности выполнения морфологической верификации новообразования следует подтвердить диагноз с помощью цитологического исследования. Выпот в плевральных полостях рекомендовано верифицировать с помощью трансторакальной пункции с последующим цитологическим исследованием полученного материала.
2.1. Жалобы и анамнез
• Всем пациенткам рекомендуется тщательный сбор жалоб и анамнеза. На ранних стадиях РЯ может протекать бессимптомно или с незначительными явлениями дискомфорта. При распространенном процессе заболевание манифестирует неспецифическими симптомами: увеличение живота в объеме, диспепсические явления, потеря веса, аппетита, болевой синдром в животе или области таза, одышка, общая слабость[1,4].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).Комментарий: сбор информации о жалобах и деталях анамнеза, в том числе семейного анамнеза, проводится с целью выявления факторов, которые могут повлиять на выбор тактики лечения.
2.2. Физикальное обследование
• Рекомендуется тщательный физикальное обследование. Физикальное обследование включает в себя ректо-вагинальное исследование, пальпацию органов брюшной полости и всех групп периферических лимфатических узлов, аускультацию и перкуссию легких, пальпацию молочных желез [4, 5].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: особого внимания требуют оценка состояния тяжести пациента по версии ВОЗ/ECOG и/или шкале Карновского (см.Приложение Г1-2), оценка алиментарного статуса, болевого синдрома, температуры тела, гемодинамики, увеличения периферических лимфоузлов, наличие плеврита и асцита.
2.5. Лабораторные диагностические исследования.
• Рекомендуется выполнять общий (клинический) анализ крови развернутый, анализ крови биохимический общетерапевтический с оценкой показателей функции печени, почек, общий (клинический) анализ мочи, исследование свертывающей системы крови всем пациенткам с РЯ в целях оценки состояния пациента, определения тактики и алгоритма лечения пациента, оценки прогноза заболевания [5, 86-92].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарии: Клинический анализ крови выполняется (повторяется) не менее чем за 5 дней до начала очередного курса XT. [5, 86-92].В общем (клиническом) анализе крови развернутом целесообразна оценка следующих параметов - гемоглобин, гематокрит, эритроциты, средний объем эритроцитов,распределение эритроцитов но величине, среднее содержание гемоглобина в эритроцитах, средняя концентрация гемоглобина в эритроцитах, тромбоциты лейкоциты, лейкоцитарная формула, скорость оседания эритроцитов; в анализе крови биохимическом общетерапевтическом с оценкой показателей функции печени, ночек - общий белок, глюкоза, билирубин, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), асиаргпагпаминотрансфераза (ACT), билирубин общий, лактатаминотрансфераза (ЛДГ), щелочная фосфатаза (ЩФ), электролиты плазмы (калий, натрий, хлор), общем (клиническом) анализе мочи - определение цвета, прозрачности мочи, ее удельного веса, белка в моче, pH, глюкозы, кетоновых тел, уробилиногена, лейкоцитарной эстеразы, путем аппаратной микроскопии-клеток эпителия, эритроцитов, цилиндров, соли, слизи, бактерий и грибов.
В рамках исследования свертывающей системы крови оценивается коагулограмма (ориентировочное исследование системы гемостаза) (фибриноген, протромбин (по Квику), МНО, протромбиновое время, протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время), по показаниям, дополнительно— антитромбин III, Д-димер, плазминоген, % активности).
• Рекомендуется выполнить всем пациентам исследование уровня антигена аденогенных раков СА 125 в крови в целях выявления РЯ и его рецидивов [5, 93-94].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
• При отсутствии морфологической верификации диагноза рекомендуется рекомендуется всем пациентам с подозрением на РЯ определение секреторного белка эпидидимиса человека 4 (НЕ4) в крови и определение индекса ROMA в целях оценки вероятности РЯ [6,124,125].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
Комментарий: определение НЕ4 в крови и индекса ROMA не заменяет необходимость морфологической верификации диагноза, однако повышенный уровеньНЕ4 увеличивает специфичность диагностики РЯ.
• При подозрении на муцинозную карциному рекомендуется, помимо исследования уровня антигена аденогенных раков СА 125 в крови, исследование уровня антигена аденогенных раков СА 19-9 в крови и исследование уровня ракового эмбрионального антигена в крови (РЭА) в сыворотке крови в целях дифференциальной диагностики [7].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2)
Комментарий: РЭА и СА19-9 могут повышаться при муцинозном РЯ, что позволяет в последующем контролировать эффективность проводимого лечения.
• Для женщин до 40 лет, у которых вероятность неэпителиальных опухолей высока, рекомендуется на диагностическом этапе выполнять исследование уровня альфа-фетопротеина в сыворотке крови (АФП), исследование уровня хорионического гонадотропина в крови, исследование уровня ингибина В в крови [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: неэпителиальные опухоли яичников преобладают в молодом возрасте (подробная информация представлена в разделе неэпителиальные опухоли яичников)
• Всем пациенткам с серозными и эндометриоидными карциномами высокой степени злокачественности рекомендовано молекулярно-генетическое исследование мутаций в генах BRCA1 и BRCA2 в крови или взятием соскоба слизистой ротовой полости и/или в биопсийном (операционном) материале, как предикторов исхода заболевания и выбора алгоритма лечения пациента [1, 9, 95].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: частота мутаций генов BRCA1 и BRCA 2 при указанных гистологических типах опухоли составляет около 15 %. Информация о наличии мутации BRCA полезна с целью определения более высокой чувствительности опухоли к терапии алкилирующими препаратами, производными платины и PARP-ингибиторами.
2.4. Инструментальные диагностические исследования.
• Всем пациентам с РЯ или подозрением на РЯ рекомендуется выполнить эзофагогастродуоденоскопию (ЭЕДС) в целях исключения первичной опухоли желудочно-кишечного тракта (ЖКТ) и оценки наличия сопутствующих заболеваний ЖКТ [10].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: ЭЕДС - обязательный метод исследования пациентов с подозрением на РЯ, позволяющий исключить вторичное (метастатическое) поражение яичников при злокачественных новообразованиях (ЗНО) ЖКТ.
• Всем пациентам с РЯ или подозрением на РЯ рекомендуется выполнить колоноскопию в целях дифференциальной диагностики с ЗНО ЖКТ и оценки наличия сопутствующих заболеваний ЖКТ [10,126].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 1)
Комментарий: Колоноскопия - обязательный метод исследования пациентов с подозрением на РЯ, позволяющий исключить вторичное (метастатическое) поражение яичников при злокачественных новообразованиях (ЗНО) ЖКТ.
• Всем пациентам с РЯ или подозрением на РЯ на диагностическом этапе рекомендуется выполнить компьютерную томографию (КТ) органов грудной клетки, брюшной полости и забрюшинного пространства, почек, с внутривенным контрастированием или без него в целях определения распространенности опухолевого процесса и планирования алгоритма лечения [9, 96-97].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: КТ позволяет (а) визуализировать первичную опухоль, (б) выявить метастазы заболевания, (в) оценить возможность выполнения оптимальной циторедуктивной операции. При противопоказаниях к КТ исследованию или его недостаточной информативности возможно выполнение МРТ с в/в контрастированием. При подозрении на отдаленное метастазирование возможно выполнение ПЭТ/КТ.
• Всем пациентам с РЯ или подозрением на РЯ на диагностическом этапе рекомендуется выполнить магнитно-резонансную томографию (МРТ) органов малого таза с внутривенным контрастированием или без него в целях определения распространенности опухолевого процесса и планирования алгоритма лечения [9,96-97].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: МРТ позволяет (а) визуализировать первичную опухоль, (б) выявить метастазы заболевания, (в) оценить возможность выполнения оптимальной
циторедуктивной операции. При противопоказаниях к МРТ исследованию или его недостаточной информативности, а также при отсутствии возможности выполнить МРТ, показано КТ с в/в контрастированием или без него. При подозрении на отдаленное метастазирование возможно выполнение ПЭТ/КТ. [9,96-97]• Всем пациентам с РЯ или подозрением на РЯ на диагностическом этапе при отсутсвии возможности выполнения КТ органов грудной клетки рекомендуется выполнить рентгенографию органов грудной клетки [9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: КТ органов грудной клетки с большей чувствительностью и специфичностью способно выявить метастазы в легких, а также в лимфоузлах средостения.
• Всем пациентам с РЯ или подозрением на РЯ на диагностическом этапе рекомендуется выполнить ультразвуковое исследование (УЗИ) лимфоузлов шейнонадключичной области, подмышечных, паховых лимфоузлов, УЗИ брюшной полости, забрюшинного пространства и малого таза при невозможности выполнить КТ/МРТ/ПЭТ-КТ в целях определения распространенности опухолевого процесса и планирования алгоритма лечения [10,98].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: УЗИ - наиболее простой метод визуализации образований в брюшной полости, в полости малого таза, вторичного поражения лимфоузлов. Однако этот метод существенно уступает КТ/МРТ/ПЭТ-КТ в отношении принятия решения о первом этапе лечения. Оценка эффекта химиотерапии по критериям RECIST 1.1 также невозможна по результатамУЗИ.
• Всем пациенткам с РЯ или подозрением на РЯ на диагностическом этапе рекомендовано обследование молочных желез) с целью исключения вторичного (метастатического) поражения яичников или первично-множественных ЗНО [11, 99-101].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
Комментарии: Женщинам моложе 40 лет проводится УЗИ молочных желез в первую фазу менструального цикла при его наличии, женщинам старше 40 лет рекомендуется выполнить маммографию в первую фазу менструального цикла при его наличии, консультация врача-маммолога проводится при необходимости по результатам проведенных исследований. Обследование молочных желез проводится в соотвествии с принципами, изложенными в клинических рекомендациях по злокачественным новообразованиям молочных желез.
• Пациентам с РЯ для уточнения распространенности процесса, морфологической верификации диагноза и оценки резектабельности рекомендована диагностическая лапароскопия, а также в тех случаях, когда выполнение оптимальной циторедукции сомнительно для стадирования или если оно не было адекватно выполнено при предшествующей циторедукции, а также для морфологической верификации диагноза, если менее инвазивные способы не эффективны. [9,127].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
2.5. Иные диагностические исследования.
• Настоятельно рекомендуется морфологическая верификация диагноза у всех пациенток с подозрением на РЯ до начала лечения. Забор материала для иссследования может быть осуществлен в ходе диагностической лапароскопии или во время лапаротомии со срочным интраоперационным паталого-анатомическим исследованием биопсийного (операционного) материала [9]. Цитологическое исследование также является основанием для установления диагноза и начала XT и может быть осуществлено при наличии асцита в ходе пункции передней брюшной стенки или пункции через задний свод влагалища.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: хирургическое вмешательство в ряде случаев может быть выполнено без морфологической верификации; назначение консервативного лечения требует морфологической верификации диагноза, но при невозможности его выполнения следует подтвердить диагноз с помощью цитологического исследования. Выпот в плевральных полостях необходимо верифицировать с помощью трансторакальной пункции с последующим цитологическим исследованием полученного материала.
• Рекомендуется проводить патолого-анатомическое исследование операционного (биопийного) материала до начала лечения с отражением в заключении следующих параметров [8, 9,12,13]:
1. размеры опухоли, повреждение капсулы или распространение опухоли на капсулу;
2. гистологическое строение опухоли;
3. степень злокачественности опухоли;
4. наличие злокачественных клеток в каждом отдельно взятом биоптате брюшины, а также большом сальнике;
5. указание общего числа исследованных и поражённых лимфоузлов;
6. степень лечебного патоморфоза в случае предоперационной терапии.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: -при сомнительных или отрицательных результатах биопсии новообразования по результатам паталого-анатомического исследования пациенткам с подозрением на РЯ показано проведение хирургического вмешательства со срочным интраоперационным паталого-анатомическим исследованием биопсийного (операционного) материала;
- при необходимости морфологической верификации диагноза РЯ паталого-анатомическое исследование биопсийного (операционного) материала может дополняться иммуногистохимическим типированием.
7. - степень лечебного патоморфоза в случае предоперационной терапии оценивается в соответствии с международными рекомендациями по шкале оценки регресса опухоли TRG (Tumor Regression Grade) [152,153]: TRG 0 - полный ответ, TGR 1 - почти полный ответ, TGR 2 - частичный ответ, TGR 3 - плохой ответ, нет ответа на лечение.(см.приложение ГЗ.)
• Рекомендуется всем пациенткам с РЯ цитологическое исследование аспиратов/ пунктатов/смывов с брюшины, экссудата плевральных или брюшной полостей с целью уточнения стадии заболевания [12,13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется цитологическое исследование мазков с шейки матки и цервикального канала, забор аспирата из полости матки на диагностическом этапе всем пациенткам с РЯ и подозрением на РЯ [2,4].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3. Лечение
Назначение и применение лекарственных препаратов, указанных в клинических рекомендаций, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощи, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
• При распространенности опухоли и состоянии пациентки, позволяющих выполнить оптимальную циторедуктивную операцию на первом этапе, рекомендуется проведение хирургического вмешательства в объеме полной или оптимальной циторедукции [1, 102-104].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарий: определение полной и оптимальной циторедукции см. в разделе «Термины и определения».
3.1, Хирургическое лечение I-II сталий рака яичников
• При I—II стадиях заболевания при ревизии органов брюшной полости настоятельно рекомендуется выполнить все процедуры хирургического стадирования [12,13,105-107].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2)
Комментарий: для хирургического стадирования РЯ выполняют следующие манипуляции:
1. Срединная лапаротомия для полноценной ревизии органов брюшной полости и малого таза и обеспечения адекватного доступа к большому сальнику. Лапароскопическая хирургия при ранних стадиях (I стадия) с целью стадирования может быть использована в крупных онкологических центрах при наличии подготовленных специалистов и соответствующего уровня технической оснащенности [5].
2. Если морфологической верификации диагноза нет, лапаротомию следует проводить со срочным интраоперационным паталого-анатомическим исследованием биопсийного (операционного) материала.
3. Если обнаружен асцит, жидкость аспирируют для цитологического исследования. При отсутствии асцита выполняют цитологическое исследование смывов с брюшины (в том числе с ее диафрагмальной поверхности, латеральных каналов и малого таза).
4. Все отделы брюшной полости, малого таза, включая поддиафрагмальное пространство, большой и малый сальник, тонкую и толстую кишку и их брыжейки, поверхность париетальной и висцеральной брюшины, забрюшинное пространство, тщательно и методично осматривают, все участки брюшины и спайки, подозрительные в отношении метастазов, подвергают биопсии. Вся поверхность брюшины должна быть осмотрена. Спаечный процесс, препятствующий ревизии, должен быть отмечен.
5. Если проведенная ревизия не подтвердила наличие метастазов, выполняют биопсию случайно выбранных участков брюшины стенок малого таза, прямокишечно-маточного углубления, мочевого пузыря, латеральных каналов, а также правого и левого куполов диафрагмы (может быть выполнен соскоб с поверхностей диафрагмы).
6. Удаление большого сальника является обязательным и выполняется на уровне большой кривизны желудка при распространенном РЯ.
7. Тотальная тазовая и поясничная лимфаденэктомия до уровня почечных сосудов обязательна при I стадии РЯ (кроме муцинозной аденокарциномы) для решения вопроса о необходимости адъювантной химиотерапии, во всех остальных случаях решается индивидуально.
8. Удаление аппендикса целесообразно в случае подозрения на его поражение.
Органосохраняющее хирургическое вмешательство (односторонняя аднексэктомия с резекцией второго яичника, оментэктомия, тазовая и поясничная лимфаденэктомия и выполнение процедур стадирования) в виде исключения возможно у молодых больных, желающих сохранить фертильность, при серозной карциноме низкой степени злокачественности, эндометриоидной или муцинозной карциноме IA и IC1 стадий при наличии возможности тщательного диспансерного наблюдения и доказанном отсутствии наследственного характера заболевания. При эндометриоидном гистологическом варианте
опухоли следует выполнить биопсию эндометрия для исключения синхронного рака эндометрия.Малоинвазивные хирургические вмешательства, в частности лапароскопические, могут быть использованы только для морфологической верификации диагноза, определения стадии или для прогнозирования объема циторедуктивной операции.
При невыполнении процедур стадирования при подозрении на ранние стадии (I-II) заболевания во время первой операции целесообразно выполнение повторного хирургического вмешательства с целью рестадирования [15-17].
3.2. Хирургическое лечение III-IV стадий рака яичников
• При распространенности опухоли и состоянии пациентки, позволяющих выполнить оптимальную циторедуктивную операцию на первом этапе, рекомендуется проведение хирургического вмешательства в объеме полной или оптимальной циторедукции, т.е. удаление всех видимых проявлений болезни [1,108].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: определение полной и оптимальной циторедукции см. в разделе «Термины и определения».
• При невозможности выполнения оптимальной циторедуктивной операции на первом этапе рекомендуется начинать лечение с химиотерапии (XT) [14,109-110].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарий: к пациенткам, которым показана предоперационная XT, могут относиться пациентки с тяжелым соматическим статусом, а также пациентки с крайне выраженной распространенностью опухолевого процесса, делающей невозможным выполнение оптимальной циторедукции. Эти пациентки нуждаются в промежуточной циторедуктивной операции в максимально короткие сроки (после 2-3 курсов индукционной XT). После операции пациенткам проводится дополнительно 3-4 курса XT по той же схеме.
Этапы выполнения хирургического лечения и процедуры стадирования указаны в пункте
3.1. Выполнение лимфаденэктомии при III—IV стадии РЯ рекомендуется при полной циторедукции при увеличенных, подозрительных на метастатическое поражение лимфоузлах по данным предоперационного обследования или интраоперационной ревизии [36,111].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарий: удалению подлежат внутренние, наружные, общие подвздошные, запирательные, преаортальные, парааортальные, аортокавальные, прекавальные и паракавальные лимфоузлы до уровня почечных сосудов.
3.5. Аттъювантная и первая линия химиотерапии.
Степень лечебного патоморфоза но результатам паталого-анатомического исследования операционного (биопсийного) материала после предоперационной XT не является основанием для смены линии XT.[116]
• Рекомендуется отказаться от проведения адьювантной XT при соблюдении всех следующих условий: 1 2 3 4
2. карцинома низкой степени злокачественности (low grade);
3. несветлоклеточный гистологический тип опухоли;
4. полностью выполнены процедуры хирургического стадирования [15-17,112].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств -1).
• Пациенткам с IA, IB стадиями с карциномами высокой степени злокачественности или светлоклеточным гистологическим типом, а также тем, кому не выполнены процедуры хирургического стадирования, рекомендуется провести 4-6 курсов платиносодержащей XT (табл. 2) [15-17,113].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств -1).
Комментарий: Адъювантная XT целесообразна в срок не позднее 60 дней от момента хирургического вмешательства пациенткам с РЯ. До 8-10 % пациенток могут испытывать реакции гиперчувствительности в процессе терапии платиновыми агентами. Использование протоколов десенсибилизации может улучшать выживаемость пациенток. В настоящее время отсутствуют данные, демонстрирующие преимущество какого-либо конкретного протокола перед другими возможными схемами десенсибилизации.
При лечении пациенток с анамнезом аллергических реакций (реакций гиперчувствительности) на платиновые агенты рекомендуется оценить возможность продолжения терапии платиновыми препаратами:
1. Оценить выраженность аллергической реакции. В случае развития аллергической реакции степени 1-3 по шкале СТСАЕ следует рассмотреть возможность продолжения терапии с использованием десенсибилизирующей схемы введения препарата. В случае развития аллергической реакции 4 степени (жизнеугрожающая реакция гиперчувствительности)
по международной шкале оценки выраженности нежелательных явлений (СТСАЕ, Common Terminology Criteria for Adverse Events) препарат, вызвавший её развитие, должен быть отменен и не назначаться в последующем до консультации специалиста, имеющего опыт в проведении десенсибилизирующей терапии (врач-аллерголог или врач-онколог (химиотерапевт)).2. При выборе протокола десенсибилизации следует руководствоваться данными специальной литературы. Протокол десенсибилизации должен включать дробное введение препарата, вызвавшего аллергическую реакцию и профилактическое применение препаратов, снижающих риск гиперчувствительности (блокаторы Н1-гистаминовых рецепторов, глюкокортикоиды). При лечении пациенток с реакциями гиперчувствительности обязательно следование выбранному протоколу десенсибилизации при проведении каждого последующего курса лечения.
3. Перед проведением терапии с использованием десенсибилизирующей схемы следует убедиться, что персонал медицинской организации знаком с симптомами аллергических реакций, порядком действий в случае их возникновения. Должен быть обеспечен быстрый доступ к необходимым препаратам (блокаторы Н1-гистаминовых рецепторов, глюкортикоиды, эпинефрин) и/или к реанимационной службе.
4. В случае, если было отмечено повторное развитие реакций гиперчувствительности, несмотря на следование протоколу десенсибилизации, дальнейшие решения по тактике лечения следует принимать индивидуально, с учетом соотношения риска и пользы от продолжения терапии, а также выраженности реакции гиперчувствительности;
5. В некоторых случаях может быть целесообразной замена платинового агента, вызвавшего реакцию гиперчувствительности, на другой препарат того же класса (например, цисплатина** на карбоплатин** или оксалиплатин**).
При замене препарата следует учитывать спектр его токсичности и эффективности в составе используемого режима лечения.
• Внутрибрюшинная XT рекомендована при II-IV стадии в случае выполнения первичной циторедуктивной операции с максимальным размером остаточных опухолевых узлов не более 1 см итребует предварительной имплантации внутрибрюшинного порта.[15-17,113]
• Уровень убедительности рекомендаций - А (уровень достоверности доказательств -1).
• Рекомендовано добавление к химиотерапии бевацизумаба** при наличии после циторедуктивной операции остаточных опухолевых узлов более 1 см (или если циторедуктивная операция не выполнена и не планируется в ближайшем будущем) или при IV стадии [18]. Бевацизумаб• ** используется в дозе #7,5 мг/кг в/в (вне показаний в данной дозе) или 15 мг/кг в/в с интервалом в 3 недели в течение суммарно 18-22 курсов (или до прогрессирования, если оно наступит раньше), начиная с первого или второго курса ХТ[ 114]
• Уровень убедительности рекомендаций - А (уровень достоверности доказательств -1)
• Для пациенток III-IV стадией заболевания, с высокой степенью злокачественности и с мутациями в генах BRCA, ответивших (полный или частичный ответ) на платиносодержащую XT первой линии рекомендовано проведение поддерживающей терапии #олапарибом (таблетки)** в дозировке 300 мг (две таблетки по 150 мг) 2 раза в сутки, в течение двух лет или до прогрессирования заболевания. В случае полного ответа (отсутствие радиологических признаков заболевания) терапия должна быть прекращена через 2 года после начала лечения. [5,121]
• Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Всем пациенткам с РЯ, начиная с 1C стадии, при отсутствии противопоказаний рекомендована лечебная платиносодержащая XT в количестве 6 курсов (см. табл. 2) [12].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1а).
• В случае серозного РЯ низкой степени злокачественности после окончания XT рекомендуется поддерживающая эндокринная терапия [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 3).
Комментарий: в качестве препаратов рекомендованы ароматазы ингибиторы [132] или #тамоксифен** (20 мг 2 раза в день, 28-дневный цикл) [132] до прогрессирования или в течение трех лет. Необходимость иммуногистохимического типирования для определения экспрессии рецепторов эстрогенов и прогестерона при выполнении паталого-анатомического исследования операционного (биопсийного) материала с целью определения чувствительности к эндокринной терапии не доказана и является опциональной.
• Рекомендовано прекратить лечение после проведения шести (максимум восьми) курсов XT и перейти к проведению динамического наблюдения до признаков прогрессирования заболевания. [115].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств -1).
Комментарий: в случае прогрессирования опухолевого процесса на фоне XT первой линии (платинорефрактерный рак) возможна попытка назначения монохимиотерапии одним из неплатиновых препаратов (табл. 3). Во всех других случаях, в том числе при неполном эффекте проведенного лечения и наличии остаточной опухоли, рекомендуется динамическое наблюдение до прогрессирования. Поддерживающая терапия, за исключением бевацизумаба и эндокринной терапии, является неэффективной. Операция «second-look» также не рекомендуется.
3.4. Лечение репиливов рака яичников
Прогрессированием РЯ считается наличие любого из следующих критериев [20]: (а) клинически или радиологически подтвержденное прогрессирование; (б) рост СА125 в два раза выше верхней границы нормы (если ранее он находился в пределах нормы) или рост СА125 в два раза выше своего наименьшего значения, зарегистрированного во время проводимого лечения (если во время лечения нормализации СА125 не зафиксировано), подтвержденный повторным анализом с интервалом не менее 1 недели.[117]
Критерии прогрессирования РЯ НЕ являются абсолютным показанием для начала новой линии XT, а служат для оценки эффективности предыдущего лечения, например, для оценки длительности бесплатинового интервала.
Показаниями к XT второй и последующих линий являются рост очагов и наличие жалоб со стороны пациентки, связанных с прогрессированием опухолевого процесса [23].
• XT, и/или таргетную терапию, и/или гормонотерапию рекомендуется начинать у
пациенток с рецидивом РЯ при наличии показаний и отсуствии медицинских противопоказаний не позднее 60 дней от момента выявления клинических симптомов прогрессирования заболевания. [12,20]Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется рассматривать хирургическое лечение рецидивов РЯ как одну из опций лечения при соблюдении следующих условий:
1. длительность бесплатинового интервала более 6 месяцев;
2. наличие одной или нескольких рецидивных опухолей, в отсутствие канцероматоза и асцита;
3. общее состояние по шкале оценки тяжести состояния пациента по версии ВОЗ/ECOG -О баллов и по шкале Карновского - 80-100 баллов. (см.Приложение Г1-Г2). [21, 22,133].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарий: отдельные пациентки с рецидивами РЯ могут рассматриваться как кандидаты для повторных циторедуктивных вмешательств. Повторная циторедукция целесообразна только в том случае, если может быть выполнена без макроскопически определяемой остаточной опухоли. Хирургическое вмешательство следует планировать до начала XT по поводу рецидива.
• Рекомендуется основывать выбор XT рецидивов РЯ, в первую очередь, на длительности бесплатинового интервала, который рассчитывается от даты последнего введения производного платины до даты прогрессирования [12, 20].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: в таблице 3 суммированы рекомендуемые для лечения рецидивов РЯ режимы XT.
• При рецидиве заболевания с длительностью бесплатинового интервала от 6 месяцев до 24 месяцев рекомендуется назначение комбинации производного платины (цисплатина• ** или карбоплатина**) в сочетании с другим противоопухолевым препаратом, ранее не использованным для лечения данной пациентки (см. табл. 3) [24-26].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2а).
• Рекомендовано при длительности бесплатинового интервала более 24 месяцев рассмотреть возможность повторного назначения комбинации производного платины и таксанов для лечения рецидива РЯ [26, 27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Для пациенток с платиночувствительным рецидивом РЯ высокой степени злокачественности, ответивших (полный или частичный ответ) на платиносодержащую XT рекомендовано проведение поддерживающая монотерапии # олапарибом (таблетки)** в дозировке 300 мг ( по 150 мг 2 раза в сутки), до прогрессирования заболевания или #олапариб** в капсулах 400 мг (8 капсул) (по 200 мг 2 раза в сутки), что соответствует суточной дозе 800 мг [122, 8,9]
• Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 3).
• При рецидиве с длительностью бесплатинового интервала менее 6 месяцев, если не было прогрессирования в период проведения платиносодержащей XT, рекомендуется бесплатиновая монохимиотерапия и повторное назначение платиносодержащей XT в качестве возможной опции в будущем (см. табл. 3) [24, 25].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 3).
Комментарий: при длительности бесплатинового интервала менее 6 месяцев и при невыраженных симптомах онкологического процесса рекомендуется бесплатиновая монохимиотерапия. При прогрессировании опухоли в дальнейшем повторное применение платиносодержащей XT является предпочтительным, если ранее не было зарегистрировано прогрессирования опухоли во время XT производными платины. При выраженных симптомах, связанных с прогрессированием опухолевого процесса или при наличии мутации в генах BRCA1/2 целесообразно сразу возобновить платиносодержащую XT, если ранее не было зарегистрировано прогрессирования опухоли во время XT производными платины
В случае неэффективности двух подряд режимов XT дальнейшее ее проведение сомнительно ввиду прогнозируемой низкой эффективности. Рекомендуются либо симптоматическая терапия, либо включение в клинические исследования [28].
• При использовании в качестве XT первой линии бестаксановой комбинации рекомендуется включение таксанов в качестве XT второй линии [27].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендуется добавление PARP-ингибитора олапариба в рамках поддерживающей терапии у пациенток с патогенной или соматической мутациями генов BRCA1/2 при соблюдении всех следующих условий: 1) серозная карцинома высокой степени злокачественности; 2) объективный ответ после последней платиносодержащей XT, назначенной по поводу платиночувствительного рецидива [33,118].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: прием #олапариба** (капсулы) в суточной дозе 400 мг (200 мг 2 раза в сутки) [122, 8,9] должен быть начат в течение 8 недель после окончания платиносодержащей XT и продолжен до прогрессирования заболевания или непереносимой токсичности. Одновременное применение #олапариба** и бевацизумаба** не рекомендуется [122, 8,9].
• В отдельных клинических ситуациях у больных с рецидивами заболевания рекомендовано рассмотреть возможность применения лучевой терапи по индивидуальным показаниям с паллиативной целью [34,119].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: некоторые несерозные гистологические типы опухоли, например светлоклеточный, муцинозный или эндометриоидный, во многих случаях локализованы в тазу, а метастазирование может быть ограничено регионарными лимфатическими узлами. В условиях резистентности несерозных гистотипов к лекарственной терапии возможно применение лучевой терапии на рецидивные очаги и метастазы,.
3.5 Обезболивание
Порядок и рекомендации по обезболиванию при РЯ соответствуют рекомендациям, представленным в рубрикаторе «Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи»
• К настоящему моменту имеются данные о повышенном риске развития онкологических заболеваний у пациенток с избыточной массой тела (ожирением), в этой связи
рекомендованы мероприятия, направленные на снижение избыточного веса пациенток до нормальных значений. Коррекция привычного рациона питания у таких пациенток будет способствовать профилактике осложнений проводимого лечения (хирургического, лекарственного или лучевого). [2]Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
4. Реабилитация
4.1. ТТререабилитапия
Проведение пререабилитации значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания. Пререабилитация включает в себя физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование больных [40].
Физическая пререабилитация состоит из комбинации аэробной и анаэробной нагрузки. Подобная комбинация улучшает толерантность к физическим нагрузкам, улучшает качество жизни и увеличивает тонус мышц.
Увеличение физической активности за 2 недели до операции улучшает качество жизни в послеоперационном периоде, позволяя вернуться к полноценной повседневной активности уже через 3 недели после операции [41].
Повышенный уровень физической активности значительно улучшает качество жизни и выживаемость пациенток с РЯ [55].
• Рекомендуется проведение ЛФК на предоперационном этапе с целью уменьшения частоты и вероятности развития послеоперационных осложнений [42].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
• Рекомендуется тренировка дыхательных мышц пациентам в ходе пререабилитации в целях снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [43].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется психологическая поддержка пациентов в рамках пререабилитации, так как она улучшает настроение, снижает уровень тревоги и депрессии у пациентов. Пациентки, прошедшие курс психологической пререабилитации, лучше адаптируются к повседневной жизни после хирургического лечения [42].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 3).
• Рекомендуется в психологической пререабилитации и поддержки пациенток использовать методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя), в течение 40-60 минут 6 дней в неделю, которая начинается за 5 дней до операции и продолжается 30 дней после, что значительно улучшает качество жизни пациенток [44].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
4.2.1 этап реабилитации при хирургическом лечении
• В целях уменьшения длительноси пребывания пациенток в стационаре и частоты послеоперационных осложнений рекомендуется проводить реабилитацию пациентов при хирургическом лечении по программе fast track rehabilitation («быстрый путь») и ERAS («early rehabilitation after surgery» - «ранняя реабилитация после операции»), включающую в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1-2 суток после операции не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций [45,46].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется в рамках ранней реабилитации пациенток раннее начало выполнения комплекса ЛФК с включением в программу аэробной, силовой нагрузок и упражнений на растяжку в целях повышения физической выносливости пациентов. Раннее начало ЛФК не увеличивает частоту послеоперационных осложнений, улучшая качество жизни [47].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендуется применение побудительной спирометрии, подъем головного конца кровати более чем на 30 градусов, раннее начало дыхательной гимнастики, гигиена полости рта 2 раза в день и ранняя активизация пациенток в целях профилактики застойных явлений в легких и послеоперационной пневмонии в послеоперационном периоде [48].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется профилактика венозной тромбоэмболии (ранняя активизация, назначение антикоагулянтов с профилактической целью и ношение компрессионного трикотажа) у всех пациенток в послеоперационном периоде - более чем у 75% пациенток она выявляется более чем через 7 дней после операции, кроме того пациентки с РЯ, длительной госпитализацией и наличием венозной тромбоэмболии в анамнезе имеют повышенный риск ее развития. [49].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 3).
• Рекомендуется купирование болевого синдрома в послеоперационном периоде осуществлять с использованием междисциплинарного подхода, а также помимо медикаментозной коррекции использовать следующие методы - физическую реабилитацию (ЛФК), лечение положением, психологические методы коррекции боли (релаксация), чрескожную электростимуляцию, аккупунктуру [50].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомедуется проведение сеансов массажа медицинского, начиная со 2-х суток после операции в целях уменьшения интенсивности болевого синдрома, беспокойства, напряжения, улучшения качества жизни пациентки [51].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендовано проведение психологической коррекции и методик релаксации в послеоперационном периоде, что позволяет снизить тревожность, напряжения пациентов, кратность обезболивания и улучшить качество жизни онкогинекологических пациентов [52].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
4.5. II этап реабилитации при хирургическом лечении
• Рекомендуется активный образ жизни пациенток после завершения лечения - ожирение и малоподвижный образ жизни после комплексного лечения РЯ являются самостоятельными факторами, ухудшающими качество жизни пациенток, приводя к дистрессу [53].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Всем пациенткам рекомендуется физическая активность - сочетание силовых нагрузок, аэробных, упражнений на растяжку, что значительно улучшает качество жизни пациенток, позволяет контролировать вес [54].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется при возникновении лимфедемы нижних конечностей у пациентки проводить полную противоотечную терапию, включающую в себя мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [56, 57].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Рекомендуется при возникновении лимфедемы нижних конечностей у пациентки также назначить:
• перемежающую пневмокомпрессию конечностей в сочетании с полной противоотечной терапией [57]. Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5);
• низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией [58]. Уровень убедительности рекомендаций - 5 (уровень достоверности доказательств - С);
• электротерапию в сочетании с полной противоотечной терапией [59]. Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2);
• низкочастотную магнитотерапию в сочетании с полной противоотечной терапией [60]. Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5);
• глубокую осцилляцию (массаж переменным электрическим полем) в сочетании с полной противоотечной терапией [61]. Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Всем пациенткам рекомендованы сеансы аккупунктуры, так как она значительно уменьшает слабость и улучшает качество жизни [62].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
4.4. III этап реабилитации при хирургическом лечении
Функциональные нарушения органов малого таза в значительной степени затрудняют социальную адаптацию пациенток с опухолями женской репродуктивной системы, приводя их к физической и психологической инвалидизации [67].
Здоровый образ жизни, ежедневная физическая нагрузка позволяет контролировать такие клинические проявления менопаузы, как депрессия, слабость, а также проводить профилактику сердечно-сосудистых осложнений и осложнений, связанных с остеопорозом, у пациенток после комбинированного лечения злокачественных новообразований [63, 64]. Повышение уровня физической активности положительно влияет на сексуальную функцию у пациенток с гинекологическим раком [66].
• Рекомендованы психологическая поддержка и информирование пациенток - они позволяют улучшить качество жизни на фоне менопаузы у пациенток с гинекологическим раком [64].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендовано проведение периодических курсов медицинского массажа, так как они значительно улучшают качество жизни у онкогинекологических пациенток, уменьшая слабость, депрессию, клинические проявления менопаузы [120].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
4.5. Реабилитация при химиотерапии
• Рекомендовано всем пациенткам ежедневное выполнение комплекса ЛФК в процессе комбинированного лечения и после его окончания - ежедневная физическая активность увеличивает мышечную силу, улучшает работу сердечно- сосудистой системы, уменьшает опасность развития тревоги и депрессии, уменьшает слабость, тошноту, рвоту, болевой синдром, улучшает настроение [69, 70].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
Комментарии: Дозированная, постепенно нарастающая физическая нагрузка улучшает переносимость химиотерапии у пациенток с онкогинекоогическими заболеваниями [70].
• Рекомендовано пациенткам с анемией применение аэробной нагрузки на фоне высокодозной химиотерапии, так как аэробная нагрузка положительно влияет на уровень гемоглобина и эритроцитов и снижает длительность лейко- и тромбоцитопении [71].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Для уменьшения усталости, слабости и депрессии на фоне химиотерапии рекомендовано проведение ЛФК. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [72].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендовано для уменьшения усталости, слабости и депрессии проведение курса массажа медицинского пациенткам в течение 6 недель на фоне комбинированного лечения [73].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: данная рекомендация сделана на основании результатов исследования влияния массажа на состояние пациентов с раком молочной железы, нет оснований предполагать, что данная терапия не будет эффективна у пациенток с РЯ.
• Рекомендованы упражнения на тренировку баланса для корекции полинейропатии, так как они более эффективны, чем сочетание упражнений на выносливость и силовых упражнений [74].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Пациентам, получающим XT, рекомендован курс терренного лечения (лечения ходьбой) длительностью 6 недель в целях контроля клинических проявлений полинейропатии [75].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендуется применение низкоинтенсивной лазеротерапии в лечении периферической полинейропатии на фоне химиотерапии [76].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендована низкочастотная магнитотерапия для лечения периферической полинейропатии, возникшей на фоне XT [77].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендована чрескожная электростимуляция в течение 20 минут в день 4 недели в дополнение к стандартной противорвотной терапии для контроля контроля тошноты и рвоты пациентам, получающих XT основе цисплатина [78,123].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендована низкоинтенсивная лазеротерапия в целях профилактики мукозитов полости рта на фоне XT пациенту [79].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендуется применение системы охлаждения головы при проведении химиотерапия (аппарата для профилактики алопеции при XT) в целях профилактики алопеции [80, 81].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -3).
• Всем пациентам рекомендуется выполнение комплекса ЛФК в целях снижения частоту развития кардиальных осложнений на фоне химиотерапии [82].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
5. Профилактика
• Рекомендуется динамическое наблюдение пациента после окончания лечения, подразумевающее обследование пациента каждые 12-16 недель в течение первых 2 лет, каждые 6 месяцев в последующем [2, 5, 9,146].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: принципы наблюдения за пациентами после первичного лечения до конца не определены. Результаты крупного международного исследования MRC OV-05 [23] продемонстрировали отсутствие необходимости тщательного инструментального обследования с целью максимально раннего выявления рецидива. XT второй линии целесообразно начинать при появлении клинических симптомов. Раннее начало XT второй линии, например при маркерном рецидиве, не увеличивает продолжительность жизни, но ухудшает ее качество за счет побочных эффектов лечения.
Вместе с тем повторные циторедуктивные вмешательства оптимального объема могут улучшить отдаленные результаты лечения у пациентов, которым ранее была выполнена оптимальная циторедуктивная операция и длительность бесплатинового интервала после окончания химиотерапии составила >6 мес. По этой причине члены рабочей группы предлагают следующий алгоритм наблюдения за пациентами:
• исследование уровня антигена аденогенных раков СА 125 в крови, осмотр врача-гинеколога и УЗИ брюшной полости и малого таза 1 раз в 3 мес в течение первых 2 лет, 1 раз в 4 мес в течение 3-го года, далее - каждые 6 мес;
• углубленное обследование (КТ или МРТ брюшной полости и малого таза, рентгенография/ КТ грудной клетки) при повышении СА-125, появлении жалоб или выявлении патологии при гинекологическом осмотре или УЗИ.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на РЯ у пациентки или его выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациентку на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ей первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи - врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических
исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациентка направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения морфологической верификации диагноза злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на РЯ или его выявлении в ходе оказания скорой медицинской помощи пациенток переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациентку в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
1. наличие осложнений РЯ, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т. д.) РЯ.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациентки или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/ или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациентки в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
Дополнительная информация отсутсвует.
Критерии оценки качества медицинской помощи
1. Pal Т., Permuth-Wey J., Betts J.A. et al. BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases // Cancer. - 2005. - V. 104. - N 12. - P. 2807-16.
2. Rooth C. Ovarian cancer: risk factors, treatment and management //Br J Nurs. - 2013. - V. 22. -N 17. - P. S23-30.
3. Кагтрин А.П.. Старинский B.B.. Петрова Г.В. Злокачественные новообразования в России в 201 Яг.Сзаболеваемостъ и смертность). М.: МНИОИ им. П.А. Герттена - филиал ФГВУ «НМШ1 радиологии» Минздрава России. 2019. 250 с.
4. F.bell М.Н.. Culp М.В.. Radke T.l. A Systematic Review of Symptoms for the Diagnosis of Ovarian Cancer // Am 1 Prev Med. - 2016. - V. 50. - N 5. - P. 584-94.
5. NCCN guidelines panel. Epithelial Ovarian Cancer (including Fallopian Tube Cancer and Primary Peritoneal Cancer). Version 1.2016 // published online:
6. Stiekema A.. Boldingh О.1.. Korse C.M. et al. Serum human epididvmal protein 4 CHE41 as biomarker for the differentiation between epithelial ovarian cancer and ovarian metastases of gastrointestinal origin // Gvnecol Oncol. - 2015. - V. 156. - N 5. - P. 562-6.
7. Santotoribio I.D.. Garcia-de la Torre A.. Canavate-Solano C. et al. Cancer antigens 19.9 and 125 as tumor markers in patients with mucinous ovarian tumors // Eur 1 Gvnaecol Oncol. - 2016. - V.
57. - N 1. - P. 26-9.8. Colombo N.. Peiretti M.. Garbi A. et al. Non-Epithelial Ovarian Cancer: ESMO Clinical Practice Guidelines //Ann Oncol. - 2012. - V. 25 CSuppl 71. - P. vii20-vii26.
9. Ledennann 1. A.. Raia F. A.. Fotopoulou C. et al. Newly Diagnosed and Relapsed Epithelial Ovarian Carcinoma: ESMO Clinical Practice Guidelines //Ann Oncol. - 2015. -V. 24 CSuppl 61. -P. vi24-vi52.
10. Sankaranaravanan R. Screening for cancer in low- and middle-income countries // Ann Glob Health. - 2014. - V. 80. - N 5. - P. 412-1.
11. Yadav B.S.. Shanna S.C.. Robin T.P. Synchronous primary carcinoma of breast and ovary versus ovarian metastases. // Semin Oncol. - 2015. - V. 42. - N 2. - P. e15-24.
12. Stuart G.. Kitchener H.. Bacon M. et al. 2010 Gynecologic Cancer InterGroup tGCIGl Consensus Statement on Clinical Trials in Ovarian Cancer Int 1 Gvnecol Cancer 2011:21: 750Y755.
13. Trimbos 1.В.. Parrnar M.. Vergote I. et al. International Collaborative Ovarian Neoplasm trial 1 and Adjuvant ChemoTherapv In Ovarian Neoplasm trial: two parallel randomized phase III trials of adjuvant chemotherapy in patients with earlv-stage ovarian carcinoma. 1 Natl Cancer Inst. 2005 Ian ЕЗ^ЗСгУЮЗ-Тг.
14. Vergote E. Trope C.G.. Amant F. et al. Neoadjuvant chemotherapy or primary surgery in stage 111C or IV ovarian cancer // N Engl 1 Med. - 2010. - V. 565. - P. 945-55.
15. Young R.C.. Walton E.A.. Ellenherg S.S. et al. Adjuvant therapy in stage 1 and stage 11 epithelial ovarian cancer // N Engl 1 Med. - 1990. - V. 522. - P. 1021 -7.
16. Young R.C.. Bradv M.F.. Nieherg R.M. et al. Adjuvant treatment for early ovarian cancer: a randomized phase 111 trial of intraperitoneal 52P or intravenous cyclophosphamide and cisplatin - A Gynecologic Oncology Group study //1 Clin Oncol 2005. - V 21. - N 25. P. 4550-5.
17. Bolis G„ Colombo N.. Pecorelli S. et al. Adjuvant treatment for early epithelial ovarian cancer: results of two randomized clinical trials comparing cisplatin to no further treatment or chromic phosphate C52PY GICOG: Gruppo Interregional Collaborativo in Ginecologia Oncologica //Ann Oncol. - 1995. - V. 6. N 9. - P. 887-95.
18. Oza A.M.. Cook A.D.. Pfisterer 1. et al. Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON?1): overall survival results of a phase 5 randomised trial // The Eancet Oncology. 2015. - V. 16. N 8. - P. 928-956.
19. Gershenson D.. Bodurka D.. Coleman R. et al. Hormonal Maintenance Therapy for Women With I.ow-Grade Serous Cancer of the Ovary or Peritoneum //1 Clin Oncol. - 2017. In print.
20. Rustin G.T.. Verente T. Risenhaner F,. et al. Definitions for Response and Progression in Ovarian Cancer Clinical Trials IncorporatineRFCTST 1,1 and CA 125 Agreed bv the Gynecological Cancer Intergroup CGCIGl // Int I Gvnecol Cancer. - 2011. - V 21. N 2. - P. 419-25.
21. Harter P.. du Bois A.. Hah man n M. et al. Surgery in recurrent ovarian cancer: the Arbeitsgemeinschaft Gvnaekologische Onkoloeie (AGO) DESKTOP OVAR trial //Ann Surg Oncol. - 2006. - V. 15. N 12. - P. 1702-10.
22. Harter P.. Sehouli I.. Reuss A. et al. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: the Multicenter Intergroup Study DESKTOP II. A project of the AGO Konmiission OVAR. AGO Study Group. NOGGO. AGO-Austria. and MITO // Int I Gvnecol Cancer. - 2011. - V. 21. N 2. - P. 289-95.
23. Rustin G.T.. van der Burg M.E.. Griffin C.L. et al. Early versus delayed treatment of relapsed ovarian cancer 1MRC OV05/F.QRTC 339331: a randomised trial // Lancet. - 2010. - V. 376. N 9747. -P. 1155-63.
24. Markman M„ Rothman R.. Hakes T. et al: Second-line platinum therapy in patients with ovarian cancerpreviouslvtreated with cisplatin. 1 Clin Oncol 9:389-393.1991.
25. Gore M.. Frvatt I.. Wiltshaw E.. Dawson T. Treatment of relapsed carcinoma of the ovary with cisplatin or carhoplatin following initial treatment with these components. Gvnecol Oncol 56:207-211.1990.
26. Mahner S.. Meier W.. du Bois A. et al. Carhoplatin and peevlated liposomal doxorubicin versus carhoplatin and paclitaxel in very platinum-sensitive ovarian cancer patients: results from a subset analysis of the CALYPSO phase III trial. Eur 1 Cancer. 2015 Feb:51151:552-8.
27. The ICON and AGO Collaborators Paclitaxel plus platinum-based chemotherapy versus conventional platinum-based chemotherapy in women with relapsed ovarian cancer: the ICON4/AGO-OVAR-2.2 trial // Lancet. - 2005. - V. 561. - P. 2099-106.
28. Hoskins Р.1.. Le N. Identifying patients unlikely to benefit from further chemotherapy: A descriptive study of outcome at each relapse in ovarian cancer // Gynecologic Oncology. 2005. -V. 97. - P. 862-869.
29. Aghaianian C.. Goff B.. Nvcurn L.R. et al. Final overall survival and safety analysis of OCEANS, a phase 5 trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent ovarian cancer // Gvnecol Oncol. - 2015. - V. 159. N 1. - P. 10-6.
30. Puiade-Lauraine E.. Hilpert F. Weber B. et al. Bevacizumab Combined With Chemotherapy for Platinum-Resistant Recurrent Ovarian Cancer: The AIJRF.1.1A Open-1,ahel Randomized Phase 111 Trial //1 Clin Oncol. - 2014. - V.52. - P. 4014-4025.
31. Okamoto A.. Sugivama T.. Harnano T. et al. Randomized phase III trial of paclitaxel/carboplatin tPCl versus cisplatin/irinotecan (CPT-P) as first-line chemotherapy in patients with clear cell carcinoma СССР of the ovarv: A lapanese Gynecologic Oncology Group (1GOGVGCIG study // 1 Clin Oncol. - 2014. - V. 52. N 5s Csuppl: abstr 55071.
32. Sato S.. Itamochi H.. Kigawa 1.. Oishi T.. Shimada M.. Sato S.. Naniwa 1.. IJegaki K.. Nonaka M.. Terakawa N. Combination chemotherapy of oxaliplatin and 5-fluorouracil may be an effective regimen for mucinous adenocarcinoma of the ovarv: a potential treatment strategy // Cancer Sci. - 2009. - V. 100. N 5. - P. 546-51.
33. Ledennann 1.. Harter P.. Gourlev C. et al. Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes hv BRCA status in a randomised phase 2 trial. Lancet Oncol. 20141ul:15181:852-61.
34. Swenerton K.D.. Santos I.L.. Gilks C.B. et al. Histotvpe predicts the curative potential of radiotherapy: the example of ovarian cancers /7 Annals of Oncology. - 2011. - V. 22. - P. 341-547.
35. Holt K.A.. Moeerisen O.. lensen P.T.. Hansen D.G. Goal setting in cancer rehabilitation and relation to quality of life among women with gynaecological cancer // Acta Oncol. - 2015. - V. 54. N 10. - P. 1814-25.
36. Harter P.. Sehouli T.. T.omsso D. et al. A Randomized Trial of T.ymphadenectomy in Patients with Advanced Ovarian Neoplasms // N F.ngl T Med. - 2019. - V. 380. - P. 822-832.
37. Schofield C.. Newton R.IJ.. Galvao D.A. et al. A Physiological Profile of Ovarian Cancer Survivors to Inform Tailored F.xercise Interventions and the Development of F.xercise Oncology Guidelines //IntI GvnecolCancer. - 2017. - V. 27.N7.-P. 1560-1567.
38. Whicker M„ Black I.. Altwerger G. et al. Management of sexuality, intimacy, and menopause symptoms in patients with ovarian cancer /'/' Am I Obstet Gvnecol. - 2017. - V. 217. N 4. - P. 595-405.
39. Клинические рекомендации по лечению хронического болевого синдрома у взрослых пациентов при оказании паллиативной медицинской помощи.
41. Nilsson H.. Angeras U.. Bock D.. Boriesson M.. Onerup A.. Fagevik Olsen M.. Gellerstedt M.. Haelind F... Aneenete F,. Is preoperative physical activity related to post-surgery recovery? BM1 Open. 2016 lan 14:6m:e007997. doi: 10.1156/hmjopen-201.5-007997.
42. Hiiazi Y.. Gondal U.. Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int 1 Surg. 2017 Mar:59:156-162. doi: 10.1016/j.ijsu.2017.01.111. F.puh 2017 Feb 2.
43. Silver T.K.. Raima 1. Cancer prehabilitation: An opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am 1 Phvs Med Rehabil. 2015:92:715-27.
44. Tsimopoulou 1.. Pasquali S.. Howard R.. Desai A.. Gourevitch П.. Tolosa 1.. Vohra R. Psychological Prehabilitation Before Cancer Surgery: A Systematic Review. Ann Surg Oncol. 2015 Рес:22С15'):4117-25. doi: 10.1245/sl0454-015-4550-z. Epub 2015 Apr 14.
45. lonathan Carter. Fast-Track Surgery in Gynaecology and Gvnaecologic Oncology: A Review of a Rolling Clinical Audit. ISRN Surgery. Vol. 2012. Article ID 568014.19 pages. 2012.
46. Nelson G.. Bakkum-Gamez 1.. Kalogera E. et al Guidelines for perioperative care in gvnecologic/oncologv: Enhanced Recovery After Surgery CERASt Society recommendations -2019 update International journal of Gynecologic Cancer Published Online First: 15 March 2019. doi: 10.1156/ijgc-2019-000556.
47. De Almeida E.P.M.. De Almeida 1.Р.. Landoni G.. Galas F.R.B.G.. Fukushima 1.Т.. Fominskiv E.. De Brito C.M.M.. (...)¦ Haiiar 1„A. F.arlv mobilization programme improves functional capacity after major abdominal cancer surgery: A randomized controlled trial. 120171 British loumal of Anaesthesia. 119 151. - Pp. 900-907.
48. Wren S.M.. Martin M.. Yoon T.K.. Bech F. Postoperative pneumonia-prevention program for the inpatient surgical ward // loumal of the American College of Surgeons. - 2010. -Vol. 210. No. 4 -pp. 491-495.
49. Peedicavil A.. Weaver A., hi X.. Carev F... Clihv W.. Mariani A. Incidence and timing of venous thromboembolism after surgery for gynecological cancer // Gynecologic Oncology. - 2011. - Vol. 121. No. l.-Pp. 64-69.
50. Swarm R.. Abernethv A.P.. Anghelescu D.L. et al. NCCN Adult Cancer Pain. Adult cancer pain. 1 Natl Cornpr Cane Netw. 2010:8: 1046-1086.
51. Ben-Arve E.. Samuels N.. Lavie O. Integrative Medicine for Female Patients with Gynecologic Cancer // The loumal of Alternative and Complementary Medicine. - Vol. 24. No. 9-10.
52. GoerlingU.. laeger C.. Walz A. et al. The efficacy of psvcho-oncological interventions for women with gynaecological cancer: A randomized study // Oncology. 2014:87:114-124. Crossref. Medline.
53. Smits A.. Lopes A.. Bekkers R. et al. Body mass index and the quality of life of endometrial cancer survivors - a systematic review and meta-analvsis // Gvnecol Oncol 2015:157:180-7. doi:10.1016/j.yeyno.2015.01.540.
54. Schmitz K.H.. Courneva K.S.. Matthews C. et al. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports F.xerc 2010:42:1409-26.
55. Zhou Y. et al. Body mass index, physical activity, and mortality in women diagnosed with ovarian cancer: results from the Women's Health Initiative. Gvnecol Oncol. 2014. 155П1: p. 4-Ж
56. Biglia N.. Zanfagnin V.. Daniele A.. Rohha F... Bounous V.F.. T.ower Body T.vmphedema in Patients with Gynecologic Cancer. Anticancer Res. 2017 Aug:57('81:4005-4015.
57. Shaitelman S.F.. Cromwell K.D.. Rasmussen T.C.. Stout N.T,.. Anner T.M.. T.asinski B.B.. Cormier l.N. Recent progress in the treatment and prevention of cancer-related lymphedema. CA Cancer 1 Clin. 2015 lan-Feb:65m:55-81. doi: 10.5522/caac.21255. Epub 2014 Nov 19. Erratum in: CA Cancer 1 Clin. 2015 Mav-Tun:65G):252. PubMed PMID: 25410402: PubMed Central PMCID: PMC4808814.
58. Bonnan P. Lymphedema diagnosis, treatment, and follow-up from the view point of physical medicine and rehabilitation specialists. Turk 1 Phvs Med Rehab 2018:64151:179-197.
Приложение А1. Состав рабочей группы
1. Ашрафян Л.А., академик РАН, д.м.н., профессор, заместитель директора ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, директор института онкогинекологии и маммологии.
2. Тюляндина А.С., д.м.н., с.н.с. онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
3. Урманчеева А.Ф. ., д.м.н., профессор, ведущий научный сотрудник отделения онкогинекологии ФГБУ «НМИЦ онкологии им Н.Н. Петрова» Минздрава России, Санкт-Петербург
4. Берлев И.В., д.м.н., профессор, заведующий научным отделением онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
5. Кузнецов В.В., д.м.н., профессор, ведущий научный сотрудник онкогинекологического отделения ФБГУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
6. Коломиец Л. А., профессор, заведующая отделением гинекологии с группой профилактики и ранней диагностики НИИ онкологии Томского НИМЦ, Томск
7. Шевчук А.С. к.м.н. заведующий отделением онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
8. Новикова Е.Г., д.м.н., профессор МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
9. Вереникина Е.В., к.м.н., заведующая отделением онкогинекологии ФГБУ «РНИОИ» Минздрава России.
10. Давыдова И.Ю., д.м.н., старший научный сотрудник отделения гинекологического, ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России П.Покатаев И.А., к.м.н., научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
12. Демидова Л.В., д.м.н., в.н.с. отдела лучевой терапии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
13. Жорданиа К.И., д.м.н., профессор, ведущий сотрудник отделения онкогинекологического ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
14. Антонова И.Б., д.м.н., заведующая лабораторией профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ РНЦРР Минздрава России.
15. Бабаева Н.А. д.м.н., ведущий научный сотрудник лаборатории профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ РНЦРР Минздрава России.
16. Кравец О.А., д.м.н., руководитель группы лучевой терапии онкогинекологических заболеваний ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
17. Крикунова Л.И., д.м.н.профессор, зав. Отд. Лучевых и комбинированных методов лечения гинекологических заболеваний. ФГБУ «НМИЦ радиологии» Минздрава России.
18. Коломиец Л.А., д.м.н., профессор, заведующая гинекологическим отделением НИИ онкологии ФГБНУ «Томский НИМЦ РАН».
19. Крейнина Ю.М., д.м.н., в.н.с. лаборатории инновационных технологий радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ «РНЦРР» Минздрава России.
20. Мухтаруллина С.В., д.м.н., заведующая отделением онкогинекологии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
21. Нечушкина В.М., д.м.н., ведущий научный сотрудник онкологического отделения хирургических методов лечения N8 (онкогинекологии) ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
22. Хохлова С.В., д.м.н., Заведующая онкологическим отделением противоопухолевой лекарственной терапии ФГБУ « НМИЦ акушерства, гинекологии и перинатологии им. В.И. Кулакова» МЗРФ
23. Снеговой А.В., д.м.н., заведующий отделением онкологического дневного стационара ФБГУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
24. Трякин А.А., д.м.н., главный научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России;
25. Тюляндин С.А., д.м.н., профессор, онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России;26. Ульрих Е.А., д.м.н., профессор кафедры детской гинекологии и женской репродуктологии факультета повышения квалификации и профессиональной переподготовки ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России и кафедры онкологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И.Мечникова» Минздрава России, Санкт-Петербург
27. Карселадзе А.И., д.м.н., профессор, ведущий научный сотрудник отдела патологической анатомии опухолей человека ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
28. Румянцев А.А., врач-онколог онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, Москва
29. Герфанова Е.В., онкогинеколог ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, институт онкогинекологии и маммологии.
Блок по медицинской реабилитации:
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
3. Гильмутдинова И.Р., к.м.н., заведующая отделом биомедицинских технологий и лаборатория клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
4. Буланов А.А., д.м.н., с.н.с. отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Бутенко А.В., д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель НС «Ассоциация специалистов по онкологической реабилитации».
6. Назаренко А.В., к.м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Российской ассоциации терапевтических радиационных онкологов (РАТРО), European Society for Radiotherapy & Oncology (ESTRO), Российско-американского альянса по изучению рака (ARCA), представитель России в МАГАТЭ.
7. Обухова О.А., к.м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Ткаченко Г.А., психолог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10. Петрова Т.А., логопед-педагог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Семиглазова Т.Ю., д.м.н., в.н.с. научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «СЗГМУ им. Н.Н. Мечникова» Минздрава России.
12. Пономаренко Г.Н., д.м.н., профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ «ФНЦРИ им. Г.А. Альбрехта» Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
13. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военномедицинская академия им. С.М. Кирова» Минобороны России.
14. Каспаров Б.С., к.м.н., заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
15. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
16. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
17. Кондратьева К.О., медицинский психолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
18. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
19. Романов А.И., академик РАН, д.м.н., профессор, главный врач ФГБУ «Центр реабилитации» Управления делами Президента РФ.
20. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
21. Степанова А.М., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра «В осстановление ».
Блок по организации медицинской помощи:
1. Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
2. Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3. Иванов С.А., д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ НМИЦ онкологии им. Н.Н. Блохина.
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендации
Целевая аудитория данных клинических рекомендаций:
• врачи-онкологи;
• врачи-хирурги;
• врачи-радиологи;
• студенты медицинских вузов, врачи-стажеры, врачи, обучающиеся в ординатуре и аспирантуре.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РТМ в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• внешняя экспертная оценка;
• внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациенток с РТМ. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций
Приложение Б. Алгоритмы ведения пациента
Пациент с подозрением на рак яичников, маточной трубы или первичный рак брюшины (КОД МКБ10: С48,56,57)
Приложение В. Информация для пациентов
Рекомендуется: при осложнениях XT - связаться с врачом-онкологом.
1. При повышении температуры тела 38 °С и выше:
• обратиться на прием к врачу-онкологу
2. При стоматите:
• диета - механическое, термическое щажение;
• частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом—по рекомендации врача-онколога:
• обрабатывать полость рта по рекомендации врача-онколога.
3. При диарее:
• диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
• принимать препараты по рекомендации врача-онколога.
4. При тошноте:
• принимать препараты по рекоменлаттии врача-онколога.
Приложение Г.
Приложение Г1. Шкала оценки тяжести состояния пациента по версии B03/EC0G
Название на русском языке: Шкала оценки тяжести состояния пациента по версии B03/EC0G [82]
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. Д-)-
Содержание:
Балл Описание
0 Пациент полностью активен, способен выполнять все, как и до заболевания (90-100 % по шкале Карновского)
1 Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80 % по шкале Карновского)
2 Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении (50-60 % по шкале Карновского)
3 Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30-40 % по шкале Карновского)
4 Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20 % по шкале Карновского)
Ключ (интерпретация): приведен в самой шкале
Приложение Г2. Шкала Карновского
Название на русском языке: Шкала Карновского [83]
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Kamofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents, edn. Edited by MacLeod C.
New York: Columbia University Press; 1949: 191-205
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. Д-)-
Содержание (шаблон):
Шкала Карновского
100— Состояние нормальное, жалоб нет
90— Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80— Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70— Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60— Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50— Нуждается в значительной помощи и медицинском обслуживании
40— Инвалид, нуждается в специальной помощи, вт.ч. медицинской
30— Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20— Тяжелый больной. Необходимы госпитализация и активное лечение 10— Умирающий
0— Смерть
Ключ (интерпретация): приведен в самой шкале
Приложение ГЗ. Шкала оценки степени терапевтического патоморфоза опухоли (Tumor regression grading (TRGJ).
Название на русском языке: Шкала оценки степени терапевтического патоморфоза опухоли [152-153]
Оригинальное название (если есть): Tumor regression grading
Источник (официальный сайт разработчиков, публикация с валидацией): AJCC. PART III: digestive systems. In: Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti III A, editors. AJCC cancer staging manual. 7th ed. New York:
Springer; 2010. p. 103-26.[152-153]
Тип: шкала оценки
Назначение: описать уровень терапевтического патоморфоза опухоли.
Содержание (шаблон):
Теги: рак
234567 Начало активности (дата): 16.03.2023 20:11:00
234567 Кем создан (ID): 989
234567 Ключевые слова: рак яичников, рак маточной трубы, рак брюшины, опухолевый антиген
12354567899
Похожие статьи
Рак щитовидной железыРак шейки матки
Рентген на дому 8 495 22 555 6 8
Рак трахеи
Рак полости носа и придаточных пазух



