 06.02.2023
06.02.2023
Первичные опухоли центральной нервной системы
По клиническому течению, формирующему подходы к лечению, разделяют герминому (устоялся также термин «чистая герминома») и негерминогенные герминативно- клеточные опухоли.
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:С70, С71, С72Год утверждения (частота пересмотра) :2020
Возрастная категория :Взрослые,Дети
Год окончания действия:2022
Ш:578
Разработчик клинической рекомендации
• Общероссийский национальный союз "Ассоциация онкологов России"
• • Общероссийская общественная организация "Ассоциация нейрохирургов России"
• • Общероссийская общественная организация "Российское общество клинической онкологии"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
CBTRUS - Central Brain Tumor Register of the United States
CTV (Clinical Tumor Volume) - клинический объем опухоли
GTV (Gross Tumor Volume) - объем видимой опухоли
PTV (Planning Tumor Volume) - планируемый объем опухоли
АФП - альфа-фетопротеин
БДУ - без дополнительных уточнений
ВИЧ - вирус иммунодефицита человека
ВОЗ - Всемирная организация здравоохранения
КСО - краниоспинальное облучение
КТ - компьютерная томография, компьютерная томограмма
ЛТ - лучевая терапия
МР - магнитно-резонансный
МРТ - магнитно-резонансная томография, магнитно-резонансная томограмма
ПЭТ - позитронная эмиссионная томография
РОД - разовая очаговая доза
СОД - суммарная очаговая доза
СТБ - стереотаксическая биопсия
фМРТ - функциональная магнитно-резонансная томография (3-ХГЧ - бета-хорионический гонадотропин человеческий XT - химиотерапия ЦНС - центральная нервная система
** - жизненно необходимые и важнейшие лекарственные препараты
Термины и определения
Глиомы - собирательный термин, который объединяет все диффузные астроцитарные и олигодендроглиальные опухоли, а также другие виды - пилоидную астроцитому, субэпиндимарную гигантоклеточную астроцитому, астробластому и другие опухоли, исходящие их клеток глии. Ведено понятие “Grade”, которое определяет степень злокачественности глиомы от I до IV.
Выделяют глиомы низкой степени злокачестенности Grade I—II (высокодифференцированные глиомы, включающие астроцитому, олигодендроглиому, олигоастроцитому, а также редкие типы опухолей - плеоморфную ксантоастроцитому, субэпиндимарную гигантоклеточную астроцитому, пилоидную астроцитому) и злокачественные глиомы Grade III—IV (анапластическая астроцитома, анапластическая олигоастроцитома, анапластическая олигодендроглиома, глиобластома). Наиболее злокачественными являются глиомы Grade IV.
Астроцитома - опухоль, развивающаяся из астроцитарной части глии и представленная астроцитами. Может локализоваться как в больших полушариях мозга, так и в мозжечке, а также в стволе головного мозга и спинном мозге. Различают астроцитомы низкой (Grade I—II) и высокой (Grade III—IV) степени злокачественности. В зависимости от наличия мутации ЮН-1,2 различают астроцитомы с наличием данной мутации и без таковой, так называемый «дикий тип», или “wild type” (wt).
Олигодендроглиома и олигоастроцитома - опухоли, преимущественно состоящие из олигодендроцитов. В классификации Всемирной организации здравоохранения (ВОЗ) 2016 г. принято решение отказаться от термина «олигоастроцитома». Для олигодендроглиомы характерным является наличие мутации IDH-1 и коделеции lp/19q (а также мутации ATRX). Различают олигодендроглиому Grade II и анапластическую олигодендроглиому Grade III.
Плеоморфная ксантроастроцитома по данным магнитно-резонансной томографии (МРТ), как правило, кистозная, хорошо отграниченная от окружающего мозгового вещества опухоль, локализующаяся в субкортикальной области больших полушарий мозга, солидная часть которой интенсивно накапливает контраст и расположена асимметрично относительно кисты. Чаще встречается плеоморфная ксантроастроцитома Grade II, но в классификации Всемирной организации здравоохранения (ВОЗ 2016) внесено понятие «анапластическая плеоморфная астроцитома Grade III». Более чем в половине случаев в плеоморфной ксантоастроцитоме встречается мутация BRAF (V600E).
Субэпиндимарная гигантоклеточная астроцитома - чаще всего одно из проявлений туберозного склероза (болезни Бурневилля). На магнитно-резонансной томографии (МРТ) представлена солидной опухолью, расположенной чаще всего в проекции одного или обоих отверстий Монро, гиподенсивной в Т1-режиме и интенсивно накапливающей контраст. На компьютерной томограмме (КТ) характерно наличие симметричных кальцинатов в проекции зрительных бугров. Стандартом лечения этих опухолей является оптимальное (тотальное) удаление.
Пилоидная астроцитома - в классическом варианте по магнитно-резонансным (МР) характеристикам гиподенсивная в Т1-режиме и гиперденсивная в Т2-режиме опухоль, как правило, хорошо и равномерно накапливающая контрастное вещество, нередко с наличием кистозного компонента. Обычно встречается в детском возрасте и у молодых взрослых.
Глиома высокой степени злокачественности (Grade III—IV) по МРТ-признакам является гипоинтенсивной в Т1-режиме, гиперинтенсивной в режимах Т2 и FLAIR, сливается с зоной перифокального отека. Клинические признаки: короткий анамнез, быстрое нарастание симптомов, относительно редко наблюдается судорожный синдром. Если по данным МРТ нельзя исключить лимфому центральной нервной системы (ЦНС), пациенту необходимо сначала выполнить стереотаксическую биопсию (СТБ) (см. рис. 7). Молекулярно-генетические факторы, определяющие прогноз, -мутации ШН-1,2, метилирование гена MGMT (оба благоприятные).
Глиоматоз головного мозга - диффузное поражение глиомой структур головного мозга (более 3 анатомических областей больших полушарий, обычно с переходом через мозолистое тело и перивентрикулярным распространением).
Глиомы ствола головного мозга. На разных уровнях поражения ствола головного мозга встречаются различные по анатомо-морфологическим характеристикам и клиническим проявлениям глиальные опухоли. Часть этих опухолей (например, глиома четверохолмной пластинки) носит доброкачественный характер и может не прогрессировать без лечения в течение всей жизни человека. Другие (например, злокачественные глиомы моста) характеризуются, напротив, агрессивным течением с ограниченными возможностями специализированной помощи таким пациентам.
Глиомы спинного мозга. Как правило, диффузные интрамедуллярные опухоли, поражающие различные уровни спинного мозга, требуют специальных подходов к хирургии и лучевой терапии (ЛТ). Лечению интрамедуллярных опухолей посвящены отдельные клинические рекомендации.
Менингиомы - опухоли, происходящие из клеток паутинной оболочки головного мозга. Менингиомы являются самой частой первичной опухолью ЦНС. Наиболее часто менингиомы локализуются в области свода черепа (конвекситальные менингиомы), верхнего сагиттального синуса (парасагиттальные менингиомы) и крыльев основной кости. Реже менингиомы встречаются в других отделах основания черепа - в ольфакторной ямке, области бугорка турецкого седла, задней черепной ямке, области намета мозжечка, боковых желудочках, области оболочки зрительного нерва. Примерно в 6 % случаев менингиомы располагаются в области позвоночного канала. По классификации ВОЗ (2016) выделяют 3 степени злокачественности менингиом. К 1-й степени (Grade I) относятся следующие гистологические варианты менингиом:
менинготелиоматозная, фиброзная (фибробластическая), смешанного строения, псаммоматозная, ангиоматозная, микрокистозная, секреторная, с лимфоплазмоцитарными инфильтратами, метапластическая. Ко 2-й степени (Grade II) относятся хордоидная, светлоклеточная и атипическая менингиомы. Папиллярная, рабдоидная и анапластическая менингиомы относятся к 3-й степени (Grade III) и обладают наиболее агрессивные поведением и/или высокой способностью к рецидивированию.Эпендимомы - редкие опухоли, возникающие из эпендимы головного или спинного мозга, примерно одинаково часто встречаются у детей и взрослых. В головном мозге эпендимомы чаще располагаются в пределах желудочковой системы головного мозга. Реже выявляются экстравентрикулярные эпендимомы. Другую группу составляют эпендимомы спинного мозга, которые растут интрадурально (нередко в проекции расширенного центрального канала).
Часто эти опухоли достаточно хорошо отграничены от окружающего мозгового вещества и по мере роста вызывают расширение соответствующих отделов желудочковой системы (или центрального канала спинного мозга, соответственно). Примерно в половине случаев по данным КТ и МРТ выявляются признаки мелких кальцинатов. Хорошо накапливают контрастное вещество, чаще - негомогенно. По классификации ВОЗ (2016) выделяют эпендимому (Grade II) и анапластическую эпендимому (Grade III).
Первичная лимфома ценральной нервной системы (ЦНС) - относительно редкая опухоль ЦНС (5-7 % всех первичных опухолей ЦНС), относящаяся согласно онкогематологическим классификациям к редким формам неходжкинских экстранодальных лимфом. Морфологически более чем в 90 % случаев представлена диффузной В-крупноклеточной лимфомой В-клеточным вариантом. Различают лимфомы ЦНС у иммунокомпетентных пациентов и ВИЧ-ассоциированные (Вирус иммунодефицита человека) лимфомы. Примерно у 15-20 % пациентов с первичной лимфомой ЦНС выявляется поражение опухолью стекловидного тела или сетчатки глаза.
Первичные герминогенные (герминативно-клеточные) опухоли ЦНС - редкая группа первичных опухолей ЦНС (0,9 % всех первичных опухолей ЦНС), встречается в основном в детском и молодом возрасте (медиана - примерно 20 лет), преобладает у лиц мужского пола (в соотношении 7:1). Гистологически все разновидности этих опухолей идентичны аналогичным семиномным и несеминомным опухолям яичка и яичника. Самой частой локализацией первичных герминативно-клеточных опухолей ЦНС является пинеальная область, а также хиазмально-селярная область (особенно у детей), что обусловливает соответствующую симптоматику: окклюзионно-гидроцефальный синдром и глазодвигательные нарушения, а также зрительные и гормональные нарушения.
По клиническому течению, формирующему подходы к лечению, разделяют герминому (устоялся также термин «чистая герминома») и негерминогенные герминативно-
клеточные опухоли. При нормальных уровнях маркеров показана биопсия опухоли.В соответствии с морфологической классификацией ВОЗ опухолей ЦНС (2016) выделяют следующие морфологические типы первичных герминативно-клеточных опухолей ЦНС:
• герминома;
• эмбриональная карцинома;
• опухоль желточного мешка;
• хориокарцинома;
• тератома;
• зрелая;
• незрелая;
• тератома со злокачественной трансформацией;
• смешанные герминативно-клеточные опухоли.
Ведущую роль в лечении герминативно-клеточных опухолей ЦНС занимает ЛТ. Облучение должно проводиться на современной аппаратуре с использованием линейных ускорителей и трехмерного планирования (стереотаксическая радиотерапия).
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Термин «первичные опухоли ЦНС» объединяет различные по гистологическому строению, злокачественности и клиническому течению опухоли, общим для которых является происхождение из тканей, составляющих ЦНС и ее оболочки.
Под термином «глиомы» подразумевают часть первичных опухолей ЦНС, включающую опухоли астроцитарного, олигодендроглиального, смешанного происхождения, ганглиоглиомы.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
У 5 % пациентов с опухолями ЦНС развитие заболевания может быть связано с наличием известных наследственных синдромов (нейрофиброматоз I и II типов, некоторые другие), причем все, за исключением синдрома Тюркотта, демонстрируют аутосомально-доминантный механизм наследования. В абсолютном большинстве случаев первичные опухоли ЦНС возникают спорадически.
Для большинства глиом характерен диффузный характер роста с инвазией окружающих нормальных тканей мозга. В зависимости от злокачественности глиомы могут развиваться годами, не проявляя себя какими-либо симптомами (например, олигодендроглиома), или напротив, появляются и развиваются в течение нескольких месяцев (например, глиобластома). Часть первичных опухолей ЦНС связана с дизэмбриогенетическими процессами (например, медуллобластома, первичные герминогенные опухоли ЦНС, краноифарингиома и др.).
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Первичные опухоли ЦНС составляют около 2 % всех опухолей человека, или, по данным CBTRUS (Central Brain Tumor Register of the United States), 21,4 случая на 100 тыс. населения [1]. Другими словами, каждый год в России появляется примерно 32 100 новых случаев первичных опухолей ЦНС. Это разнородная группа опухолей, причем морфологический диагноз - основной фактор прогноза и дифференцированного подхода к лечению.
Среди первичных опухолей ЦНС преобладают менингиомы (35,6 %, причем только 1 % составляют злокачественные менингиомы) и глиомы (35,5 %, причем 15,6 % от общего числа первичных опухолей мозга составляет глиобластома). Питуитарные опухоли составляют 15 %, невриномы VIII нерва - 8 % (CBTRUS, 2014).
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С70 Злокачественное новообразование мозговых оболочек С71 Злокачественное новообразование головного мозга
С72 Злокачественное новообразование спинного мозга, черепных нервов и других отделов центральной нервной системы
D18 Гемангиома любой локализации
D32 Доброкачественное новообразование мозговых оболочек
D33 Доброкачественное новообразование головного мозга и других отделов центральной нервной системы
D43 Новообразование неопределенного или неизвестного характера головного мозга и центральной нервной системы
Кодирование первичных опухолей ЦНС по МКБ-10 следует осуществлять в соответствии с кодом МКБ в классификации.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1 Международная классификация (ВОЗ. 20161)
Система классификации ВОЗ (по шкале злокачественности) для первичных опухолей ЦНС
Диффузные астроцитарные и олигодендроглиальные опухоли
Диффузная астроцитома БДУ (без дополнительных уточнений) II 9400/3 С71.0-С71.9
Диффузная астроцитома с мутацией в гене ЮН II 9400/3 С71.0-С71.9
Гемистоцитарная астроцитома II 9411/3 С71.0-С71.9
Диффузная астроцитома без мутаций в гене ЮН II 9400/3 С71.0-С71.9
Анапластическая астроцитома БДУ III 9401/3 С71.0-С71.9
Анапластическая астроцитома с мутацией в гене ЮН III 9401/3 С71.0-С71.9
Анапластическая астроцитома, без мутаций в гене ЮН III 9401/3 С71.0-С71.9
Глиобластома БДУ IV 9440/3 С71.0-С71.9
Глиобластома без мутаций в гене ЮН IV 9440/3 С71.0-С71.9
Глиосаркома IV 9442/3 С71.0-С71.9
Гигантоклеточная глиобластома IV 9440/3 С71.0-С71.9
Эпителиоидная глиобластома IV 9440/3 С71.0-С71.9
Глиобластома с мутацией в гене ЮН IV 9445/3 С71.0-С71.9
Диффузная глиома средней линии IV 9385/3 С71.0-С71.9
Олигодендроглиома БДУ II 9450/3 С71.0-С71.9
Олигодендроглиома с мутацией в гене ЮН и коделецией lp/19q II 9450/3 С71.0-С71.9
Анапластическая олигодендроглиома БДУ III 9451/3 С71.0-С71.9
Анапластическая олигодендроглиома, с мутацией в гене ЮН и коделецией 1 р/ 19q III 9451/3 С71.0-С71.9
Олигоастроцитома II 9382/3 С71.0-С71.9
Анапластическая олигоастроцитома III 9382/3 С71.0-С71.9
Другие астроцитарные опухоли
Пилоцитарная/пилоидная астроцитома I 9421/1 D33.1 D33.0 D 33.4
Пиломиксоидная астроцитома IV 9425/3 С71.0-С71.9 С72.0
Субэпендимальная гигантоклеточная астроцитома I 9425/3 С71.0-С71.9
Плеоморфная ксантоастроцитома II 9424/3 С71.0-С71.9
Анапластическая плеоморфная ксантоастроцитома III 9424/3 С71.0-С71.9
Эпендимарные опухоли
Субэпендимома I 9383/1 D33.1-D33.0-D 33.4
Миксопапиллярная эпендимома II 9394/1 D33.1 D33.0-D 33.4
Эпендимома II 9391/3 D33.1 D33.0-D 33.4
Папиллярная эпендимома 9393/3 D33.1-D33.0-D 33.4
Светлоклеточная эпендимома 9391/3 D33.1 D33.0-D 33.4
Таницитарная эпендимома 9391/3 D33.1 D33.0-D 33.4
Эпендимома с химерой RELA 9396/3 С71.0-С71.9
Другие глиомы 1 1 1
Хордоидная глиома III желудочка п 9444/1 D33.0-
Ангиоцентрическая глиома 9431/1 D33.0-
Астробластома IV 9430/3 С71.0-С71.9
Опухоли сосудистого сплетения
Папиллома сосудистого сплетения I 9390/0 D18.0
Атипическая папиллома сосудистого сплетения II 9390/1 D33.0-
Карцинома сосудистого сплетения III 9390/3 С71.0-С71.9
Нейрональные и смешанные нейронально-глиальные опухоли
Дизэмбриопластическая нейроэпителиальная опухоль I 9413/0 D33.0
Ганглиоцитома I 9492/0 D33.0
Ганглиоглиома I 9505/1 D33.0-
Анапластическая ганглиоглиома III 9505/3 С71.0-С71.9
Диспластическая ганглиоцитома мозжечка (болезнь Лермитта-Дюкло) I 9493/0 D33.1
Десмопластическая астроцитома и ганглиоглиома у детей I 9412/1 D33.0
Папиллярная глионейрональная опухоль I 9509/1 D33.0
Розеткообразующая глионейрональная опухоль I 9509/1 D33.1
Диффузная лептоменингеальная глионейрональная опухоль Не определена Нет
Центральная нейроцитома II 9506/1 D33.0
Внежелудочковая нейроцитома II 9506/1 D33.0
Липонейроцитома мозжечка II 9506/1 D33.1
Параганглиома I 8693/1 D36.1
Опухоли пинеальной области
Пинеоцитома I 9361/1 D33.0
Паренхиматозная опухоль шишковидной железы промежуточной дифференцировки II или III 9362/3 С71.9
Пинеобластома IV 9362/3 С71.9
Папиллярная опухоль пинеальной области II или III 9395/3 С71.9
Эмбриональные опухоли
Медуллобластома БДУ IV 9470/3 С71.0-С71.9
Медуллобластома классическая IV 9470/3 С71.0-С71.9
Медуллобластома, десмопластическая/ нодулярная IV 9471/3 С71.0-С71.9
Медуллобластома выраженной нодулярностью IV 9471/3 С71.0-С71.9
Медуллобластома, крупноклеточная/ анапластическая IV 9474/3 С71.0-С71.9
Медуллобластома с активацией сигнального каскада WNT IV 9475/3 С71.0-С71.9
Медуллобластома с активацией сигнального каскада SHH и мутацией в гене ТР53 IV 9476/3 С71.0-С71.9
Медуллобластома с активацией сигнального каскада SHH без мутаций в гене ТР53 IV 9471/3 С71.0-С71.9
Медуллобластома без активации сигнальных каскадов WNT/SHH IV 9477/3 С71.0-С71.9
Медуллобластома, группа 3 IV Нет С71.0-С71.9
Медуллобластома, группа 4 IV Нет С71.0-С71.9
Эмбриональная опухоль с многослойными розетками, с повреждением гена С19МС IV 9478/3 С71.0-С71.9
Эмбриональная опухоль с многослойными розетками БДУ IV 9478/3 С71.0-С71.9
Медулл оэпителиома IV 9501/3 С71.0-С71.9
Нейробластома ЦНС IV 9500/3 С71.0-С71.9
Ганглионейробластома ЦНС IV 9490/3 С71.0-С71.9
Эмбриональная опухоль ЦНС БДУ IV 9473/3 С71.0-С71.9
Атипичная тератоидная/рабдоидная опухоль IV 9508/3 С71.0-С71.9
Эмбриональная опухоль ЦНС с рабдоидными чертами ЦНС IV 9508/3 С71.0-С71.9
Опухоли черепных и спинальных нервов
Шваннома I 9560/0 D36.1
Плексиформная шваннома I (эта и 2 следующие являются подтипами шванномы) 9560/0 D36.1
Клеточная шваннома I 9560/0 D36.1
Меланоцитарная шваннома I 9560/1 D36.1
Нейрофиброма I
Атипичная нейрофиброма I 9540/0 D36.1
Плексиформная нейрофиброма I 9550/0 D36.1
Периневриома I-III 9571/0 D36.1
Злокачественная опухоль оболочек периферического нерва (ЗОПН) Есть и доброкачественная и злокачественная, но по ICD злокачественная 9540/3 D36.1 С72.4 С72.5
Эпителиоидная ЗОПН IV 9540/3 D36.1 С72.4 С72.5
ЗОПН с периневральной дифференцировкой IV 9540/3 D36.1 С72.5
Менингиомы
Менингиома I 9530/0 D32.0
Менинготелиальная менингиома I 9531/0 D32.0
Фиброзная менингиома I 9532/0 D32.0
Переходная менингиома I 9537/0 D32.0
Псаммоматозная менингиома I 9533/0 D32.0
Ангиоматозная менингиома I 9534/0 D32.0
Микрокистозная менингиома I 9530/0 D32.0
Секреторная менингиома I 9530/0 D32.0
Менингиома с выраженной лимфоплазмоцитарной инфильтрацией I 9530/0 D32.0
Метапластическая менингиома I 9530/0 D32.0
Хордоидная менингиома II 9538/1 D32.0
Светлоклеточная менингиома II 9538/1 D32.0
Атипическая менингиома II 9539/1 D32.0
Папиллярная менингиома III 9538/3 С70.0 С70.1
Рабдоидная менингиома III 9538/3 С70.0 С70.1
Анапластическая (злокачественная) менингиома III 9530/3 С70.0 С70.1
Мезенхимальные, неменинготелиальные опухоли
Солитарная фиброзная опухоль/ гемангиоперицитома Grade 1 I 8815/0 D33.1 D33.0 D 33.4
Солитарная фиброзная опухоль/ гемангиоперицитома Grade 2 II 8815/1 D33.1 D33.0 D 33.4
Солитарная фиброзная опухоль/ гемангиоперицитома Grade 3 III 8815/3 С71.0-С71.9
Гемангиобластома I 9161/1 D33.1 D33.0-33.4
Гемангиома I 9120/0 D18.0
Эпителиоидная гемангиоэндотелиома 9133/3
Ангиосаркома IV 9120/3 С71.0-С71.9
Саркома Капоши IV 9140/3 С71.0-С71.9
Саркома Юинга/простые нейроэктодермальные опухоли IV 9364/3 С71.0-С71.9
Липома I 8850/0 D33.1 D33.0 D33.4
Ангиолипома I 8861/0 D33.1 D33.0 D33.4
Г ибернома I 8880/0 D33.1 D33.0 D33.4
Липосаркома IV 8850/3 С71.0-С71.9
Фиброматоз десмоидного типа Неизвестно 8821/1 D33.1 D33.4
Миофибробластома I 8825/0 D33.1 D33.0 D33.4
Воспалительная миофибробластическая опухоль Неизвестно 8825/1 D33.1 D33.0 D33.4
Доброкачественная фиброзная гистиоцитома I 8830/0 D33.1 D33.0 D33.4
Фибросаркома IV 8810/3 С71.0-С71.9
Недифференцированная плеоморфная саркома/ злокачественная фиброзная гистиоцитома IV 8802/3 С71.0-С71.9 С72.0
Лейомиома I 8890/0 D33.1 D33.0 D33.4
Лейомиосаркома IV 8890/3 С71.0-С71.9 С72.0
Рабдомиома I 8900/0 D33.1 D33.0 D33.4
Рабдомиосаркома IV 8900/3 С71.0-С71.9 С72.0
Хондрома I 9220/0 D33.1 D33.0 D33.4
Хондросаркома IV 9220/3 С71.0-С71.9 С72.0
Остеома I 9180/0 D33.1 D33.0 D33.4
Остеохондрома I 9210/0 D33.1 D33.0 D33.4
Остеосаркома IV 9180/3 С71.0-С71.9 С72.0
Меланоцитарные опухоли
Оболочечный меланоцитоз I 8728/0 D32.0 D31.1
Оболочечная меланоцитома II 8728/1 D32.0 D31.1
Оболочечная меланома IV 8720/3 С70.0 С70.1
Оболочечный меланоматоз IV 8728/3 С70.0 С70.1
Лимфомы
Диффузная крупноклеточная В-клеточная лимфома ЦНС IV 9680/3 С71.0-С71.9 С72.0
Диффузная крупноклеточная В-клеточная лимфома при СПИДе IV Нет С71.0-С71.9 С72.0
EBV-позитивная диффузная крупноклеточная В-клеточная лимфома, БДУ IV Нет С71.0-С71.9 С72.0
Лимфоматоидный грануломатоз II 9766/1 D32.0 D31.1
Внутрисосудистая крупноклеточная В-клеточная лимфома IV 9712/3 С71.0-С71.9 С72.0
В-клеточные лимфомы ЦНС низкой степени злокачественности Нет Нет D43.0
Т-клеточные и NK/T-клеточные лимфомы ЦНС IV Нет С71.0-С71.9 С72.0
Анапластическая крупноклеточная, ALK-позитивная лимфома IV 9714/3 С71.0-С71.9 С72.0
Анапластическая крупноклеточная, ALK-негативная лимфома IV 9702/3 С71.0-С71.9 С72.0
MALT-лимфома твердой мозговой оболочки IV 9699/3 С71.0-С71.9 С72.0
Гистиоцитарные опухоли
Гистиоцитоз из клеток Лангерганса IV 9751/3 С71.0-С71.9
Болезнь Розаи-Дорфмана Нет Нет
Ювенильная ксантогранулома Нет Нет
Гистиоцитарная саркома IV 9755/3 С71.0-С71.9
Герминогенные опухоли
Герминома IV 9064/3 С71.0-С71.9
Эмбриональный рак IV 9070/3 С71.0-С71.9
Опухоль желточного мешка IV 9071/3 С71.0-С71.9
Хорионкарцинома IV 9100/3 С71.0-С71.9
Тератома II 9080/1 D33.0
Зрелая тератома I 9080/0 D33.0
Незрелая тератома IV 9080/3 С71.0-С71.9
Смешанная герминогенная опухоль IV 9085/3 С71.0-С71.9
Опухоли области турецкого седла
Краниофарингиома 9350/1 D35.3
Адамантиномоподобная краниофарингиома II 9351/1 D35.3
Папиллярная краниофарингиома II 9352/1 D35.3
Гранулоклеточная опухоль области турецкого седла I 9582/0 D33.0
Питуицитома II 9432/1 D33.0
Веретеноклеточная онкоцитома I 8290/0 D33.0
1.5.2 Стадирование
Первичные опухоли ЦНС - разнородная группа опухолей, включающая глиомы, менингиомы, невриномы, аденомы гипофиза, первичную лимфому ЦНС, первичные герминогенные опухоли ЦНС, опухоли паренхимы пинеальной железы, медуллобластому и др. Классификация TNM не применяется при первичных опухолях ЦНС. Определяющим как в тактике лечения, так и в прогнозе заболевания является морфологический (гистологический) диагноз. Для первичных опухолей ЦНС одним из наиболее важных классификационных признаков является морфологический диагноз, в частности степень злокачественности опухоли (Grade I—IV в соответствии с классификацией ВОЗ, 2016) [2].
Для опухолей ЦНС с частым метастазированием (как правило, только в пределах ЦНС) используют классификацию Chang (для медуллобластомы, пинеобластомы) (табл. 1).
Таблица 1. Классификация медуллобластом по классификации Chang


Клиническая картина первичных опухолей ЦНС разнородна, определяется как природой опухоли, так и ее расположением, распространенностью. Ведущим в оценке клинической симптоматики пациентов с опухолями ЦНС является неврологический осмотр.
1. Общемозговая симптоматика:
• головные боли;
• гипертензионно-гидроцефальный синдром.
2. Очаговая неврологическая симптоматика:
• симптомы выпадения/снижения функции - нарушение движений, нарушения функций черепно-мозговых нервов, нарушение чувствительности, психические нарушения, речевые нарушения речи и письма, нарушения памяти и т.д.;
• судорожный синдром.
3. Эндокринные нарушения (главным образом у пациентов с опухолями гипофиза, краниофарингиомой, первичными герминативно-клеточными опухолями ЦНС и т.д.) [3].
По течению развитие опухолей ЦНС можно разделить на симптоматическое и бессимптомное (когда в течение длительного времени не выявляется никаких проявлений болезни). Симптомы заболевания могут проявиться остро в виде эпилептиформного синдрома, или окклюзионно-гидроцефального приступа, или в результате кровоизлияния в опухоль [4].
2. Диагностика
Дифференциальную диагностику следует проводить с неопухолевыми заболеваниями, например, с кровоизлиянием на фоне артериальной или артериовенозной мальформации, псевдотуморозной формой демиелинизирующих процессов, воспалительными процессами (абсцесс головного мозга, токсоплазмоз и др.). Кроме этого, следует дифференцировать первичные и метастатические опухоли ЦНС. Современные возможности МРТ позволяют с высокой степенью достоверности проводить как дифференциальную диагностику с другими заболеваниями, так и уточнить природу первичной опухоли ЦНС.
Стандартом диагностического обследования пациентов с первичными опухолями ЦНС является выполнение МРТ головного мозга с контрастным усилением в режимах Т1 без контрастирования, Т2, Т2 FLAIR, Т1 с контрастированием либо в 3 проекциях, либо тонкими срезами в аксиальной проекции (в режиме SPGR). Эти методики несут максимальную диагностическую информацию о локализации, размерах, структуре опухоли, взаимоотношении ее с важными анатомическими областями головного мозга, магистральными сосудами.
Основным критерием для постановки диагноза опухоли ЦНС является заключение гистологического исследования Гистологические признаки зависят от происхождения опухоли (астроцитарные, эпендимальные, эмбриональные, пинеальные, опухоли оболочек головного мозга). Преимущественно признаками опухолей высокой степени злокачественности являются клеточная атипия и их полиморфизм, малое количество цитоплазмы, выраженная митотическая активность, тесное расположение клеточных элементов, пролиферация эндотелия сосудов, зоны кровоизлияния и некрозов, изменения межклеточного матрикса. Микроскопическая картина медуллобластом во многом зависит от гистологического варианта опухоли и обусловлена низкой степенью дифференцировки клеточных элементов и высокой митотической активностью, присущей другим эмбриональным опухолям. В виду этого большое значение имеет иммунофенотипирование или геномное профилирование исследуемого патоморфологического материала с целью дифференциальной диагностки. В ряде случаев, при локализации опухолевого процесса в функционально важных зонах, тяжелом соматическом состоянии пациента, выраженной васкуляризации, гистологическая верификация может быть сопряжена с высоким риском инвалидизации или летального исхода. В этих ситуациях возможна постановка диагноза на основании клинико-рентгенологических данных. Клиническая картина первичных опухолей ЦНС разнородна, формируется как природой опухоли, так и её расположением, распространенностью. Ведущим в оценке клинической симптоматики пациентов с опухолями ЦНС выступает неврологический осмотр. Отмечаются как общемозговые симптомы, обусловленные нарастанием внутричерепной гипертензии (головная боль, тошнота, рвота, отек зрительных дисков, нарушения ряда психических, мнестических, когнитивных функций), так и местные симптомы (очаговая неврологическая симптоматика - парезы, параличи, нарушения всех видов чувствительности, выпадения функций анализаторов, эпилептические припадки, эндокринные нарушения). При МРТ исследовании основным признаком опухолевого роста явлется масс-эффект, приводящий к смещению и сдавливанию внутримозговых структур, нарушению ликвородинамики. Также по данным МРТ возможно оценить характер роста опухоли, структуру опухоли, наличие зон обызвествления, кровоизлияний, некроза, степень контрастного усиления. Ряд образований ЦНС, например, невриномы, менингиомы, имеют типичные клинические и нейровизуализационные характеристики, которые позволяют установить диагноз без проведения биопсии.
Для опухолей, при которых вероятна диссеминация по оболочкам головного и спинного мозга (медуллобластома, пинеобластома, первичные герминогенные опухоли ЦНС, все опухоли спинного мозга), обязательно выполнение МРТ всего длинника спинного мозга с контрастированием и без него в сагиттальной, фронтальной проекциях и дополнительно в аксиальной проекции в зоне выявленных опухолевых очагов.
Магнитно-резонансная семиотика первичных опухолей ЦНС весьма вариабельна и позволяет как дифференцировать опухолевые и неопухолевые процессы, так и предположить тот или иной гистологический диагноз. В дополнение к данным стандартным методикам обследования.
По показаниям могут быть выполнены компьютерная томография (КТ) с контрастным усилением и без него, КТ-ангиография и/или МР-ангиография, МР-трактография, функциональная МРТ (фМРТ) с определением двигательных зон и/или речевых корковых центров, КТ-перфузия и/или МР-перфузия. Также важным дополнительным методом обследования является позитронная эмиссионная томография (ПЭТ), совмещенная с КТ (ПЭТ/КТ), головного мозга с аминокислотами (метионин, тирозин, холин и др.).
В случаях, когда МРТ не может быть выполнена (например, при наличии кардиостимуляторов или ферромагнитных имплантов), рекомендовано проведение КТ с контрастным усилением и без него [5].
Диагноз формулируется в соответствии с классификацией ВОЗ опухолей ЦНС от 2007 г. или 2016 г. и включает название опухоли с указанием степени злокачественности.
Диагноз должен быть интегративным (стандарт), включающим:
• гистологическое строение;
• степень злокачественности согласно классификации ВОЗ опухолей ЦНС;
• молекулярную информацию (например, для глиом: ЮН-1,2 коделеция lp/19q, мутации TERT и ARTX или «опухоль БДУ», или «неклассифицируемая опухоль»);
• указание локализации и распространения опухолевого процесса;
• указание ранее проведенных лечебных мероприятий.
Составление плана лечебных мероприятий осуществляется консилиумом с участием нейрохирургов, врачей рентгенодиагностики и при необходимости с привлечением специалистов смежных специальностей (неврологов, врачей-радиотерапевтов, онкологов, офтальмологов и др.). Основанием для конкретизации плана лечебных мероприятий является необходимое сочетание верифицированных данных (рекомендация):
• рентгенодиагностические данные по критериям локализации и гистологической структуры [5];
• возраст пациента;
• общесоматический статус;
• наличие сопутствующих заболеваний;
• избирательная гипо- и гиперчувствительность к фармакологическим препаратам.
2.1 Жалобы и анамнез
• Пациентам с опухолями ЦНС рекомендованы сбор анамнеза, оценка неврологического и соматического статуса, а также функционального статуса по шкале Карновского (Приложение Г. Шкала оценки тяжести состояния пациента) [3].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.2 Физикальное обследование
• Пациентам с опухолями ЦНС рекомендованы тщательный физикальный осмотр, включающий оценку неврологического статуса и интеллектуально-мнестических нарушений [3,4].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.3 Лабораторные диагностические исследования
• Пациентам с опухолями ЦНС рекомендуется выполнить развернутый клинический анализ крови, для выявления отклонений цитологических показателей крови и их дальнейшей коррекции. [4, 6,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Пациентам с опухолями ЦНС рекомендуется выполнить анализ свертывающей системы крови с целью выявления нарушений свертывающей функции крови путем оценки показателей системы гемостаза [4, 6,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• При подозрении на опухоль пинеальной области пациентам рекомендовано выполнение анализа крови на опухолевые маркеры - исследование уровня альфа-фетопротеина (АФП) в сыворотке крови, уровня хорионического гонадотропина в крови, определение активности лактатдегидрогеназы в крови [7, 8,18].
• Для уточнения прогноза, пациентам при анапластической астроцитоме и глиобластоме дополнительно рекомендовано молекулярно-генетическое исследование мутаций в генах IDH1 и IDH2 в биопсийном (операционном) материале, определение метилирования гена MGMT в биопсийном (операционном) материале, при олигодендроглиоме (Grade П-Ш) и олигоастроцитоме (Grade П-Ш) -молекулярно-генетическое исследование транслокации lp/19q в биопсийном (операционном) материале [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Поскольку негерминогенные герминативно-клеточные опухоли ЦНС
характеризуются повышением в плазме крови опухолевых маркеров (АФП (альфа-фетопротеин) и/или (3-ХГЧ (бета-хорионический гонадотропин человеческий)), при подозрении на данные опухоли, пациентам рекомендовано выполнение анализов крови на данные маркеры с целью дифференциальной диагностики опухолей [8].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Для уточнения прогноза при медуллобластомах у детей рекомендовано определение молекулярно-генетических подтипов опухоли (WNT, SHH, Group 3 (С) и Group 4(D)) [7,9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2.4 Инструментальные диагностические исследования
• Пациентам с опухолями ЦНС рекомендовано проведение МРТ головного и/или спинного мозга для оценки объема поражения тканей [5,7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Пациентам с опухолями ЦНС рекомендовано проводить МРТ головного мозга в 3 проекциях в стандартных режимах (Tl, Т2, FLAIR, Т1 + контраст) для оценки состояния тканей мозга [5,7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Пациентам старше 18 лет с опухолями ЦНС рекомендовано проведение ультразвукового исследования вен нижних конечностей, с целью оценки их проходимости и наличия тромбозов [6,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Пациентам с опухолями ЦНС рекомендовано проведение функциональной магнитно-резонансной томографии (фМРТ двигательных зон, речевых зон) и магнитно-резонансных исследований (МР) - МР-трактографии, МР-ангиографии, протонной МР-спектроскопии, МР-перфузии головного мозга [7,10].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• При подозрении на опухоль с риском диссеминации по оболочкам головного и спинного мозга (медуллобластома, пинеобластома, первичные герминативноклеточные опухоли ЦНС и др.), пациентам с опухолями ЦНС рекомендовано выполнить МРТ всего спинного мозга с контрастированием [5,7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендовано проведение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией головного мозга (ПЭТ головного мозга с аминокислотами (метионином, тирозином) в целях оценки метаболической активности опухоли и повторно в процессе лечения и наблюдения для оценки динамики метаболической активности [5,7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендовано проведение КТ головного мозга в дополнение к МРТ в случаях костных опухолей в целях лучшей визуализации костных структур [3, 5,7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: при показаниях рекомендовано проведение КТ-перфузии, КТ- ангиографии.
• Пациентам с опухолями ЦНС рекомендовано проведение электроэнцефалографии с целью оценки электрофизиологического состояния коры головного мозга [3].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендовано проведение биопсии опухоли (СТБ опухоли головного мозга, открытая биопсия опухоли головного мозга) с последующим патолого-анатомическим исследованием биопсийного материала с применением иммуногистохимических методов в случаях, когда хирургическое удаление невозможно или нецелесообразно, а также при подозрении на первичную лимфому ЦНС [11].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендовано проведение рентгенографии органов грудной клетки, ультразвуковое исследование органов брюшной полости, с целью подготовки к оперативному вмешательству [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2.5 Иные диагностические исследования
• Пациентам с опухолями ЦНС настоятельно рекомендована морфологическая и иммуногистохимическая верификация опухоли для подтверждения диагноза [7, 8, 111-
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендован пересмотр гистологических препаратов в условиях патоморфологического отделения онкологического учреждения (при выполнении биопсии в условиях онкодиспансера или онкологического отделения многопрофильной больницы) с целью уточнения морфологического диагноза [7,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендована консультация врача-онколога (центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) для определения тактики лечения и дальнейшей маршрутизации пациента [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендована консультация врача-нейрохирурга (в специализированном, хорошо оснащенном нейрохирургическом центре или отделении с опытом лечения нейроонкологических пациентов) с целью определения тактики лечения и оценки возможности проведения хирургического лечения [12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендуется проведение консилиума с участием врача-онколога, врача-нейрохирурга, врача-рентгенолога и врача-радиотерапевта в целях определения тактики лечения[6,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При подозрении на опухоль пинеальной области пациентам рекомендована консультация врача - эндокринолога с целью определения и коррекции возможных эндокринологических нарушений, опосредованных опухолевым процессом [12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями ЦНС рекомендован осмотр врачом-офтальмологом на предмет глазодвигательных, зрительных нарушений, а также для оценки признаков внутричерепной гипертензии на глазном дне [6,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3. Лечение
В целях обеспечения комплексного подхода к лечению пациентов со злокачественными глиомами необходимо формирование «нейроонкологической команды» с участием врачей-нейрохирургов, врачей-радиотерапевтов, врачей-онкологов, при необходимости привлечение врачей смежных специальностей.
Стандартными лечебными процедурами у пациентов с первичными опухолями ЦНС в настоящее время являются хирургия, радиотерапия, противоопухолевая лекарственная терапия. В процессе лечения регулярно должен проводиться контроль его эффективности: МРТ с контрастным усилением и без него в 3 проекциях и в стандартных режимах (Tl, Т2, FLAIR, Т1 + контраст) [12]. Частота выполнения зависит от гистологического диагноза и этапа лечения (см. Приложение Б). Оценка динамики опухоли проводится согласно критериям RAN О (см. Приложение Б).
3.1 Хирургическое лечение
Хирургическое удаление производится для максимально возможного уменьшения объема опухоли в целях разрешения внутричерепной гипертензии, уменьшения неврологического дефицита и получения достаточного количества морфологического материала.
Для хирургического лечения или биопсии пациент должен быть помещен в специализированное нейрохирургическое учреждение с опытом проведения нейроонкологических операций. Обязательным условием хирургии опухолей ЦНС является применение хирургического микроскопа, микрохирургической техники.
Хирургический доступ осуществляется путем костно-пластической трепанации в проекции планируемого хирургического вмешательства. •
• При операциях в анатомической близости от моторных зон коры или моторных путей, а также в области проекции ядер черепно-мозговых нервов и по ходу черепно-мозговых нервов пациентам с опухолями ЦНС рекомендовано использование интраоперационного электрофизиологического мониторинга [10].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам рекомендовано проведение хирургического лечения в течение 14 дней с момента постановки диагноза, в виду возможного нарастания неврологической симптоматики, приводящему к угрожающему жизни состоянию [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Для повышения радикальности нейрохирургического вмешательства пациентам с опухолями ЦНС рекомендовано использование нейронавигационных систем, а
также интраоперационной флуоресцентной навигации с применением 5-аминолевуленовой кислоты (5-АЛА) [10,13,14,15].Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• В послеоперационном периоде после удаления опухоли пациентам с опухолями ЦНС рекомендовано выполнение КТ с контрастированием или без него и/или МРТ с контрастным усилением или без него в течение 24-72 ч [7,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При глиоматозе головного мозга пациентам рекомендована верификация диагноза путем СТБ, так как от гистологического диагноза может зависеть выбор лечебной тактики (например, при олигодендроглиальных опухолях обычно показано определение коделеции lp/19q, при ее выявлении - назначение химиотерапии (XT) на основе нитрозопроизводных) [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: в зависимости от клинической ситуации, данных нейровизуализации, морфологического исследования, иммуногистохимических и молекулярно-генетических маркеров и мнения специалистов могут рассматриваться 3 подхода: наблюдение (если у пациента нет клинических симптомов заболевания), химиотерапия (XT) (ломустин• **, прокарбазин**, винкристин**/ломуспшн**/темозоломид**) и лучевая терапия (ЛТ) головного мозга.
• В отдельных клинических ситуациях противоопухолевая лекарственная терапия и/ или ЛТ могут планироваться на основании данных нейровизуализации и клинической картины по решению консилиума с участием врачей-нейрохирургов, врачей-онкологов, врачей-радиотерапевтов, врачей-рентгенологов и при необходимости с привлечением специалистов смежных специальностей (врачей-неврологов, врачей-радиотерапевтов, врачей-онкологов, врачей-офтальмологов и др.) [6, 7,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При узловых формах опухолей ствола мозга, экзофитном характере роста, МР-признаках полной или частичной ограниченности от структур ствола (например, при пилоидной астроцитоме) рекомендовано удаление опухоли (или открытая биопсия) [7,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При диффузном характере роста опухолей ствола (например, при диффузной глиоме моста - «диффузной понтинной глиоме») рекомендовано использование ЛТ и противоопухолевой лекарственной терапии без обязательной верификации [7,16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При глиомах четверохолмной пластинки после разрешения гидроцефалии пациентам рекомендовано регулярное клиническое и MPT-наблюдение (в случае прогрессирования опухоли рассматривается вопрос об удалении с последующей ЛТ) [7,16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При эпендимоме пациентам с опухолями ЦНС рекомендовано хирургическое удаление опухоли с максимальной резекцией опухоли [9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: Химиотерапия (XT) может использоваться в случаях рецидива эпендимомы (см. рис. 5). Режимы XT при эпендимомах указаны в разделе 3.3.
• При установлении гистологического диагноза эпендимомы или анапластической эпендимомы пациентам рекомендовано проведение МРТ головного и спинного мозга с контрастированием (в целях определения радикальности операции и выявления возможных спинальных метастазов) и исследование спинномозговой жидкости на опухолевые клетки [9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Как метод выбора в установлении диагноза лимфомы ЦНС пациентам рекомендована стереотаксическая биопсия (СТБ) [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При выявлении клинически значимого повышения одного или обоих маркеров ([3-ХГЧ - от 5 норм, АФП - более 2 норм) лечение пациента с первичной герминогенной (герминативно-клеточной) опухолью ЦНС рекомендовано начинать без гистологической верификации опухоли с XT [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При первичной (чистой) герминоме ЦНС пациентам рекомендовано проведение XT в режиме цисплатин** + этопозид** (см. раздел 3.3) с последующим облучением желудочковой системы головного мозга с суммарной очаговой дозой (СОД) 24 Гр (при отсутствии данных о наличии метастазирования по оболочкам спинного мозга) [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При поражении хиазмально-селярной области при первичной (чистой) герминоме ЦНС пациентам рекомендован динамический контроль на всех этапах лечения уровня гормонов гипофиза с участием врача-эндокринолога [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При неполном удалении/биопсии глиомы Grade II или при наличии более 1 фактора риска пациентам показано назначение ЛТ и/или XT (см. рис. 1) [7,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При субэпендимарной гигантоклеточной астроцитоме пациентам рекомендовано тотальное удаление опухоли [7].
• Пациентам с субэпиндимарной гигантоклеточной астроцитомой с диффузным поражением рекомендовано лечение эверолимусом** [18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с пилоидной астроцитомой рекомендовано хирургическое удаление (при условии операбельности опухоли) с выполнением МРТ в послеоперационном периоде для оценки радикальности операции [7].
Комментарий: в случае радикального удаления опухоли пациенту показано наблюдение; в случае остаточной опухоли - ЛТ.
• Пациентам детского возраста с глиомами хиазмы при наличии узловой формы и признаках прогрессии опухоли показано хирургическое лечение в целях уменьшения объема опухоли [19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Если же радикальная операция невыполнима или после операции есть остаточная опухоль, адъювантным методом лечения является ЛТ, объем которой определяется выявленной распространенностью опухоли (см. рис. 2) [9,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.2 Методы выбора проведения XT
• У детей старше 3 лет при отсутствии признаков нейрофиброматоза I типа и неэффективности XT рекомендуется проведение конформной ЛТ [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При наличии диффузной формы опухоли у детей и взрослых и наличии нейрофиброматоза I типа рекомендуется проведение XT на основе данных нейровизуализации и клинической картины без гистологического подтверждения диагноза [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с глиобластомой режимом выбора послеоперационного лечения является режим химиолучевой терапии с темозоломидом• ** (см. рис. 1): химиолучевая терапия с ежедневным приемом темозоломида** (75 мг/м2) (в течение всего курса ЛТ - 30 фракций по 2 Гр на фракцию), с последующими 6-12 курсами темозоломида** 150-200 мг/м2 5/23 (см. раздел 3.3)) [21, 22, 23].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Пациентам с анапластической астроцитомой рекомендованы либо ЛТ с последующими курсами противоопухолевой лекарственной терапии в режиме PCV или в виде монотерапии (ломустин**, темозоломид**), либо режим химиолучевой терапии с темозоломидом** (см. раздел 3.3) [18, 22, 23, 24].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При наличии коделеции lp/19q (+/- мутация ЮН-1,2) у пациентов с анапластической олигоастроцитомой и анапластической олигодендроглиомой в послеоперационном периоде рекомендованы как ЛТ, так и XT (PCV или монотерапия темозоломидом** 5/23) [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: в случае полного ответа на XT у пациентов с такими опухолями ЛТ может быть отложена в качестве резерва лечения при рецидиве (см. рис. 3).
• Пациентам старше 60 лет и/или с индексом Карновского 60 % (Приложение Г. Шкала оценки тяжести состояния пациента) и ниже с глиомой высокой степени злокачественности (Grade III—IV) ЛТ может проводиться в режиме гипофракционирования (10 фракций до СОД 34 Гр, 15 фракций до СОД 40 Гр, 15 фракций до СОД 45 Гр, 20 фракций до СОД 50 Гр) или назначается монотерапия темозоломидом** 5/23 [7, 42,43,44].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: назначение ЛТ и/или противоопухолевой лекарственной терапии пациентам с низким индексом Карновского и/или с признаками внутричерепной гипертензии, большой распространенностью опухоли решается индивидуально.
• Рекомендовано обсуждение пациентов с рецидивом глиомы онкологическим консилиумом (мультидисциплинарной командой) для выбора метода лечения (показания к хирургии/ЛТ/противоопухолевой лекарственной терапии) с участием врача-нейрохирурга, врача-онколога, врача-радиотерапевта, врача-рентгенолога и врачей других необходимых смежных специальностей [6,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: методами лечения пациентов с рецидивами глиом являются повторная хирургия, системная противоопухолевая лекарственная терапия, повторное облучение и паллиативная терапия (см. рис. 1). При небольших локальных рецидивах возможно применение радиохирургии или гипофракционированной ЛТ.
• В качестве противоопухолевой лекарственной терапии у пациента с рецидивами глиобластомы после 1-й линии лечения (химиолучевая терапия с темозоломидом• **) рекомендовано назначение схем с включением бевацизумаба** (см. раздел 3.3) [18, 24, 25, 26].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2)
• В качестве противоопухолевой лекарственной терапии у пациента с рецидивами анапластических астроцитарных и олигодендроглиальных опухолей Grade III рекомендовано назначение темозоломида** (если ранее не использовался или если использовался, но был достаточно длительный (не менее 6 мес) контроль болезни без лечения) (см. рис. 2, 3) [18, 23, 24].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: нитрозопроизводные могут также быть предложены, если они раньше не использовались. При олигодендроглиальных и анапластических астроцитарных опухолей стратегия зависит от использованной ранее схемы лечения. В случае применения радиотерапии назначается XT в режиме PCV; если использовались радиотерапия и XT PCV, то предпочтение отдается XT темозоломидом**. В случае первичного лечения только XTPCV возможно проведение радиотерапии.
• При плеоморфной ксантоастроцитоме рекомендовано удаление опухоли без проведения адъювантной терапии [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При первичной лимфоме ЦНС удаление опухоли в целях верификации диагноза рекомендовано в случаях локализации опухоли в опасных для выполнения СТБ областях мозга (например, мостомозжечковый угол, IV желудочек, небольшая опухоль в проекции III желудочка и др.) или для разрешения угрожающих жизни состояний, обусловленных большим объемом опухоли [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Лечение пациента с первичной лимфомой ЦНС рекомендовано осуществлять под руководством врача-онколога или врача-гематолога (см. рис. 6-7) [7, 27, 28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У детей с медуллобластомами рекомендована максимально возможная безопасная резекция опухоли. Тотальное удаление опухоли исключено, если опухоль инфильтрирует ствол головного мозга [9,19, 29].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У пациентов с опухолями ЦНС при наличии гидроцефалии, но без признаков окклюзионного синдрома шунтирующие операции до удаления опухоли не рекомендованы. При сохранении признаков повышения внутричерепного давления после удаления опухоли рекомендована вентрикулоперитонеостомия [9, 19, 20,29].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Основным принципом послеоперационного ведения пациента является стратификация пациентов на группы риска. К группе стандартного риска относятся пациенты с тотально и субтотально удаленной опухолью (<1,5 см2), отсутствием опухолевых клеток в ликворе, отсутствием метастазов (МО). К группе высокого риска относятся пациенты с наличием остаточной опухоли >1,5 см2 в максимальном сечении по данным МРТ и/или наличием опухолевых клеток в ликворе, и/или наличием метастазов в ЦНС, и/или метастазов вне ЦНС (М1-М4), пациенты с крупноклеточной или анапластической медуллобластомой, а также дети в возрасте младше 4 лет [9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.3 Лучевая терапия
Дистанционные методы лучевого лечения, или ЛТ, являются основным компонентом лечения большинства пациентов с опухолями ЦНС.
Лучевое лечение используется как самостоятельный метод терапии либо после хирургического удаления/биопсии опухоли, при возникновении рецидива/продолженного роста опухоли. ЛТ может проводиться как на область опухоли (на остаточную опухоль или на ложе опухоли), так и на пути возможного метастазирования (например, краниоспинальное облучение (КСО) в лечении медуллобластомы), а также в качестве буст-терапии (дополнительное облучение опухоли/ложа опухоли). Оптимальной методикой ЛТ является применение конформных техник облучения, которое позволяет осуществить максимально безопасное подведение дозы на область опухоли с минимально возможной лучевой нагрузкой на здоровые ткани с учетом толерантности прилегающих структур.
При планировании облучения пациентов с опухолями ЦНС проводят разметку с помощью мультиспиральной КТ, при возможности формируют индивидуальное фиксирующее устройство - термопластическую маску.
• Пациентам с крупными и/или диффузно растущими опухолями различной гистологической природы (в основном глиомы Grade I—IV, менингиомы, невриномы и др.), а также при проведении облучения путей возможного метастазирования опухоли (медуллобластомы, герминомы, анапластические эпендимомы и др.) рекомендован режим гипофракционирования с разовой очаговой дозой (РОД) 3 Гр, который возможно применять в медицинских учреждениях с опытом использования данной методики ЛТ [7, 30].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с небольшими опухолями (до 3 см в максимальном измерении), имеющими четкие границы, которые располагаются вне критических структур (глиомы (пилоидные астроцитомы, эпендимомы), менингиомы, невриномы, параганглиомы, аденомы гипофиза, параганглиомы, краниофарингиомы и др.) возможно проведение радиохирургического лечения - одномоментное подведение высокой дозы с использованием стереотаксической техники [11,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам при лечении злокачественных опухолей (Grade III—IV) рекомендовано начинать ЛТ в сроки до 6 нед. после операции, в ряде случаев комбинируя ее с противоопухолевой лекарственной терапией [18, 21] (см. раздел 3.3).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При планировании ЛТ для уточнения границ остаточной опухоли пациентам рекомендовано использовать данные МРТ с контрастированием, а также при необходимости ПЭТ/КТ головного мозга с аминокислотами (метионин, тирозин, холин и др.). Объем видимой опухоли (GTV) и клинический объем опухоли (CTV) определяются видом и степенью злокачественности опухоли. Отступ на планируемый объем опухоли (PTV) определяется в соответствии с характеристиками аппарата, системы фиксации и навигации [31].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При первом контроле (в течение 1 мес) после ЛТ глиомы, можно наблюдать феномен псевдопрогрессии: увеличение контрастируемой части опухоли при отсутствии
нарастания неврологической симптоматики и стабильных дозах кортикостероидов. В таком случае рекомендован МРТ-контроль через 1-3 мес. (суммарно 2-3 мес. после завершения ЛТ) в целях окончательной оценки динамики болезни [18, 32].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Для лучшей дифференциации послеоперационных изменений, более точного определения ложа удаленной опухоли в ряде случае при определении мишени целесообразно использовать дооперационные снимки [32]. В зависимости от локализации, объема опухоли, вовлеченности критических структур, предшествующих курсов ЛТ возможно уменьшение отступов и дозы облучения для снижения риска лучевых реакций и развития неврологического дефицита [33]. При рецидивирующем течении, агрессивном поведении опухоли возможна эскалация дозы относительно рекомендованных величин [33]. После проведения ЛТ возможно возникновение отдаленных постлучевых реакций и повреждений головного мозга, в том числе развитие лучевого некроза. Для дифференциации постлучевых осложнений и рецидива опухоли целесообразно использование дополнительного к МРТ с контрастированием ПЭТ/КТ головного мозга с аминокислотами (метионин, тирозин, холин и др.), МР-спектроскопии, КТ-перфузии и др. Для лечения клинически значимых постлучевых осложнений возможно применение стероидной терапии и/или назначение бевацизумаба** [7,26].
Лечение эпендимом
• Пациентам старше 1,5 лет при анапластической эпендимоме рекомендуется проведение адъювантной ЛТ с Разовой очаговой дозой (РОД) 1,8-2,0 Гр, суммарной очаговой дозой (СОД) 59,4 Гр (со снижением СОД до 54 Гр в области ствола, хиазмы, спинного мозга). При локальном облучении в CTV (Clinical Tumor Volume) включается остаточная опухоль или послеоперационная полость +10 мм [33].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам старше 1,5 лет после неполной резекции при эпендимоме G2 рекомендуется проведение адъювантной ЛТ с РОД 1,8-2,0 Гр, СОД 59,4 Гр. При локальном облучении в CTV включается остаточная опухоль с отступом до 10 мм [33].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с подтвержденным метастазированием в пределах ЦНС рекомендуется проведение краниоспинального облучения (КСО) [7, 9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с эпендимомой рекомендуется проведение КСО с СОД 36 Гр с РОД 1,8 Гр. При выявлении опухоли в спинном мозге рекомендуется проведение бусттерапии до 45-59,4 Гр [7, 9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Не рекомендуется проведение ЛТ у пациентов младше 1,5 года [9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При эпендимоме с локализацией в спинном мозге и неполной резекцией опухоли ЛТ проводится до СОД 45 Гр. Возможен буст до СОД 50,4-59,4 Гр [7, 9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Лечение гермином (герминативно-клеточных опухолей) и негерминомных герминативно-клеточных опухолей
Лечение локализованных чистых гермином
• При лечении чистых гермином рекомендуется облучение желудочковой системы [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при отсутствии возможности 3D-конформного облучения показано облучение всего головного мозга.
• После полихимиотерапии на основе препаратов платины для контроля заболевания рекомендуется облучение желудочковой системы в дозе 21,6-25,5 Гр с облучением ложа опухоли в дозе 30-40 Гр (при наличии остаточной опухоли) [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
GTV (Gross Tumor Volume) = область желудочковой системы + ложе опухоли
CTV = GTV + 5 мм
РОД = 1,8-2,0 Гр, СОД = 24 Гр
Лечение диссеминированных чистых гермином
При соответствующей лечебной стратегии контроль за заболеванием и прогноз для мультифокальных чистых гермином ЦНС такой же, как и при очаговых формах заболевания [17].
• В качестве стандартного подхода к лечению диссеминированных чистых гермином рекомендуется применение КСО с РОД 1,6-1,8 Гр до СОД 24-36 Гр с бустом на область остаточной опухоли и метастазов (если они визуализируются по данным МРТ с контрастным усилением после завершения курса КСО) до СОД 40-50 Гр [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение бифокальных чистых гермином
• При наличии бифокальных гермином без признаков диссеминации (могут считаться локализованными опухолями) рекомендуется полихимиотерапия с облучением желудочковой системы с РОД 1,8-2,0 Гр, СОД 24 Гр с локальным бустом или без него до СОД 40 Гр [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение рецидивов чистых гермином
• Пациентам с рецидивами чистых гермином рекомендуется применение хирургических методов лечения, локального облучения или облучения всей ЦНС и полихимиотерапию включая высокодозную XT с аутологичной пересадкой гематопоэтических стволовых клеток [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение негерминогенных герминативно-клеточных опухолей ЦНС
• Пациентам с негерминогенными герминативно-клеточными опухолями ЦНС рекомендуется применение полихимиотерапии на основе препаратов платины, ЛТ (КСО 24-35 Гр, локально 40-56 Гр), а также резекция остаточной опухоли [17].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение зрелых тератом
• В качестве основного метода лечения зрелых тератом рекомендуется рассматривать максимально возможное удаление опухоли [7, 21].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при тотальном удалении адъювантное лечение не требуется. При частичном удалении применяются стереотаксические методики ЛТ и радиохирургия.
Лечение глиом Grade I-II
• При глиомах низкой степени злокачественности рекомендуется проведение лучевой терапии с РОД 1,8-2,0 Гр до СОД 50,4-54 Гр. [7, 21].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• В объем облучения рекомендуется включать остаточную опухоль и/или ложе опухоли (для определения объемов облучения рекомендовано использование следующих режимов MPT: Т1 с контрастным усилением, T2/FLAIR). В CTV входит GTV + 0,5 см [7,21].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение глиом Grade III-IV
• В GTV рекомендуется включать остаточную опухоль и/или ложе опухоли. CTV = GTV + 1,5-2,0 см (рекомендовано использование следующих режимов MPT: Т1 с контрастным усилением, T2/FLAIR) [30].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется проводить облучение с РОД 1,8-2,0 Гр до СОД 59,4 Гр. [30].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: на дозе 46 Гр при РОД 2 Гр и 50,4 Гр при РОД 1,8 Гр возможно сокращения объема облучения (буст)
• На фоне ЛТ рекомендуете ярассмотреть прием темозоломида** [21] (см. раздел 3.3).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение медуллобластом
• У пациентов младше 3 лет рекомендовано облучение ложа опухоли. С 3 лет рекомендовано проведение КСО. В GTV включается остаточная опухоль и/или ложе опухоли (рекомендовано использование следующих режимов MPT: Т1 с контрастным усилением, T2/FLAIR). В CTV включают размер опухоли до операции + размер послеоперационного полости + 1,5 см [7, 9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Пациентам старше 3 лет рекомендуется:
• при стандартном риске применение КСО с РОД 1,6-2,0 Гр до СОД 23,4 Гр. На ложе опухоли подводится буст с РОД 1,8-2,0 Гр до СОД 54 Гр [7, 9];
• при высоком риске применение КСО с РОД 1,6-2,0 Гр до СОД 36 Гр. На ложе опухоли подводится буст с РОД 1,8-2,0 Гр до СОД 54-55,8 Гр [29];
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При облучении пациентов в возрасте до 16 лет рекомендуется обеспечить перепад дозы в телах позвонков не более 20 %, с целью уменьшения риска ассиметричного роста позвонков [29].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение диффузной глиомы моста/глиомы среднего мозга/глиомы ствола мозга
• Рекомендуется применение стереотаксической техники облучения до СОД 54 Гр за 30 фракций. В CTV включается видимая опухоль + ствол головного мозга + 0,5-1,0 см.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5). Лечение менингиом
Во всех случаях (менингиомы Grade I-III) GTV включает контрастируемую часть опухоли и гиперостотические изменения. Включение «дурального хвоста» в GTV решается в индивидуальном порядке. При менингиоме Grade II в GTV может быть включено ложе удаленной опухоли. При менингиоме Grade III в GTV обязательно следует включать ложе удаленной опухоли [33, 34].
При менингиомах Grade I GTV= CTV. Оптимальный захват CTV при менингиомах Grade II не определен. При менингиомах Grade III CTV= GTV + 1-2 см [33, 34].
• У пациентов с менингиомой Grade I рекомендуется лучевая терапия с РОД 1,8-2,0 Гр до СОД 50-54 Гр; с РОД 7,5 Гр до СОД 22,5 Гр; с РОД 5,5 Гр до СОД 27,5 Гр; при радиохирургическом лечении - 14-16 Гр [34, 35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У пациентов с менингиомой Grade II рекомендуется лучевая терапия с РОД 1,8-2,0 Гр до СОД 54-60 Гр; возможно радиохирургическое и гипофракционированное облучение с увеличением дозы по сравнению с Grade I [34, 35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У пациентов с менингиомой Grade III рекомендуется лучевая терапия с РОД 1,8-2,0 Гр до СОД 59,4-60 Гр; возможно радиохирургическое и гипофракционированное облучение с увеличением дозы по сравнению с Grade I [34, 35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Лечение лимфом
• Пациентам с первичной лимфомой ЦНС рекомендована XT на основе высокодозного метотрексата (3-8 г/м2, см. раздел 3.3) при возрасте пациента не старше 65 лет, индексе Карновского >50 (Приложение Г. Шкала оценки тяжести состояния пациента), сохранных функциях печени и почек (см. рис. 6, 7) [27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с первичной лимфомой ЦНС рекомендуется интраартериальная XT в условиях временного открытия гематоэнцефалического барьера [27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: данное лечение возможно только в стационарном режиме в условиях гематологического отделения или в стационаре XT с обязательным контролем уровня метотрексата в крови после его введения.
• В случае неполного ответа на лечение пациенту с первичной лимфомой ЦНС рекомендовано проведение ЛТ с облучением всего головного мозга в дозе 36 Гр (20 фракций по 1,8 Гр) с последующим выполнением МРТ головы с контрастным усилением и при необходимости с добавлением буста до СОД 45 Гр на сохраняющийся очаг контрастирования (см. рис. 7, 8) [28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: при выявлении лимфомы глаза показано дополнение лечения интравитриальным введением метотрексата и/или ЛТ пораженного глазного яблока (до СОД 40 Гр) [28].
3.4 Противоопухолевая лекарственная терапия первичных опухолей ЦНС
Показания и выбор схемы противоопухолевой лекарственной терапии зависят от гистологического диагноза: глиальные опухоли, медуллобластома, первичная лимфома ЦНС, первичные герминогенные опухоли ЦНС, паренхиматозные опухоли шишковидной железы (пинеобластома и пинеоцитома с промежуточной дифференцировкой), хориоидкарционома и др. [18].
Основные режимы противоопухолевой лекарственной терапии первичных опухолей ЦНС
Глиомы
• Рекомендовано при глиомах проведение XT в одном из следующих режимов в зависимости от клинической ситуации и состояния пациента:
• режиме PC: ломустин** (CCNU) 100 мг/м2 - день 1 + прокарбазин** 60 мг/м2 - дни 1-14; каждые 6 нед [7];
• в режиме ломустин** (CCNU) 110 мг/м2 - день 1; каждые 6 нед [24].
• темозоломид** 5/23: 150-200 мг/м2 - дни 1-5; каждые 28 дней (стандартный режим при Grade lll-lV) [7];
• темозоломид** в составе химиолучевой терапии 75 мг/м2 - ежедневно на протяжении всего курса ЛТ (стандартный режим при Grade III—IV) [21];
• темозоломид• ** 150-200 мг/м2 - дни 1-5 + цисплатин**/карбоплатин (карбоплатин AUC 3 или цисплатин** 80 мг/м2 - день 1); каждые 4 нед. [7];
• в режиме темозоломид** 150 мг/м2 - дни 1-5 + цисплатин** 20 мг/м2 - дни 1-5; каждые 4 нед. [7];
• темозоломид** 7/7:100 мг/м2 - дни курса 1-8 и 15-22, повтор каждые 28 дней [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендовано при рецидивах злокачественных глиом проведение XT в одном из следующих режимов в зависимости от клинической ситуации и состояния пациента:
• в режиме бевацизумаб** 5-10 мг/кг - дни 1, 15 + иринотекан 125-200 мг/м2 - дни 1, 15; каждые 28 дней [7, 25, 26];
• в режиме бевацизумаб** 5-10 мг/кг - дни 1, 15, 29 + ломустин** 90 мг/м2 - день 1; каждые 6 нед [24, 26];
• в режиме бевацизумаб** 5-10 мг/кг - дни 1,15 + ломустин** 40 мг/м2 - дни 1, 8, 15, 22; каждые 6 нед [25, 26];
• в режиме бевацизумаб** 5-10 мг/кг - дни 1,15; каждые 28 дней [25, 26].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при наличии мутации V600 BRAF в опухоли вопрос о проведении таргетной терапии решается индивидуально консилиумом.
Рекомендовано при первичной лимфоме головного мозгафоведение XT в одном из следующих режимов в зависимости от клинической ситуации и состояния пациента:
• в режиме метотрексат 3-8 г/м2 + дексаметазон** 8 мг/сут - дни 1-3; каждые 3 нед. проводится в стационарных условиях гематологического отделения или отделения химиотерапии [7, 27];
• в режиме ритуксимаб 375 мг/м2; каждые 3 нед [7];
• в режиме темозоломид** 150-200 мг/м2 - дни 1-5; каждые 28 дней + ритуксимаб 375 мг/м2; каждые 3 нед. [7, 28];
• в режиме темозоломид** 150-200 мг/м2 - дни 1-5; каждые 28 дней [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендовано при первичных герминативно-клеточных опухолях ЦНС проведение XT в режиме цисплатин** + этопозид** (см. ниже) каждые 21-28 дней [12];
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендовано при первичных негерминативно-клеточных опухолях ЦНС проведение XT в одном из следующих режимов в зависимости от клинической ситуации и состояния пациента:
• в режиме цисплатин• ** 25 мг/м2 - дни 1-4 + этопозид** 80 мг/м2 - дни 1-4; каждый 21 день [12,17];
• в режиме цисплатин** 20 мг/м2 - дни 1-5 + этопозид** 80 мг/м2 - дни 1-5 + ифосфамид** 1500 мг/м2 (+ месна) в/в в 1 й, 3 й, 5 й дни; каждые 3-4 нед [12,17];
• в режиме цисплатин** 20 мг/м2 - дни 1-4 + этопозид** 80 мг/м2 - дни 1-4 + циклофосфамид** 600мг/м2 -4 день; каждые 4-6 нед., всего 6 курсов лечения [12,
17].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендовано при медуллобластоме, пинеобластоме проведение XT в режиме Цисплатин** 20 мг/м2 - дни 1-4 + этопозид** 80 мг/м2 - дни 1-5 + циклофосфамид** 600 мг/м2 - день 4; каждые 4-6 нед, всего 6 курсов лечения [7].
3.5. Сопроводительная терапия
3.5.1. Кортикостероидная терапия
• При наличии нарастающего неврологического дефицита и признаках отека мозга (головная боль, спутанность сознания) пациентам рекомендовано назначение кортикостероидов (S01BA01 Дексаметазон**, Н02АВ06 Преднизолон** и др.) [18, 36].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: дозы кортикостероидной терапии зависят от выраженности симптоматики. Подбирается минимальная необходимая доза. После регресса симптомов необходимо постепенное снижение дозировки, при отсутствии возобновления симптомов - до полной отмены [40].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Одновременно с кортикостероидной терапией рекомендовано использовать гастропротекторы (Н2-гистаминные блокаторы или блокаторы протонной помпы) [18,40].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Салуретики (фуросемид**), осмотические диуретики (маннитол**) рекомендованы к применению при выраженном отеке и дислокации мозга в комплексе с кортикостероидами в условиях отделений интенсивной терапии [18,40].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.5.2. Противосудорожная терапия
• В случаях наличия судорожного синдрома (в том числе в анамнезе) или признаков эпилептиформной активности на электроэнцефалограмме пациентам с опухолями ЦНС рекомендовано назначение антиконвульсантов [12,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У пациентов, которым предполагается проведение XT, рекомендовано использование антиконвульсантов, не индуцирующих ферменты печени (вальпроевая кислота• **, ламотриджин, леветирацетам**). Использование
карбамазепина**, фенитоина, фенобарбитала** и др. не рекомендовано [12,18].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Профилактическое применение антиковульсантов у пациентов без истории эпилептических приступов не рекомендовано [12,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.5.3. Обезболивающая терапия
• Головную боль у пациентов с опухолями мозга рекомендовано купировать преимущественно стероидной терапией, но важно, чтобы при подозрении на перинатальное поражение ЦНС кортикостероиды не назначались до верификации диагноза [18, 36,40].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При нейропатических болях пациентам с опухолями головного мозга рекомендуется консультация врача-невролога и/или врача-психиатра [18, 36, 37].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: в остальных случаях используются нестероидные противовоспалительные препараты, трамадол**.
• Рекомендуется отмена нестероидных противовоспалительных препаратов за 5-7 сут до операции для снижения риска периоперационного кровотечения или же контроль гемостаза с использованием тромбоэластограммы [18, 36, 37].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с болевым синдромом, обусловленным поражением спинного мозга и/ или позвоночника с целью обезболивания рекомендован прием наркотических препаратов (тримеперидин**, фентанил** и др.) [18, 36, 37].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.5.4. Коррекция гемостаза
• В периоперационном периоде для предупреждения тромбоэмболии легочной артерии начиная с 3-х суток после операции пациентам с опухолями головного мозга рекомендовано назначение низкомолекулярных гепаринов (надропарин кальция, эноксапарин натрия**, далтепарин натрия и др.) [18, 38, 39].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При постоянном использовании пациентами антикоагулянтов/антиагрегантов (варфарин**, клопидогрел**, ацетилсалициловая кислота**, фениндион, аценокумарол и т.п.) рекомендовано переведение на низкомолекулярные гепарины (например, под контролем тромбоэластограммы перед операцией) не менее чем за 7 сут до операции с последующей отменой гепаринов за 12-24 ч до операции и восстановлением через 1-2 сут. [18, 38, 39].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При выявлении в процессе лекарственной терапии тромбозов вен нижних конечностей пациентам с опухолями головного мозга рекомендована терапия прямыми антикоагулянтами и решение вопроса о необходимости установки КАВА-фильтра [18, 38, 39].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: по завершении приема прямых антикоагулянтов лекарственную терапию опухоли можно возобновить, назначаются непрямые антикоагулянты на период 3-6 мес с соблюдением осторожности при развитии тромбоцитопении.
4. Реабилитация
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
5. Профилактика
• Пациентам с опухолями головного мозга рекомендовано регулярное выполнение МРТ головного мозга с контрастированием (в 3 проекциях в стандартных режимах -Tl, Т2, FLAIR, Т1 + контраст). Для отдельных патологий - также и МРТ всех отделов спинного мозга [7,18, 32].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с опухолями головного мозга рекомендована оценка МР-данных, в соответствии с критериями эффективности лечения RANO*(cm. Приложение Г.) [7,12, 18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Для пациентов с глиомами Grade I—II МРТ рекомендовано выполнять каждые 3-6 мес, Grade III—IV - каждые 2-3 мес, при первичной лимфоме ЦНС - каждые 2-4 мес. При первичных герминативно-клеточных опухолях, эпендимоме, медуллобластоме, пинеобластоме выполняется МРТ головного мозга с контрастированием и МРТ всех отделов спинного мозга с контрастированием каждые 2-3 мес в течение первых 2 лет наблюдения, затем - каждые 4-6 мес в течение 3-го и 4-го годов наблюдения, затем - 1 раз в год или при выявлении неврологической симптоматики. У пациентов с первичными негерминогенными герминативно-клеточными опухолями также проводится контроль опухолевых маркеров [7,12,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• После завершения лечения пациента с первичной негерминогенной герминативноклеточной опухолью ЦНС рекомендовано проведение контрольного МРТ головного и спинного мозга проводить каждые 3 мес (+ контроль опухолевых маркеров) в течение первых 2 лет наблюдения, затем - каждые 6 мес в течение последующих 3-4 лет наблюдения, затем - 1 раз в год или при выявлении неврологической симптоматики [7,12,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• После завершения лечения пациентов с первичной (чистой) герминомой ЦНС рекомендовано проведение контрольного МРТ головного и спинного мозга каждые 3 мес в течение 1-го года наблюдения, затем - каждые 6 мес в течение последующих 2-3 лет наблюдения, затем - 1 раз в год или при выявлении неврологической симптоматики [18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• После завершения лечения пациента с эпендимомой рекомендовано проведение контрольных обследований (МРТ головного и спинного мозга с контрастированием и клиническое обследование) не реже 1 раза в 3 мес на протяжении 1-го года наблюдения, затем при отсутствии данных о прогрессирование - не реже 1 раза в 6 мес или при выявлении неврологической симптоматики [9,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: в случае прогрессирования в виде солитарного очага рассматривается вопрос о повторном облучении или хирургическом лечении.
• В случае достижения полной ремиссии у пациентов с диагнозом первичной лимфомы ЦНС после проведения противоопухолевой лекарственной терапии рекомендовано наблюдение врачом-онкологом или врачом-гематологом [7,12, 28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• В случае выполнения максимальной резекции эпендимомы рекомендовано наблюдение пациента (при отсутствии признаков метастазирования в виде наличия клеток опухоли в ликворе или спинальных метастазов по данным МРТ спинного мозга с контрастированием).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При рецидивах лимфомы ЦНС решение о методе лечения пациента рекомендовано принимать исходя из времени с момента первичной верификации, продолжительности ремиссии, общего состояния пациента, распространенности опухоли на момент рецидива [18, 28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Схемы алгоритмов лечения первичных опухолей головного мозга соответственно различным гистологическим группам приведены в Приложении Б.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», «нейрохирургия», «радиотерапия», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• в соответствии с порядком оказания помощи по профилю «нейрохирургия», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом, нейрохирургом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента неврологических симптомов, характерных для опухоли головного/спинного мозга, он направляется к врачу-неврологу и/или на проведение МРТ головного и/или спинного мозга с контрастным усилением.
При выявлении признаков объемного процесса в головном/спинном мозге пациент направляется на консультацию к нейрохирургу для определения дальнейшей тактики лечения. В случаях, когда данные обследования головного/спинного мозга не позволяют исключить метастатическое поражение головного мозга, пациент направляется в центр амбулаторной онкологической помощи для первичного онкологического обследования. Если выявленное объемное образование в головном/спинном мозге в совокупности с клиническими проявлениями представляет непосредственную угрозу жизни, пациент госпитализируется для проведения нейрохирургического лечения в соответствии с порядком оказания помощи по профилю «нейрохирургия».
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию.
При выявлении признаков онкологического заболевания в головном/спинном мозге пациент направляется в отделение/учреждение нейрохирургического профиля, где решение о хирургической тактике принимается в соответствии с порядком оказания медицинской помощи по профилю «нейрохирургия»
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей- онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
2. наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, дистанционная и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/ или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Показания к направлению пациента в другую медицинскую организацию
Исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациентам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи, рекомендуется воспользоваться системой маршрутизации в другие медицинские организации, в том числе за пределы субъекта Федерации, в том числе в Федеральные центры, имеющие соответствующую оснащенность и кадры.
Клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации, рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в Федеральные или национальные медицинские исследовательские центры для уточнения тактики лечения.
Выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению данного этапа лечения, требует маршрутизации в профильные медицинские организации.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
Одним их основных критериев в выработке программы лечения глиом остается морфологическое заключение. Довольно редко учитывается разработанная для опухолей высокой степени злокачественности классификация RPA с выделенными в ней факторами риска. Классификация RPA объединяет такие факторы, как возраст пациента, индекс Карновского, психическое состояние, проведенное хирургическое лечение, морфологический диагноз, и позволяет определить медиану выживаемости и дозу, которую необходимо подвести в процессе ЛТ. (Приложение Г. Классификация RPA)
Критерии оценки качества медицинской помощи
Таблица 3. Критерии оценки качества медицинской помощи
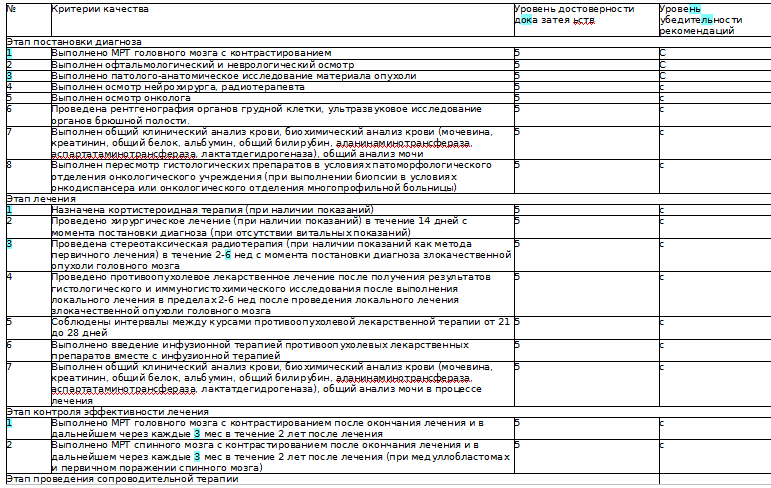

1. Ostrom О.Т., Gittleman Н., Liao Р. et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2007-2011. Neuro Oncol 2014;16 Suppl 4:ivl-63.
2. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016;131(6):803-20. DOI: 10.1007/s00401-016-1545-1.
3. Неврология. Национальное руководство. Под ред. Е.И. Гусева, А.Н. Коновалова, В.И. Скворцовой, А.Б. Гехт. М.: ГЭОТАР-Медиа, 2009.
4. Онкология: национальное руководство. Под ред. В.И. Чиссова, М.И. Давыдова. М.: ГЭОТАР-Медиа, 2008.
5. В.Н. Корниенко, И.Н. Пронин. Диагностическая нейрорадиология. В 4 т. М.: Москва, 2008-2012 г.
6. "Об утверждении стандарта специализированной медицинской помощи при новообразованиях головного мозга и мозговых оболочек". Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. № 715н.
7. NCCN Clinical Practice Guidelines in Oncology ((NCCN Guidelines®). Central Nervous System Cancers. Version 3.2019.
8. Kortmann R.D. Current concepts and future strategies in the management of intracranial germinoma. Expert Rev Anticancer The. 2014;14:105-19.
9. HIT-MED Therapy Guidance Version 4.0 - 0.2, May 2017
10. Лошаков B.A., Жуков В.Ю., Пронин И.Н. и др. Планирование хирургического доступа при удалении внутримозговых опухолей больших полушарий с использованием фМРТ, навигационных систем и электрофизиологического мониторинга. Вопросы нейрохирургии им. Н.Н. Бурденко 2010;(2):9-13.
11. Меликян А.Г. Стереотаксические методы в диагностике и лечении опухолей головного мозга. Дис.... д-ра мед. наук. М., 1997.
12. Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии (RUSSCO). М., 2017.
13. De Witt Hamer Р.С., Robles S.G., Zwinderman A.H. et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. Neurooncology 2011;13 (Suppl 3).
14. Stummer W., Pichlmeier U., Meinel T. et al. ALA-Glioma Study Group. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol 2006;7(5):392-401.
15. Горяйнов C.A., Потапов A.A., Пицхелаури Д.И. и др. Интраоперационная флуоресцентная диагностика и лазерная спектроскопия при повторных операциях по поводу глиом головного мозга. Вопросы нейрохирургии им. Н.Н. Бурденко 2014;2:18-25.
16. Кобяков Г.Л. Химиотерапия в комплексном лечении больных с первичными злокачественными опухолями головного мозга. Дис.... д-ра мед. наук. М., 2012.
18. Кобяков Г. Л., Абсалямова О. В., Аникеева О. Ю., Бекяшев А.Х., Голанов А. В., Коновалов А.Н. и соавт. Практические рекомендации по лекарственному лечению первичных опухолей центральной нервной системы // Злокачественные опухоли. -2015. - № 4, спецвыпуск. - С. 55-79.
19. Nalin Gupta., Pediatric CNS Tumors. Pediatric Oncology, Springer 3rd ed. 2017 Edition.
20. Robert Carachi. The Surgery of Childhood Tumors. Springer, Third Edition 2008.
21. Stupp R., Hegi M.E., Mason W.P. et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial.; European Organisation for Research and Treatment of Cancer Brain Tumour and Radiation Oncology Groups; National Cancer Institute of Canada Clinical Trials Group. Lancet Oncol 2009;10(5):459-66.
22. Stupp R., Brada M., van den Bent MJ. High-grade glioma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014 Sep:25 Snppl S:iii9S-101.
23. Birk H.. Han S.. Butowski N.. Treatment options for recurrent high-grade glioma. CNS Oncol. 2017 Tan: 6(1): 61-70.
24. Taal W.. Oosterkamp H.M.. Walenkamp A.M. et al. Single-agent hevacizumah or lomustine versus a comhination of hevacizumah plus lomustine in patients with recurrent gliohlastoma 1BELOB triall: a randomised controlled phase 2 trial. Lancet Oncol 2014:15191:943-53. DPI: 10.1016/S1470-2045H4170314-6.
25. Vredenhurgh 1.1.. Desjardins A.. Herndon l.E. 2— et al. Phase II trial of hevacizumah and irinotecan in recurrent malignant glioma. Clin Cancer Res 2007:13141:1253-9.
26. Friedman H.S.. Prados M.D.. Wen P.Y. et al. Bevacizumah alone and in comhination with irinotecan in recurrent gliohlastoma. 1 Clin Oncol 2009:27:4733-40.
27. Angelov L.. Doolittle N.. Kraemer D. et al. Blood-hrain harrier disruption and intra-arterial methotrexate-based therapy for newlv diagnosed primary CNS lvmphoma: a multi-institutional experience. ICO 2009:3503-9.
28. DeAngelis L.M.. Seiferheld W.. Schold S.C. et al. Comhination chemotherapy and radiotherapy for primary central nervous system lvmphoma: Radiation Therapy Oncology Croup Study 93-10.1 Clin Oncol 2002:20:4643-8.
29. Kunshner L.L. Lang F.F. Medulloblastoma. Youmans Neurological Surgery. Ed. hv H.R. Winn. 5— edn. Philadelphia. PA: Saunders. 2004. Vol. 1. Pp. 1031-1042.
30. Wirsching H.G.. Galanis E.. Weller M. Gliohlastoma. Handh Clin Neurol 2016:134:381-97. DPI: 10.1016/B978-0-12-802997-8.00023-2.
31. Maximilian Nivazi. Michael Brada et al. ESTRO-ACROP guideline “target delineation of glioblastomas” // Radiotherapy and Oncology 118 120161 35-42.
32. Трофимова Т.Н. Нейрорадиология: Опенка эффективности хирургии и комбинированной терапии глиом. Практическая онкология. Т. 17. №1. 2016
33. N.Y. Lee et al. (eds.). Target Volume Delineation for Conformal and Intensity-Modulated Radiation Therapy. 3 Medical Radiology. Radiation Oncology. DPI: 10.1007/174 2014 1005
34. Goldbrunner R.. Minniti G.. Preusser M.. EANO guidelines for diagnosis and treatment of meningiomas. Lancet Oncol. 2016 Sep: 17(9):e383-91
35. Галкин M.B. Стереотаксическая лучевая терапия в лечении менингиом медиальных отделов средней черепной ямки. Дисс канд. мед, наук. М.. 2011
36. Когония Л.М.. Волошин А.Г.. Новиков Г. А.. Сидоров А. В. Практические рекомендации по лечению хронического болевого синдрома v онкологических больных // Злокачественные опухоли: Практические рекомендации RUSSCO #5s2. 2018 (том 8"). с 617-655.
37. NCCN Clinical Practice Guidelines in Oncology (YNCCN Guidelines®!. Adult Cancer Pain. Version 3. 2019
38. Сомонова O.B.. Ahtvx Э. А.. Елизарова А. Л.. Матвеева И. И.. Сельчук В. Ю.. Черкасов В. А. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных //
Злокачественные опухоли: Практические рекомендации RUSSCO #3s2. 2018 (том 81. с. 604-609.
39. NCCN Clinical Practice Guidelines in Oncology (YNCCN Guidelines®!. Cancer Associated Venous Thromboembolic Disease. Version 3. 2019
40. Ainaz Sourati. Ahmad Ameri. Acute Side Effects of Radiation Therapy: A Guide To Management. Springer. 2017.
41. Vargo M.. Brain Tumor Rehabilitation. American Journal of Physical Medicine and Rehabilitation. v901Suppl 1). 2011. p50-62
42. Харченко В.П.. Паньшин Г.А.. Сотников B.M.. Измайлов Т.Р. Новые режимы лучевой терапии злокачественных опухолей головного мозга. Разрешение ФС№ 2009/147 от 11.06.09г.
43. Wick W. et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NQA-08 randomised, phase 3 trial //The lancet oncology. -2012. -T. 13. -№. 7. -C. 707-713
44. Malmstrom A. et al. Temozolomide versus standard 6-week radiotherapy versus hvpofractionated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial //The lancet oncology. - 2012. - T. 13. - №. 9. - C. 916-926.
Приложение А1. Состав рабочей группы
1. Измайлов Т.Р., д.м.н., заведующий дневным радиотерапевтическим стационаром клиники радиотерапии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России.
2. Кобяков Г.Л., д.м.н., руководитель группы химиотерапии ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
3. Банов С.М., к.м.н., врач-онколог, ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России, Центр «Гамма-нож».
4. Бекяшев А.Х., д.м.н., заведующий отделением нейрохирургии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Важенин А.В., д.м.н., академик РАН, главный врач ГЛПУ «Челябинский окружной клинический диспансер».
6. Виноградова Ю.Н., д.м.н., руководитель отдела лучевых и комбинированных методов лечения ФГБУ «Российский научный центр радиологии и хирургических технологий им. А.М. Гранова» Минздрава России.
7. Голанов А.В., чл.-корр. РАН, д.м.н., заведующий отделением радиологии и радиохирургии ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
8. Горелышев С.К., д.м.н. заведующий 1-м нейрохирургическим отделением (детская нейрохирургия) ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
9. Гриневич В.Н., к.м.н., заведующий патологоанатомическим отделением ГБУЗ г. Москвы «Московская городская онкологическая больница № 62 Департамента здравоохранения г. Москвы».
10. Драпкина О.М., чл.-корр. РАН, д.м.н. директор ФГБУ «НМИЦ центр профилактической медицины» Минздрава России.
11. Зайцев А.М., к.м.н. заведующий нейрохирургическим отделением МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
12. Коновалов Н.А., чл.-корр. РАН, д.м.н., заведующий спинальным отделением ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
13. Маряшев С.А., д.м.н., старший научный сотрудник ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
14. Насхлеташвили Д.Р., к.м.н., старший научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
15. Новиков С.Н., д.м.н., заведующий радиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
16. Потапов А.А., д.м.н., академик РАН, директор ФГАУ «НМИЦ нейрохирургии им. академика Н.Н. Бурденко» Минздрава России.
17. Пронин И.Н., академик РАН, д.м.н., заместитель директора ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
18. Росторгуев Э.Е., к.м.н., заведующий отделением нейроонкологии ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России.
19. Рыжова М.В., д.м.н., заведующая патологоанатомическим отделением ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
20. Смолин А.В., к.м.н., начальник радиологического центра, ФГБУ «Главный военный клинический госпиталь им. Н.Н. Бурденко» Минобороны России.
21. Снеговой А.В., д.м.н., заведующий отделением амбулаторной химиотерапии «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
22. Таняшин С.В., д.м.н, профессор, преподаватель кафедры нейрохирургии с курсами нейронаук ФГАУ «НМИЦ нейрохирургии им. Н.Н. Бурденко» Минздрава России.
23. Чойнзонов Е.Л., академик РАН, д.м.н., директор НИИ онкологии ФГБНУ «Томский НИМЦ РАН».
25. Феденко А.А., заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
26. Гулидов И.А., заведующий отделом лучевой терапии МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
27. Филоненко Е.В., заведующий Центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
Блок по организации медицинской помощи:
1. Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
2. Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3. Иванов С.А., д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ НМИЦ онкологии им. Н.Н. Блохина.
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендации
• врачи-нейрохирурги;
• врач-неврологи;
• врач-онкологи;
• врачи-радиотерапевты;
• Врачи-патологоанатомы;
• студенты медицинских вузов, ординаторы, аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 - Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)


Приложение АЗ. Связанные документы
Данные клинические рекомендации разработаны с учетом следующих нормативноправовых документов:
• Федеральный закон № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», Москва, 2013.
• Приказ Минздрава России от 15 ноября 2012 г. № 931н «Об утверждении порядка оказания медицинской помощи взрослому населению по профилю «нейрохирургия».
• Приказ Минздрава России от 7 июля 2015 г. № 422ан «Об утверждении критериев оценки качества медицинской помощи».
• Приказ Минздрава России от 15 ноября 2012 г. № 915н «Об утверждении порядка оказания медицинской помощи населению по профилю «онкология».
Форма помощи. Проведение диагностических и лечебных мероприятий пациентам при первичных опухолях ЦНС может носить как плановый, так и неотложный характер.
Неотложные мероприятия осуществляются в случае развития гипертензионно-гидроцефального синдрома, признаков вклинения головного мозга, кровоизлияния в опухоль.
Условия оказания медицинских услуг. Проведение диагностических мероприятий на этапе постановки диагноза и в период наблюдения или между этапами лечения, а также предоперационные обследования, в том числе лабораторные, осуществляются в амбулаторных условиях. Проведение хирургического лечения осуществляется в условиях специализированного нейрохирургического стационара, имеющего нейрохирургическую операционную и оснащенного в соответствии с Приказом Минздрава России от 15 ноября 2012 г. № 931н «Об утверждении порядка оказания медицинской помощи взрослому населению по профилю «нейрохирургия», имеющего опыт проведения рассматриваемого вида хирургических операций и специалистов, прошедших специализированную подготовку, с опытом работы не менее 5 лет.
Проведение лучевого (радиохирургического) лечения возможно как в стационарных, так и в амбулаторных условиях или условиях дневного стационара.
Приложение Б. Алгоритмы ведения пациента
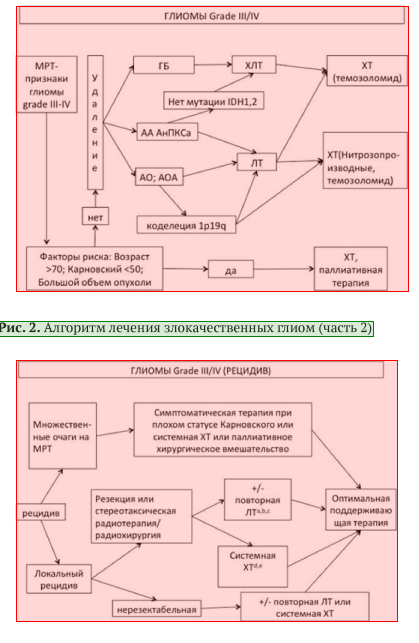
Рис. 3. Алгоритм лечения злокачественных глиом (часть 3)
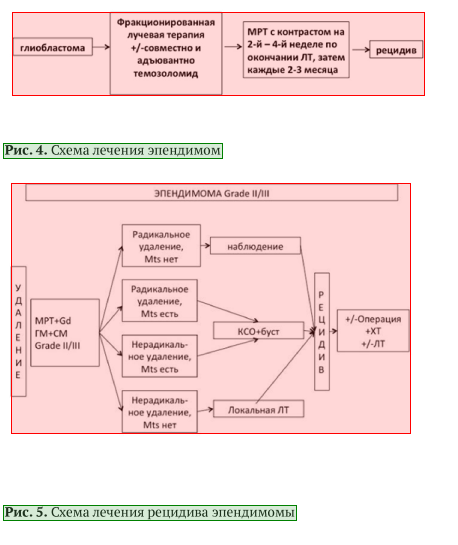
Приложение В. Информация для пациентов
Под первичной профилактикой злокачественных новообразований понимается предупреждение возникновения злокачественных опухолей и предшествующих им предопухолевых состояний путем устранения или нейтрализации воздействий неблагоприятных факторов окружающей среды и образа жизни, а также путем повышения неспецифической резистентности организма. В соответствии с современными данными о механизмах канцерогенеза у человека и роли воздействия канцерогенных факторов в возникновении онкологических заболеваний первичная профилактика рака проводится по следующим направлениям.
Онкогигиеническая профилактика, т. е. выявление и устранение возможности действия на человека канцерогенных факторов окружающей среды, а также выявление и использование возможностей уменьшения опасностей такого воздействия. Спектр форм воздействия в этом направлении чрезвычайно обширен, и можно конкретизировать лишь основные из них, такие как образ жизни и питание человека.
Большое значение в возникновении злокачественных опухолей придается действию ионизирующих излучений, ультрафиолетовому облучению, а также неионизирующим электромагнитным излучениям радио- и микроволнового диапазона. Установлена отчетливая связь стрессовых ситуаций (событий) в жизни человека с возникновением злокачественных новообразований. Риск возникновения этих заболеваний резко возрастает при эмоциональной подавленности невротического характера вследствие нервно-психической травмы.
Вторичная профилактика злокачественных новообразований представляет комплекс мероприятий, направленных на выявление предопухолевых заболеваний, раннюю диагностику онкологических заболеваний, что обеспечивает эффективность их хирургического (и других видов противоопухолевого) лечения. В осуществлении этого вида профилактики имеет значение применение цитологических, гистологических, эндоскопических, рентгенологических и других специальных методов обследования.
Диспансеризация населения, формирование групп повышенного онкологического риска и их углубленное обследование позволяют повысить выявляемость предраковых заболеваний и злокачественных новообразований на ранних стадиях.
На ранних этапах течения заболевания пациентов с первичными новообразованиями головного мозга может насторожить комплекс различных симптомов.
Таблица 5. Тактика ведения пациента и виды лечения при различных симптомах
Приложение Г.
Приложение Г1. Критерии оценки эффективности лечения опухолей ЦНС по RANO
Название на русском языке: Критерии оценки эффективности лечения опухолей ЦНС по RANО
Оригинальное название (если есть): Response assessment in neuro-oncology criteria
Источник (официальный сайт разработчиков, публикация с валидацией): Ouant, Е. С., & Wen, Р. Y. Response Assessment in Neuro-Oncology. Current Oncology Reports, 13(1), 50-56. (2010).
Тип (подчеркнуть):
шкала оценки
индекс
вопросник
Назначение: оценки эффективности лечения опухолей ЦНС Содержание:
Критерии оценки эффективности лечения опухолей ЦНС по RANO (международной группы Response Assessment in Neuro-Oncology)
B03/EC0G
Название на русском языке: Шкала оценки тяжести состояния пациента по версии B03/EC0G
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Oken ММ, Creech RH, Tormey DC, Horton J, Davis ТЕ, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655
De Kock, I., Mirhosseini, M., Lau, F., Thai, V., Downing, M., Ouan, H., Yang, J. Conversion of Karnofsky Performance Status (Kps) and Eastern Cooperative Oncology Group Performance Status (Ecog) to Palliative Performance Scale (Pps), and the interchangeability of Pps and Kps in Prognostic Tools. Journal of Palliative Care, 29(3), 163-169. (2013).
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).Приложение ГЗ. Классификация RPA (RTOG)
Li, J., Wang, M., Won, M., Shaw, E. G., Coughlin, C., Curran, W. J., & Mehta, M. P. (2011).
Validation and Simplification of the Radiation Therapy Oncology Group Recursive Partitioning Analysis Classification for Glioblastoma. International Journal of Radiation Oncology*Biology*Physics, 81(3), 623-630.
Приложение Г4. Шкала Карновского
Название на русском языке: Шкала Карновского
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In:
Evaluation of chemotherapeutic agents, edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191-205
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание (шаблон):
Шкала Карновского
100— Состояние нормальное, жалоб нет 90— Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80— Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70— Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60— Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50— Нуждается в значительной помощи и медицинском обслуживании
40— Инвалид, нуждается в специальной помощи, в т.ч. медицинской 30— Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20— Тяжелый больной. Необходимы госпитализация и активное лечение 10— Умирающий
0— Смерть
Ключ (интерпретация): приведен в самой шкале
Теги: первичные опухоли
234567 Начало активности (дата): 06.02.2023 13:59:00
234567 Кем создан (ID): 989
234567 Ключевые слова: герминома, опухоли, хориокарцинома, нервная система, первичные опухоли
12354567899
Похожие статьи
Опухоли средостенияОпухоли невыявленной первичной локализации
Рентген на дому 8 495 22 555 6 8
Нодальные Т-клеточные лимфомы
Множественная миелома



