 05.05.2022
05.05.2022
Трабекуляризация корковой пластинки при хроническом остеомиелите
Данные литературы и анализ собственного материала свидетельствуют об изменении плотности корковой пластинки длинных костей у больных хроническим остеомиелитом на всем протяжении, однако характер и степень структурных нарушений коркового слоя вне зоны воспаления, представляют собой неизученную область рентгеноморфологии
ВВЕДЕНИЕ
При исследовании методом микрокомпьютерной томографии были выявлены значительные изменения структуры кортикальной кости, которые обычно наблюдаются в пожилом возрасте и при остеопорозе (кортикальная пористость (cp), истончение коры (ct) и трабекуляризация (тр)) [1, 2]. Авторы определяли «корковую пористость» как значительное увеличение количества и слияние пор, «истончение коры» как уменьшение толщины корковой пластинки и термин «трабекуляризация» как появление трабекулярных структур внутри кортикального компартмента, предоженныый R. Zebaze et al. (2010). Было предположено, что «интракортикаль-ное ремоделирование вызывает формирование пористости и корковых фрагментов, которые напоминают трабекулы». Высказанное мнение позволяет оценить риск переломов и морфологические эффекты роста, старения, заболеваний и возможного лечения [3]. Изменение качества кости при трабекуляризации проявляется ухудшением микроструктуры в виде перфорации трабекул, истончения и потери связи между ними, а также истончения кортикального слоя и повышенной пористости наряду с другими изменениями в кости, такими как состав и степень сшивки коллагена [4]. Y. Kameo et al. (2020) предложили новую теоретическую концепцию математической модели ремоделирования кортикальной и губчатой костей, которая должна способствовать выявлению основных особенностей потери кортикальной кости из-за различных причин, в частности при старении, когда уменьшается нагрузка на кость, и начинают преобладать процессы резорбции под влиянием биохимических факторов, выделяемых остеоци-тами. С помощью компьютерного моделирования продемонстрировано, как кость моделируется в процессе роста в зрелую трехмерную трабекулярную структуру. Снижение нагрузки приводит к потере костной массы из-за истончения трабекул и потери трабекулярных связей, тогда как повышение нагрузки приводит к утолщению трабекул [5]. Анализируя литературу, Y. Bala et al. (2015) предположили, что потеря прочности кортикального слоя кости является результатом дисбаланса внутрикортикального и эндокортикального ремоделирования в результате уменьшения механического фактора (нагрузки) и активизации биохимических процессов в результате деятельности остеоцитов, что приводит к пористости и истончению коры, объясняя этим хрупкие переломы, связанные, в основном, с возрастом [6]. R. Huiskestn et al. (2000) предположили, что биохимические сигнальные каскады инициируются механическими сигналами. Было показано, что факторы роста, такие как TGF-b, высвобождаются во время фазы резорбции. Эти факторы являются мощными стимуляторами образования остеобластов. Другая форма связи, существование которой недавно было доказано, заключается в том, что клетки линии остеобластов, которые экспрессируют RANKL, участвуют в созревании и активации остеокластов, выделяющих RANK, являющийся рецептором для RANKL, распознают RANKL посредством прямого межклеточного взаимодействия и затем дифференцируются в остеокласты [7, 8]. Явление трабекуляриза-ции было изучено с помощью микроКТ и электронной микроскопии [9, 10, 11]. В работе C. Chen et al. (2018) было показано, что современные сканеры МСКТ подходят для эффективной количественной визуализации периферической микроархитектоники кости, если ориентироваться на определенные количественные показатели [12]. На возможность количественного изучения некоторых характеристик кости методом МСКТ указано также в работах SA Holcombe et al., (2018) и S. Zachary et al. (2019) [13, 14]. G. Iori et al. (2019) показали, что микроструктурные характеристики большеберцовой кости (толщина кортикальной кости и преобладание больших пустот) принимаются во внимание как биомаркеры механического повреждения бедра в качестве альтернативы или в дополнение к стандартным DXA [9].
Проведенные нами ранее исследования показали, что методом МСКТ было выявлено уменьшение толщины корковой пластинки вне зоны деструкции или очага воспаления, изменение плотности кости, которая для кортикальной и трабекулярной костей значительно отличается [15].
Поскольку исследования Zebaze et al. (2010) были выполнены с помощью периферической компьютерной томографии высокого разрешения и сканирующей электронной микроскопии для количественной оценки и сравнения корковой и трабекулярной кости, предложенные показатели не могли быть изучены при помощи МСКТ, но определить уменьшение толщины корковой пластинки и ее слоев возможно. МСКТ также позволяла качественно оценить изменение структуры корковой пластинки, характерной для отделов кости, имеющих трабекулярное строение, а также измерить ее плотность [3].
Цель исследования. Изучить особенности строения корковой пластинки бедренной и большеберцовой костей вне очага воспаления, степень изменения ее строения в виде трабекуляризации.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование ретроспективное, одноцентровое. Уровень доказательности - IV. Критерии включения: наличие хронического остеомиелита бедренной и большеберцовой кости без тотального поражения, полный МСКТ-архив. Критерии исключения: тотальное поражение кости.
Исследование выполнено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации с поправками Минздрава РФ, одобрено этическим комитетом ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России. Все больные подписали информированное согласие на публикацию данных без идентификации личности.
Статистическую обработку параметров плотности проводили с помощью программы Attestat, встроенной в Microsoft Excel. Для подтверждения выводов о различиях между полученными результатами в двух группах, учитывая малые выборки, применяли U-критерий Манна-Уитни. Выборочные параметры, приводимые далее в таблицах, имели следующие обозначения: М -среднее, ст - стандартное средне-квадратичное отклонение, n - количество больных, р - достигнутый уровень значимости. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Полипозиционная рентгенография и МСКТ выполнена до лечения 86 больным хроническим остеомиелитом бедренной и большеберцовой кости в возрасте от 18 до 65 лет, проходившим лечение в клинике Гнойной остеологии «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России. Среди обследованных было 72 мужчины,
14 женщин. Причиной воспалительного процесса в кости в 75 случаях была травма или операция, в одиннадцати - последствия гематогенного остеомиелита. В 96,5 % случаев была 3 группа по Cierny-Mader, в 3,5 % — 2 (2) и 4 (1). Наиболее частой локализацией хронического остеомиелита был дистальный отдел бедренной (24) и большеберцовой костей (25), у 13 больных воспаление локализовалось в проксимальном отделе бедренной кости, в
15 случаях - в средней трети большеберцовой кости, в 9 - на границе средней и нижней трети голени. У 11 больных сформировался ложный сустав или дефект кости. Исследования выполняли на компьютерных томографах «Toshiba Aquilion-64», «GE Lihgt Speed VCT». МСКТ проводили с использованием специального алгоритма реконструкции «BONE».
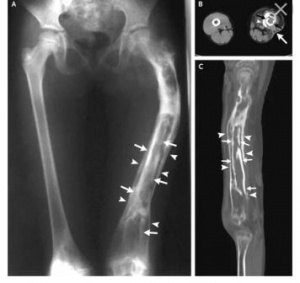
Обработку аксиальных срезов проводили в режиме мультипланарной реконструкции (MPR) в корональной и сагиттальной плоскостях. Изучали строение корковой пластинки на расстоянии 3-5 см от зоны деструкции в различных ее отделах: в прилежащих к периосту участках, на расстоянии от 2 до 7 мм, в зоне, прилежащей к эндосту. Измеряли толщину, общую (с построением гистограммы) и локальную плотность (единицы Хаунсфилда - HU) (рис. 1).
РЕЗУЛЬТАТЫ
Анализ данных МСКТ у 86 больных хроническим остеомиелитом показал, что анатомические изменения бедренной и большеберцовой костей при хроническом остеомиелите были индивидуальны у всех пациентов. Структурные нарушения характеризовались некоторыми общими проявлениями, но выраженность их имела существенные отличия. Наиболее выраженные изменения отмечались у всех больных с локализацией воспалительного процесса в метаэпифизарном отделе (62 пациента). У 24 больных с локализацией очага воспаления в области диафиза протяженность деструкции кости была меньше.
Наиболее плотная часть корковой пластинки (компактный слой) бедренной кости пораженной конечности имела толщину от 1,5 до 2,4 мм, тогда как в норме в верхней трети бедренной кости толщина корковой пластинки составляла 7,8 ± 1,1 мм. В средней трети толщина корковой пластинки на аксиальном срезе была несколько больше: 8,4 ± 0,7 мм.
Изучение толщины корковой пластинки у больных хроническим остеомиелитом бедренной и большеберцовой кости вблизи зоны деструкции или оперативного вмешательства (толщина корковой пластинки изучалась вне зоны оперативного вмешательства) показало, что она значительно меньше, чем на здоровой конечности (табл. 1).
Измерение плотности корковой пластинки вне очага воспаления и на здоровой конечности показало, что вне зоны деструкции или оперативного вмешательства на всем протяжении кости плотность корковой пластинки была меньше, чем на здоровой конечности и зависела от продолжительности заболевания (табл. 2).
У 92,6 % больных структура и плотность корковой пластинки на расстоянии 3-5 см от зоны воспаления была изменена. Степень трабекуляризации, протяженность, уменьшение плотности зависело от многих причин: давности заболевания, количества рецидивов, функции конечности. Учитывая большой разброс по длительности заболевания (от 1 до 65 лет), посчитать среднюю продолжительность заболевания было некорректно. В 15,1 % заболевание длилось больше 20 лет, в 5,8 % - от 10 до 15 лет, в 8,1 % - от 5 до 10 лет, в остальных случаях - от года до 5 лет. Дополнительными средствами опоры пользовались 26,7 % больных.
У 13 больных толщина компактной части корковой пластинки была уменьшена на 2-4 мм, а на расстоянии от 4 до 6 мм от периостального края корковой пластинки выявлены участки с плотностью от 189,20 до 313,45 HU, что соответствовало плотности кости, имеющей трабекулярное строение. Общая толщина компактной части и зоны трабекуляризации не на много превышала толщину корковой пластинки здоровой конечности, поскольку даже на расстоянии от очага воспаления корковая пластинка имела строение, отличное от здоровой конечности на данном уровне. Плотность компактной части корковой пластинки у больных, продолжительность заболевания у которых не превышала 1-2 года, была практически нормальной (рис. 2, а), тогда как у пациентов с неоднократными рецидивами и длительностью заболевания более пяти лет плотность корковой пластинки уменьшалась на большую величину (40-44 %) (рис. 2, б).
У 37 больных степень трабекуляризации была выражена больше, и толщина компактной части не превышала 2-3 мм, остальная часть имела строение, отличающееся от типичной корковой пластинки с плотностью не больше плотности трабекулярной кости (рис. 3).
У 20 больных трабекуляризация распространялась не на всю корковую пластинку, занимала 10-15 % ее окружности, у 16 больных - до 20 %.
Как показали наши предыдущие исследования, плотность кости, имеющая трабекулярное строение, колеблется в значительных пределах, особенно при различной патологии (деформирующий артроз, врожденные укорочения конечности, хронический остеомиелит), но не превышает 280-300 HU, за исключением таранной кости, имеющей мелкоячеистое строение и плотность в пределах 380-460 HU. Плотность метафизарного отдела бедренной кости у больных с очагом воспаления, расположенным на границе средней и нижней трети, достигала в некоторых участках 210-230 HU, в зоне резорбции, в ряде случаев, не превышала 70-110 HU. Плотность мета-физа контралатеральной конечности у больных хроническим остеомиелитом также меньше, чем в норме (рис. 4).
Плотность кости на расстоянии 2,9 мм от периостального края у больного П., 37 лет, составляет 302 HU, что соответствует плотности трабекулярной кости. Корковая пластинка на расстоянии, максимально удаленном от очага воспаления, сохраняла свою нормальную толщину, имело место умеренное изменение структуры на ограниченном участке и незначительное снижение плотности (рис. 5).
Изучение корковой пластинки на аксиальных срезах также показало, что внутрикортикальная пористость обширна, сопровождается истончением кортикального слоя из-за трансформации части корковой пластинки, прилежащей к эндосту. У 12 больных имел место участок с выраженным неоднородным строением, плотность которого составляла 215 HU (рис. 6, а, стрелка). На расстоянии 7,4 мм от периостального края корковой пластинки, то есть еще в зоне бывшего коркового слоя, поскольку его толщина на здоровой конечности равна 7,6-9,2 мм, плотность кости не превышала 261 HU, что соответствовало плотности трабекулярной кости в данной зоне (рис. 6, б).
ОБСУЖДЕНИЕ
Анализ строения и плотности корковой пластинки больных хроническим остеомиелитом показал, что особенности архитектоники и показатели плотности участков с эндостальной стороны соответствует плотности трабекулярной кости, и, хотя мы не можем на основании только данных МСКТ говорить о трабекуляризации корковой пластинки с количественной оценкой всех показателей (толщина трабекул, размеры пор), которая выявляется при периферической компьютерной томографии, можно утверждать, что почти треть корковой пластинки приобретает трабекулярное строение, учитывая ее плотность и архитектонику, и что «внутрикортикальная пористость обширна и связана с истончением кортикального слоя из-за трансформации внутренней части костномозгового канала в трабекуляризованную структуру корковых остатков, напоминающих трабекулы» [11]. Полученные данные можно объяснить исследованием R.M. Zebaze et al. (2010), где указано, что потеря костной массы кортикальная, а не трабекулярная, при остеомиелите напоминает обширную внутрикортикальную пористость и связана с истончением кортикального слоя из-за трансформации внутренней части костномозгового канала в трабекуляризованную структуру остатков корковой пластинки, как у пожилых людей при остеопорозе [3]. В наших предыдущих исследованиях мы указывали, что у больных хроническим остеомиелитом отмечено уменьшение толщины корковой пластинки (не в зоне остеомиелитического очага, где она может быть утолщена) и ее плотности на многих участках, где нет склерозирования и эбурнеации [15].
Известны работы, в которых показано, что изменение структуры кости в виде трабекуляризации связаны не только с возрастным остеопорозом, но и с некоторыми заболеваниями [16, 17, 18]. Полученные нами данные при изучении бедренной и большеберцовой костей у больных хроническим остеомиелитом показали, что эндокортикальное ремоделирование с последующей трабекуляризацией корковой пластинки имеет место у большинства больных при длительном течении заболевания. Степень трабекуляризации выражена у больных в разной степени, сопровождается уменьшением толщины компактной части корковой пластинки, формированием в зоне, прилежащей к костномозговому каналу, трабекулярноподобной кости с плотностью, соответствующей трабекулярному отделу длинных костей. Рентгеноморфологические изменения корковой пластинки проявляются уменьшением толщины вне зоны деструкции, в прилежащих отделах у 79,5 %, у 47,2 % больных - трабекуляризацией. Известны данные, что изменение структуры бедренной кости в области шейки (уменьшение минеральной плотности) приводит к изменению микроструктуры большеберцовой кости, а толщину компактной кости и преобладание больших пустот в корковой пластинке большеберцовой кости следует принимать во внимание как биомаркер механического повреждения бедра, в качестве альтернативы или в дополнение к стандартным показателям DXA [9]. Это совпадает с нашими данными, когда при хроническом остеомиелите бедренной кости выявляются изменения и в большеберцовой кости [15, 19]. Несомненно, причиной возникающей в длинных костях трабекуляризации является не только воспалительный процесс, как основное заболевание, но и нарушение функции конечности, ограничение нагрузки или иннервации, что дополнительно вызывает интракортикаль-ное ремоделирование [16, 20-22]. К описанным ранее различным патоморфологическим изменениям костной ткани при хроническом остеомиелите [23] можно добавить еще одно проявление - трабекуляризацию. Полученные нами данные позволили выявить явление трабекуляризации у больных хроническим остеомиелитом, сопровождающееся значительным уменьшением толщины корковой пластинки, изменением структуры кости, свидетельствующих о реакции на заболевание (хронический остеомиелит), значительно изменяющих прочностные свойства кости и способствующих распространению воспалительного процесса [6].
ЗАКЛЮЧЕНИЕ
Рентгеноморфологические изменения корковой пластинки бедренной и большеберцовой костей у больных хроническим остеомиелитом вблизи от очага деструкции характеризовались уменьшением толщины и плотности корковой пластинки, сопровождались полной или частичной трабекуляризацией ее с плотностью, не превышающей 315,5 ± 38,6 единицы Хаунс-филда (HU) у 41 (47,7 %) из 86 пациентов.
СПИСОК ИСТОЧНИКОВ
1. Micro-CT analyses of historical bone samples presenting with osteomyelitis / C. Lamm, M. Dockner, B. Pospischek, E. Winter, B. Patzak, M. Pretterklieber, G.W. Weber, P. Pietschmann // Skeletal Radiol. 2015. Vol. 44, No 10. P. 1507-1514. DOI: 10.1007/s00256-015-2203-8.
2. The effect of voxel size on high-resolution peripheral computed tomography measurements of trabecular and cortical bone microstructure / W. Tjong, G.J. Kazakia, A.J. Burghardt, S. Majumdar // Med. Phys. 2012. Vol. 39, No 4. P. 1893-1903. DOI: 10.1118/1.3689813.
3. Intracortical remodelling and porosity in the distal radius and post-mortem femurs of women: a cross-sectional study / R.M. Zebaze, A. Ghasem-Zadeh, A. Bohte, S. Iuliano-Burns, M. Mirams, R.I. Price, E.J. Mackie, E. Seeman // Lancet. 2010. Vol. 375, No 9727. Р. 1729-1736. DOI: 10.1016/ S0140-6736(10)60320-0.
4. Relationship of age to bone microstructure independent of areal bone mineral density / K.M. Nicks, S. Amin, E.J. Atkinson, B.L. Riggs, L.J. Melton 3rd, S. Khosla // J. Bone Miner. Res. 2012. Vol. 27, No 3. Р. 637-644. DOI: 10.1002/jbmr.1468.
5. Kameo Y., Sakano N., Adachi T. Theoretical concept of cortical to cancellous bone transformation // Bone Rep. 2020. Vol. 12. P. 100260. DOI: 10.1016/j.bonr.2020.100260.
6. Bala Y., Zebaze R., Seeman E. Role of cortical bone in bone fragility // Curr. Opin. Rheumatol. 2015. Vol. 27, No 4. P. 406-413. DOI: 10.1097/ BOR.0000000000000183.
7. Effects of mechanical forces on maintenance and adaptation of form in trabecular bone / R. Huiskes, R. Ruimerman, G.H. van Lenthe, J.D. Janssen // Nature. 2000. Vol. 405, No 6787. P. 704-706. DOI: 10.1038/35015116.
8. Baron C. Using the gradient of human cortical bone properties to determine age-related bone changes via ultrasonic guided waves // Ultrasound Med. Biol. 2012. Vol. 38, No 6. P. 972-981. DOI: 10.1016/j.ultrasmedbio.2012.02.024.
9. Large cortical bone pores in the tibia are associated with proximal femur strength / G. Iori, J. Schneider, A. Reisinger, F. Heyer, L. Peralta, C. Wyers, M. Grasel, R. Barkmann, C.C. Gluer, J.P. van den Bergh, D. Pahr, K. Raum // PLoS. One. 2019. Vol. 14, No 4. P. e0215405. DOI: 10.1371/journal. pone.0215405.
10. Intracortical Bone Mechanics are related to Pore Morphology and Remodeling in Human Bone / L.P. Bakalova, C.M. Andreasen, J.S. Thomsen, A. Bruel, E.M. Hauge, B.J. Kiil, J.M. Delaisse, T.L. Andersen, M.E. Kersh // J. Bone Miner. Res. 2018. Vol. 33, No 12. P. 2177-2185. DOI: 10.1002/ jbmr.3561.
11. A new method of segmentation of compact-appearing, transitional and trabecular compartments and quantification of cortical porosity from high resolution peripheral quantitative computed tomographic images / R. Zebaze, A. Ghasem-Zadeh, A. Mbala, E. Seeman // Bone. 2013. Vol. 54, No 1. P. 8-20. DOI: 10.1016/j.bone.2013.01.007.
12. Quantitative imaging of peripheral trabecular bone microarchitecture using MDCT / C. Chen, X. Zhang, J. Guo, D. Jin, E.M. Letuchy, T.L. Burns, S.M. Levy, E.A. Hoffman, P.K. Saha // Med. Phys. 2018. Vol. 45, No 1. P. 236-249. DOI: 10.1002/mp.12632.
13. Hostetler Z.S., Stitzel J.D., Weaver A.A. Comparing rib cortical thickness measurements from computed tomography (CT) and Micro-CT // Comput. Biol. Med. 2019. Vol. 111. P. 103330. DOI: 10.1016/j.compbiomed.2019.103330.
14. Measuring rib cortical bone thickness and cross section from CT / S.A. Holcombe, E. Hwang, B.A. Derstine, S.C. Wang // Med. Image Anal. 2018. Vol. 49. P. 27-34. DOI: 10.1016/j.media.2018.07.003.
15. Качество кости у больных старше 60 лет с хроническим остеомиелитом длинных костей нижних конечностей по данным мультисрезовой компьютерной томографии / Г.В. Дьячкова, Н.М. Клюшин, К.А. Дьячков, Т.А. Ларионова // Успехи геронтологии. 2017. Т. 30, № 5. С. 716724.
16. Innervation is higher above Bone Remodeling Surfaces and in Cortical Pores in Human Bone: Lessons from patients with primary hyperparathyroidism / M. Sayilekshmy, R.B. Hansen, J.M. Delaisse, L. Rolighed, T.L. Andersen, A.M. Heegaard // Sci. Rep. 2019. Vol. 9, No 1. P. 5361. DOI: 10.1038/ s41598-019-41779-w.
17. Comparative Analysis of Bone Structural Parameters Reveals Subchondral Cortical Plate Resorption and Increased Trabecular Bone Remodeling in Human Facet Joint Osteoarthritis / C. Netzer, P. Distel, U. Wolfram, H. Deyhle, G.F. Jost, S. Scharen, J. Geurts // Int. J. Mol. Sci. 2018. Vol. 19, No 3. P. 845. DOI: 10.3390/ijms19030845.
18. Chronic kidney disease and bone metabolism / J.J. Kazama, K. Matsuo, Y. Iwasaki, M. Fukagawa // J. Bone Miner. Metab. 2015. Vol. 33, No 3. P. 245-252. DOI: 10.1007/s00774-014-0639-x.
19. «Многоликий» хронический остеомиелит: лучевая диагностика / Г.В. Дьячкова, К.А. Дьячков, Н.М. Клюшин, Т.А. Ларионова, А.Л. Ша-стов // Гений ортопедии. 2020. Т. 26, № 3. С. 385-391.
20. Щудло Н.А., Щудло М.М. Структурные механизмы повышения порозности корковых пластинок длинных костей при чрескостном дистракционном остеосинтезе // Гений ортопедии. 2012. № 4. С. 112-118.
21. Evaluation and Management of Osteoporosis and Sarcopenia in Patients with Distal Radius Fractures / G.M. Shah, H.S. Gong, Y.J. Chae, Y.S. Kim, J. Kim, G.H. Baek // Clin. Orthop. Surg. 2020. Vol. 12, No 1. Р. 9-21. DOI: 10.4055/cios.2020.12.1.9.
22. Остеомиелитические полости, как форма хронического остеомиелита, с точки зрения рентгеноморфологии / Г.В. Дьячкова, Н.М. Клюшин, А.Л. Шастов, К.А. Дьячков, П.В. Нецветов, Т.А. Ларионова // Гений ортопедии. 2019. Т. 25, № 2. С. 199-206. DOI: 10.18019/1028-4427-2019-25-2-199-206.
23. Миронов С.П., Цискарашвили А.В., Горбатюк Д.С. Хронический посттравматический остеомиелит как проблема современной травматологии и ортопедии (обзор литературы) // Гений ортопедии. 2019. Т. 25, № 4. С. 610-621. DOI 10.18019/1028-4427-2019-25-4-610-621.
Информация об авторах:
1. Галина Викторовна Дьячкова - доктор медицинских наук, профессор
2. Николай Михайлович Клюшин - доктор медицинских наук
3. Константин Александрович Дьячков - доктор медицинских наук
4. Александр Леонидович Шастов - кандидат медицинских наук
5. Татьяна Адиславовна Ларионова - кандидат медицинских наук
Теги: хронический остеомиелит
234567 Начало активности (дата): 05.05.2022 11:07:00
234567 Кем создан (ID): 989
234567 Ключевые слова: хронический остеомиелит, длинные кости, МСКТ, корковая пластинка, трабекуляризация
12354567899
Похожие статьи
Новые лабораторные тесты для оценки эффективности лечения больных с хроническим остеомиелитом костей стопы в условиях использования метода чрескостного остеосинтезаРентген на дому 8 495 22 555 6 8
Мониторинг ведущей грамположительной микрофлоры и ее антибиотикочувствительности у лиц с хроническим остеомиелитом за трехлетний период
Интрамедуллярный эластичный остеосинтез при диафизарных переломах у детей (часть 2)
МРТ суставы верхней конечности



