 11.08.2021
11.08.2021
Несовершенный остеогенез: современные аспекты этиологии, патогенеза, классификации (систематический обзор)
Постоянно меняющаяся информация о генетической природе несовершенного остеогенеза (НО), новые подходы к классификации и диагностике, возрастающий интерес к данной патологии требует тщательного анализа и обобщения имеющихся данных в современной литературе
ВВЕДЕНИЕ
Несовершенный остеогенез (НО) известен как болезнь «хрупких костей» и является фенотипически и генетически гетерогенной группой наследственных костных дисплазий [1, 2].
Это наследственное генерализованное гетерогенное заболевание соединительной ткани, которое поражает, в основном, кости, связки, дентин и склеры [3-7]. Частота встречаемости НО составляет 1/10 000 - 1/20 000 случаев, что выводит это заболевание в ранг одной из самых распространенных скелетных дисплазий [8-10].
О возрастающем интересе к данной патологии за последние десять лет свидетельствуют несколько недавних публикаций, в которых представлены прекрасные обзоры патофизиологии и генетики НО и родственных заболеваний [3, 4, 11, 12].
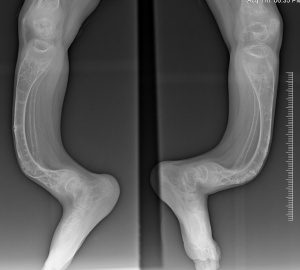
Несовершенный остеогенез - неоднородное заболевание, степень тяжести которого варьирует от незначительного увеличения частоты переломов до смерти в перинатальном периоде [1]. Люди с несовершенным остеогенезом имеют сниженную костную массу и хрупкость костей, что приводит к переломам длинных костей и компрессии позвонков, различной деформации длинных костей, ребер и позвоночника, значительному дефициту роста [2, 7, 13, 14].Типичное клиническое описание пациентов с несовершенным остеогенезом также может включать изменение цвета склеры в синий или серый цвет, аномалии зубов, называемые несовершенным дентиногенезом [4, 15], гипермобильность суставов, слабость связок [3, 14, 16], потерю слуха и т.д. Но эти внескелетные особенности часто могут и отсутствовать [3]. Клинические проявления несовершенного остеогенеза значительно варьируют.
Даже в пределах одного и того же типа НО внешний вид пациентов может значительно различаться [17, 18].
Постоянно меняющаяся информация о генетической природе несовершенного остеогенеза [2-5, 7, 19, 20], новые подходы к классификации и диагностике [3, 21-24], возрастающий интерес к данной патологии требуют тщательного анализа и обобщения имеющихся в современной литературе данных.
Целью данной работы являлся анализ современной литературы по вопросам эпидемиологии, патогенеза, этиологии, классификации несовершенного остеогенеза.
МАТЕРИАЛЫ И МЕТОДЫ
Был проведен поиск литературы на английском, русском, немецком языках с использованием электронных баз данных PubMed, Web of Science, Cochrane Library, E-library. Также были проанализированы ссылки из найденных исследований. Производили отбор статей, опубликованных в течение временного периода с 2010 по 2021 год.
Использовались следующие критерии включения: обзоры литературы, обзорные статьи, мультицентровые исследования, контролируемые когортные исследования, неконтролируемые когортные исследования, исследования «случай-контроль» пациентов с несовершенным остеогенезом.
Ключевые слова поиска: несовершенный остеогенез (osteogenesis imperfecta), эпидемиология несовершенного остеогенеза (epidemiology of osteogenesis imperfecta), этиология и патогенез несовершенного остеогенеза (etiology and pathogenesis of osteogenesis imperfecta), классификация несовершенного остеогенеза (classification of osteogenesis imperfect).
Критерии исключения: исследования на животных, описания клинических случаев или серии случаев, рефераты, материалы конференций, повторные публикации.
Исследование выполнено в соответствии с международными рекомендациями по написанию систематических обзоров и метаанализов PRISMA [25]. Сначала проводился поиск литературных источников с использованием ключевых слов, затем просматривали рефераты статей и исключали публикации, не соответствовавшие критериям. На заключительном этапе анализировали полный текст выбранных статей на соответствие критериям включения и список литературы на наличие релевантных исследований (рис. 1).
РЕЗУЛЬТАТЫ
В данный систематический обзор были включены 18 публикаций. Все публикации, выбранные в соответствии с критериями включения, относились к периоду 2012-2020 годов, и это были обзорные статьи или обзоры литературы. География публикаций была достаточно широкой (табл. 1).
Несовершенный остеогенез является одной из самых распространенных скелетных дисплазий. НО встречается примерно у 1/10 000-1/20 000 новорожденных [8-10, 32]. Это генетически гетерогенная дисплазия скелета с более высокой смертностью, чем у населения в целом [6].
Результаты исследований, проведенных в Европе и США, показали, что распространенность несовершенного остеогенеза при рождении составляет 0,3-0,7 на 10 000 рождений [33, 34]. Эти когортные исследования новорожденных отражают тяжелые типы несовершенного остеогенеза и не включают более легкие формы, которые становятся очевидными после рождения.
Популяционное исследование, в котором использовался Датский национальный регистр пациентов, показало, что ежегодная частота несовершенного остеогенеза в период с 1997 по 2013 год составляла 1,5 на 10 000 рождений [35].
Опросы населения в странах с обширными медицинскими базами данных, таких как Финляндия, определили распространенность около 0,5 на 10 000 человек [36], при этом большинство из них имели фенотипически более мягкий несовершенный остеогенез (I и IV тип).
Поскольку эти когортные и популяционные опросы при рождении основаны на клинических данных и, как правило, выявляют взаимоисключающие популяции, приемлемые значения частоты несовершенного остеогенеза составляют примерно 1 на 10 000 человек [2].
В популяциях с высоким уровнем кровного родства или большим количеством носителей частота несовершенного остеогенеза выше, чем в аутбредных (неродственных) популяциях [37-39]. Например, среди афроамериканцев в США несущая частота для одного патогенного варианта в P3H1 составляет примерно 1 из 240 человек [38].
Этиология и патогенез несовершенного остеогенеза
Мутации в генах, кодирующих коллаген I типа (COL1A1 и COL1A2), являются наиболее частыми причинами несовершенного остеогенеза [2, 21, 40]. Коллаген I - это белок-гетеротример, содержащий две цепи а1 (I) и одну а2 (I) [21]. Он синтезируется в виде молекулы проколлагена и претерпевает множество посттрансляционных модификаций.
Фланкирующие пропептиды удаляются специфическими протеазами, затем молекула спонтанно собирается в фибриллы в ткани и далее стабилизируется с помощью поперечных связей [4, 6, 21].
Возникающие мутации приводят к негативным сдвигам в a-цепи, нарушению посттрансляционной модификации, сшиванию молекул коллагена в фибриллы [4, 40, 41]. Вследствие этих событий формируются измененные коллагеновые волокна и нарушается структура костной ткани.
Нельзя исключать, что данные изменения могут способствовать негативным отклонениям в процессе ремоделировная костной ткани (его ускорению) [19].
По данным большинства авторов, несовершенный остеогенез формируется в 70-90 % случаев за счет ау-тосомно-доминантных мутаций в генах COL1A1 и COL1A2, которые приводят к количественным и качественным изменениям коллагена I типа [2, 4, 21, 40]. При количественных сдвигах сохраняется структура коллагена, но почти в два раза уменьшается его количество.
Более 80 % мутаций, изменяющих структуру коллагена типа I, представляют собой изменения одной пары оснований, приводящие к заменам остатков глицина в цепи a1 (I) или a2 (I). Более крупная боковая цепь замещающего остатка вызывает задержку сворачивания спирали и последующую посттрансляционную сверхмодификацию остатков лизина и пролина по длине спиральной области. Фенотипическая выраженность зависит от аминокислотной замены, цепи и положения [4, 40].
Изучение генома пациентов с НО в последние двадцать лет показало наличие других причин развития данного заболевания - дефектов генов белков, которые взаимодействуют с коллагеном для сворачивания или посттрансляционных модификаций [4, 19]. Были идентифицированы отклонения формирования костной ткани, не связанные с коллагеном, а обусловленные нарушениями минерализации кости, функционирования и дифференцировки остеобластов [4]
Кроме аутосомно-доминантного пути наследования были определены X-связанные, аутосомно-рецессивные и дополнительные.
В 2000 году была идентифицирована первая, не связанная с синтезом коллагена мутация в гене IFITM5 с ау-тосомно-доминантным путем наследования [21, 42, 43]. Характерной особенностью данной мутации было образование гипертрофической костной мозоли и оссифи-кация межкостной мембраны. В 2006 году R. Morello et al. описали первую мутацию с аутосомно-рецессивным путем наследования в гене CRTAP [44].
В настоящее время, исследование генома в семьях пациентов с НО определило наличие более 20 генов, мутации в которых могут привести к различным формам НО [7, 23].
Выявлено более 1500 мутаций, которые зарегистрированы в базе данных НО [45].
По мнению T.J. Cho et al. [30], учитывая множество причинных генов и их фенотипическое сходство, целесообразно тестировать все известные гены НО одновременно. Авторы провели молекулярно-генетический анализ с использованием секвенирования следующего поколения и/или секвенирования по Сэнгеру у 177 корейских пациентов с НО и обнаружили, что 96 пациентов (54 %) имели мутации COL1A1, 39 (22 %) COL1A2, 10 (6 %) IFITM5, 5 (3 %) FKBP10, 1 BMP1 и 1 WNT1 и у 25 пациентов (14 %) мутации не обнаружены. Эти авторы сделали вывод, что 88 % всех выявленных мутаций связаны с генами коллагена I типа по сравнению с 6,6 % случаев IFITM5 (тип V) и 4,6 % аутосомно-рецессивных случаев в обследованной когорте.
Классификации несовершенного остеогенеза
Несовершенный остеогенез - неоднородное заболевание, степень тяжести которого варьирует от незначительного увеличения частоты переломов до смерти в перинатальном периоде [1, 26]. Поэтому при планировании лечебных мероприятий необходимо классифицировать все подтипы. Трудность создания исчерпывающей классификацией подтипов НО состоит в том, что нет четкой взаимосвязи фенотип-генотип, на основании мутации нельзя делать выводы о клинической тяжести [14, 26].
Кроме того, внедрение современных технологий секвенирования следующего поколения (NGS) способствовало прогрессу исследования молекулярного патогенеза несовершенного остеогенеза, определению новых генов, мутации в которых могут привести к НО (около 20 генов). Большое количество причинных генов усложняет процесс создания оптимальной классификации НО [23].
D.O. Sillence (1979) была предложена первая классификация НО, она основывалась на клинических, рентгенологических и генетических характеристиках пациента и включала четыре типа - I, II, III, IV [46]. Все они обусловлены аутосомно-доминантными мутациями в генах COL1A1 и COL1A2, отвечающих за синтез коллагена I типа. Распределение тяжести течения НО можно представить следующим образом: I < IV < III < II. Хотя многие авторы отмечают, что для НО характерна высокая степень вариабельности проявлений даже в пределах одного типа и одной семьи [1, 2, 4, 47, 48].
В настоящее время классификация Sillence (I, II, III, IV типы) по-прежнему в наибольшей степени остается востребованной в практической работе врачей [7, 28, 29, 30].
I тип НО - недеформирующий НО с синей склерой, является самой легкой формой. Он в наибольшей степени распространен во всем мире, за исключением некоторых изолированных уникальных популяций пациентов, где более распространены редкие рецессивные формы [31]. Частота переломов относительно низка и снижается в период полового созревания, а серьезных деформаций костей немного. Рост обычно нормальный или незначительно сниженный. Наблюдается предрасположенность к прогрессирующей потере слуха, которая может начаться в подростковом возрасте и продолжаться на протяжении всей жизни [21]. Тип наследования - аутосомно-доминантный.
II тип НО - перинатально летальный. Обычно приводит к смерти вскоре после рождения. На внутриутробном этапе определяются множественные переломы [49]. Как правило, эти пациенты имеют короткие и деформированные конечности, синие или серые склеры. Они погибают вследствие дыхательной недостаточности [50]. II тип НО обычно возникает в результате гетерозиготных мутаций в генах коллагена I типа, но фенотипическое представление имеет сходство с некоторыми формами НО, вызванными биаллельными мутациями (рецессивно наследуемыми) в неколлагеновых генах (CRTAP, P3H1, PPIB, TMEM38B, CREB3L1 и другие). Повторение в семьях может быть результатом рецессивного наследования или, в некоторых случаях, родительского мозаицизма причинной доминантной мутации в гене коллагена типа I.
III тип НО - прогрессивно деформирующий. Это наиболее тяжелая форма заболевания выживших детей в неонатальный период. Для данного типа свойственны прогрессирующие деформации конечностей. Больные переносят сотни переломов в течение жизни [51]. Пациенты, как правило, имеют низкий рост. Определяется несовершенный дентиногенез, платибазия, базилярная импрессия, компрессия тел позвонков, сколиоз. Форма лица часто треугольная, с выступающими лобными буграми, склеры синего или серого цвета.
Продолжительность жизни сокращается из-за легочной недостаточности. Наследование обычно является аутосомно-доминантным в результате мутаций в генах коллагена I типа, но у некоторых людей, чья первоначальная клиническая классификация относилась к этой группе, были доказаны биаллельные мутации в неколлагеновых генах (рецессивное наследование).
IV тип НО - умеренная степень тяжести, имеет широкий фенотипический диапазон, перекрывающий типы I и III. Большинство пациентов способно передвигаться, количество переломов исчисляется десятками. У пациентов с этим типом заболевания регистрируется вариабельность роста, базилярная импрессия, несовершенный дентиногенез, нарушение слуха. Формирование IV типа НО является следствием мутаций в генах коллагена I типа (COL1A1 и COL1A2) с аутосомно-до-минантным наследованием.
В 2000 году классификация была дополнена V типом, который характеризуется хрупкостью кости от умеренной до тяжелой. Отличительной особенностью данного типа является формирование гипертрофической костной мозоли (после переломов или хирургических вмешательств) и оссификации межкостной мембраны на предплечье, которые могут привести к вторичному вывиху головки лучевой кости [52]. Несовершенный остеогенез V типа имеет аутосомный доминантный паттерн, он является результатом повторяющейся мутации, которая приводит к добавлению пяти аминокислот в аминокислотном терминале белка, который мешает функции.
Несовершенный остеогенез был известен с начала 1980-х годов как доминантно наследуемое заболевание, вызванное мутациями в любом из генов, кодирующих коллаген типа I (то есть COL1A1 и COL1A2), основного компонента внеклеточного матрикса кости и кожи [40].
С 2006 года было определено, что новые мутации в генах, связанных с коллагеном, имеют различные типы наследования и формируют несовершенный остеогенез [2, 4].
Идентификация этих новых причинных генов привела к адаптации исходной системы классификации несовершенного остеогенеза к новым результатам генетических исследований.
Появились как клинические, так и генетические классификации, охватывающие редкие формы несовершенного остеогенеза, поскольку большинство новых генов не имеют специфических диагностических признаков.
В клинической классификации новые формы расстройства были объединены в типы D.O. Sillence от I до IV по клинической степени тяжести. Например, несовершенный остеогенез типа II, перинатальная летальная форма, включал летальные мутации коллагена и некоторые мутации CRTAP, LEPRE1, PPIB, SERPINH1 и SP7 [27]. Некоторые клинические классификации сохранили типы V, VI и VII, первоначально обозначенные клинически [54].
Эта классификация приводит к множеству несовместимых ситуаций, включая повторное определение типа индивидуума по степени тяжести в течение его жизни и братьев и сестер с разными типами несовершенного остеогенеза. В том же типе люди будут иметь доминантное или рецессивное наследование, что затрудняет генетическое консультирование и затрудняет исследования механизма заболевания и реакции на терапию.
В генетической классификации типы Sillence используются только для мутаций коллагена, и нумерация продолжается для каждого нового открытия в генах [27]. Этот образец устраняет проблемы, упомянутые выше, и обеспечивает лучшую организацию исследований и клинического ведения, чем клиническая классификация. Тем не менее, генетическая классификация имеет недостаток в виде постоянно меняющегося списка, который генетикам и родителям может быть сложно использовать, если он превышает десяток типов.
Чтобы удовлетворить как клинические, так и генетические требования, A. Forlino et al. предположили [4], что функциональная метаболическая классификация будет иметь самое широкое применение и при этом позволит сохранить нумерацию генетических типов.
Подобная перегруппировка синдрома Элерса-Дан-лоса по функциям оказалась успешной как для клиницистов, так и для семей [55]. В этом плане гены, продукты которых действуют одним и тем же путем и, вероятно, имеют общие механизмы, объединены в пять функциональных групп: 1) дефекты в структуре или процессинге коллагена (COL1A1, COL1A2 и BMP1) -группа A; 2) дефекты модификации коллагена (CRTAP, LEPRE1, PPIB и TMEM38B) - группа B; 3) дефекты сворачивания и сшивания коллагена (SERPINH1, FKBP10 и PLOD2) - группа C; 4) дефекты окостенения или минерализации (IFITM5 и SERPINF1) - группа D; 5) дефекты развития остеобластов с коллагеновой недостаточностью (WNT1, CREB3L1 и SP7) - группа E. Функциональная генетическая классификация может быть с пользой дополнена параллельным баллом клинической тяжести [56].
Таким образом, увеличение информации о генетической природе несовершенного остеогенеза, привело к появлению двух новых подходов к классификации: 1) более клинически обоснованного подхода, в котором новые рецессивные типы помещаются под «клинический зонтик» типов по Sillence; 2) генетико-функционального подхода, в котором используемые типы Sillence (I-IV) зарезервированы для мутаций в COL1A1 или COL1A2, а новым генам присваиваются дополнительные номера типов на основе мутации без клинической корреляции [2].
Однако использование этих классификаций в клинической практике вызывает затруднение вследствие отсутствия выраженных отличий новых идентифицированных типов НО от четырех классических типов по Sillence.
Они подверглись критике со стороны клиницистов и исследователей [4, 55]. В документе «Nosology and Classification of Genetic Skeletal Disorders», опубликованном в 2015 году, принят фенотипический критерий для классификации несовершенного остеогенеза, ограниченный пятью типами (типы несовершенного остеогенеза 1-5) [3, 57, 58].
По мнению T. Palomo et al. [6], более оптимально описывать типы несовершенного остеогенеза, указывая фенотипическую тяжесть и вовлеченный ген, как это было предложено F.S. Van Dijk et al. [3, 21]. В 2019 году эта классификация была модифицирована (в документе «Nosology and Classification of Genetic Skeletal Disorder») (табл. 2) [22].
Отдельные типы НО по этой классификации клинически характеризуются следующим образом [14]:
- НО 1 типа - это самая легкая форма НО, при которой не возникают деформации длинных трубчатых костей. Большинство страдающих почти «нормальные». Переломы чаще всего возникают во время всплеска подросткового возраста. Ухудшение слуха характерно для молодых людей. Обычно наблюдается слабость связок с чрезмерной растяжкой суставов и снижение мышечного тонуса. Обычно склеры имеют голубоватый цвет. Поражение зубов происходит редко. У некоторых людей диагноз ставится в зрелом возрасте [2, 59].
- НО 2 типа - самая тяжелая форма НО. Переломы обычно возникают внутриутробно. Течение обычно заканчивается перинатально смертельным исходом [2, 59].
- НО 3 типа - пациенты этого типа имеют наиболее тяжелое совместимое с жизнью клиническое течение НО и склонны к развитию тяжелой деформации костей. Диагноз обычно ставится при рождении. Деформации затрагивают длинные трубчатые кости и череп (относительная макроцефалия). Сколиоз и деформация грудной клетки (бочкообразная грудь) приводят к проблемам с дыханием. Пациенты очень низкого роста (иногда менее 1 м) и в основном используют инвалидную коляску. Они предрасположены к большому количеству переломов, часто более 200. Часто нарушается слух. Во многих случаях пациентам требуется несколько операций еще в детстве. Телескопические интрамедуллярные стержни устанавливаются в длинных трубчатых костях у детей в период роста. Необходимы операции при прогрессировании сколиоза. Склеры в
основном синие. Базилярная платибазия - не редкость. Возможны неврологические осложнения [2, 59].
- НО 4 типа - очень вариабелен по клиническим проявлениям. Пациенты невысокого роста, но снижение менее выражено, чем у больных 3 типа. Деформации костной системы также менее выражены, чем при 3-ем типе. Сколиоз присутствует почти всегда. Может возникнуть базилярная платибазия, но она встречается реже и менее выражена, чем при 3 типе. Многие пациенты могут передвигаться с костылями или лишь изредка нуждаются в инвалидной коляске. Склеры в большинстве случаев нормального окраса [2, 59].
- НО 5 типа - типичным для этого типа является формирование гиперпластической мозоли (после переломов и хирургических вмешательств), кальцификация перепонок между костями без признаков перелома. Особенно страдают синдесмозы на предплечье и голени. У пациентов с НО следует избегать про- и супина-ционных движений предплечья или стопы. Для этого типа характерна дисплазия средней степени тяжести, вызывающая первичные дефекты окостенения или минерализации эндохондральной кости, плохое качество кости, деформации позвоночника, в том числе сколиоз. Выполняют рентгеновское обследование, чтобы без всяких сомнений отнести пациента к этому фенотипу [3, 22, 28, 57, 60].
Классификация различных типов несовершенного остеогенеза все еще остается предметом дискуссий и исследований. Остро стоит вопрос о создании схемы классификации, которая не меняет критериев для новых типов НО [2, 23].
ЗАКЛЮЧЕНИЕ
Несовершенный остеогенез является одной из самых распространенных скелетных дисплазий, фенотипически и генетически гетерогенной группой наследственных костных заболеваний. НО свойственна высокая степень вариабельности проявлений даже в пределах одного типа и одной семьи. Результаты анализа распространенности данного заболевания и его различных форм в разных группах населения различных регионов мира остаются до конца не освещенными. До сих пор не определена степень генетической гетерогенности заболевания. Продолжаются исследования, идентифицирующие новые гены, вовлеченные в патогенез НО. Внедрение современных методов опре-
деления мутаций в генах способствовало прогрессу исследования молекулярного патогенеза несовершенного остеогенеза, определению новых генов, мутации в которых могут привести к НО.Большое количество причинных генов усложняет процесс создания оптимальной классификации НО. Трудность создания исчерпывающей классификации подтипов НО состоит в том, что нет четкой взаимосвязи "фенотип-генотип", на основании мутации нельзя делать выводы о клинической тяжести. Классификация различных типов несовершенного остеогенеза все еще остается предметом продолжающихся дискуссий и исследований.
ЛИТЕРАТУРА
1. Rauch F., Glorieux F.H. Osteogenesis imperfecta // Lancet. 2004. Vol. 363, No 9418. P. 1377-1385. DOI: 10.1016/S0140-6736(04)16051-0.
2. Osteogenesis imperfecta / J.C. Marini, A. Forlino, H.P. Bachinger, N.J. Bishop, P.H. Byers, A. Paepe, F. Fassier, N. Fratzl-Zelman, K.M. Kozloff, D. Krakow, K. Montretit, O. Selmer // Nat. Rev. Dis. Primers. 2017. Vol. 3. P. 17052. DOI: 10.1038/nrdp.2017.52 .
3. Trejo P., Rauch F. Osteogenesis imperfecta in children and adolescents - new developments in diagnosis and treatment // Osteoporos. Int. 2016. Vol. 27, No 12. P. 3427-3437. DOI: 10.1007/s00198-016-3723-3.
4. Forlino A., Marini J.C. Osteogenesis imperfecta // Lancet. 2016. Vol. 387, No 10028. P. 1657-1671. DOI: 10.1016/S0140-6736(15)00728-X.
5. The genetic implication of scoliosis in osteogenesis imperfecta: a review / G. Liu, J. Chen, Y. Zhou, Y. Zuo, S. Liu, W. Chen, Z. Wu, N. Wu // J. Spine Surg. 2017. Vol. 3, No 4. P. 666-678. DOI: 10.21037/jss.2017.10.01.
6. Palomo T., Vila T., Lazaretti-Castro M. Osteogenesis imperfecta: diagnosis and treatment // Curr. Opin. Endocrinol. Diabetes Obes. 2017. Vol. 24, No 6. P. 381-388.
7. Byers P.H., Rustad C.F. Introduction to Osteogenesis Imperfecta. In: Osteogenesis Imperfecta. Kruse R.W., editor. Springer Nature Switzerland AG. 2020. DOI: 10.1007/978-3-030-42527-2_1.
8. Andersen P.E. Jr., Hauge M. Osteogenesis imperfecta: a genetic, radiological, and epidemiological study // Clin. Genet. 1989. Vol. 36, No 4. P. 250255.
9. Classification of osteogenesis imperfecta revisited / F.S. Van Dijk, G. Pals, R.R. Van Rijn, P.G. Nikkels, J.M. Cobben // Eur. J. Med. Genet. 2010. Vol. 53, No 1. P. 1-5. DOI: 10.1016/j.ejmg.2009.10.007.
10. Genetic epidemiology, prevalence, and genotype-phenotype correlations in the Swedish population with osteogenesis imperfecta / K. Lindahl, E. Astrom , C.J. Rubin, G. Grigelioniene, B. Malmgren, O. Ljunggren, A. Kindmark // Eur. J. Hum. Genet. 2015. Vol. 23, No 8. P. 1042-1050. DOI: 10.1038/ejhg.2015.81
11. Hendrickx G., Boudin E., Van Hul W. A look behind the scenes: the risk and pathogenesis of primary osteoporosis // Nat. Rev. Rheumatol. 2015. Vol. 11, No 8. P. 462-474. DOI: 10.1038/nrrheum.2015.48.
12. Rivadeneira F., Makitie O. Osteoporosis and bone mass disorders: from gene pathways to treatments // Trends Endocrinol. Metab. 2016. Vol. 27, No 5. P. 262-281. DOI: 10.1016/j.tem.2016.03.006.
13. Longitudinal growth curves for children with classical osteogenesis imperfecta (types III and IV) caused by structural pathogenic variants in type I collagen / L.A. Barber, C. Abbott, V. Nakhate, A.N.D. Do, A.R. Blissett, J.C. Marini // Genet. Med. 2019. Vol. 21, No 5. P. 1233-1239. DOI: 10.1038/ s41436-018-0307-y.
14. Rehabilitation seltener Erkrankungen im Erwachsenenalter: Osteogenesis imperfecta / M. Gehlen, M. Schwarz-Eywill, C. Hinz, M. Pfeifer, U. Siebers-Renelt, M. Ratanski, A. Maier // Z. Rheumatol. 2021. Vol. 80, No 1. P. 29-42. DOI: 10.1007/s00393-020-00927-8.
15. New perspectives on osteogenesis imperfecta / A. Forlino, W.A. Cabral, A.M. Barnes, J.C. Marini // Nat. Rev. Endocrinol. 2011. Vol. 7, No 9. P. 540557. DOI: 10.1038/nrendo.2011.81.
16. Arponen H., Makitie O., Waltimo-Siren J. Association between joint hypermobility, scoliosis, and cranial base anomalies in pediatric osteogenesis imperfecta patients: a retrospective cross-sectional study // BMC Musculoskelet. Disord. 2014. Vol. 15. P. 428. DOI: 10.1186/1471-2474-15-428.
17. Salzmann M., Krohn C., Berger N. Osteognesis imperfecta [Osteogenesis imperfecta] // Orthopade. 2014. Vol. 43, No 8. P. 764-771. DOI: 10.1007/ s00132-013-2229-3. (in German)
18. Hoyer-Kuhn H., Netzer C., Semler O. Osteogenesis imperfecta: pathophysiology and treatment // Wien Med. Wochenschr. 2015. Vol. 165, No 13-14. P. 278-284. DOI: 10.1007/s10354-015-0361-x.
19. Bacon S., Crowley R. Developments in rare bone diseases and mineral disorders // Ther. Adv. Chronic Dis. 2018. Vol. 9, No 1. P. 51-60. DOI: 10.1177/ 2040622317739538.
20. Marini J.C., Dang Do A.N. Osteogenesis Imperfecta. In: Endotext [Internet]. K.R. Feingold, B. Anawalt, A. Boyce, G. Chrousos, W.W. de Herder, K. Dhatariya, K. Dungan, A. Grossman, J.M. Hershman, J. Hofland, S. Kalra, G. Kaltsas, C. Koch, P. Kopp, M. Korbonits, C.S. Kovacs, W. Kuohung, B. Laferrere, E.A. McGee, R. McLachlan, J.E. Morley, M. New, J. Purnell, R. Sahay, F. Singer, C.A. Stratakis, D.L. Trence, D.P. Wilson, editors. South Dartmouth (MA): MDText.com, Inc. 2000.
21. Van Dijk F.S., Sillence D.O. Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assessment // Am. J. Med. Genet. A. 2014. Vol. 164A, No 6. P. 1470-1481. DOI: 10.1002/ajmg.a.36545.
22. Nosology and classification of genetic skeletal disorders: 2019 revision / G.R. Mortier, D.H. Cohn, V. Cormier-Daire, C. Hall, D. Krakow, S. Mundlos, G. Nishimura, S. Robertson, L. Sangiorgi, R. Savarirayan, D. Sillence, A. Superti-Furga, S. Unger, M.L. Warman // Am. J. Med. Genet. A. 2019. Vol. 179, No 12. P. 2393-2419. DOI: 10.1002/ajmg.a.61366.
23. Zaripova A.R., Khusainova R.I. Modern classification and molecular-genetic aspects of osteogenesis imperfecta // Vavilovskii Zhurnal Genet. Selektsii. 2020. Vol. 24, No 2. P. 219-227. DOI: 10.18699/VJ20.614.
24. Marom R., Rabenhorst B.M., Morello R. Osteogenesis imperfecta: an update on clinical features and therapies // Eur. J. Endocrinol. 2020. Vol. 183, No 4. P. R95-R106. DOI: 10.1530/EJE-20-0299.
25. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration / A. Liberati, D.G. Altman, J. Tetzlaff, C. Mulrow, P.C. G0tzsche, J.P. Ioannidis, M. Clarke, PJ. Devereaux, J. Kleijnen, D. Moher // J. Clin. Epidemiol. 2009. Vol. 62, No 10. P. e1-e34. DOI: 10.1016/j.jclinepi.2009.06.006.
26. Biggin A., Munns C.F. Osteogenesis imperfecta: diagnosis and treatment // Curr. Osteoporos. Rep. 2014. Vol. 12, No 3. P. 279-288. DOI: 10.1007/ s11914-014-0225-0.
27. Marini J.C., Blissett A.R. New genes in bone development: what's new in osteogenesis imperfecta // J. Clin. Endocrinol. Metab. 2013. Vol. 98, No 8. P. 3095-3103. DOI: 10.1210/jc.2013-1505.
28. Osteogenesis imperfecta: from diagnosis and multidisciplinary treatment to future perspectives / A. Bregou Bourgeois, B. Aubry-Rozier, L. Bonafe, L. Laurent-Applegate, D.P. Pioletti, P.Y. Zambelli // Swiss Med. Wkly. 2016. Vol. 146. P. w14322. DOI: 10.4414/smw.2016.14322.
29. Современный подход к диагностике и лечению детей с несовершенным остеогенезом / М.Е. Бурцев, А.В. Фролов, А.Н. Логвинов, Д.О. Ильин, А.В. Королев // Ортопедия, травматология и восстановительная хирургия детского возраста. 2019. Т. 7, № 2. С. 87-102. https:// doi.org/10.17816/PTORS7287-102.
30. Management of Osteogenesis Imperfecta: A Multidisciplinary Comprehensive Approach / T.J. Cho, J.M. Ko, H. Kim, H.I. Shin, W.J. Yoo, C.H. Shin // Clin. Orthop. Surg. 2020. Vol. 12, No 4. P. 417-429. DOI: 10.4055/cios20060.
31. Steiner R.D., Basel D. COL1A1/2 Osteogenesis Imperfecta. In: GeneReviews® [Internet]. Adam M.P., Ardinger H.H., Pagon R.A., et al., editors. Seattle (WA): University of Washington, 1993-2021. 2005.
32. Genetic causes and mechanisms of osteogenesis imperfecta / J. Lim, I. Grafe, S. Alexander, B. Lee // Bone. 2017. Vol. 102. P. 40-49. DOI: 10.1016/j. bone.2017.02.004.
33. Orioli I.M., Castilla E.E., Barbosa-Neto J.G. The birth prevalence rates for the skeletal dysplasias // J. Med. Genet.1986. Vol. 23, No 4. P. 328-332. DOI: 10.1136/jmg.23.4.328.
34. Analysis of skeletal dysplasias in the Utah population / D.A. Stevenson, J.C. Carey, J.L. Byrne, S. Srisukhumbowornchai, M.L. Feldkamp // Am. J. Med. Genet A. 2012. Vol. 158A, No 5. P. 1046-1054. DOI: 10.1002/ajmg.a.35327.
35. Mortality and causes of death in patients with osteogenesis imperfecta: a register-based nationwide cohort study / L. Folkestad, J.D. Hald, V. Canudas-Romo, J. Gram, A.P. Hermann, B. Langdahl, B. Abrahamsen, K. Brixen // J. Bone Miner. Res. 2016. Vol. 31, No 12. P. 2159-2166. DOI: 10.1002/ jbmr.2895.
36. Hearing loss in Finnish adults with osteogenesis imperfecta: a nationwide survey / K. Kuurila, I. Kaitila, R. Johansson, R. Grenman // Ann. Otol. Rhinol. Laryngol. 2002. Vol. 111, No 10. P. 939-946. DOI: 10.1177/000348940211101014.
37. Osteogenesis imperfecta type VII: an autosomal recessive form of brittle bone disease / L.M. Ward, F. Rauch, R. Travers, G. Chabot, E.M. Azouz, L. Lalic, PJ. Roughley, F.H. Glorieux // Bone. 2002. Vol. 31, No 1. P. 12-18. DOI: 10.1016/s8756-3282(02)00790-1.
38. A founder mutation in LEPRE1 carried by 1.5 % of West Africans and 0.4 % of African Americans causes lethal recessive osteogenesis imperfecta / W.A. Cabral, A.M. Barnes, A. Adeyemo, K. Cushing, D. Chitayat, F.D. Porter, S.R. Panny, F. Gulamali-Majid, S.A. Tishkoff, T.R. Rebbeck, S.M. Gueye, J.E. Bailey-Wilson, L.C. Brody, C.N. Rotimi, J.C. Marini // Genet. Med. 2012. Vol. 14, No 5. P. 543-555. DOI: 10.1038/gim.2011.44.
39. Experience of a skeletal dysplasia registry in Turkey: a five-years retrospective analysis / E.D. Kurt-Sukur, P.O. Simsek-Kiper, G.E. Utine,
K. Boduroglu, Y. Alanay // Am. J. Med. Genet. A. 2015. Vol. 167A, No 9. P. 2065-2074. DOI: 10.1002/ajmg.a.37122.
40. Consortium for osteogenesis imperfecta mutations in the helical domain of type I collagen: regions rich in lethal mutations align with collagen binding sites for integrins and proteoglycans /J.C. Marini, A. Forlino, W.A. Cabral, A.M. Barnes, J.D. San Antonio, S. Milgrom, J.C. Hyland, J. Korkko, D.J. Prockop, A. de Paepe, P. Coucke, S. Symoens, F.H. Glorieux, PJ. Roughley, A.M. Lund, K. Kuurila-Svahn, H. Hartikka, D.H. Cohn, D. Krakow, M. Mottes, U. Schwarze, D. Chen, K. Yang, C. Kuslich, J. Troendle, R. Dalgleish, P.H. Byers // Hum. Mutat. 2007. Vol. 28, No 3. P. 209221. DOI: 10.1002/humu.20429.
41. Ishikawa Y., Bachinger H.P. A molecular ensemble in the rER for procollagen maturation // Biochim. Biophys. Acta. 2013. Vol. 1833, No 11. P. 2479-2491. DOI: 10.1016/j.bbamcr.2013.04.008.
42. Osteogenesis imperfecta type V: marked phenotypic variability despite the presence of the IFITM5 c.-14C>T mutation in all patients / F. Rauch , P. Moffatt, M. Cheung, P. Roughley, L. Lalic, A.M. Lund, N. Ramirez, S. Fahiminiya, J. Majewski, F.H. Glorieux // J. Med. Genet. 2013. Vol. 50, No 1. P. 21-24. DOI: 10.1136/jmedgenet-2012-101307.
43. A mutation in the 5'-UTR of IFITM5 creates an in-frame start codon and causes autosomal-dominant osteogenesis imperfecta type V with hyperplastic callus / O. Semler, L. Garbes, K. Keupp, D. Swan, K. Zimmermann, J. Becker, S. Iden, B. Wirth, P. Eysel, F. Koerber, E. Schoenau, S.K. Bohlander, B. Wollnik, C. Netzer // Am. J. Hum. Genet. 2012. Vol. 91, No 2. P. 349-357. DOI: 10.1016/j. ajhg.2012.06.011.
44. CRTAP is required for prolyl 3- hydroxylation and mutations cause recessive osteogenesis imperfecta // R. Morello, T.K. Bertin, Y. Chen, J. Hicks, L. Tonachini, M. Monticone, P. Castagnola, F. Rauch, F.H. Glorieux, J. Vranka, H.P. Bachinger, J.M. Pace, U. Schwarze, P.H. Byers, M. Weis, R.J. Fernandes, D.R. Eyre, Z. Yao, B.F. Boyce, B. Lee // Cell. 2006. Vol. 127, No 2. P. 291-304. DOI: 10.1016/j.ceU.2006.08.039.
45. OMIM. Online Mendelian Inheritance in Man®. An Online Catalog of Human Genes and Genetic Disorders.
46. Sillence D.O., Senn A., Danks D.M. Genetic heterogeneity in osteogenesis imperfecta // J. Med. Genet. 1979. Vol. 16, No 2. P. 101-116. DOI: 10.1136/ jmg.16.2.101.
47. Sillence D.O., Rimoin D.L., Danks D.M. Clinical variability in osteogenesis imperfecta-variable expressivity or genetic heterogeneity // Birth Defects Orig. Artic. Ser. 1979. Vol. 15, No 5B. P. 113-129.
48. Thomas I.H., DiMeglio L.A. Advances in the Classification and Treatment of Osteogenesis Imperfecta // Curr. Osteoporos. Rep. 2016. Vol. 14, No 1. P. 1-9. DOI: 10.1007/s11914-016-0299-y.
49. Внутриутробные переломы костей скелета у плодов с несовершенным остеогенезом: обзор литературы и собственное клиническое наблюдение / Е.Г. Скрябин, И.В. Комарова, А.Н. Буксеев, И.И. Кукарская, М.А. Аксельров, Е.Б. Храмова, С.Н. Супрунец, Д.А. Попков // Гений ортопедии. 2018. Т. 24, № 4. С. 521-529.
51. Мингазов Э.Р., Чибиров Г.М., Попков Д.А. Ортопедические осложнения и ятрогении при коррекции деформаций нижних конечностей у пациентов, страдающих тяжелыми формами несовершенного остеогенеза // Гений ортопедии. 2018. Т. 24, № 2. С. 168-176.
52. Type V osteogenesis imperfecta: a new form of brittle bone disease / F.H. Glorieux, F. Rauch, H. Plotkin, L. Ward, R. Travers, P. Roughley, L. Lalic, D.F. Glorieux, F. Fassier, N.J. Bishop // J. Bone Miner. Res. 2000. Vol. 15, No 9. P. 1650-1658. DOI: 10.1359/jbmr.2000.15.9.1650.
53. Rohrbach M., Giunta C. Recessive osteogenesis imperfecta: clinical, radiological, and molecular findings // Am. J. Med. Genet. C. Semin. Med. Genet. 2012. Vol. 160C, No 3. P. 175-189. DOI: 10.1002/ajmg.c.31334.
54. Osteogenesis Imperfecta: A Review with Clinical Examples / F.S. van Dijk, J.M. Cobben, A. Kariminejad, A. Maugeri, P.G. Nikkels, R.R. van Rijn, G. Pals // Mol. Syndromol. 2011. Vol. 2, No 1. P. 1-20. DOI: 10.1159/000332228.
55. De Paepe A., Malfait F. The Ehlers-Danlos syndrome, a disorder with many faces // Clin. Genet. 2012. Vol. 82, No 1. P. 1-11. DOI: 10.1111/j.1399-0004.2012.01858.x.
56. A scoring system for the assessment of clinical severity in osteogenesis imperfecta / M.S. Aglan, L. Hosny, R. El-Houssini, S. Abdelhadi, F. Salem, R.A. Elbanna, S.A. Awad, M.E. Zaki, S.A. Temtamy // J. Child. Orthop. 2012. Vol. 6, No 1. P. 29-35. DOI: 10.1007/s11832-012-0385-3.
57. Nosology and classification of genetic skeletal disorders: 2015 revision / L. Bonafe, V. Cormier-Daire, C. Hall, R. Lachman, G. Mortier, S. Mundlos, G. Nishimura, L. Sangiorgi, R. Savarirayan, D. Sillence, J. Spranger, A. Superti-Furga, M. Warman, S. Unger // Am. J. Med. Genet. A. 2015. Vol. 167A, No 12. P. 2869-2892. DOI: 10.1002/ajmg.a.37365.
58. DNA sequence analysis in 598 individuals with a clinical diagnosis of osteogenesis imperfecta: diagnostic yield and mutation spectrum / G. Bardai, P. Moffatt, F.H. Glorieux, F. Rauch // Osteoporos. Int. 2016. Vol. 27, No 12. P. 3607-3613. DOI: 10.1007/s00198-016-3709-1.
59. Tauer J., Robinson M.E., Rauch F. Osteogenesis imperfecta: new perspectives from clinical and translational research // JBMR Plus. 2019. Vol. 3, No 8. P. e10174. DOI: 10.1002/jbm4.10174.
60. Type V osteogenesis imperfecta undergoing surgical correction for scoliosis / M. Jones, L. Breakwell, A. Cole, P. Arundel, N. Bishop // Eur. Spine J. 2018. Vol. 27, No 9. P. 2079-2084. DOI: 10.1007/s00586-018-5465-8.
Сведения об авторах:
1. Рябых Сергей Олегович, д. м. н., ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
2. Попков Дмитрий Арнольдович, д. м. н., профессор РАН, член-корр. Французской Академии медицинских наук, ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
3. Щурова Елена Николаевна, д. б. н., ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
4. Очирова Полина Вячеславовна, к. м. н., ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
5. Рябых Татьяна Викторовна, ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
Теги: остеогенез
234567 Начало активности (дата): 11.08.2021 16:58:00
234567 Кем создан (ID): 989
234567 Ключевые слова: несовершенный остеогенез, эпидемиология, этиология, патогенез, классификация
12354567899
Похожие статьи
Заживление перелома в условиях возбуждения локального очага остеогенеза в контралатеральной конечностиРентген на дому 8 495 22 555 6 8
Внеочаговый остеосинтез закрытых осложнённых переломов голени
Особенности формирования костного регенерата, структурных изменений суставного хряща и большеберцового нерва в условиях автоматического удлинения голени по Илизарову с темпом 3 мм с применением ахиллотомии (экспериментальное исследование)
Этиология и патогенез асептического некроза головки бедренной кости



