 23.05.2021
23.05.2021
Суставной хрящ: изменения при чрескостном дистракционном остеосинтезе, физиологическая и репаративная регенерация (обзор литературы)
Анализ специальной литературы показал, что в настоящее время при исследовании суставного хряща в условиях дистракционного остеосинтеза смежного сегмента конечности остаются не изученными вопросы о механизмах клеточной гибели, о формах клеточного деления, что требует применения специальных методов иммуногистохимического исследования
Научный интерес к хрящу постоянно растет.
По мере того, как накапливаются новые данные, суставной хрящ оказывается не такой уж инертной и мало способной к регенерации структурой, каковой он считался ранее.
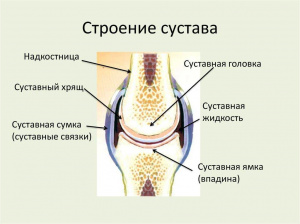
Суставной хрящ состоит из клеточного компартмента и внеклеточного матрикса, которые находятся в тесной генетической, морфологической и функциональной связи друг с другом, представляя в целом единую тканевую систему. Хондроциты участвуют в регуляции синтеза (анаболизм) и деградации (катаболизм) компонентов хрящевого матрикса, эти процессы в норме находятся в сбалансированном состоянии [2, 5, 29].
Исследование цитоархитектоники позволяет выделить в суставном хряще три структурные зоны: поверхностную, обращенную к синовиальной полости сустава; промежуточную и глубокую, обращенную к кости. Клетки хряща на различной глубине залегания отличаются друг от друга по объему, форме, репродуктивным свойствам, плотности распределения в матриксе, ультраструктурной организации и пр. Различия структурно-функционального состояния генетически однородных клеток являются следствием их адаптации к условиям, складывающимся в процессе морфогенеза самого суставного хряща [11, 52].
В суставном хряще различают три фенотипа хондроцитов. Клетки I типа характеризуются высоким ядерно-цитоплазматическим отношением, комплекс Гольджи и эндоплазматическая сеть относительно слабо выражены, вакуоли немногочисленны.
Хондроциты I типа часто делятся, т.е. являются источником репродукции изогенных групп клеток. Клетки II типа – зрелые, высокодифференцированные, активные в секреторном отношении клетки, имеют высоко электронно-плотное неровной формы ядро, комплекс Гольджи и эндоплазматическая сеть хорошо развиты. Постоянным цитоплазматическим включением является гликоген. Клетки III типа – также высокодифференцированные, отличаются самым низким ядерно-цитоплазматическим отношением. Их ультраструктурные особенности свидетельствуют об активной секреторной деятельности. Клетки содержат значительные скопления гликогена [14, 27, 52].
По данным электронной и световой микроскопии, наименее дифференцированные клетки в суставном хряще зрелых животных расположены в верхней части промежуточной зоны (переходная зона), а наиболее дифференцированные в глубокой зоне (зона колонок и гипертрофированных клеток) [11, 14].
1. Физиологическая и репаративная регенерация суставного хряща
Физиологическое самовосстановление (физиологическая регенерация) суставного хряща осуществляется механизмами интерстициального роста (рис. 1).
Хондроциты промежуточной зоны образуют изогенные группы. Уже само явление изогении свидетельствует о способности клеток к саморепродукции, которая сохраняется в этой зоне в течение всей жизни. В настоящее время доказано, что формы клеточного деления в хрящевой ткани суставов
– митоз и амитоз. Митотическое деление клеток происходит обычно в хряще растущих животных, главным образом в промежуточной зоне, по окончании роста животного митоз становится редким, преобладает амитоз [34, 38, 43].
В хондроцитах промежуточной зоны хорошо развиты гранулярная эндоплазматическая сеть, аппарат Гольджи, митохондрии, а также разной величины и формы вакуоли, что отражает активное состояние в них метаболизма и биосинтеза, направленных на удовлетворение потребностей саморепродукции клеток и пополнение компонентов матрикса [11, 52 и др.].
Одним из самых широко распространенных заболеваний суставов является остеоартроз. В основе дегенеративно-дистрофических поражений суставного хряща лежит нарушение синтетических процессов, обусловливающих снижение репарации и преобладание деградации [17, 26]. В результате этих процессов хрящ истончается, становится шероховатым, мутным, менее упругим, в местах максимальной нагрузки появляются эрозии. При этом гистологически обнаружено разволокнение межклеточного вещества, гибель клеток, формирование глубоких узур, появление многоклеточных пролифератов, нарушение непрерывности базофильной линии, проникновение сосудов [4, 20, 26, 27].
С помощью современных количественных методов исследования на ранних стадиях остеоартроза выявлено уменьшение толщины хряща, снижение количества хондроцитов, уменьшение их размеров, коэффициента формы, снижение количества ядер, их площади [1, 26, 28, 51].
Учитывая большую социальную значимость заболеваний крупных суставов, регенерация хряща является одним из наиболее актуальных вопросов, связанных с морфологией и функцией суставного хряща. Способность хряща к репаративной регенерации лимитирована двумя факторами: отсутствием прямого кровоснабжения и особенностями
структуры. Аваскулярная природа хряща делает невозможным развёртывание воспалительной фазы и миграцию стволовых клеток в хрящ [48]. Плотный внеклеточный матрикс формирует физический барьер для миграции в дефект существующих хондроцитов. Особенностью хрящевой ткани, по сравнению с другими видами тканей в организме, является то, что в ней мало клеток и они окружены большим количеством межклеточного пространства. На основании способности к клеточному обновлению, хрящевая ткань относится к тканям растущего типа, для которой характерно постепенное снижение митотической активности. Хотя хондроциты продуцируют матрикс на протяжении всей жизни, эта продукция не может обеспечить потребности, которые развиваются после повреждений суставного хряща. При неглубоких повреждениях хрящевая ткань мобилизует свои регенераторные возможности в виде пролиферации хондроцитов, внутриклеточной гипертрофии и фибробластической их трансформации [27, 29, 44].
Репаративная регенерация суставного хряща выражается в возбуждении пролиферативных и секреторных возможностей хондроцитов [27, 39].
Установлено, что хондроцит в ответ на повреждение начинает делиться, однако избыточная пролиферация не ведет к увеличению секреторно-активных клеток. В процессе заживления не все клетки способны к делению. Во вновь формирующихся изогенных группах часть хондроцитов активно синтезирует коллаген и протеогликаны. Увеличение
числа активно продуцирующих клеток, способных создавать новые участки матрикса – основной источник восстановительных процессов в суставном хряще. Оба процесса тесно взаимосвязаны, и именно этим определяется и пролиферация, и дифференцировка, и жизнеспособность восстанавливающегося хряща [5, 15, 27].
Вплоть до настоящего времени вопросы о механизмах клеточной гибели, регенерации суставного хряща и ее источниках при разных видах повреждения остаются дискутабельными.
Реакция клеток на повреждение зависит от типа, продолжительности действия, тяжести повреждающего фактора. Некроз и апоптоз признаются разновидностями клеточной смерти.
Особую роль апоптоз играет в развитии остеоартроза, связанного с нарушением биомеханики суставов [26]. Установлено, что механическое давление на хрящ ведет к увеличению секреции оксида азота, сопровождающемуся развитием апоптоза значительной части хондроцитов [28]. Образуемые хондроцитами апоптотические тела проявляют функциональные свойства (содержат щелочную фосфатазу, преципитируют кальций), которые могут способствовать кальцификации хряща [37].
Недостаточно выяснены вопросы о возможности, месте и формах пролиферации хондроцитов.
Учитывая зональную неоднородность суставного хряща, исследователи высказывали различные мнения о наличии какой-то определенной зоны, имеющей наибольшее значение для его роста и восстановления. По данным ряда исследователей [11, 26, 27, 45, 52], в суставном хряще постоянно имеются признаки репродукции и отмирания клеток. Прямые и косвенные признаки деления хондроцитов (двуядерные клетки, тесные клеточные пары и др.) чаще встречаются в промежуточной зоне. Хондроциты промежуточной зоны сохраняют способность пролиферировать в течение всей жизни и выполняют роль камбия для всей структуры суставного хряща. Возможность репродукции клеток глубокой зоны подтверждена рядом исследователей. Мажуга П.М. (1999), Wezeman F.H. (1998) обнаружили в глубокой зоне неизмененного хряща клетки с фигурами митотического деления [11, 52].
Результаты исследований ряда авторов позволяют считать хондроциты поверхностной зоны резервными клетками, а поверхностную зону – зоной резервных клеток, так как при действии ряда факторов в период восстановления часть клеток поверхностной зоны подвергается делению [14, 27]. Так, при действии постоянного давления на суставной хрящ в его поверхностной зоне были обнаружены фигуры митоза [38].
По-видимому, степень и качество регенерации хряща зависит от глубины его повреждения, площади поврежденного участка и от условий существования хряща после повреждения.
Ограниченные способности суставного хряща к регенерации привели к развитию заместительных операций: пересадка надкостницы, надхрящницы, пластика костно-хрящевыми ауто- и аллотрансплантатами, «костномозговая стимуляция», применение метода клеточной и тканевой инженерии [3, 13, 15, 16, 21, 33, 40 и др.]. Каждый из этих методов успешно применяется, но может лишь частично помочь восстановлению функционирования сустава. Ни один из этих способов не приводит к образованию гиалинового хряща, способного выдерживать нагрузку, которая прилагается к суставу в естественных условиях. Проблема заключается в том, что после трансплантации жизнеспособные хондроциты обладают пониженной пролиферативной и синтетической активностью [15]. Это послужило основанием для разработки новых подходов к лечению дефектов хряща на основе культивирования клеток. Известно, что лабораторные условия культивирования, при которых выращиваются тканево-инженерные конструкции, не повторяют физиологическое микроокружение, которое существует в хрящевой и костной тканях. Высокая трудоемкость и стоимость процесса культивации ограничивает применение этого метода [33, 40].
В настоящее время среди способов стимуляции рапаративного остео- и хондрогенеза широкое распространение получили субхондральная туннелизация, абразия и формирование микропереломов субхондральной кости, объединенные названием «костномозговая стимуляция» [12, 16, 19, 36, 47].
Однако особенности строения регенератов, образующихся после применения субхондральной туннелизации, мало изучены и недостаточно согласованы с реальным восстановлением функции коленного сустава. Вновь образующаяся ткань носит характер скорее волокнистой, чем хрящевой, значительно отличается от нормального хряща по биомеханическим и биохимическим свойствам, чем нарушает гомеостаз синовиальной среды сустава [15, 19, 35].
Таким образом, самостоятельное восстановление хряща после глубокого повреждения никогда не бывает полным. Добиться реституции сустава удается редко. В связи с этим, с целью обеспечения положительного анатомо-функционального результата в настоящее время актуален поиск более эффективных способов стимуляции и оптимальных условий
репаративной регенерации суставного хряща.2. Изменения суставного хряща при удлинении конечности
В вопросах удлинения конечностей важное место занимает проблема сохранения функциональных возможностей суставов. Широкое внедрение в клиническую практику чрескостного дистракционного остеосинтеза вызывает необходимость углубленного изучения процессов, происходящих в смежных с удлиняемым сегментом конечности суставах, поскольку сохранение их функциональных возможностей имеет очень большое значение для медицинской, социальной реабилитации и улучшения качества жизни пациентов.
Реакция суставов на удлинение конечности аппаратом Илизарова отмечалась в клинике многими авторами [6, 9, 31, 41, 42]. По мнению исследователей, в процессе дистракционного остеосинтезасустав подвергается действию комплекса факторов, однако значение каждого из них еще не получило полной теоретической оценки. Вынужденное ограничение функции удлиняемой конечности сопровождается изменением распределения нагрузки на суставные поверхности, изменением состояния сосудистого русла, длительным раздражением периферических нервов, что влечет нарушение трофики костной ткани и компонентов сустава с развитием функциональных нарушений [9, 18, 23, 25].
При действии растягивающих усилий, возникающих в условиях дистракционного остеосинтеза, сопротивление мышечно-связочного аппарата нарастает, что ведет к увеличению сдавления смежных с удлиняемым сегментом суставов [6].
Под действием постоянной сдавливающей нагрузки, возникает статическая перегрузка, происходят дегидратация и уменьшение толщины суставного хряща. При этом ослабевает или выключается диффузионный механизм питания, что приводит к дегенеративно-некробиотическим изменениям, накоплению метаболитов, продуктов клеточного распада и протеолитических ферментов, вызывающих дезорганизацию матрикса хряща [23].
Биохимические исследования, выполненные в РНЦ «ВТО», показали, что при удлинении голени методом чрескостного дистракционного остеосинтеза в гиалиновом хряще не только оперированной, но и контрлатеральной конечности происходят изменения его химического состава, показателей обмена гликозаминогликанов и обусловленных ими механических свойств [8, 10].
Вопрос о морфологических изменениях в суставном хряще в зависимости от величины удлинения и условий удлинения изучен недостаточно. В литературе встречаются лишь единичные работы, освещающие отдельные аспекты этой проблемы.
При экспериментально-морфологическом исследовании коленного сустава при удлинении большеберцовой кости с суточным темпом 1 мм за 1 прием на 20 % от исходной длины были выявлены дегенеративные изменения в суставном хряще (очаговый поверхностный некроз, паннус, васкуляризация со стороны субхондральной кости), которые подвергались обратному развитию под влиянием нормализации функции конечности [22].
При гистологическом исследовании суставного хряща в условиях дозированного удлинения смежного сегмента конечности с темпом 1 мм за 2 приема и 0,75 мм за 1 прием на 30 % от исходной длины зарубежными исследователями были отмечены истончение, разволокнение суставного хряща, снижение интенсивности метахромазии межклеточного вещества, в части наблюдений выявлены некротические изменения [46, 49, 50]. Авторы предполагают, что глубина изменений суставного хряща зависит от длительности периода дистракции и фиксации конечности в аппарате. По мнению E. Nakamura, H. Mizuta, K. Takagi (1995), увеличение дробности дистракции может предотвратить повреждения смежных суставов [46].
Анализируя результаты проведенных исследований, можно сказать, что дистракционный остеосинтез добавил вопросов в изучение проблемы патологии суставов и их лечения.
Одной из актуальных задач удлинения конечности, требующих теоретического и практического решения, является выбор оптимального дифференцированного темпа дистракции в зависимости от индивидуальных особенностей пациента, максимальное повышение дробности дистракции с помощью автоматических устройств. В РНЦ «ВТО» высокодробная дистракция в автоматическом режиме начала внедряться в 80-90-е годы прошлого века. Преимущества автоматической дистракции неоспоримы, применение автоматических дистракторов позволило снизить травматичность хирургической коррекции и приблизить адаптивные реакции растяжения к естественным процессам роста [7, 25, 30].
При удлинении голени собак аппаратом Илизарова на 14-16 % от исходной длины с суточным темпом 1 мм в двух режимах: за 60 приемов (автодистракция) и за 8 приемов (ручные подкрутки) в суставном хряще наружного мыщелка бедра нами были выявлены структурно-функциональные изменения реактивного и/или деструктивно-репаративного характера, степень которых зависела от величины разового удлинения. Наиболее интенсивно деструктивные изменения были выражены при 8-кратной дробности дистракции.
При этом регенерация хряща осуществлялась за счет активизации пролиферативных и биосинтетических процессов. Наибольшая частота встречаемости изогенных групп клеток в обеих сериях наблюдалась в промежуточной зоне. Необходимо также отметить увеличение количества изогенных групп клеток и в неповрежденных участках более глубоких слоев поверхностной зоны, наиболее выраженное при 8-кратной дробности дистракции. Выраженность процессов пролиферации и биосинтеза в суставном хряще при разных режимах дистракции была различна и зависела от степени повреждения.
При 8-кратной дробности дистракции в суставном хряще были более выражены пролиферативные процессы, при 60-кратной – биосинтетические. К концу эксперимента (30 суток после снятия аппарата) при автодистракции репаративная регенерация по типу реституции завершалась формированием суставной поверхности, приближающейся по структуре к интактной, при 8-кратной дробности дистракции регенерация суставного хряща имела незавершенный характер [32]. При количественном исследовании на клеточном уровне (цито- и кариометрии) наиболее ярко выражены изменения хондроцитов неповрежденных участков поверхностной зоны. На всех этапах эксперимента в неповрежденных участках поверхностной зоны наблюдалось увеличение параметров, характеризующих размер, форму клеток и их ядер за счет увеличения в большей степени объемной доли цитоплазмы.
Выявлено снижение ядерно-цитоплазматического индекса, что свидетельствовало об активно развивающихся процессах внутриклеточной регенерации (гипертрофии, гиперплазии структурных компонентов). Максимальные количественные характеристики клеток промежуточной и глубокой зон были выявлены в конце периода фиксации [24].
Таким образом, результаты наших исследований[24, 32] показали, что степень выраженности изменений в суставном хряще зависит от темпа дистракции и величины разового удлинения. Высокодробная автодистракция с темпом 1 мм позволяет снизить травматизацию смежных суставов и обеспечивает высокую эффективность адаптационных реакций, направленных на восстановление структуры суставного хряща. Полученные нами результаты о функциональной значимости хондроцитов поверхностной зоны как резерва клеточной пролиферации согласуются литературными данными [14, 27, 38]. Анализ специальной литературы показал, что в настоящее время при исследовании суставного хряща в условиях дистракционного остеосинтеза смежного сегмента конечности остаются не изученными вопросы о механизмах клеточной гибели, о формах клеточного деления, что требует применения специальных методов иммуногистохимического исследования.
Дальнейшее развитие направления по выбору оптимального темпа и ритма дистракции требует изучения состояния физиологических резервов, резистентности и адаптивности тканей удлиняемой конечности в зависимости от режима дистракции, в том числе адекватной оценки реактивных изменений и репаративных потенций суставного хряща на основе современных представлений о его адаптивности и пластичности.
ЛИТЕРАТУРА
1.Алексеева Л.И. Основные достижения в лечении отеоартроза. Качество жизни // Медицина. 2003. No 3. С. 34-38.
2.Актуальные проблемы теоретической и клинической остеоартрологии / Ю.И. Денисов-Никольский [и др.]. М., 2005. 336 с.
3.Беллендир Э.Н., Ариэль Б.М. Экспериментально-морфологические особенности перихондриального хондрогенеза // Морфология. 2005. No 3. С. 63-67.
4.Виноградова Е.В. Механизмы деструкции и регенерации хряща коленного сустава при остеоартрозе // Ортопедия, травматология и протезирование. 2000. No 2. С. 97-98.
5.Гистологические основы регенерации тканей опорно-двигательного аппарата / Р.К. Данилов [и др.] // Ортопедия, травматология и протезирование. 2000. No 2. С. 102.
6.Дьячкова Г.В. Мышечно-фасциальный аппарат голени при удлинении ее по методу Илизарова в эксперименте // Лечение ортопедотравматологических больных в стационаре и поликлинике методом чрескостного остеосинтеза, разработанным в КНИИЭКОТ: Курган, 1982. Ч. 2. С. 176-179.
7.Зависимость репаративной регенерации кости и функционального состояния удлиняемой конечности от дробности дистракции: (эксперимент исслед.) / Г. А. Илизаров [и др.] // Гений ортопедии. 1995. No 1. С. 8-12.
8.Изменения показателей углеводного компонента протеогликанов тканей коленного сустава при удлинении голени у собак / Е.Л. Матвеева [и др.] // Гений ортопедии. 1997. No 1. С. 71-73.
9.Клинико-физиологические и морфологические характеристики адаптивной перестройки в мягкотканных структурах удлиняемой конечности / В.И. Калякина [и др.] // Значение открытых Г.А. Илизаровым общебиологических закономерностей в регенерации тканей: сб. науч. тр. Курган, 1988. Вып. 13. С. 63-70.
10.Лунева С. Н. Состояние хряща и кости коленного сустава собак в условиях удлинения голени // Гений ортопедии. 2004. No 1. C. 25-29.
11.Мажуга П.М. Источники трофики и структурного самовосполнения суставного хряща // Морфология. 1999. No 1. С. 43-50.
12.Макушин В.Д., Чегуров О.К. Субхондральная туннелизация: вопросы технологии и эффективности лечения при гонартрозе: (обзор лит. и собств. данные) // Гений ортопедии. 2006. No 4. С.99-104.
13.Маленков И.Ю. Экспериментально-теоретическое обоснование перихондропластики в костно-суставной хирургии // Травматология и ортопедия России. 1995. No 6. С. 58-61.
14.Модяев В.П. Некоторые особенности репродукции хондроцитов в суставном хряще // Физиология и патология соединительной ткани. Новосибирск, 1980. Т. 1. С. 149-150.
15.Об оптимальных условиях репаративной регенерации опорных органов / Г.И. Лаврищева [и др.] // Гений ортопедии. 2002. No 1. С. 120-125.
16.Пластика полнослойных дефектов покровного хряща коленного сустава цилиндрическими костно-хрящевыми ауто- и аллотрансплантатами малого размера: (эксперимент. исслед.) / Д.А. Маланин [и др.] // Вестник травматологии и ортопедии. 2000. No 2. С. 16-21.
17.Поворознюк В.В. Остеоартроз: современные принципы лечения // Здоровье Украины. 2003. No 11. С. 45-48.
18.Реакция нервов на растяжение и их структурная адаптация к удлинению конечности / М.М. Щудло [и др.] // Гений ортопедии. 2009. No 4. С.48-55.
19.Регенерация костно-хрящевых повреждений в коленном суставе после их пластики композитным препаратом на основе гидроксиапатита и коллагена / Ю.Э. Питкевич [и др.] // Бюл. Волгоград. науч. центра РАМН. 2007. No 1. С. 3-7.
20.Слесаренко Н.А. Метаболические свойства суставного хряща // Ортопедия, травматология и протезирование. 1994. No 4. С. 90.
21.Современные возможности и перспективы хирургического лечения повреждений и заболеваний суставного хряща / О.Л. Эйсмонт [и др.] // Мед. новости. 2008. No 7. С. 12-19.
22.Старцева И.А., Никитенко Е.Т. Морфологические изменения в коленном суставе при удлинении голени в эксперименте // Заболевания и повреждения суставов: сб. тр. науч. конф. Свердловск, 1973. Т. 12. С. 104-108.
23.Стецула В.И., Веклич В.В. Основы управляемого чрескостного остеосинтеза. М.: Медицина, 2003. 224 с.
24.Ступина Т.А., Щудло М.М. Количественные характеристики адаптивной перестройки хондроцитов суставного хряща наружного мыщелка бедра на этапах удлинения голеней собак // Украин. журн. телемедицины и мед. телематики. 2006. Т. 7, No 2. C. 148-152.
25.Удлинение нижних конечностей в автоматическом режиме / В.И. Шевцов [и др.] // Гений ортопедии. 1999. No 3. С. 20-24.
26.Ультраструктурные особенности хондроцитов суставного хряща в зависимости от стадии гонартрита / Ю.И. Бородин [и др.] // Бюллетень СО РАМН. No 6 (134). 2008. С.187-190.
27.Хрящ / В.Н. Павлова [и др.]. М.: Медицина, 1988. 320 с.
28.Цветкова Е.С., Панасюк Е.Ю. Нестероидные противовоспалительные препараты в терапии ОА // Consilium Medicum. 2003. Т. 5, No 2. С. 100–103.
29.Цурко В.В. Строение и функции суставного хряща. Роль цитокинов в патогенезе остеоартроза // Клинич. геронтология. 2001. No 12. С. 63–69.
30.Чиркова А. М., Ерофеев С.А. Рентгено-морфологические особенности репаративного остеогенеза при автоматической дистракции // Травматология и ортопедия России. 1994. No 2. С. 142-148.
31.Шевцов В.И., Попков А.В. Оперативное удлинение нижних конечностей. М.: Медицина, 1998. 192 с.
32.Щудло М.М., Ступина Т.А., Ерофеев С.А. Экспериментально-гистологическое исследование суставного хряща наружного мыщелка бедра при удлинении голени собак // Морфология. 2005. No 5. С. 67-71.
33.Adipose-derived adult stem cells for cartilage tissue engineering / F. Guilak [et al.] // Biorheology. 2004. V.41, NN 3-4. P. 389-399.
34.Acridine orange induces binucleation in chondrocytes / K. Kusuzaki [et al.] // Osteoarthritis Cartilage. 2001. Vol. 9, No. 2. P. 147-151.
35.Articular cartilage repair using tissue engineering technique - novel approach with minimally invasive procedure / M. Ochi [et al.] // Artif. Organs. 2004. Vol. 28, No. 1. P. 28-32.
36.Buckwalter J. A., Mankin H. J. Articular Cartilage: Degeneration and osteoarthritis, repair, regeneration, and transplantation // Instr. Course Lect. 1998. Vol. 47. Р. 487-504.
37.Chondrocyte-derived apoptotic bodies and calcification of articular cartilage / S. Hashimoto [et al.] // Proc. Natl. Acad. Sci. U.S.A. 1998. Vol. 95, No. 6. P. 3094-3099.
38.Crelin E. S., Southwick W. О. Mitosis of chondrocytes induced in the knee joint articular cartilage of adult rabbits // Yale J. Biol. Med. 1960. Vol. 33, No. 3. P. 243-244.1.
39.Hesse I. Zur Regenerationsfähigkeit – von Gelenkknorpel // Anat. Anz. 1989. Bd. 168. H. 1. S. 64.
40.Influence of oxygen on the proliferation and metabolism of adipose derived adult stem cells / D. W. Wang [et al.] // J. Cell Physiol. 2005. Vol. 204, No. 1. P. 184-191.
41.Knee range of motion in isolated femoral lengthening / J. E. Herzenberg [et al.] // Clin. Orthop. Relat. Res. 1994. No. 301. Р. 49-54.
42.Maffulli N., Nele U., Matarazzo L. Changes in knee motion following femoral and tibial lengthening using the Ilizarov apparatus: a cohort study // J. Orthop. Sci. 2001. Vol. 6, No. 4. Р. 333-338.
43.Mankin H. J. Localization of tritiated thymidine in articular cartilage of rabbits // J. Bone Jt. Surg. 1963. Vol. 45-A. Р. 529-540.
44.Mankin H. J. The response of articular cartilage to mechanical injury // J. Bone Jt. Surg. 1982. Vol. 64-A, No. 3. Р. 460-466.
45.Mohr W. On the morphology of (inflammatory) cartilage destruction // J. Clin. Chem. Clin. Biochem. 1986. Vol. 24, No. 11. P. 929-951.
46.Nakamura E., Mizuta H., Takaqi K. Knee cartilage injury after tibial lengthening. Radiographic and histological studies in rabbits after 3-6 months // Acta Orthop Scand. 1995. Vol. 66, No. 4. Р. 313-316.
47.Newman A. P. Articular cartilage repair // Am. J. Sports Med. 1998. Vol. 26, No. 2. P. 309-324.
48.Pacifici M., Koyama E., Iwamoto M. Mechanisms of synovial joint and articular cartilage formation : recent advances, but many lingering mysteries // Birth Defects Res. C Embryo Today. 2005. Vol. 75, No. 3. Р. 237-248.
49.Stanitski D. F., Rossman K., Torosian M. The effect of femoral lengthening on knee articular cartilage : the role of apparatus extension across the joint // J. Pediatr Orthop. 1996. Vol. 16, No. 2. Р. 151-154.
50.The effect of tibial lengthening using the Ilizarov method on the cartilage and the menisci of the knee joint / B. Fink [et al.] // J. Orthop. Res. 2001. Vol. 19, No. 4. Р. 665-670.
51.Watson R. E., Griffiths C. E. Pathogenic aspects of cutaneous photoaging // J. Cosmet. Dermatol. 2005. Vol. 4, No. 4. Р. 230-236.
52.Wezeman F. H. Introducton to histology and histochemistry of cartilage. Historical and contemporary aspects of cartilage development and structure // Microsc. Res. Techn. 1998. Vol. 43, No. 2. Р. 89-90.
1. Ступина Татьяна Анатольевана – ФГБУ «РНЦ «ВТО» им. акад. Г.А. Идизарова» Минздравсоцразвития РФ, с. н. с. лаборатории морфологии, к. б. н.
2. Щудло Михаил Моисеевич – ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздравсоцразвития РФ, в. н. с. клинико-экспериментальной лаборатории реконструктивно-восстановительной микрохирургии и хирургии кисти, д. м. н.
Теги: суставной хрящ
234567 Начало активности (дата): 23.05.2021 23:54:00
234567 Кем создан (ID): 989
234567 Ключевые слова: суставной хрящ, физиологическая и репаративная регенерация, удлинение конечности
12354567899
Похожие статьи
Современные представления об условиях консолидации переломов и возможность их обеспечения различными типами фиксаторов (обзор литературы)Рентген на дому 8 495 22 555 6 8
Чрескостный остеосинтез в системе лечения травм эпифизарной зоны роста у детей
Лечение коксалгии у пациентов с дегенеративным остеоартрозом тазобедренного сустава 3–4 стадии
Осложнения при паллиативных вмешательствах при вывихе бедра у пациентов с ДЦП



