Острая боль в спине в практике невролога
 01.07.2017
01.07.2017
Острая боль в спине в практике невролога
Острая боль в спине является одной из ведущих причин обращения за медицинской помощью. В Международной классификации болезней 10-го пересмотра данное патологическое состояние обозначается как «дорсопатия», однако в современной научной литературе в последние годы чаще употребляется термин «неспецифическая боль в спине».Актуальность терапии этого состояния определяется его широкой распространенностью, выраженной дезадаптацией и снижением качества жизни у лиц трудоспособного возраста, что приводит к значительному социально-экономическому ущербу в большинстве развитых стран мира. В частности, боли в нижней части спины отмечаются до 80% в популяции, нарушая качество жизни у пациентов до 45 лет [1]. В США боли в спине являются 5-й по частоте причиной среди наиболее частых причин госпитализации и 3-й – среди показаний к хирургическому лечению [1, 2].
У 80–90% больных при адекватной и своевременной терапии острая боль в спине регрессирует в течение 2–3 мес. [3, 4]. Хронизация дорсопатии отмечается у 10–20% пациентов трудоспособного возраста, именно эта группа больных характеризуется неблагоприятным прогнозом для выздоровления [4]. Следует отметить, что до 80% всех затрат здравоохранения приходится на лечение хронической боли в спине, что в 3 раза превышает затраты на терапию онкологических больных [5].
Эпидемиология боли в пояснично-крестцовой области изучена значительно лучше, что отчасти связано с меньшей распространенностью БС в шейном и грудном отделах позвоночника. Показано, что изолированная боль в верхней части спины наблюдается лишь у 15% больных [6]. При этом наиболее часто в клинической практике (до 85% больных с болями в спине) встречаются скелетно-мышечные БС, обусловленные раздражением рецепторов фиброзного кольца, мышечно-суставных структур позвоночника и не связанные с поражением корешков [6]. Однако они могут наблюдаться и в случае рефлекторных БС при поражении корешка.
Вопросы фармакологических воздействий при болях в спине относятся к одним из самых изученных в современной доказательной медицине. Тем не менее непрерывно растущий арсенал средств и увеличение количества пациентов (идущее параллельно с нарастающим старением населения развитых стран) диктуют необходимость анализа имеющихся данных по этой теме. Так, согласно данным недавнего метаанализа литературы, ацетаминофен неэффективен при лечении боли в нижней части спины, эффективность НПВП при терапии этого состояния была меньшей в современных условиях, чем ранее описывалось, а применение бензодиазепинов при острой радикулопатии не давало адекватного клинического результата [7].
Основные принципы ведения пациентов с острой болью в спине
Тактика ведения больных с остро возникшей дорсопатией заключается в следующем:
1. Исключение потенциально опасных заболеваний и/или состояний для возникновения БС.
2. Своевременное и эффективное купирование БС, способствующее восстановлению активности пациента.
3. Адекватное расширение двигательного режима.
4. Предотвращение хронизации заболевания.
Важным этапом при обращении пациента с острой болью в спине является исключение специфического или вторичного характера патологического процесса, в основе которого могут лежать серьезные, порой опасные для жизни заболевания (табл. 1).
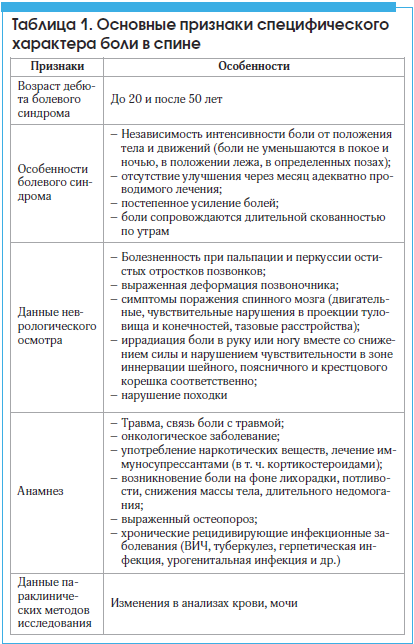
Таблица 1. Основные признаки специфического характера боли в спине.
При анализе имеющегося БС необходимо помнить о том, что боли в спине могут быть полностью психогенными по своей природе, приводя при этом к значимому нарушению социальной адаптации, затруднению профессиональной деятельности. Среди возможных критериев, указывающих на отсутствие органической причины боли в спине и/или ее психогенный характер, рассматриваются: боль на вершине копчика; боль и онемение «во всей ноге», ощущение, что «подкашиваются ноги», а также уменьшение выраженности симптома Ласега при отвлечении внимания пациента [8].
Следует отметить отсутствие строгого параллелизма между наличием боли в спине и результатами параклинического исследования позвоночника. Диагностическая значимость результатов рентгенографии и методов нейровизуализации при болях в спине сомнений не вызывает, однако эти методы позволяют в основном оценивать анатомические, а не патофизиологические изменения [9]. В частности, методы визуализации с высокой частотой выявляют дегенеративно-дистрофические изменения в позвоночнике даже у больных без боли в спине и наличия какой-либо неврологической симптоматики, например, по данным МРТ поясничного отдела позвоночника, асимптоматические грыжи межпозвонковых дисков выявляются у лиц до 40 лет в 30–40% случаев, а у лиц старше 60 лет – в 100% [9]. С другой стороны, наличие у пациентов с неспецифической болью в спине признаков дегенеративно-дистрофического поражения тканей позвоночника не коррелирует ни с характером боли, ни с ее интенсивностью, поэтому, несмотря на соблазн отнести рентгенологически выявляемые признаки остеохондроза позвоночника к причине возникновения боли, до сих пор не было получено убедительных доказательств такой связи [6]. В связи с этим в современных отечественных и зарубежных методических рекомендациях по диагностике боли в спине рентгенологическое исследование не является необходимым звеном первичного обследования [6, 7, 10]. Таким образом, сами по себе, без учета клинической картины, нейровизуализационные данные редко позволяют поставить правильный диагноз, при этом рассказ больного о своем заболевании зачастую имеет не менее важное значение, чем результаты нейровизуализационного исследования [11].
Часто назначаемые неврологами при первичном обследовании пациентов с болями в спине методы нейрофизиологической диагностики, в первую очередь электронейромиография, имеют большую ценность в выявлении органических нарушений со стороны периферической нервной системы, в то время как их эффективность в выявлении функциональных нарушений ограниченна [12]. С помощью диагностической транскраниальной магнитной стимуляции возможно исследование времени прохождения сигнала по корешку или показателя «корешковой задержки», изменение которого позволяет выявить радикулопатию или повреждение спинномозговых корешков [13].
Методы визуализации и другие инструментальные и параклинические обследования, как и консультации соответствующих специалистов, рекомендуется назначать пациентам с болями в спине в неясных случаях, когда возникают подозрения на специфический характер боли, который может быть следствием опухолевого, воспалительного или травматического поражения позвоночника, инфекционных процессов, метаболических нарушений, заболеваний внутренних органов, повреждения мышц, поражения нервной системы и т. д.
Ведущее значение для постановки правильного диагноза и подбора терапии при неспецифической боли в спине имеет тщательная клиническая оценка статуса больного, в т. ч. состояния его костно-мышечной системы. В частности, при неврологическом обследовании желательно не ограничиваться осмотром только спины, следует попросить больного раздеться, обращая внимание на наличие и выраженность сколиоза; на положение таза и длину ног; на наличие сглаженности физиологического лордоза на поясничном уровне [14]. Последний симптом свидетельствует о спазмировании паравертебральных мышц на этом уровне, что подтверждается при пальпаторном исследовании. Также при осмотре пациента важно обращать внимание на возможные высыпания на кожных покровах; изменение позы, осанки, походки, объема движений в позвоночнике, тазобедренных суставах; на степень напряжения и болезненность мышц, локализацию миофасциальных триггерных точек. При этом слабовыраженная ортопедическая симптоматика при сильных болях может служить признаком серьезной сопутствующей патологии [6]. Неврологическое обследование позволяет предположить повреждение корешков и структур спинного мозга.
Кроме того, для установления правильного диагноза существенную роль играют анамнестические сведения (включая информацию об условиях труда больного и наличии постоянного стресса), результаты физикального и параклинического обследования, а также оценка психологического состояния.
Купирование острой неспецифической боли в спине
Своевременное и эффективное купирование острого эпизода боли в спине является крайне важным этапом ведения этой категории больных, поскольку позволяет увеличить объем проводимых реабилитационных мероприятий, адекватно расширить двигательный режим и сократить сроки нетрудоспособности.
Показано, что ограничительное поведение (как интуитивно выбираемое самим больным, так и рекомендуемое врачом), как и соблюдение длительного постельного режима (более 7 сут) связано с высоким риском увеличения длительности обострения, трансформацией острой боли в хроническую и высокой вероятностью формирования депрессивных расстройств [15]. С другой стороны, существует очевидная связь между эффективностью противоболевой терапии и длительностью восстановления адекватного двигательного режима [16]. В связи с этим необходимо ориентировать пациента на максимально раннее включение в программу восстановительно-реабилитационных мероприятий, рекомендовать больному активное поведение в рамках курса восстановительного лечения, формировать позитивную мотивацию, обеспечивающую настрой на достижение реконвалесценции и компенсацию существующего неврологического и ортопедического дефекта [16, 17].
С целью купирования БС наиболее широко используются лекарственные средства из группы НПВП. НПВП представляют собой патогенетическое средство лечения боли, связанной с патологическими состояниями, обусловленными локальными и генерализованными воспалительными реакциями, что определяет основные показания для назначения этой группы лекарственных средств в различных областях медицины – воспалительные процессы различного генеза, боль и лихорадка [13].
Возникновение и внедрение используемых сегодня препаратов из группы НПВП имеет свою историю. Более 5 тыс. лет назад в качестве обезболивающего средства при заболеваниях опорно-двигательного аппарата использовалась кора ивы [18], из которой в 1828 г. был выделен салицилин [19]. Парацетамол был синтезирован Х. Морзе в 1877 г., спустя 10 лет применен на практике Д. Мерингом, однако широкое распространение получил лишь в середине XX в. из-за ошибочно сложившегося представления о его токсичности [20]. Прототипом современных НПВП была ацетилсалициловая кислота, синтезированная Ф. Хоффманом в конце XIX в. Токсичность высоких доз препарата явилась мощным стимулом для разработки новых, «несалицилатных» НПВП, в частности диклофенака натрия в исследовательской лаборатории фирмы «Гейги» (1966) [20]. В течение последующих 10 лет были разработаны и стали использоваться применяемые сегодня индометацин, ибупрофен и напроксен [19].
В настоящее время НПВП представляют собой весьма многочисленную и неоднородную группу лекарственных средств, в основе противовоспалительного и анальгетического действия которых лежит подавление активности фермента циклооксигеназы (ЦОГ) и биосинтеза простагландинов. Клиническая эффективность НПВП, а также характер сопровождающих их применение побочных эффектов в значительной степени определяются основными точками приложения – способностью угнетать активность ЦОГ 1-го или 2-го типа [16]. Определенное значение имеют также особенности химической структуры препаратов, пути их метаболизма в организме, способность взаимодействовать с другими поступающими в организм химическими соединениями.
Две изоформы ЦОГ отличаются особенностями экспрессии в зависимости от состояния организма человека. В нормальных условиях ЦОГ-1 вырабатывается в большинстве тканей и принимает участие в широком разнообразии адаптационно-приспособительных реакций [16]. Противовоспалительный эффект НПВП обусловлен способностью ингибировать процессы синтеза ЦОГ-2, поскольку повышенная экспрессия именно этой изоформы наблюдается при развитии воспалительного процесса. Разработка препаратов с избирательной селективностью в отношении ЦОГ-2 обусловлена развитием побочных реакций из-за подавления физиологического фермента – ЦОГ-1, тогда как неселективные НПВП ингибируют обе изоформы ЦОГ.
Хотя на популяционном уровне все лекарственные средства из группы НПВП в эквивалентных дозах обладают сходной эффективностью и токсичностью, клинический опыт свидетельствует о существенных различиях в ответе на препараты этой группы у отдельно взятых пациентов [21]. У некоторых из них один препарат значительно эффективнее подавляет боль и воспаление или, напротив, чаще вызывает токсические реакции, чем другой. Причины этого явления до конца не ясны. Обсуждается значение индивидуальных особенностей абсорбции, распределения и метаболизма препаратов, относительное преобладание зависимых и не зависимых от блокады ЦОГ механизмов действия [21].
Одним из селективных ингибиторов ЦОГ-2 является нимесулид (Найз®), представляющий собой производное сульфонамидов. Нимесулид является высокоэффективным и хорошо изученным в ходе многочисленных экспериментальных и клинических исследований препаратом, обладающим широким спектром разнообразных влияний. В частности, было показано, что под действием нимесулида уменьшается продукция короткоживущего простагландина Н2 с последующим значительным снижением концентрации в крови продукта его метаболизма – простагландина Е2, являющегося одним из ключевых медиаторов воспаления [16]. Указанный эффект приводит к снижению активации простаноидных рецепторов ЕР-типа, следствием чего является наступление обезболивающего и противовоспалительного эффектов, поскольку простагландины с помощью различных механизмов повышают чувствительность первичных сенсорных нейронов к боли. Нимесулид, как и ряд других селективных ингибиторов ЦОГ-2, оказывает воздействие на различные системы организма, участвующие в инициации и/или поддержании процессов воспаления, в первую очередь предупреждении активации фибробластов.
Следует отметить, что нимесулид (Найз®) обладает рядом фармакологических эффектов, независимых от класс-специфического воздействия на ЦОГ-2. В частности, он подавляет гиперпродукцию главных провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли альфа), снижает активность металлопротеиназ, ответственных в т. ч. за разрушение гликопротеинового комплекса хрящевой ткани при остеоартрозе, оказывает антигистаминное действие [21]. Отсутствие повреждающего действия нимесулида на протеогликаны и коллаген хрящевой ткани выгодно отличает этот препарат от значительного числа НПВП и, вероятно, объясняет сохранность хрящевой ткани даже при длительном применении нимесулида [16].
Среди не-ЦОГ-2-ассоциированных эффектов нимесулида следует особо отметить способность подавлять фермент фосфодиэстеразу 4 и тем самым снижать активность макрофагов и нейтрофилов, играющих важную роль в патогенезе острой воспалительной реакции [21]. Показано, что нимесулид обладает способностью не только угнетать выработку медиаторов воспаления непосредственно в очаге поражения, но и обратимо ингибировать образование простагландина Е2 в восходящих путях, проводящих болевые сигналы, в частности в спинном мозге. Благодаря оказываемым фармакологическим эффектам нимесулид угнетает образование и проведение болевой импульсации на разных уровнях ноцицептивной системы, тем самым не только купируя острую боль, но и предупреждая формирование хронического БС [21], что важно для пациентов с неспецифической болью в спине.
Показано, что неселективные представители НПВП обладают бóльшей гастро- и гепатотоксичностью, а высокоселективные ингибиторы ЦОГ-2 (прежде всего коксибы) чаще способствуют тромбообразованию, что может привести к кардиоваскулярным заболеваниям, например инсультам и инфарктам [22]. На протяжении последних лет накоплен значительный опыт не только эффективного применения нимесулида (Найза®) для лечения разнообразных БС, но и его высокой безопасности и хорошей переносимости пациентами даже при длительном использовании.
Так, проведенное А.Е. Каратеевым в 2009 г. исследование, посвященное ретроспективному анализу развития побочных эффектов и осложнений со стороны ЖКТ, кардиоваскулярной системы и функции печени при длительном использовании нимесулида (не менее 1 года) у 322 пациентов с ревматическими заболеваниями, не показало клинически выраженной патологии исследуемых систем по данным дополнительных лабораторных и инструментальных обследований [23]. Нимесулид (Найз®) может применяться у достаточно широкого круга пациентов, отличаясь от многих других НПВП низким риском развития осложнений со стороны ЖКТ и кардиоваскулярной системы [17, 22, 23]. К очевидным и существенным достоинствам нимесулида (Найза®) относится сочетание быстрого анальгетического эффекта (через 15–20 мин после перорального приема препарата), противовоспалительного действия, безопасности применения, хорошей переносимости и доступной цены [17].
Немедикаментозные методы лечения острой неспецифической боли в спине
Среди нелекарственных методов лечения острой боли в спине используются мануальная терапия, лечебная физкультура, иглорефлексотерапия, физиотерапия, методы социальной поддержки [3], специальные приспособления для опорно-двигательной системы или костно-мышечного аппарата [11] – ортезы; следует помнить о необходимости удобной мебели, правильной позы при сидячей работе и т. д.
Ортезы или корсеты представляют собой внешние приспособления, предназначенные для воздействия на структурные и функциональные характеристики скелетно-мышечной и опорно-двигательной системы: разгрузки, фиксации, активизации и коррекции функций поврежденного сустава или конечности. Поскольку частыми причинами для развития дорсопатии являются мышечно-тонические БС пояснично-крестцовой локализации, противоболевой эффект от использования люмбосакральных ортезов (ЛСО) вполне ожидаем. ЛСО являются одними из наиболее используемых разновидностей медицинских корсетов и применяются в комплексном лечении боли в нижней части спины или с ортопедической целью – для коррекции осанки [24]. Терапия с применением ортезов является не только эффективной, но и экономически более выгодной, нежели стандартные методы воздействия [25]. В частности, крупный метаанализ 2008 г. продемонстрировал бóльший эффект лечения неспецифической боли в спине с помощью ЛСО, чем сугубо медикаментозные воздействия [26]. При обращении в медицинские учреждения других стран по поводу боли преимущественно в поясничном отделе позвоночника ношение ЛСО рекомендуется в большинстве случаев (73%), причем это назначение осуществляется терапевтами первичного звена [27]. Вместе с тем использование корсета помогает уменьшить выраженность боли, однако на вероятность рецидива подобного эпизода в будущем не влияет [11].
Несмотря на очевидный клинический эффект при использовании корсетов в виде уменьшения выраженности БС, существует устоявшееся представление об опасности развития мышечной слабости и атрофии при его длительном применении [28, 29]. В качестве возможных причин рассматриваются непосредственное механическое воздействие ортеза на прилежащие мышцы [30]. Однако крупный метаанализ (36 источников литературы), где проводилось исследование данного вопроса, не обнаружил подобной взаимосвязи [31], как и другой метаанализ, изучавший возможность негативного воздействия длительного ношения ЛСО (до полугода) на мышцы-разгибатели спины с помощью инструментальных методов обследования (УЗИ и МРТ) [30].
В последние годы при возникновении острого эпизода боли в спине достаточно широко используется метод кинезиотейпирования, позволяющий с разной степенью устранить локальную боль и мышечное напряжение [4, 7]. Также при острой неспецифической боли в спине все чаще используется терапевтическая транскраниальная магнитная стимуляция; при этом в основном применяются высокочастотные протоколы [13].
Несмотря на полное и своевременное купирование острого БС, дальнейший прогноз течения неспецифической боли в спине не всегда однозначен, поскольку даже при полном регрессе боли более чем в 50% случаев у больных отмечаются ее рецидивы [9]. Именно поэтому особое значение для предотвращения повторных болевых эпизодов придается соблюдению поведенческих рекомендаций и необходимому изменению образа жизни у пациентов с болью в спине. При этом при возникновении повторных рецидивов неспецифической боли в спине своевременный прием эффективного, безопасного и хорошо переносимого обезболивающего и противовоспалительного препарата нимесулида (Найза®) для купирования острой боли и предотвращения дальнейшей хронизации патологического процесса является патогенетически оправданным.
Научно-клинический центр ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ
Екушева Е.В., Воитенков В.Б. Острая боль в спине в практике невролога // РМЖ. 2017. №9. С. 632-636



