 23.09.2015
23.09.2015
Симптомокомплекс КТ- и МР-признаков негеморрагического венозного инсульта в сравнении с артериальным ишемическим инсультом
Диагностика ЦВТ базируется на клиническом подозрении и подтверждении методами нейровизуализации (Saposnik G., 2011). Окклюзия симптомсвязанного сосуда верифицирована во всех случаях инсульта при МСКТА и/или МРА (рис.2), а также при визуализации симптома гиперденсного сосуда при рутинной КТ (рис.3а,б).
А Б

В Г
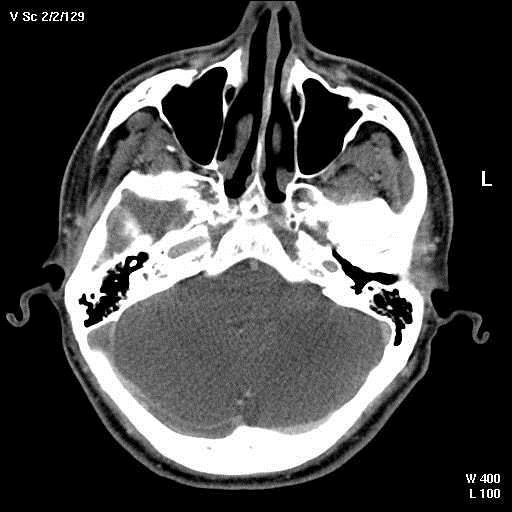

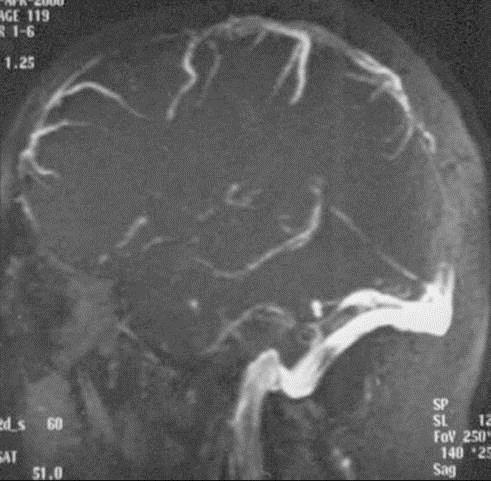
Рис.2. Верификация тромбоза дуральных синусов: а) верхнего сагиттального синуса при МСКТА на реконструированном в MPR срезе; б) верхнего сагиттального синуса при МРА на реконструированном в MIP изображении; в) латерального синуса справа при МСКТА на аксиальном срезе (стрелки); г) в виде отсутствия контрастирования поперечного синуса слева (стрелка) при МСКТА на реконструированном в VR изображении.
Специфичным признаком как ЦВТ, так и острой артериальной тромботической окклюзии является симптом гиперденсного сосуда при рутинной КТ (Ананьева Н.И., 2001; Lee S.K., 2003; Shelley R., 2004; Хеннерици М.Г., 2008; Palena L.M., 2009; Семенов С.Е., 2009
Нами этот симптом выявлен при ВИ в 54,54% случаев (рис.3а,б), при ИИ в 30,3% случаев. Присутствие симптома гиперденсного сосуда на нативных КТ-изображениях прямо свидетельствует о том, какой сосуд и по нашему мнению, в случаях его обнаружения диагноз ЦВТ становится очевиден и в выполнении МСКТА в принципе нет необходимости. Дополнительным и характерным симптомом окклюзии поперечного дурального синуса можно считать значительное компенсаторное расширение вен намета мозжечка со стороны окклюзии (рис.3в), которое является проявлением обходного кровотока и встретилось нам в 19 из 21 случаев (90%) тромбоза поперечного синуса. Косвенным свидетельством внутричерепного венозного застоя может служить принятие поперечным профилем венозных сосудов округлой формы (рис.3г). Наблюдалось это не только со стороны обычно овальных внутренних яремных вен, но даже и со стороны треугольных дуральных синусов (Лесницкая В.Л., 1970). Этот признак зарегистрирован нами в 9 случаях ВИ со стороны нетромбированных венозных сосудов дистальнее места тромбоза и в 7 случаях сопровождался повышением ЦВД от 140 до 170 мм вод. ст.
В группе ВИ острый ЦВТ сочетался с очаговым поражением мозга следующих локализаций: только лобная доля при окклюзии ВСС - в 2 случаях (2,89%); лобно-теменная область при окклюзии ВСС и корковых вен - в 3 случаях (10,14%); только теменная доля при окклюзии ВСС и/или НСС (рис.3б) – в 6 случаях (8,69%); только таламус при окклюзии НСС и ПС, а также внутренних вен мозга (рис.3а) – в 7 случаях (10,14%); подкорковая область (не только таламус) - в 4 случаях (5,79%); теменно-височная область при окклюзии НСС и ПС, а также внутренних вен мозга - в 2 случаях (2,89%); только область мозолистого тела при окклюзии НСС - в 6 случаях (8,69%); теменно-затылочная область при окклюзии ВСС, НСС и латерального синуса - в 12 случаях (17,38%); теменно-затылочная область (с преимущественным поражением мозолистого тела) + мозжечок при окклюзии ВСС и латерального синуса - в 2 случаях (2,89%); только височная доля – в 1 случае (1,44%); только затылочная доля при окклюзии ВСС и/или латерального синуса (рис.4а) – в 8 случаях (11,6%); только мозжечок при окклюзии латерального синуса – в 7 случаях (10,14%); затылочная доля + мозжечок при окклюзии латерального синуса – в 3 случаях (4,34%). Кроме того, диагностировано 2 стволовых инфаркта, сочетавшихся с окклюзией обеих внутренних яремных вен в одном случае и односторонней окклюзией безымянной, внутренней яремной вен и латерального синуса во втором случае. Распределение локализаций поражения при ВИ получилось довольно обширное, и, поэтому мы произвели группировку поражений аналогично применяемому при описании ишемических инфарктов «бассейнового» принципа. Только в случаях с ВИ «бассейн» был не кровоснабжаемый, а дренируемый определенным сосудом. Выделились три группы, неравнозначные по количеству пациентов. В первую группу с локализацией очагов в лобной и лобно-теменной областях при окклюзии передней и средней третей верхнего сагиттального синуса вошло всего 5 пациентов (7,2%); во вторую группу с локализацией в теменной и затылочной долях (преимущественно парасагиттально), мозжечке и стволе при окклюзии задней трети ВСС, латеральных синусов и внутренних яремных вен вошло 40 пациентов (58%) и в третью группу с локализацией поражения в области мозолистого тела и подкорковых структур при окклюзии нижнего сагиттального и прямого синусов, а также внутренних вен мозга вошло 24 пациента (34,8%). Таким образом, достаточно «типичными» локализациями для ВИ можно считать теменно-затылочную область и мозжечок в результате тромбоза верхнего сагиттального и латерального (поперечного и сигмовидного) дуральных синусов - на первом месте по частоте поражения (см. рис.3б), и мозолистое тело с подкорковой областью (преимущественно зрительные бугры) в результате тромбоза нижнего сагиттального и прямого дуральных синусов, а также внутренних вен мозга - на втором месте по частоте поражения (см. рис.3а). Меньше чем в половине случаев поражение касалось только одного венозного сосуда и в подавляющем большинстве распространялось на несколько венозных структур, чаще смежных.
В группе ИИ локализация очага поражения при окклюзии СМА была только в теменной доле в 5 случаях (15,15%); в теменно-височной области – в 9 случаях (27,27%); в области переднего стыка (лобно-теменно-височная зона) – в 6 случаях (18,18%); в подкорковой области (с преимущественным поражением скорлупы и хвостатого ядра) - в 3 случаях (9%); при окклюзии ПМА в лобно-теменной области – в 4 случаях (12,12%); при окклюзии ЗМА в затылочной доле - в двух случаях (6%). Кроме того, диагностировано 3 лакунарных инфаркта подкорковой области и 2 стволовых инфаркта.
Одним из ведущих радиологических симптомов инсульта считается фокальное понижение плотности в проекции локально ишемизированной мозговой ткани (Корниенко В.Н., 2006). Причем факт понижения плотности на нативном КТ-изображении приравнивается к развившемуся инфаркту. В нашем исследовании фокальная плотность при нативной МСКТ была снижена при ВИ (см. рис.3а,б и 4а) чаще (в 57,6%), чем при ИИ (в 39,4%).
Для артериального ишемического инсульта геометрически «правильная» форма зон поражения считается одним из ведущих дифференциальных признаков в отличие от патологии иного рода. Венозный инсульт, как правило, не вписывается в привычные для артериального инсульта рамки «бассейнового» поражения, не повторяет территориального рельефа «бассейнов» магистральных артерий виллизиева круга. В подавляющем большинстве случаев (в 62 из 69 – в 90%) форма очагов ВИ была неправильной, а контуры неровными и нечеткими, со «стушеванностью» границ очагов. Лишь в 7 случаях отмечены относительно ровные контуры очагов ВИ. Это наблюдалось в 3 случаях инсульта в лобной доле при тромбозе передних отделов верхнего сагиттального синуса в сочетании с тромбозом корковых вен и в одном случае ВИ в затылочной доле при тромбозе верхнего сагиттального и поперечного синусов, а также в 3 случаях поражения зрительного бугра. Контуры ИИ на диагностических томографических изображениях (рутинная КТ, Т2ВИ, FLAIR, PD) в подавляющем большинстве случаев ровные и четкие. Неровность контуров может при этом наблюдаться на ДВИ из-за меньшего размера матрицы изображения и на Т1ВИ вследствие низкой контрастности между здоровой и патологически измененной тканью, которые присущи данной последовательности без использования контрастного усиления.
Площадь очага была измерена на всех полученных в исследовании диагностических томографических изображениях и сравнены между собой в отношении совпадения и корреляции. Так по картам СBV при ПКТ, считающимся наиболее точными в прогнозе конечного размера инфаркта (Кротенкова М.В., 2011) диапазон размеров очага при ВИ колебался от 1,82 см2 до 16,48 см2 (среднее значение 6,56±3,94), при ИИ – от 1,5 см2 до 32,57 см2 (9,53±9,44). Отсутствие статистически достоверных различий между ВИ и ИИ в отношении площади очага инсульта отмечено при измерениях на изображениях в различных последовательностях МРТ (Т2ВИ, FLAIR, DWI, ADC). Важное значение, на наш взгляд, имеет прямая корреляция площади очага между T2ВИ (см. рис.5а) и CBV (r=0,86; см. рис.4г), а также на DWI (r=0,87; см. рис.5в), так как она свидетельствует о высокой значимости считающейся очень чувствительной, но малоспецифичной МР-последовательности Т2ВИ.
Отличительной особенностью ВИ от ИИ явилось присутствие признаков фокального и перифокального полнокровия в первые сутки заболевания по данным ПКТ и вазогенного отека по данным МРТ (табл.1).
Табл.1. Показатели коэффициентов фокальных и перифокальных изменений тканевой перфузии (по данным ПКТ) и диффузии (по данным DWI+ADC при венозном инсульте и ишемическом повреждении в первые сутки заболевания (# - достоверное отличие от ИИ, * - достоверное отличие от КГ при p<0,05).
|
|
ВИ |
ИИ |
КГ |
|
rMTT фокуса |
1,7±0,61* |
1,91±0,67* |
1,03±0,03 |
|
rMTT перифокально |
1,26±0,18 #* |
1,67±0,56* |
1,03±0,04 |
|
rCBF фокуса |
0,76±0,51#* |
0,35±0,21* |
0,97±0,09 |
|
rCBF перифокально |
1,28±0,25 #* |
0,69±0,27* |
0,95±0,19 |
|
rCBV фокуса |
0,88±0,41 # |
0,55±0,25* |
0,98±0,08 |
|
rCBV перифокально |
1,27±0,25 #* |
1,07±0,42 |
0,99±0,1 |
|
rDWI фокуса |
1,69±0,34 #* |
2,11±0,47* |
1,01±0,13 |
|
rDWI перифокально |
1,1±0,41 # |
2,14±0,32* |
1,01±0,12 |
|
rADC фокуса |
1,26±0,99 # |
0,63±0,25 |
0,94±0,32 |
|
rADC перифокально |
1,24±0,43* |
1,16±0,38 |
0,92±0,22 |
При анализе показателей перфузии у больных с ВИ (рис.4) и ИИ установлено статистически значимое увеличение коэффициентов асимметрии времени транзита контраста rMTT и времени пика контрастирования rTTP между ядром в случаях некроза или фокальными изменениями без некроза с зеркальными ROI контралатерального полушария при ВИ (р=0,000004) и ИИ (р=0,000000) в сравнении с КГ. Статистически значимых различий в показателях rMTT между ВИ и ИИ фокально без некроза или в зоне ядра при некрозе получено не было. При анализе же показателей перфузии в перифокальной зоне (рядом с ядром при некрозе или в целом в зоне поражения без некроза) при ВИ и в зоне пенумбры при ИИ установлено статистически значимое увеличение rMTT и rTTP между всеми группами в исследовании (р<0,05). Таким образом, показатель rМТТ в центральной части очага инсульта является высокоинформативным методом выявления инсульта в целом, а при изучении в зоне перифокальной центру очага может позволить отличить ВИ от ИИ, следовательно может быть принят как один из паттернов дифференциальной диагностики с обозначением (±) при ВИ в отличие от (+) или (–) в ядре ИИ и (++) в зоне пенумбры ИИ, отражая тем самым невыраженные изменения времени транзита при ВИ (рис.4б) в отличие от выраженных при ИИ.
Выявленные статистически достоверные различия (р<0,05) групп ВИ, ИИ и КГ по показателю rCBF как фокально (в зоне ядра при некрозе или в центре очага без некроза), так и перифокально (зона пенумбры при ИИ или перифокальная зона при ВИ), свидетельствуют об его информативности в выявлении инсульта в целом, а также о том, что он может являться одним из паттернов дифференциальной диагностики с обозначением (±) при ВИ в отличие от (--) в ядре и зоне пенумбры ИИ, отражая не выраженное уменьшение кровотока как при ИИ, а скорее увеличение его при ВИ, то есть элемент полнокровия (рис.4в).
Отличная картина выявлена при анализе объемного кровотока по данным изучения показателя rCBV. Имело место достоверное отличие между группами ВИ и ИИ (р=0,00001) и группами ИИ и КГ (р=0,000000), тогда как группы ВИ и КГ достоверно не отличаются между собой. rCBV в зоне ядра ИИ в нашем исследовании был практически в 2 раза ниже, чем в КГ, что свидетельствует о практическом отсутствии перфузии, самом известном и широко применяемом в диагностике инсульта симптоме. Перифокально при анализе rCBV достоверные различия (р<0,05) выявлены между группами ВИ и ИИ, группами ВИ и КГ, тогда как группы ИИ и КГ достоверно не различны между собой. Таким образом, в области пенумбры при ИИ наблюдаются элементы полнокровия-гиперперфузии (хотя и статистически недостоверно), вероятно компенсаторного характера. В зоне же перифокальной центру очага при ВИ отмечаются очевидные признаки полнокровия (рис.4г), и мы не можем не предложить их в качестве еще одного паттерна дифференциальной диагностики между ВИ и ИИ - (+) против (–) в зоне ядра ИИ и (±) в зоне пенумбры.
Выявлены значимые (r≥0,4) корреляции между показателями перфузии при р<0,05. Прямо коррелировали значения rCBF и rCBV (r=0,83), сильно коррелировали rMTT и rCBF (r=-0,62) в зоне фокуса инсульта. Средняя корреляция наблюдалась между показателями rCBF в фокусе и rMTT перифокально (r=-0,42), rMTT и rCBF перифокально (r=-0,47), rCBF и rCBV перифокально (r=0,54), rCBV в фокусе и rMTT перифокально (r=-0,46).
Инфаркт с некрозом развился в исследовании при ВИ в 55% против 79% при ИИ. Особенностью венозного инсульта явилось то, что в половине случаев некротическое ядро не образовывалось вовсе, то есть развитие инсульта останавливалось на стадии обратимых повреждений вещества мозга, коэффициент асимметрии параметров перфузии имел значения r<1,5.
Роль МР-томографии в диагностике инсульта чрезвычайно высока, благодаря тому, что МР-сигнал в ишемизированной зоне повышается в Т2ВИ и FLAIR последовательностях уже в первые 24 часа (Корниенко В.Н., 2006) даже без использования контрастных средств. Нами в исследовании не выявлено достоверных отличий характеристик МР-сигнала очага инсульта при выполнении основных импульсных последовательностей МРТ (Т1ВИ и Т2ВИ, PD), а также градиентной FLAIR при ВИ от характеристик МР-сигнала при ИИ. Как при ВИ, так и при ИИ очаги инсульта выражались в очевидном повышении МР-сигнала на Т2ВИ и изображениях FLAIR и легком понижении на Т1ВИ. Дополнительное использование контрастного усиления гадолиниевыми препаратами также не привело к выявлению каких-либо специфических признаков ВИ в отличие от ИИ. Наблюдалось патологическое контрастное Т1 усиление очагов по сосудистому или гиральному типам, описанным в других исследованиях (Satou A., 1994; Virapongse C., 1996; Karonen J.O., 2001). При больших размерах супратенториальных очагов как при ВИ, так и при ИИ наблюдалось объемное воздействие («масс-эффект») в виде смещения серпа мозга в противоположную сторону, сглаженность борозд и сужение субарахноидального пространства в области поражения.
Достоверно дифференцировать вазогенный отек от цитотоксического можно с помощью МР-режимов DWI и ADC-картирования. Вазогенный отек характеризуется гипо- или изоинтенсивными очагами на DWI (Corvol J.C., 1998; Keller E., 1999; Труфанов Г.Е. и др., 2005; Семенов С.Е., 2010) и повышением интенсивности сигнала при ADC-картировании (Богданов Э.И., 2011). Проявления вазогенного отека раньше, чем цитотоксического некоторые авторы причисляют к особенностям венозного инфаркта (Труфанов Г.Е. и др., 2005). Характерный для вазогенного отека симптом понижения МР-сигнала наблюдался нами на фоне повышенного сигнала цитотоксического отека на изотропных DWI в проекции очагов ВИ в 47 случаях (68%) случаях (рис.5в). Неоднородный характер очагов со смешанным сигналом наблюдался во всех этих случаях, когда на фоне в целом гиперинтенсивного очага имели место гипоинтенсивные участки. Гипоинтенсивные участки локализовались как в центре очагов (в 31 случае – 66%), так и по периферии (16 случаев – 34%). Следует принимать во внимание, что снижение сигнала в зоне инсульта на DWI может быть признаком сидероза из-за кровоизлияний, но полученные в исследовании данные рутинной КТ, выполненной перед МРТ позволяют исключить первичную геморрагию (см. рис.4а). Снижения МР-сигнала, не связанного с кровоизлиянием в очагах ИИ мы не наблюдали. Отмечены достоверные различия (p<0,00001) средних значений коэффициента асимметрии интенсивности МР-сигнала на DWI по результатам измерений в проекции ядра инфаркта или центра инсульта без развития некроза по отношению к здоровой стороне между группами ВИ, ИИ и КГ. Тот же показатель в зоне пенумбры или перифокально достоверно различался (p<0,05) между группами ВИ и ИИ, ИИ и КГ, тогда как между группами ВИ и КГ достоверных различий не выявлено. При ADC-картировании инверсия МР-сигнала в виде появления участков его повышения на фоне обычного понижения (рис.5г) в первые 24 часа наблюдалась в меньшем количестве случаев ВИ (36 случаев – 52%), чем инверсия на DWI. В то же время мы наблюдали такую инверсию и при ИИ в 2 случаях (6%). Практически во всех этих случаях инверсия МР-сигнала отмечена по периферии очагов инсульта. Отмечены достоверные различия (p=0,00093) средних значений коэффициента асимметрии интенсивности МР-сигнала при ADC-картировании между группами ВИ и ИИ по результатам измерений в проекции ядра инфаркта или центра инсульта без развития некроза по отношению к здоровой стороне. Достоверных различий между группами в других сопоставлениях не выявлено.
Сильно коррелировали значения rDWI в ядре некроза или центре инсульта в отсутствие некроза и rDWI пенумбры или перифокальной зоны (r=0,62). Средней силы отрицательная корреляция отмечена между rDWI и rADC в зоне фокуса инсульта (r=-0,49).
Проводя параллели между МСКТ и МРТ по результатам корреляционного анализа по методике Спирмана с построением квадратной матрицы для радиологических показателей, была отмечена достоверная (p<0,05) корреляционная связь средней силы (r=0,46) между таким радиологическим симптомом как гиперинтенсивность пораженного сосуда при МРТ и коэффициент асимметрии скорости перфузии (rCBF) в области пенумбры или перифокальной зоне при ПКТ. Под симптомом гиперинтенсивого сосуда при МРТ подразумевалось повышение сигнала в проекции тромбированного сосуда на МР-изображениях, полученных при импульсных последовательностях (в норме кровоток отображается очень низким сигналом). Также достоверно коррелировали (p<0,05) между собой коэффициент асимметрии времени транзита контраста (rMTT) при ПКТ и коэффициент асимметрии диффузии (rDWI) при МРТ в области пенумбры или перифокальной зоне (r=0,44); коэффициент асимметрии объемного кровотока (rCBV) при ПКТ и коэффициент асимметрии диффузии (rDWI) при МРТ в области пенумбры или перифокальной зоне (r=0,59).
Таким образом, даже не беря во внимание показатели перфузии, а вернее их практически полное отсутствие в зоне ядра инфаркта, являющегося некрозом, нами в целом выявлены различия между паттернами перфузии при ПКТ и диффузии при МРТ в сохранивших жизнеспособность очагах ВИ и ИИ (табл.2).
Табл.2. Паттерны фокальных нарушений тканевой перфузии и диффузии головного мозга при ишемическом и венозном инсульте в остром периоде (p<0,05*).
|
Тип тканевого ишемического повреждения |
rMTT |
rCBF |
rCBV |
rDWI |
rADC |
|
Инфаркт |
+/- |
-- |
- |
++ |
-- |
|
Пенумбра |
++ |
-- |
± |
+ |
- |
|
Зона венозного инсульта |
±* |
±* |
+* |
±* |
+* |
Геморрагическая трансформация зарегистрирована нами при проведении контрольной рутинной КТ на 5-7 сутки, а также при ухудшении состояния на 2-3 сутки при исходно негеморрагическом ВИ в 27% (в том числе в 2 случаях с образованием внутримозговых гематом, в остальных с диапедезным пропитыванием) (рис.6) и в 9% при ИИ (ни одного случая образования гематом).
По всей видимости, геморрагическая трансформация при ВИ также имеет несколько иные патофизиологические механизмы, чем при ИИ. Условием для развития ГТ является обычно состояние гипокоагуляции в системе гомеостаза. Но, если ГТ при ИИ развивается в зоне некроза, то при ВИ это связано с затруднением оттока в микроциркуляторном русле при интерстициальном (вазогенном) отеке, развивающемся сравнительно раньше (часто в первые сутки), чем при ишемическом инсульте (обычно на 6-8 сутки).
Теги: инсульт
234567 Описание для анонса:
234567 Начало активности (дата): 23.09.2015 22:24:00
234567 Кем создан (ID): 6
234567 Ключевые слова: Симптомокомплекс КТ- и МР-признаков негеморрагического венозного инсульта в сравнении с артериальным ишемическим инсультом
12354567899



