 21.02.2026
21.02.2026
Методика оценки раздельной функции почек при компьютерной томографии:ретроспективное исследование
Точное определение процентного вклада почек в их общую функцию — важный показатель при выборе клинической тактики при трансплантации почки и хирургических вмешательств
Введение.
Традиционные методы оценки, такие как расчет скорости клубочковой фильтрации (СКФ) по креатинину, мочевине [1–3] и другим показателям [4], позволяют определить функциональное состояние почек, однако не дают возможность оценить вклад каждой почки в общую экскреторную функцию. Определение процентного вклада почек в их общую функцию — важный показатель при выборе клинической тактики.
В настоящее время основным способом оценки раздельной функции почек является динамическая нефросцинтиграфия, основанная на регистрации выведения с мочой нефротропного фармпрепарата, меченного радионуклидом, после его внутривенного введения [5, 6]. Однако необходимость отдельного исследования, связанного с лучевой нагрузкой, для пациентов, которые уже зачастую подвергались КТисследованиям, и погрешности, связанные, например, с положением и морфологией почек, стимулируют поиск альтернативных методов оценки раздельной функции почек [7].
На основе механизма выведения рентгеноконтрастных веществ, аналогичного большинству нефротропных радиофармацевтических препаратов, посредством клубочковой фильтрации, были предприняты попытки определения раздельного вклада почек с помощью данных компьютерно-томографических исследований. В рамках научных исследований, направленных на оценку функциональной эффективности почек, особое внимание было уделено количественным и качественным параметрам почечной паренхимы [8–19]. Ключевыми показателями, позволяющими детально проанализировать раздельную работу почек, стали объем почечной паренхимы и её денситометрические характеристики, выраженные в единицах Хаунсфилда, в различных фазах исследования с контрастированием.
В самых ранних работах определение объема почечной паренхимы представляло собой трудоемкий процесс послойного выделения контуров почек с помощью специальных инструментов на каждом срезе [8, 9]. В дальнейшем стали появляться различные программные средства, например, Voxar 3D Advanced, Advantage Workstation Siemens, Vitrea Advanced Visualization, Amira 3D и др., позволяющие упростить получение данных об объеме и плотности паренхимы почек путем ручной, а затем полуавтоматической и автоматической сегментации паренхимы почки [10–15].
Внедрение данных программ способствовало разработке разнообразных подходов к оценке функциональной активности почек. Однако каждый из этих методов имел определенные недостатки или ограничения, препятствующие их широкому клиническому применению.
В ряде случаев раздельный вклад почек оценивался после расчета скорости клубочковой фильтрации в каждой почке на основании вычислений интегралов плотности содержания контрастного вещества, распределенного в корковом, мозговом веществе и в мочевых путях почек [16]. Другие методики включали проведение КТ-исследования по строго регламентированному протоколу с четко установленными временными интервалами сканирования, в том числе предлагающие специфический протокол контрастирования почек для одновременного определения артериальной, нефрографической и экскреторной фаз [17, 18].
В отдельных случаях сложность расчетов увеличивалась из-за необходимости определения денситометрических характеристик почечной паренхимы при нативном сканировании [10, 15, 19], целесообразность которого подвергается сомнению ввиду того, что плотность паренхимы почек в нативной фазе исследования колеблется в небольшом диапазоне.
Также немаловажным фактором, препятствующим внедрению данных подходов в рутинную практику, являлась высокая стоимость подобных программных средств. Следствием этого стали отдельные разработки, целью которых являлось получение данных об объеме почечной паренхимы с помощью ручного измерения линейных размеров почек, позволяющего обойтись без их сегментации.
Наиболее распространенным и известным способом определения объема почки является использование формулы эллипсоида, которая представляет собой произведение трех размеров, умноженное на число пи и деленное на 6. В большинстве исследований, включая работы K.-Y. Kang [20], R. S. Rathore [21] и R. H. Breau [22], в качестве первых двух размеров используются ширина и толщина почечной паренхимы, которые измеряются на аксиальном срезе с наибольшей площадью поперечного сечения, расположенном перпендикулярно друг другу. Что касается третьего размера — длины почки, то подходы к ее измерению различаются. В основном ее определяют как расстояние между верхним и нижним полюсами почки, измеренное во фронтальных или сагиттальных реконструкциях.
Способ, основанный на использовании эллипсоида, отличается своей простотой и практичностью в повседневной работе. Однако, как было отмечено в исследовании R. H. Breau в 2013 г. [22], этот метод имеет тенденцию к завышению объема почек примерно на 30%. Это может быть связано с тем, что при использовании данного подхода невозможно полностью исключить влияние синуса почки, который в некоторых случаях может занимать значительную часть объема.
В некоторых работах авторы предлагали модификации формулы эллипсоида или новые подходы к измерению объема паренхимы почки для исключения влияния объема синуса почки на итоговый объем. Например, N. Rathi [24] для расчета объема паренхимы почки использовал средние значения двух измерений почки на аксиальном срезе и двух измерений на корональном изображении, исключающих синус, и одно измерение длины на корональном срезе. Данный метод продемонстрировал удовлетворительную корреляцию с полуавтоматической сегментацией и сцинтиграфией. Однако точность таких расчетов ограничена используемой методикой, которая предполагает применение эллипсоидной модели, так как почка обладает анатомической конфигурацией, значительно отличающейся от данной геометрической фигуры. Также M. T. Feder [25] и позднее Sh. Soga [14] в своих исследованиях предложили собственный способ вычисления площади почечной паренхимы, основанный на произведении средней толщины паренхимы и длины почки. Для этого они производили по три измерения толщины паренхимы на верхнем и нижнем полюсе и вычисляли среднее арифметическое этих измерений. Длину почки вычисляли, умножив толщину аксиального среза на количество срезов между верхним и нижним полюсами почек.
Подходы к определению плотности паренхимы тоже были достаточно разнообразны.
В некоторых научных работах плотность не принималась во внимание и для оценки работы почек отдельно друг от друга использовался только объем почек [11–13, 26]. Однако изменение объема почки не всегда отражает ее функциональное состояние. Данный подход показывал противоречивые результаты в разных исследованиях, от достаточно высокой корреляции [11–13] со сцинтиграфией до средней, недостоверной [26].
В работе F. Kato и T. Kamishima (2009) [27] был представлен способ определения плотности паренхимы по измерениям в трех областях паренхимы с вычитанием плотности паренхимы в нативной фазе и получением среднего арифметического этих измерений. Данный способ достаточно удобен, однако все равно требует большого числа измерений в различные фазы контрастирования.
Разработка и валидация методов оценки раздельной функции почек при стандартном КТисследовании с контрастированием, основанных на специализированных программах автоматической сегментации или на данных ручных измерений при их отсутствии.
Вследствие всех вышеизложенных фактов однозначно можно судить о необходимости разработки высокоточного и удобного в применении метода оценки раздельной функции почек при стандартном КТисследовании с контрастированием на основе автоматической сегментации с помощью специализированного программного обеспечения или на основе определения объема паренхимы почки по линейным размерам и ее денситометрическим показателям, полученным в результате ручного измерения, при отсутствии таковых программных средств.
Материалы и методы.
Исследование одобрено локальным этическим комитетом Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина, протокол № 170 от 17 июня 2024 г. Информированное согласие получено от каждого пациента.
В ретроспективное исследование включены данные 243 пациентов, которым было выполнено КТисследование органов брюшной полости и забрюшинного пространства с контрастированием в период с 2023 по 2025 г.
Среди обследованных были 147 мужчин и 96 женщин в возрасте от 3 до 83 лет (среднее арифметическое — 53,9 года). Критериями включения являлось наличие у пациента двух функционирующих почек, наличие данных инструментальных обследований: компьютерная томография почек с контрастированием.
Критериями невключения являлись: отсутствие нативной, артериальной или нефрографической фазы КТ исследования, наличие анатомически или функционально единственной почки, наличие подковообразной почки. Из общего числа исследований была выделена отдельная группа с наличием результатов нефросцинтиграфии — 122 пациента.
В процессе работы были сформированы критерии исключения из данной группы: выраженная каликопиелоэктазия или гидронефротическая трансформация одной из почек или обеих почек, наличие кисты или крупного образования по задней стенке почки. В результате численность группы пациентов с результатами нефросцинтиграфии составила 100 пациентов.
Дополнительно 120 исследований из общего числа составили промежуточную выборку, на которой производились разработка формулы для вычисления объема паренхимы и определения оптимального метода измерения плотности паренхимы.
По данным КТ, УЗИ и клинико-лабораторного обследования диагностированы: опухоль почки — 68 случаев; кисты почки — 62 случая; каликопиелоэктазия почки — 46 случаев, в том числе гидронефроз — 8 случаев; конкременты почки — 16 случаев; образование мочевого пузыря — 10 случаев; состояние после резекции почки — 6 случаев; дистопия почки — 3 случая; врожденная гипоплазия почки — 3 случая; конкремент мочеточника — 2 случая; нефросклероз — 2 случая; образование мочеточника — 1 случай; двусторонняя дисплазия мочеточников — 1 случай; изолированные чашечки почки — 1 случай; образование крестца с вовлечением мочеточника — 1 случай. Отсутствие патологий мочевыводящей системы выявлено в 31 случае.
Компьютерная томография проводилась в Научноисследовательском институте урологии и интервенционной радиологии имени Н. А. Лопаткина — филиал ФГБУ «НМИЦ радиологии» Минздрава России на томографах — Aquilion Prime SP (CANON MEDICAL SYSTEMS) — 108 исследований, и Canon Aquilion ONE (GENESIS Edition) — 80 исследований. Кроме того, в работу были включены исследования, произведенные на КТ-томографах в иных лечебных учреждениях — 55 исследований. Методика выполнения КТ-исследования с контрастированием. Протокол многофазных КТ исследований, проведенных в НИИ урологии с помощью томографов Aquilion Prime SP (160 срезов) и Canon Aquilion ONE (640 срезов), состоял из нативной фазы, артериальной фазы, сканирование которой запускалось, когда плотность рентгенконтрастного вещества в брюшной аорте достигала 100 HU, нефрографической фазы, фиксируемой через 35–60 секунд после регистрации артериальной фазы, и отсроченной фазы, фиксируемой через 7 минут после нефрографической фазы. Важными рекомендуемыми параметрами сканирования являлись: толщина среза 1 мм, скорость введения 4,0 мл/с в дозе 1,0 мл/кг. Обработка КТ-исследований. Все исследования были подвергнуты обработке на рабочей станции Vitrea Advanced Visualization для сегментации паренхимы каждой из почек и получения данных об их объеме и средних значениях плотности в единицах Хаунсфилда (HU). Для этой цели использовалась нефрографическая фаза контрастирования. Для выделения (сегментации) всей почечной паренхимы использовался инструмент «Organ». Выделение производилось отдельными кликами по паренхиме на аксиальном срезе, начиная с полюса, максимально удаленного от окружающих тканей, и постепенно перемещаясь к противоположному полюсу (рис. 1, а, б).
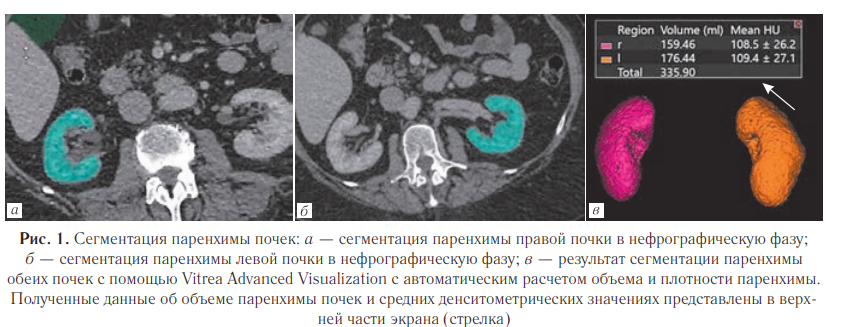
Обработка КТ-исследований. Все исследования были подвергнуты обработке на рабочей станции Vitrea Advanced Visualization для сегментацииипаренхимы каждой из почек и получения данных об их объеме и средних значениях плотности в единицах Хаунсфилда (HU). Для этой цели использовалась нефрографическая фаза контрастирования.
Для выделения (сегментации) всей почечной паренхимы использовался инструмент «Organ».
Выделение производилось отдельными кликами по паренхиме на аксиальном срезе, начиная с полюса, максимально удаленного от окружающих тканей, и постепенно перемещаясь к противоположному полюсу (рис. 1, а, б).
При «захвате» прилежащих соседних тканей (органов или сосудов) использовался инструмент «Edit», позволяющий на каждом срезе вручную убирать лишние области, не входящие в область паренхимы. После завершения сегментации почек была использована функция «Show Volume», автоматически вычисляющая и отображающая объем (V) и среднюю плотность (HU) каждой почки (рис. 1, в).
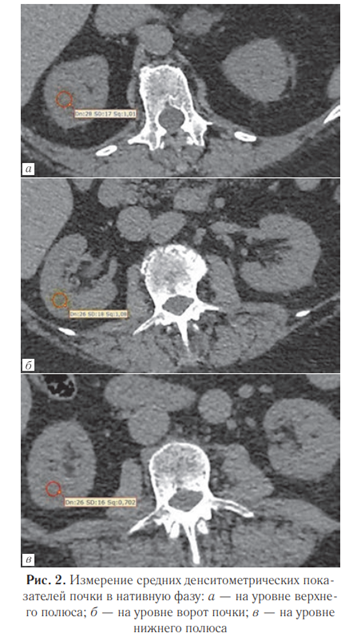
Помимо сегментации, для проведения дальнейших расчетов проводились три измерения плотности паренхимы в области полюсов почки и в области ворот каждой почки в нативной фазе (рис. 2).
Методика расчета раздельного вклада почек на основе автоматической сегментации. Для расчета «массы» контрастного препарата, находящегося в паренхиме почки в конкретный временной момент (в нефрографическую фазу), на основе произведения вычисленного объема паренхимы (V) и ее средней плотности (HU), безусловно целесообразно учитывать плотность паренхимы при нативном сканировании. Для этого из данных о средней плотности, полученных в ходе автоматической сегментации в нефрографическую фазу (HU), вычитали среднее арифметическое трех измерений плотности паренхимы, полученных в нативную фазу (HU 1 , HU2 , HU3).
Полученную «массу» контрастного препарата (M) обеих почек складывали и на полученную сумму делили его «массу» в правой почке, затем в левой почке. Полученные результаты для правой и левой почки умножали на 100%, получая раздельный вклад каждой из почек в их общую экскреторную функцию в процентах (Вклад R).
Полученные данные о процентном вкладе почек в их общую экскреторную функцию с поправкой на нативную плотность паренхимы сопоставлялись с результатами нефросцинтиграфии, имеющихся у пациентов из соответствующей группы, после определения критериев исключения и соответствующего им устранения неподходящих исследований.
Нефросцинтиграфия выполнялась как в лаборатории радиоизотопной диагностики Научно-исследовательского института урологии и интервенционной радиологии имени Н.А. Лопаткина (27 исследований), а также в различных лечебных учреждениях(73 исследования). Исследования проводились с соединениями технеция (пентатех, 99mTc), фильтрующимися исключительно клубочками почек.
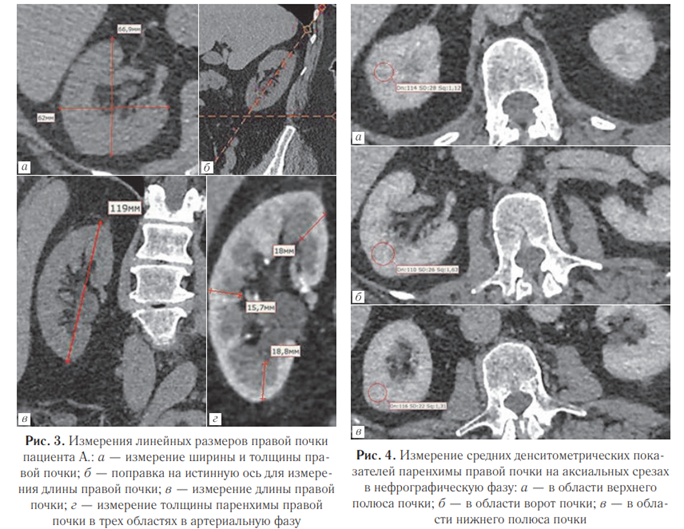
Методика определения объема почек на основе измерения их линейных размеров. При отсутствии возможности произвести расчет раздельной функции почек с помощью специализированного программного обеспечения была разработана альтернативная методика оценки раздельной функции почек при помощи КТ, основанная на ручных измерениях объема почечной паренхимы (по ее линейным размерам) и ее денситометрических показателей.
Для измерения объема были определены наиболее используемые в клинической практике линейные размеры почек:
— два перпендикулярных друг другу размера на аксиальном срезе — ширина паренхимы и толщина паренхимы (рис. 3, а);
— одно наибольшее измерение почки на фронтальном срезе с поправкой на истинную ось органа — длина почки (рис. 3, б, в);
— три измерения толщины паренхимы на фронтальном срезе в области верхнего и нижнего полюсов и в середине почечной паренхимы (рис. 3, г).
В дальнейшем полученные данные использовались для разработки формулы расчета объема паренхимы почки с помощью регрессионного анализа на основе промежуточной выборки пациентов, состоящей из 120 человек.
В качестве референтных значений объема паренхимы почки были взяты данные, полученные в результате автоматической сегментации в специализированной программе станции Vitrea.
В завершение произведен корреляционный анализ данных об объеме каждой из почек полной выборки пациентов, полученных на основе разработанной формулы, с данными об объеме паренхимы, полученными посредством автоматической сегментации.
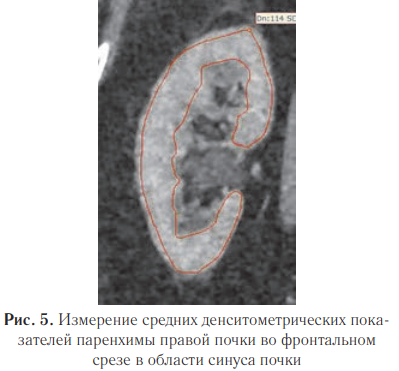
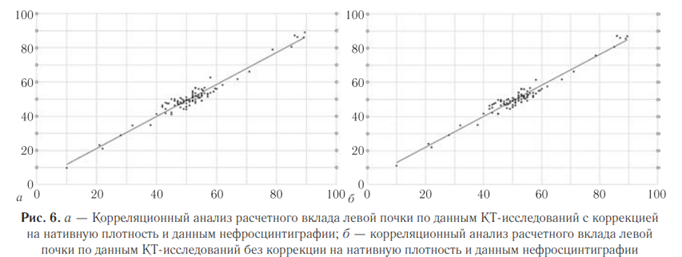
Определение рационального метода расчета средних значений плотности паренхимы почек. Для определения рационального и точного метода расчета средних значений плотности паренхимы почек было проведено сравнение двух подходов:
— измерение денситометрических показателей паренхимы на трех аксиальных срезах (в области полюсов и в середине почечной паренхимы) круглым ROI и получение среднего арифметического этих измерений (рис. 4) — первый метод;
— измерение денситометрических показателей во фронтальном срезе с помощью инструмента для произвольного обведения контуров почки (рис. 5) — второй метод.
Проведен корреляционный анализ результатов двух методов в сравнении с результатами автоматической сегментации.
Полученные ручным методом измерения денситометрических показателей плотности и объема почечной паренхимы легли в основу методики, позволяющей определить раздельный вклад каждой почки в суммарную экскреторную функцию.
Результаты, полученные в ходе исследования, обработаны с применением методов статистической оценки (корреляционный и ковариационный анализ).
Результаты.
В соответствии с заявленными целями и задачами на первом этапе работы мы разработали и валидировали методику расчета раздельного вклада почек на основе автоматической сегментации.
Для определения достоверности данных о процентном вкладе почек в общую функцию, полученных по разработанной методике с поправкой на нативную плотность паренхимы (среднее арифметическое трех областей паренхимы почек в нативную фазу вычиталось из средней плотности паренхимы в нефрографическую фазу), проведен корреляционный анализ со значениями процентного отношения вклада почек, определенными при динамической нефросцинтиграфии у 100 пациентов. Для этого были взяты данные о процентном вкладе левой почки, что предоставляет достаточную информацию для определения корреляционных связей. Ведь процентный вклад второй (правой) почки равен 100% минус процент вклада левой почки. Полученное значение коэффициента корреляции составило 0,99 (p<0,001); коэффициента ковариации — 0,95 (p<0,001), что свидетельствует об очень высокой положительной связи и достоверности результатов (рис. 6, а)
В ходе дальнейшей работы было выдвинуто предположение об отсутствии необходимости выполнения поправки средней плотности паренхимы на значения плотности паренхимы в нативную фазу ввиду их
незначительного колебания в пределах 15 HU (от 23 HU до 38 HU). Для проверки данного предположение были сделаны аналогичные расчеты раздельного вклада каждой из почек без вычитания средней плотности паренхимы в нативную фазу из средней плотности паренхимы в нефрографическую фазу.
В ходе дальнейшей работы было выдвинуто предположение об отсутствии необходимости выполнения поправки средней плотности паренхимы на значения плотности паренхимы в нативную фазу ввиду их незначительного колебания в пределах 15 HU (от 23 HU до 38 HU). Для проверки данного предположение были сделаны аналогичные расчеты раздельного вклада каждой из почек без вычитания средней плотности паренхимы в нативную фазу из средней плотности паренхимы в нефрографическую фазу
MR=VR×HUR;
Вклад R=(MR/(MR+ML))×100%,
где: V — объем паренхимы, полученный при автоматической сегментации в нефрографическую фазу;
HU — средняя плотность паренхимы, полученная при автоматической сегментации в нефрографическую фазу; M — «масса» контрастного препарата;
Вклад R/L — раздельный вклад почки в общую экскреторную функцию в процентах.
Проведен корреляционный анализ значений вклада левой почки на основе КТ, где в расчетах была использована средняя плотность паренхимы почки, полученная в нефрографическую фазу без коррекции на нативную плотность. Коэффициент корреляции составил 0,99 (p<0,001); коэффициент ковариации равен 0,96 (p<0,001), что также свидетельствует об очень высокой положительной связи данных (рис. 6, б)
На основании представленных результатов было принято решение в дальнейшем отказаться в разработанной методике от поправки на нативную плотность паренхимы для упрощения расчетов в практической работе.
Автоматическая сегментация почек дает возможность получить объем их паренхимы с очень высокой точностью, что позволило считать его «истинным» и использовать в качестве референтного значения в разработке методики оценки раздельной функции почек, основанной на ручных измерениях.
Путем регрессионного анализа методом наименьших квадратов данных автоматической сегментации объема паренхимы 120 пациентов промежуточной выборки была выведена формула для расчета объема, учитывающая различные комбинации ее линейных размеров. Наибольшая точность была достигнута формулой, интегрирующей все шесть измеренных параметров:
V=1/1000(0,92xyT–0,07y3+0,07yz2+0,19z2T),
где: х — ширина почки; y — толщина почки; z —длина почки; Т — среднее арифметическое значение трех измерений толщины паренхимы почки на фронтальном срезе (T1, T2, T3); V — объем почечной паренхимы.
Метод наименьших квадратов минимизирует суммарную погрешность оценки объема относительно референтных данных путем подбора коэффициентов для функции, представляющей сумму произведений размеров в различных комбинациях. Величина каждого коэффициента отражает вклад соответствующего размера в итоговую оценку объема.
Для практического применения формулы расчета объема разработан программный калькулятор в среде Excel. Рекомендуемая структура листа (рис. 7):
— Ячейки A1:A6: Наименования шести исходных размеров (x, y, z, Т1, Т2, Т3).
— Ячейки B1:B6: Ввод соответствующих измеренных значений.
— Ячейка B7: Содержит формулу расчета (сохранен формат Excel): =1/1000*(0,92*B1*B2* ((B4+B5+B6)/3)-0,07*(B2^3)+0,07*B2*(B3^2)+ 0,19*(B3^2)*((B4+B5+B6)/3)).
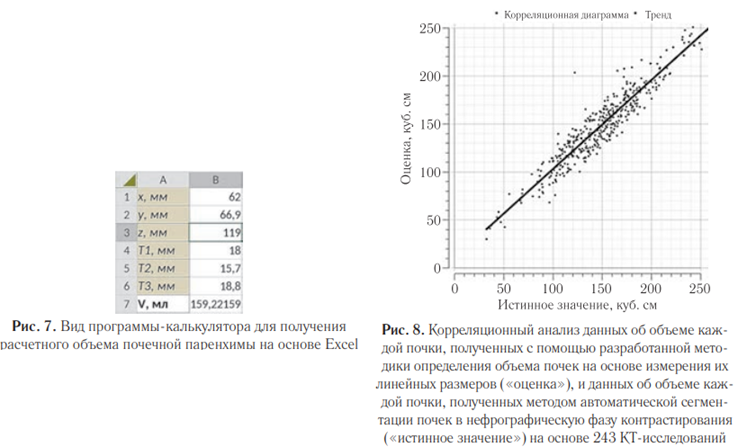
Результат расчета объема (V) отображается в ячейке B7 после заполнения исходных данных.
Следующим этапом, уже на полной выборке исследований, для проверки полученной формулы мы сравнили данные об объеме каждой почки, полученные с помощью разработанной методики, с «истинным» объемом».
Проведен корреляционный анализ (рис. 8), в ходе которого были взяты данные о расчетном объеме правой и левой почек каждого пациента.
Значение коэффициента корреляции составило 0,99 (p<0,001), а коэффициента ковариации — 0,94 (p<0,001), что свидетельствует об очень высокой положительной корреляции и точности метода.
Также на основе промежуточной выборки исследований (120 пациентов) определен оптимальный метод оценки средних значений денситометрических показателей паренхимы почек. Для этого осуществлен корреляционный анализ результатов обоих изучаемых методов (первый метод — измерение круглым ROI, второй метод — измерение во фронтальном срезе) в сопоставлении с методом автоматической сегментации почек (рис. 9, а, б).
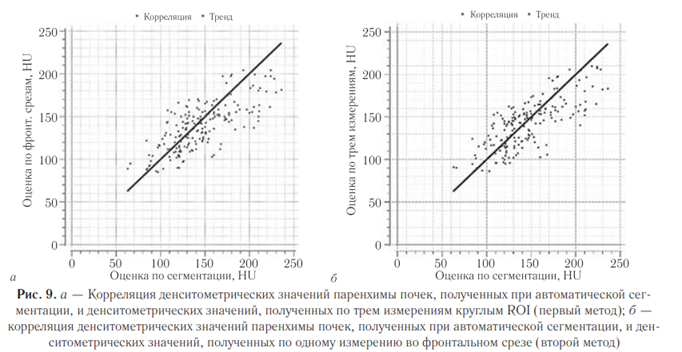
Полученное значение коэффициента корреляции для первого метода — по отдельным измерениям, составило 0,988 (p<0,001); коэффициента ковариации — 0,76 (p<0,001). Для второго метода — при обведении площади — значение коэффициента корреляции составило 0,987 (p<0,001); коэффициента ковариации — 0,73 (p<0,001). Представленные результаты свидетельствуют о высокой положительной связи.
Корреляционный анализ данных методов продемонстрировал, что обе методики допустимо использовать для измерения денситометрических значений паренхимы почек. Однако менее трудозатратная методика оценки по трем измерениям круглым ROI (первый метод) оказалась не менее точной, чем методика по одному измерению во фронтальном срезе (второй метод) при несколько лучших показателях ковариации, что позволяет остановить выбор для дальнейших расчетов на первом методе.
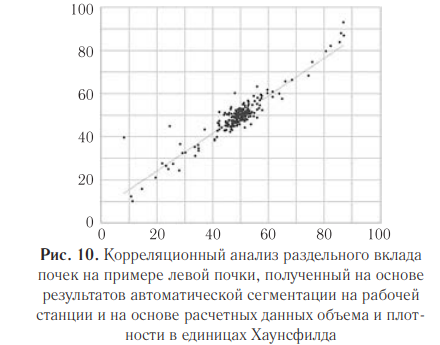
Для окончательной оценки эффективности и достоверности разработанной методики определения значений раздельной функции почек при ручных измерениях был проведен корреляционный анализ значений вклада левой почки на основе произведения значений объема и средней плотности паренхимы почек с такими же данными, полученными при автоматической ее сегментации на рабочей станции (рис. 10). Полученное значение коэффициента корреляции составило 0,93 (p<0,001); коэффициента ковариации — 0,91 (p<0,001), что также свидетельствует об очень высокой положительной связи.
Обсуждение.
Основной целью настоящего исследования была разработка и валидация методики определения процентного вклада каждой почки в общую экскреторную функцию с использованием стандартного КТ-исследования с контрастированием. Предложены два подхода:
1) основанный на автоматической сегментации паренхимы почек с последующим расчетом;
2) альтернативный метод, использующий ручные линейные измерения и денситометрию, применимый в отсутствие специализированного ПО.
Результаты, полученные при автоматической сегментации, демонстрируют высокую точность метода для оценки раздельной функции. Корреляция (0,99, p<0,001) и ковариация (0,96, p<0,001) при сопоставлении с данными динамической нефросцинтиграфии являются исключительно высокими. Это убедительно свидетельствует о том, что предложенный алгоритм адекватно отражает раздельную экскреторную функцию. Данный результат имеет первостепенное значение, представляющим возможность открыть перспективу исключения нефросцинтиграфии из обязательной программы обследования больных при определении тактики лечения.
Выявленная точность метода подтверждает теоретическую предпосылку о том, что объем распределения контрастного вещества в паренхиме в нефрографическую фазу, пропорциональный произведению объема паренхимы (V) на ее плотность (HU), является надежным способом определения клубочковой фильтрации в каждой почке.
Важным практическим выводом является отсутствие необходимости учета нативной плотности паренхимы. Корректировка значений HU в нефрографическую фазу на среднюю нативную плотность не приводит к статистически значимому улучшению корреляции (0,99) и ковариации (0,95) со сцинтиграфией по сравнению с использованием абсолютных значений HU в нефрографической фазе (корреляция — 0,99, ковариация — 0,96).
Это сокращает время расчетов и упрощает методику.
Вышеуказанная методика оптимальна при наличии соответствующего программного обеспечения в распоряжении врача. Однако, учитывая ограниченную доступность и высокую стоимость специализированных рабочих станций с функциями 3D-сегментации, разработка точного метода на основе ручных измерений представляет также значительную клиническую ценность.
Полученная формула для определения объема паренхимы, учитывающая шесть линейных размеров (ширина и толщина на аксиальном срезе; длина на фронтальном срезе; среднее арифметическое трех измерений толщины паренхимы на фронтальном срезе), показала высокую точность. Корреляция (0,994, p<0,001) и ковариация (0,94, p<0,001 между объемами, рассчитанными по формуле, и объемами, полученными при автоматической сегментации, подтверждают адекватность модели. Эта формула успешно преодолевает основной недостаток классического эллипсоидного метода за счет исключения объема синуса почки из общего объема почечной паренхимы. Хотя метод требует больше измерений, чем простой эллипсоидный, он существенно менее трудоемок, чем ручная послойная сегментация или предложенные в предшествующих работах формулы, и обеспечивает высокую точность при отсутствии автоматизированных инструментов.
Однако предложенный метод не лишен определенных недостатков.
1. Формула расчета объема включает множество арифметических операций, что может затруднять ручные вычисления. Для упрощения процесса разработан специализированный калькулятор в Excel, реализующий данную формулу.
2. Точность измерений: субъективность при определении точек замера линейных параметров почки потенциально влияет на точность. Для минимизации погрешности, особенно при измерении толщины паренхимы, рекомендуется использовать артериальную фазу контрастирования, обеспечивающую четкую визуализацию почечных столбов и соответствие методике настоящего исследования. В отсутствие артериальной фазы допустимы измерения по нативным сканам или в нефрографическую фазу.
3. Клинические ограничения: метод менее применим при выраженном гидронефрозе с истончением паренхимы и при множественных синусных/интрапаренхиматозных кистах. В этих случаях атипичная анатомия (деформация чашечек, внедрение кист в паренхиму) препятствует корректному измерению линейных размеров и последующему расчету объема.
Однако при умеренной каликопиелоэктазии без значительной деформации и при субкапсулярных кистах методика демонстрирует приемлемую точность.
При сравнении двух методов оценки средней плотности (с помощью измерения круглыми ROI на аксиальных срезах и одно ROI при обведении контура на фронтальном срезе) было отмечено, что оба подхода показали высокую корреляцию (0,988 и 0,987 соответственно) с результатами автоматической сегментации. Небольшое преимущество метода трех ROI в аксиальной плоскости (ковариация 0,76 против 0,73) делает его предпочтительным, хотя оба метода приемлемы. Выбор был остановлен на методе, основанном на измерении в трех ROI, так как он более удобен в практической работе.
Непосредственный расчет раздельного вклада почек в общую функцию на основе ручного метода продемонстрировал очень высокую положительную связь с данными автоматической сегментации, что обосновывает клиническую применимость этого подхода. Хотя точность несколько ниже, чем у полностью автоматизированного метода, она остается очень высокой и достаточной для практического использования в условиях отсутствия ПО для сегментации.
Выводы.
На основании проведенного исследования были разработаны два метода оценки раздельной функции почек (процентного вклада каждой из почек в их общую экскреторную функцию) на основе данных компьютерной томографии, выполненной по общепринятой методике:
— метод оценки раздельной функции почек на основе автоматической сегментации паренхимы почек, при наличии соответствующего программного обеспечения;
— метод оценки раздельной функции почек на основе уникального способа определения объема паренхимы почки по линейным размерам и ее денситометрическим показателям, полученным в результате ручного измерения, при отсутствии программного обеспечения для сегментации.
Оба метода доступны и удобны в практической работе, не требуют выполнения четко регламентированного временного протокола многофазной КТ.
Также оценке могут быть подвергнуты данные КТ, выполненной в стороннем лечебном учреждении, представленные на носителях.
Заключение.
Применение разработанных методов позволит во многих случаях избежать необходимости дополнительного выполнения нефросцинтиграфии, что, в свою очередь, может помочь снизить финансовые затраты и лучевую нагрузку на пациента, уменьшить время на подготовку больного к лечению.
ЛИТЕРАТУРА
1. Levey A.S., Stevens L.A., Schmid C.H., Zhang Y.L., Castro A.F. 3rd et al.; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate // Ann. Intern. Med. 2009. May 5. Vol. 150, No. 9. Р. 604–612.
2. Lamb E.J., Tomson C.R., Roderick P.J. Clinical Sciences Reviews Committee of the Association for Clinical Biochemistry. Estimating kidney function in adults using formulae // Ann. Clin. Biochem. 2005. Sep. Vol. 42 (Pt 5). Р. 321–345. doi: 10.1258/0004563054889936.
3. Каюков И.Г., Галкина О.В., Тимшина Е.И., Зубина И.М., Михеева А.Ю., Бердичевский Г.М. Креатинин в современной оценке функционального состояния почек (обзор литературы и собственные данные) // Нефрология. 2020. Т. 24, No 4. С. 21–36. [Kayukov I.G., Galkina O.V., Timshina E.I., Zubina I.M., Miheeva A.U., Berdichevsky G.M. Creatinin in the modern evaluation of the kidneys functional condition (literature review and own data). Nephrology (Saint-Petersburg), 2020, Vol. 24, No. 4, рр. 21–36 (In Russ.)].
4. Shlipak M.G., Matsushita K., Ärnlöv J., Inker L.A., Katz R., Polkinghorne K.R., Rothenbacher D., Sarnak M.J., Astor B.C., Coresh J., Levey A.S., Gansevoort R.T. CKD Prognosis Consortium. Cystatin C versus creatinine in determining risk based on kidney function // N. Engl. J. Med. 2013. Sep 5. Vol. 369, No. 10. P. 932– 943. doi: 10.1056/NEJMoa1214234.
5. Wesolowski M.J., Conrad G.R., Šámal M., Watson G., Wanasundara S.N., Babyn P., Wesolowski C.A. A simple method for determining split renal function from dynamic (99m)Tc-MAG3 scintigraphic data // Eur. J. Nucl. Med. Mol. Imaging. 2016. Mar. Vol. 43, No. 3. Р. 550–558. doi: 10.1007/s00259-015-3216-1.
6. Weyer K., Nielsen R., Petersen S.V., Christensen E.I., Rehling M., Birn H. Renal uptake of 99mTc-dimercaptosuccinic acid is dependent on normal proximal tubule receptor-mediated endocytosis // J. Nucl. Med. 2013. Jan. Vol. 54, No. 1. Р. 159–165. doi: 10.2967/jnumed.112.110528.
7. Tartaglione G., D’Addessi A., De Waure C., Pagan M., Raccioppi M., Sacco E., Cadeddu C., Vittori M., Bassi PF., Ferretti A., Al-Nahhas A., Rubello D. (99m)Tc-MAG3 diuretic renography in diagnosis of obstructive nephropathy in adults: a comparison between F-15 and a new procedure F+10(sp) in seated position // Clin. Nucl. Med. 2013. Vol. 38, No. 6. Р. 432–436.
8. Dawson P., Peters M. Dynamic Contrast Bolus Computed Tomography for the Assessment of Renal Function // Investigative Radiol. 1993. Vol. 28, No. 11. Р. 1039–1042.
9. Tsushima Y., Blomley M.J., Okabe K. et al. Determination of glomerular filtration rate per unit renal volume using computerized tomography: correlation with conventional measures of total and divided renal function // J. Urol. 2001. Vol. 165. Р. 382–385.
10. Summerlin A.L., Lockhart M.E., Strang A.M., Kolettis P.N., Fineberg N.S., Smith J.K. Determination of split renal function by 3D reconstruction of CT angiograms: a comparison with gamma camera renography // AJR Am. J. Roentgenol. 2008. Nov. Vol. 191, No. 5. Р. 1552–1558.
11. Diez A., Powelson J., Sundaram C.P., Taber T.E., Mujtaba M.A., Yaqub M.S., Mishler D.P., Goggins W.C., Sharfuddin A.A. Correlation between CT-based measuredrenal volumes and nuclear-renography-based split renal function in living kidney donors. Clinical diagnostic utility and practice patterns // Clin. Transplant. 2014. Jun. Vol. 28, No. 6. Р. 675–682.
12. Wahba R., Franke M., Hellmich M., Kleinert R., Cingöz T., Schmidt M.C., Stippel D.L., Bangard C. Computed Tomography Volumetry in Preoperative Living Kidney Donor Assessment for Prediction of Split Renal Function // Transplantation. 2016. Jun. Vol. 100, No. 6. Р. 1270–1277.
13. Houbois C., Haneder S., Merkt M., Morelli J.N., Schmidt M., Hellmich M., Mueller R.U., Wahba R., Maintz D., Puesken M. Can computed tomography volumetry of the renal cortex replace MAG3-scintigraphy in all patients for determining split renal function? // Eur. J. Radiol. 2018. Vol. 103. Р. 105–111.
14. Soga S., Britz-Cunningham S., Kumamaru K.K., Malek S.K., Tullius S.G., Rybicki F.J. Comprehensive comparative study of computed tomography-based estimates of split renal function for potential renal donors: modified ellipsoid method and other CT-based methods // J. Comput. Assist Tomogr. 2012. Vol. 36, No. 3. Р. 323–329.
15. Shi W., Liang X., Wu N., Zhang H., Yuan X., Tan Y. Assessment of Split Renal Function Using a Combination of Contrast-Enhanced CT and Serum Creatinine Values for Glomerular Filtration Rate Estimation // AJR Am. J. Roentgenol. 2020. Vol. 215, No. 1. Р. 142–147.
16. Аляев Ю.Г., Дзеранов Н.К., Хохлачев С.Б., Борисов В.В., Фиев Д.Н., Демидко Ю.Л., Проскура А.В., Юрова М.В. Новый метод оценки раздельной функции почек на основании данных мультиспиральной компьютерной томографии с контрастированием // Urology. 2018. No 2. С. 26–33. [Alyaev Yu.G., Dzeranov N.K., Khokhlachev S.B., Borisov V.V., Fiev D.N., Demidko Yu.L., Proskura A.V., Yurova M.V. A new method for assessing separate renal function based on data from multispiral computed tomography with contrast. Urology, 2018, No. 2, pp. 26–33 (In Russ.)]
17. Knox M.K., Rivers-Bowerman M.D., Bardgett H.P., Cowan N.C. Multidetector computed tomography with triple-bolus contrast medium administration protocol for preoperative anatomical and functional assessment of potential living renal donors // Eur. Radiol. 2010. Vol. 20, No. 11. Р. 2590–2599.
18. Lal H., Singh A., Prasad R., Yadav P., Akhtar J., Barai S., Mishra P., Bhadauria D., Kaul A., Prasad N., Verma P. Determination of split renal function in voluntary renal donors by multidetector computed tomography and nuclear renography: How well do they correlate? // SA J. Radiol. 2021. Vol. 25, No. 1. Р. 2009.
19. Fowler J.C., Beadsmoore C., Gaskarth M.T., Cheow H.K., Bernal R., Hegarty P., Bullock K.N., Taylor H., Dixon A.K., Peters A.M. A simple processing method allowing comparison of renal enhancing volumes derived from standard portal venous phase contrast-enhanced multidetector CT images to derive a CT estimate of differ-ential renal function with equivalent results to nuclear medicine quantification // Br. J. Radiol. 2006. Vol. 79, No. 948. Р. 935–942.
20. Kang K.Y., Lee Y.J., Park S.C., Yang C.W., Kim Y.S., Moon I.S., Koh Y.B., Bang B.K., Choi B.S. A comparative study of methods of estimating kidney length in kidney transplantation donors // Nephrol. Dial. Transplant. 2007. Vol. 22, No. 8. Р. 2322–2327.
21. Rathore R.S., Mehta N., Pillai B.S., Sam M.P., Upendran B., Krishnamoorthy H. Variations in renal morphometry: A hospital-based Indian study // Indian J. Urol. 2016. Vol. 32,
Сведения об авторах:
Громов Александр Игоревич — доктор медицинских наук, профессор, руководитель группы лучевых методов диагностики и лечения отдела онкоурологии Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина — филиала федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4; профессор кафедры лучевой диагностики федерального государственного бюджетного образовательного учреждения высшего образования «Московский государственный медико-стоматологический университет имени А. И. Евдокимова» Министерства здравоохранения Российской Федерации
Просянников Михаил Юрьевич — кандидат медицинских наук, заведующий отделом мочекаменной болезни Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина — филиала федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4
Доморовская Яна Сергеевна — врач-рентгенолог Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина — филиала федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4; ORCID 0009–0001–7686–1718;
Сивков Андрей Владимирович — кандидат медицинских наук, заместитель директора по научной работе Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина — филиала федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4
Войтко Дмитрий Алексеевич — кандидат медицинских наук, научный сотрудник отдела мочекаменной болезни Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина — филиала федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4
Каприн Андрей Дмитриевич — доктор медицинских наук, профессор, академик РАН, заслуженный врач РФ, генеральный директор федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4; директор Московского научно-исследовательского онкологического института имени П. А. Герцена, заведующий кафедрой онкологии и рентгенорадиологии имени В. П. Харченко федерального государственного бюджетного образовательного учреждения высшего образования «Российский университет дружбы народов», главный внештатный онколог Министерства здравоохранения Российской Федерации;
Алексеев Борис Яковлевич — доктор медицинских наук, профессор, заместитель генерального директора по научной работе федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4; ORCID 0000–0002–3398–4128;
Аполихин Олег Иванович — доктор медицинских наук, профессор, член-корреспондент РАН, директор Научно-исследовательского института урологии и интервенционной радиологии имени Н. А. Лопаткина — филиала федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации; 249031, Калужская область, г. Обнинск, ул. Королева, д. 4;
Теги: почки
234567 Начало активности (дата): 21.02.2026
234567 Кем создан (ID): 989
234567 Ключевые слова: раздельная функция почек, компьютерная томография, функция почки
12354567899
Похожие статьи
Камни в почкахРентген на дому 8 495 22 555 6 8
Апикальная шапочка
Рак паренхимы почки