 13.09.2025
13.09.2025
Совершенствование подходов к лечению пациентов с хронической обструктивной болезнью легких
Для пациентов с хронической обструктивной болезнью легких (ХОБЛ) характерна гиперплазия бокаловидных клеток и гипертрофия подслизистых желез с активацией их функции, что приводит к гиперсекреции слизи и образованию мокроты
Введение
Заболеваемость и смертность, связанные с хронической обструктивной болезнью легких (ХОБЛ), растут во всем мире[1]. Обострения ХОБЛ могут возникать более чем у 90% пациентов с ХОБЛ и часто требуют госпитализации, увеличивая экономические затраты на лечение таких пациентов[2]. Долгосрочный прогноз после госпитализации по поводу обострения ХОБЛ неблагоприятный, при этом уровень смертности в течение 5 лет составляет около 50% [1]. Клиническое течение ХОБЛ сопровождается затруднением эвакуации мокроты, что увеличивает риск присоединения вторичной инфекции2 [2]. Персистирующее воспаление, бронхиальная обструкция способствуют прогредиентному нарушению мукоцилиарного клиренса (МК) [3]. Мукоцилиарная система является одной из первых линий защиты дыхательных путей [4]. Нарушения МК в свою очередь предрасполагают к увеличению риска развития обострения заболевания, замыкая тем самым порочный круг. Эффективность МК в значительной степени зависит от адекватной гидратации слизи. С этой целью и для ускорения МК обычно используются ингаляционные гиперосмотические растворы [5]. Вдыхаемый гипертонический раствор (ГР) вызывает осмотический приток воды, улучшая гидратацию поверхности дыхательных путей. В настоящее время используются 3%, 6% и 7% растворы ГР [5]. С 2023 г. ГР включен в комплексную терапию ХОБЛ согласно рекомендациям GOLD 20232.
Чтобы минимизировать раздражающее действие ГР, в ряде случаев приводящее к появлению кашля и развитию бронхоспазма, в состав ГР была введена гиалуроновая кислота (ГК) [6]. ГК — это гликозаминогликан, который содержится во внеклеточном матриксе, в том числе в легких, и обладает рядом свойств, которые делают его привлекательным кандидатом в качестве терапевтического средства при ХОБЛ [7]. ГК является очень гидрофильной молекулой [8] и уже несколько лет используется в качестве средства для увлажнения и уменьшения гиперреактивности дыхательных путей. Кроме того, ГК обладает мощными противовоспалительными свойствами, уменьшает повреждение эпителия легких [9, 10]. Продемонстрированы эффект ГК в разрушении биопленок, а также бактериостатическая активность в отношении основных патогенов дыхательных путей (Moraxella catarrhalis, Haemophylus influenzae) [9].
В физиологических условиях ГК обнаруживается в высоких концентрациях в соединительнотканном матриксе легких и на поверхности эпителия дыхательных путей [8].
Молекулы ГК разной молекулярной массы (ММ) оказывают следующее действие на клеточное поведение: цепи с ММ 400–10 000 стимулируют ангиогенез, с ММ 50 000–100 000 — активизируют миграцию клеток и их пролиферацию, с ММ>500 000, напротив, подавляют ангиогенез, клеточную миграцию и пролиферацию [9, 11].
При остром воспалении ГК распадается на низкомолекулярные фрагменты, которые обладают выраженными провоспалительными свойствами [12]. Этот процесс пропорционален активности заболевания: уровень ГК в мокроте и крови связан со степенью тяжести ХОБЛ, степенью обструкции, активностью воспаления и выживаемостью пациентов [13]. Полученная информация свидетельствует о том, что дисбаланс между снижением уровня ГК и увеличением количества более мелких фрагментов ГК может быть ассоциирован с прогрессированием хронических заболеваний дыхательных путей. Поэтому экзогенная ГК может восстанавливать концентрацию высокомолекулярных молекул, ингибировать воспаление, замедлять прогрессирование заболевания [12].
Показано положительное влияние применения ГК на объем форсированного выдоха в 1-ю секунду (ОФВ1) и остаточный объем легких, а также на сроки среднего пребывания в стационаре при обострении ХОБЛ [14].
В исследовании F. Galdi et al. [15] продемонстрировано влияние ГК на сокращение продолжительности периода терапии острой дыхательной недостаточности и потребности в неинвазивной вентиляции легких у пациентов при обострении ХОБЛ. Исследования на животных моделях c воспалительными заболеваниями легких и у пациентов с астмой предполагают потенциальную роль высокомолекулярной ГК в лечении заболеваний дыхательных путей, включая уменьшение воспалительной гиперреактивности, снижение экспрессии провоспалительных цитокинов и защиту от острых воспалительных реакций, вызванных повреждением легких в экспериментальных работах [16, 17].
Один из возможных механизмов заключается в том, что высокомолекулярная ГК способствует регуляторной активности Т-клеток и подавлению приобретенного иммунитета [18, 19].
Высокомолекулярная ГК также оказывает стабилизирующее действие на миоциты дыхательных путей и предотвращает реполяризацию и сокращение, опосредованное потоком ионов кальция [20].
В экспериментальных исследованиях было показано влияние ГК на предотвращение повреждений, опосредованных эластазой, при эмфиземе легких [21].
Цель исследования: оценить эффективность и безопасность применения комбинированного препарата 7% ГР хлорида натрия (NaCl) и 0,1% гиалуроната натрия у пациентов с ХОБЛ.
В настоящее время комбинированные препараты ГК и ГР все более активно используются пациентами с ХОБЛ, однако исследования их применения в условиях реальной клинической практики пока единичны.
Материал и методы
В исследование было включено 50 больных ХОБЛ GOLD II–III в период ремиссии, обратившихся на плановую консультацию в Экспертный центр по профилю «Пульмонология» СПб ГБУЗ «ГМПБ № 2». Все пациенты получали двойную бронхолитическую терапию (тиотропия бромид /олодотерол 2,5+2,5 мкг 2 ингаляции 1 р/день, или гликопиррония бромид / индакатерол 50+110 мкг 1 ингаляция 1 р/день, или вилантерол / умеклидиния бромид 22+55 мкг 1 ингаляция 1 р/день) в соответствии с клиническими рекомендациями по лечению ХОБЛ1.
Критерии невключения: пациенты, перенесшие в течение 6 мес. до исследования острый инфаркт миокарда или эпизод нестабильной стенокардии; нарушения ритма в анамнезе, хроническая сердечная недостаточность III–IV, аллергический ринит, гастроэзофагеальная рефлюксная болезнь, патология верхних дыхательных путей, провоцирующая появление кашля (постназальный затек, фарингит, ларингит, синусит).
Все пациенты подписали информированное согласие перед включением в исследование.
Больные были разделены на 2 группы по 25 человек. Пациенты основной группы в дополнение к двойной бронхолитической терапии амбулаторно получали комбинированное средство 7% ГР NaCl и 0,1% гиалуроната натрия (Ингасалин® форте) в виде ингаляций через небулайзер 2 р/день в течение 10 дней. Пациенты контрольной группы получали только базовую терапию.
Высокая противовоспалительная активность препарата 7% ГР NaCl и 0,1% гиалуроната натрия обусловлена включенной в его состав высокомолекулярной ГК массой >1 млн Да [22].
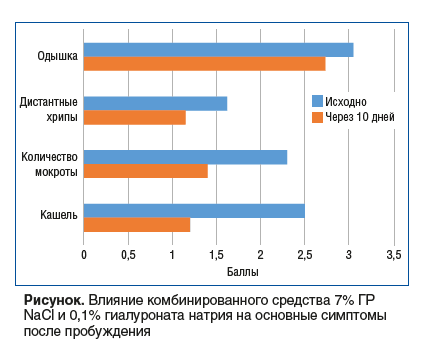
Исходно и через 10 дней применения препарата пациенты заполняли следующие вопросники: mMRC (Modified Medical Research Council Dyspnea Scale), САТ-тест, вопрос-ник, предложенный J. Beier et al. (2013) [23]. Вопросник J. Beier et al. (2013) включал в себя средний балл оценки интенсивности кашля, количества мокроты, выраженности дистантных хрипов и одышки после пробуждения (0 баллов — отсутствие симптома, 4 балла — сильно выраженный симптом).
Для оценки безопасности использования препарата выполняли следующие исследования: клинический и биохимический анализы крови (АЛТ, АСТ, глюкоза, билирубин, креатинин), электрокардиографию (ЭКГ).
Статистическую обработку проводили с использованием стандартного пакета прикладного статистического анализа Statistica for Windows 7.0. Для проверки показателей на нормальность распределения использовали критерий Шапиро — Уилка. Показатели представлены как среднее и стандартное отклонение (M±SD). Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Группы статистически значимо не различались по возрасту, полу, стажу курения и показателю ОФВ1. Все обследованные пациенты предъявляли жалобы на одышку, а также продуктивный кашель (табл. 1, 2).
Через 10 дней у пациентов проводилась повторная оценка выраженности респираторных симптомов по использованным при включении в исследование шкалам и показателей спирометрии.
У пациентов основной группы отмечалось снижение интенсивности кашля и количества мокроты (см. рисунок). Кроме того, была выявлена тенденция к уменьшению одышки и улучшению качества жизни. Следует отметить, что симптомы оценивались непосредственно после пробуждения, что особенно важно для пациентов с ХОБЛ, так как именно утренние симптомы в максимальной степени влияют на качество жизни. Среди пациентов контрольной группы достоверных изменений не было обнаружено (см. табл. 2).
Добавление к терапии препаратов, усиливающих гидратацию слизи, способствует отхождению мокроты, приводя к уменьшению выраженности респираторных симптомов, продемонстрированное пациентами основной группы.
В клиническом и биохимическом анализах крови и по данным ЭКГ за период наблюдения не выявлено значимых отклонений.
У пациентов основной группы на фоне применения исследуемого препарата серьезных нежелательных явлений выявлено не было. Двоих (8%) пациентов беспокоило ощущение соленого вкуса. Обычное полоскание горла водой после ингаляции полностью устраняло вышеуказанное нежелательное явление.
Заключение
Использование комбинированного препарата 7% ГР NaCl и 0,1% гиалуроната натрия (Ингасалин® форте) в дополнение к базовой терапии у пациентов с ХОБЛ способствует статистически значимому уменьшению интенсивности кашля и улучшению отхождения мокроты, хорошо переносится и не сопровождается клинически значимыми нежелательными явлениями, что в целом обусловливает уменьшение выраженности одышки и улучшение качества жизни.
Литература
1. Shafuddin E., Fairweather S.M., Chang C.L. et al. Cardiac biomarkers and long-term outcomes of exacerbations of COPD: a long-term follow-up of two cohorts. ERJ Open Res. 2021;22;7(1):00531–2020. DOI: 10.1183/23120541.00531-2020
2. Bhowmik A., Chahal K., Austin G., Chakravorty I. Improving mucociliary clearance in chronic obstructive pulmonary disease. Respir Med. 2009;103(4):496–502. DOI: 10.1016/j.rmed.2008.10.014
3. Симонова О.И., Горинова Ю.В. Новая форма гипертонического раствора для небулайзерной терапии. Вопросы современной педиатрии. 2016;15(6):631–634. [Simonova O.I., Gorinova Yu.V. New Form of Hypertonic Solution for Nebulization Therapy. Current Pediatrics. 2016;15(6):631–634 (in Russ.)]. DOI: 10.15690/vsp.v15i6.1662
4. Pérez B.F., Méndez G.A., Lagos R.A., Vargas M.S.L [Mucociliary clearance system in lung defense]. Rev Med Chil. 2014;142(5):606–615 (in Spanish). DOI: 10.4067/S0034-98872014000500009
5. Симонова О.И., Горинова Ю.В., Бакрадзе М.Д. Эффективность ингаляций гипертонического раствора у детей с бронхитами и бронхиолитами. Вопросы современной педиатрии. 2014;13(4):33–39. [Simonova O.I., Gorinova Yu.V., Bakradze M.D. Efficiency of hypertonic solution inhalation in children with bronchitis and bronchiolitis. Current Pediatrics. 2014;13(4):33–39 (in Russ.)]. DOI: 10.15690/vsp.v13i4.1082
6. Ros M., Casciaro R., Lucca F. et al. Hyaluronic acid improves the tolerability of hypertonic saline in the chronic treatment of cystic fibrosis patients: a multicenter, randomized, controlled clinical trial. J Aerosol Med Pulm Drug Deliv. 2014;27(2):133–137. DOI: 10.1089/jamp.2012.1034
7. Buonpensiero P., De Gregorio F., Sepe A. et al. Hyaluronic acid improves "pleasantness" and tolerability of nebulized hypertonic saline in a cohort of patients with cystic fibrosis. Adv Ther. 2010;27(11):870–878. DOI: 10.1007/s12325-010-0076-8
8. Turino G.M., Cantor J.O. Hyaluronan in respiratory injury and repair. Am J Respir Crit Care Med. 2003;167(9):1169–1175. DOI: 10.1164/rccm.200205-449PP
9. Garantziotis S., Brezina M., Castelnuovo P., Drago L. The role of hyaluronan in the pathobiology and treatment of respiratory disease. Am J Physiol Lung Cell Mol Physiol. 2016;310(9):L785–795. DOI: 10.1152/ajplung.00168.2015
10. Cantor J.O., Shteyngart B., Cerreta J.M., Liu M. The effect of hyaluronan on elastic fiber injury in vitro and elastase-induced airspace enlargement in vivo. Proc Soc Exp Biol Med. 2000;225(1):65–71. DOI: 10.1046/j.1525-1373.2000.22508.x
11. Сигаева Н.Н., Колесов С.В., Назаров П.В., Вильданова Р.Р. Химическая модификация гиалуроновой кислоты и ее применение в медицине. Вестник Башкирского университета. 2012;17(3):1220–1241. [Sigaeva N.N., Kolesov S.V., Nazarov P.V., Vildanova R.R. Chemical modification of hyaluronic acid and its use in medicine. Bulletin of the Bashkir University. 2012;17(3):1220–1241 (in Russ.)].
12. Cantor J.O., Cerreta J.M., Ochoa M. et al. Aerosolized hyaluronan limits airspace enlargement in a mouse model of cigarette smoke-induced pulmonary emphysema. Exp Lung Res. 2005;31:417–430. DOI: 10.1080/01902140590918669
13. Papakonstantinou E., Roth M., Klagas I. et al. COPD exacerbations are associated with proinflammatory degradation of hyaluronic acid. Chest. 2015;148:1497–1507. DOI: 10.1378/chest.15-0153
14. Allegra L., Della Patrona S., Petrigni G. Hyaluronic acid: perspectives in lung diseases. Handb Exp Pharmacol. 2012;(207):385–401. DOI: 10.1007/978-3-642-23056-1_17
15. Galdi F., Pedone C., McGee C.A. et al. Inhaled high molecular weight hyaluronan ameliorates respiratory failure in acute COPD exacerbation: a pilot study. Respir Res. 2021;22(1):30. DOI: 10.1186/s12931-020-01610-x
16. Jiang D., Liang J., Fan J. et al. Regulation of lung injury and repair by Toll-like receptors and hyaluronan. Nat Med. 2005;11:1173–1179. DOI: 10.1038/nm1315
17. Petrigni G., Allegra L. Aerosolised hyaluronic acid prevents exercise-induced bronchoconstriction, suggesting novel hypotheses on the correction of matrix defects in asthma. Pulm Pharmacol Ther. 2006;19:166–171. DOI: 10.1016/j.pupt.2005.03.002
18. Bollyky P.L., Falk B.A., Wu R.P. et al. Intact extracellular matrix and the maintenance of immune tolerance: high molecular weight hyaluronan promotes persistence of induced CD4+ CD25+ regulatory T cells. J Leukoc Biol. 2009;86:567–572. DOI: 10.1189/jlb.0109001
19. Bollyky P.L., Lord J.D., Masewicz S.A. et al. Cutting edge: high molecular weight hyaluronan promotes the suppressive effects of CD4+ CD25+ regulatory T cells. J Immunol. 2007;179:744–747. DOI: 10.4049/jimmunol.179.2.744
20. Lazrak A., Creighton J.R., Yu Z. et al. Hyaluronan mediates airway hyperresponsiveness in oxidative lung injury. Am J Physiol Lung Cell Mol Physiol. 2015;308:L891–L903. DOI: 10.1152/ajplung.00377.2014
21. Cantor J.O., Cerreta J.M., Armand G., Turino G.M. Aerosolized hyaluronic acid decreases alveolar injury induced by human neutrophil elastase. Proc Soc Exp Biol Med. 1998;217:471–475. DOI: 10.3181/00379727-217-44260
22. Кондратьева Е.И., Воронкова А.Ю., Каширская Н.Ю. и др. Российский регистр пациентов с муковисцидозом: уроки и перспективы. Пульмонология. 2023;33(2):171–181. [Kondratyeva E.I., Voronkova A.Yu., Kashirskaya N.Yu. et al. Russian registry of patients with cystic fibrosis: lessons and perspectives. Pulmonologiya. 2023;33(2):171–181 (in Russ.)]. DOI: 10.18093/0869-0189-2023-33-2-171-181
23. Beier J., Kirsten A.M., Mróz R. et al. Efficacy and safety of aclidinium bromide compared with placebo and tiotropium in patients with moderate-to-severe chronic obstructive pulmonary disease: results from a 6-week, randomized, controlled Phase IIIb study. COPD. 2013;10(4):511–522. DOI: 10.3109/15412555.2013.814626
Авторы
Кузубова Н.А., Склярова Д.Б. - СПб ГБУЗ «ГМПБ No 2», Санкт-Петербург, Россия
Титова О.Н. - ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, Санкт-Петербург, Россия
Теги: ХОБЛ
234567 Начало активности (дата): 13.09.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: ХОБЛ, ремиссия, кашель, мукоцилиарный клиренс,мукоцилиарный клиренс, гиалуроновая кислота
12354567899
Похожие статьи
Влияние хронической обструктивной болезни легких на выживаемость пациентов после хирургического лечения по поводу рака легкогоРентген на дому 8 495 22 555 6 8
Внебольничная пневмония у взрослых
Особенности влияния туберкулеза легких на тяжесть сопутствующей хроническкой обструктивной болезни легких
Показатели системного воспаления у больных внегоспитальной пневмонией на фоне хронической патологии гепатобилярной системы



