 01.06.2025
01.06.2025
Определение гистологического типа рака легких на основе радиомического анализа данных компьютерной томографии
Разработаны различные модели машинного обучения, наилучшими метриками обладали градиентный бустинг для дифференцировки немелкоклеточного рака легкого и мелкоклеточного рака легкого c площадью под ROC-кривой 0,973 и случайный лес на основе трех деревьев для дифференцировки аденокарциномы и плоскоклеточного рака легкого c площадью под ROC-кривой 0,833.
Введение
Рак легких является одним из самых распространенных онкологических заболеваний, занимая первое место по заболеваемости среди других злокачественных новообразований у мужчин в России и первое место по летальным исходам среди мужчин и женщин как в России, так и во всем мире [1].
В настоящее время выделяют следующие гистологические типы рака легких: немелкоклеточный рак (НМРЛ), включающий аденокарциному, плоскоклеточный рак и крупноклеточную карциному, и мелкоклеточный рак (МРЛ). НМРЛ встречается чаще и протекает медленнее, а МРЛ характеризуется меньшей распространенностью, но более быстрым ростом [1,2].
НМРЛ составляет более 80% случаев рака легких. Согласно критериям классификации ВОЗ, аденокарцинома легких (АДК) и плоскоклеточный рак легких (ПКРЛ) являются двумя преобладающими подтипами НМРЛ, которые вызывают около 40 и 30% случаев рака легких соответственно [1,3].
В настоящее время наиболее широко используемыми методами получения ткани опухоли для морфологической верификации являются бронхоскопия и трансторакальная биопсия легких под контролем компьютерной томографии (КТ) [4]. Однако обе эти технологии являются инвазивными с определенными рисками и высокими затратами. Кроме того, для некоторых форм рака легких, прилегающих к средостению, аорте и другим крупным кровеносным сосудам, биопсия под контролем КТ является высокорискованной и сложной, в то время как бронхоскопия имеет ограничение для новообразований, расположенных ниже бронхов 5-го порядка. Также в тех случаях, когда патологический очаг менее 1,5 см, возможность получить материал для исследования существенно снижается [5, 6].
Показатели удельного веса морфологически верифицированного диагноза рака легкого достигают в среднем 88,2% в России, ниже только у опухолей печени и поджелудочной железы. У значительной части больных заболевание верифицируется по данным только цитологического исследования [1, 7].
Стандартная операция при НМРЛ I-II стадии - лобэктомия или билобэктомия. У больных с III стадией хирургический метод сочетается с химиотерапией или лучевым лечением либо их комбинацией [1].
Основным методом терапии МРЛ является химиолучевое лечение. Хирургическое лечение осуществляется только для I стадии и в отдельных случаях при II стадии с обязательной адъювантной химиотерапией [1].
МРЛ является более агрессивной формой рака легкого. Так, у 80% пациентов при первичном обращении выявляют метастатическое (IV стадия или распространенная форма) поражение и лишь у 20% - локализованную форму I-III стадии [1,8].
Прогноз также сильно варьирует в зависимости от гистологического типа и стадии. У больных с операбельным НМРЛ пятилетняя выживаемость может достигать более 70% при стадии IA, но лишь 20% при увеличении стадии до IIIA. Лишь 5% больных МРЛ при первичном обращении имеют I стадию болезни; у таких больных пятилетняя выживаемость составляет 50% [1,9].
В настоящее время “золотым стандартом” диагностики рака легких является КТ органов грудной клетки, по данным которой можно оценить распространенность, размеры и форму патологического очага, однако выявление гистологического типа по данным КТ невозможно [10, 11].
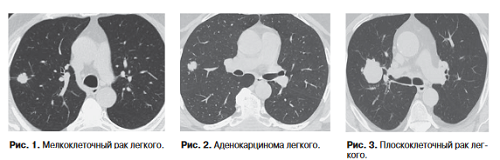
В одном из клинических наблюдений у пациента с периферическим МРЛ (рис. 1) на серии компьютерных томограмм выявлено солидное мягкотканное образование с четкими неровными контурами, которое визуально не отличалось от образования у другого пациента с АДК (рис. 2) аналогичной локализации и размеров. В третьем случае у пациента с периферической формой ПКРЛ (рис. 3) также наблюдалось образование с равномерной структурой и четкими неровными контурами, которое не проявляло характерных признаков, позволяющих визуально отличить ее от двух предыдущих гистологических типов. Модели на основе радиомических признаков на этапе диагностики классифицировали образования так же, как и гистологическое исследование постоперационного материала.
Цель исследования: разработка метода определения наиболее распространенных гистологических типов рака легких на основе текстурного анализа КТ-изображений органов грудной клетки.
Развивающимся направлением обработки КТ- изображений является радиомика - математический анализ данных лучевых методов исследований, позволяющий выявлять особенности текстуры ткани на уровне, недоступном глазу врача- рентгенолога. Применение методов радиомики может способствовать определению гистологического типа рака легкого еще на этапе диагностического поиска [12].
Материал и методы
В исследование были включены данные 200 пациентов, проходивших лечение в РНЦРР с гистологически подтвержденным раком легкого, из них 100 пациентов с МРЛ, 100 пациентов с НМРЛ (50 из них с АДК и 50 - с ПКРЛ).
Критериями включения являлись:
наличие гистологической верификации опухоли;
наличие КТ-исследования органов грудной клетки до хирургического, химио- и лучевого лечения с толщиной среза 1 мм;
возраст пациентов старше 18 лет.
Сегментация областей интереса проводилась вручную тремя врачами-рентгенологами на нативной фазе исследования в бесплатном программном обеспечении 3D-Slicer с функцией выгрузки показателей радиомики из областей интереса.
Для каждого образования было рассчитано 107 радиомических показателей. В исследовании участвовало 148 мужчин и 52 женщины. Средний возраст пациентов составлял 65 [59; 70] лет.
Данные были разделены на обучающую и тестовую выборки с процентным соотношением 60:40%. Для сокращения признакового пространства использовался корреляционный анализ с применением критерия Пирсона, а также проводилась оценка значимости каждого признака мерой feature_importances на основе лесов решений и LASSO-регрессией.
Построение моделей машинного обучения производилось на языке программирования Python 3.10 c использованием специализированных библиотек. Были построены 4 модели машинного обучения: дерево решений, случайный лес, логистическая регрессия и градиентный бустинг (LGBM) - метод, основанный на оптимизации деревьев решений путем настройки градиентного спуска. Для каждой модели были подобраны наиболее эффективные гиперпараметры.
Для выбора наиболее эффективных моделей использовались стандартные метрики машинного обучения: precision, recall, accuracy, ^-мера и площадь под характеристической кривой ROC-AUC.
Результаты исследования
Исследование проводилось в два этапа: на первом этапе осуществлялся поиск наиболее эффективной модели для дифференцировки НМРЛ и МРЛ, на втором этапе - АДК и ПКРЛ.
Дифференцировка НМРЛ и МРЛ
Сокращение признакового пространства
Проведен корреляционный анализ с применением критерия Пирсона для исключения сильно коррелирующих признаков с порогом = 0,8. Таким образом, из 107 показателей радиомики было отобрано 35.
На следующем этапе для отбора наиболее значимых признаков была построена Lasso-регрессия. В результате было получено 2 признака: Skewness (показатели статистики первого порядка) и Gray Level Variance (матрицы GLRLM).
Построение моделей машинного обучения
Результаты работы моделей для обучающей и тестовой выборок представлены в табл. 1.
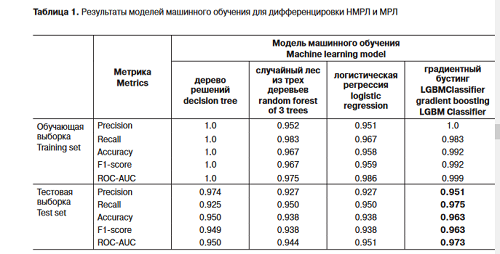
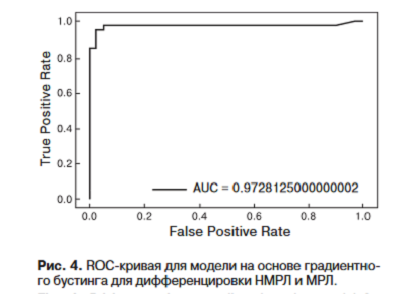
Как видно из табл. 1, наилучшими метриками обладает модель на основе градиентного бустин- га с площадью под ROC-кривой 0,973 на тестовой выборке (рис. 4).
По полученным результатам можно сделать вывод о том, что показатель Skewness, показывающий ассиметрию распределения значений уровня серого относительно среднего, в среднем более чем в 3 раза выше в группе пациентов с МРЛ, что свидетельствует о более неоднородной текстуре МРЛ относительно НМРЛ. Показатель Gray Level Variance (матрицы GLRLM) в группе с МРЛ в среднем в 20 раз выше, чем в группе пациентов с НМРЛ, что показывает более высокую дисперсию интенсивностей длин уровней серого, что также свидетельствует о большей разнородности ткани МРЛ.
Полученные нами метрики диагностической точности подтверждают, что радиомические признаки позволяют с высокой точностью дифференцировать два основных гистологического типа рака легкого по данным первичного КТ-ис- следования.
Дифференцировка АДК и ПКРЛ
Сокращение признакового пространства
Проведен корреляционный анализ с применением критерия Пирсона для исключения сильно коррелирующих признаков с порогом 0,8. Таким образом, из 107 показателей радиомики было отобрано 34.
На следующем этапе была рассчитана мера feature_importances для отбора наиболее значимых признаков. В результате было получено 4 признака: Entropy (статистики первого порядка), Cluster Prominence (матрицы GLCM), Large Area Emphasis (матрицы GLSZM), Idmn (матрицы GLCM).
Построение моделей машинного обучения
Результаты работы моделей для обучающей и тестовой выборок представлены в табл. 2.
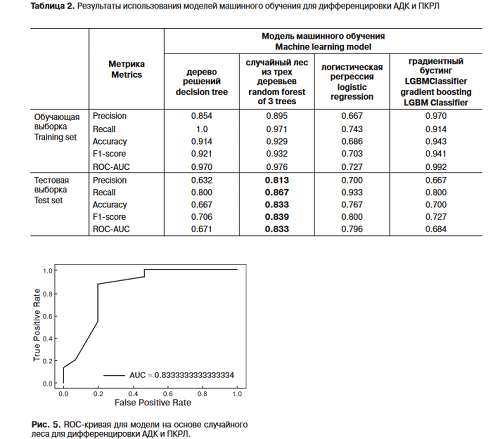
Как видно из табл. 2, наилучшими метриками обладает модель на основе случайного леса с площадью под ROC-кривой 0,833 на тестовой выборке (рис. 5).
По полученным результатам можно сделать обоснованный вывод о том, что показатель Entropy выше в группе АДК, что свидетельствует о большей вариабельности значений уровней внутри опухоли. Показатель Cluster Prominence в группе АДК в 4 раза выше, чем у плоскоклеточных форм рака, что показывает больший разброс значений уровней серого от среднего значения внутри опухоли, что также свидетельствует о большей гетерогенности АДК. Показатель Large Area Emphasis существенно выше у плоскоклеточных форм рака, что подтверждает присутствие внутри них крупных зон одного уровня серого и в целом более грубую текстуру опухоли.
Показатель Idmn также выше в группе с плоскоклеточным раком, что свидетельствует о крупных зонах с локальной однородностью.
Таким образом, АДК как группа отличаются более гетерогенной текстурой, чем плоскоклеточные формы рака легкого.
Полученные нами метрики диагностической точности подтверждают перспективность использования радиомических признаков для дифференциальной диагностики данных типов рака легкого. Однако выявленные нами закономерности менее выражены, чем в группах НМРЛ и МРЛ, что убеждает в необходимости дальнейших исследований в этой области с анализом большего количества данных.
Обсуждение
Вопрос применения радиомики в диагностике рака легкого широко освещен в научной литературе, но исследований, посвященных дифференци- ровке немелкоклеточного и мелкоклеточного рака легкого, встречается не так много. Так, B.T. Chen и соавт. получили для модели дифференцировки АДК и МРЛ площадь под ROC-кривой (ROC-AUC) 0,93 [13].
Как отмечают сами авторы, данное исследование является пилотным и основано только на радиомических данных от небольшой выборки из 69 пациентов. Данные ограничения отсутствуют в работе J. Wang и соавт., где модель классификации периферических АДК и МРЛ, основанная на комбинации клинических, рентгенологических и радиомических данных 240 пациентов, показала ROC-AUC 0,967 в валидационной выборке [14]. Подобные показатели однозначно вызывают интерес, но обе работы имеют важное ограничение - отсутствие в выборках пациентов с плоскоклеточным раком. Эта проблема устранена в исследовании E. Linning и соавт., где созданы три классификационные модели: АДК и ПКРЛ, АДК и МРЛ, МРЛ и ПКРЛ [15]. Авторы также использовали не только нативные КТ-серии, но и артериальные и венозные фазы. Наилучшие результаты (ROC-AUC - 0,864, 0,864 и 0,664 соответственно) получены при использовании радиомических показателей, извлеченных в венозную фазу. Интересно, что в исследовании L. Huanhuan и соавт. с такими же моделями, но при использовании только артериальных фаз ROC-AUC составили 0,879, 0,836, 0,783 соответственно, что, за исключением модели АДК и МРЛ, выше, чем в предыдущем исследовании [16].
В нашей работе мы сознательно отказались от использования контрастных серий. Наше решение основано на предположении, что дополнительная вариабельность в характеристиках изображения может негативно сказаться на воспроизводимости показателей и эффективности работы моделей. Помимо этого, частота проведения контрастных КТ-исследований у пациентов с раком легкого в целом по популяции невысока [1].
Наше исследование наиболее схоже со второй работой E. Linning и соавт., где на основе нативных КТ-серий 278 пациентов были созданы модели классификации НМРЛ и МРЛ, АДК и ПКРЛ, ROC- AUC которых составила 0,741 и 0,655 соответственно, что ниже полученных нами результатов [17].
Интересный подход в дифференцировке новообразований легкого выбрали R. Shah и соавт. [18]. В основу их исследования был положен факт, что среди легочных неоплазий МРЛ обладает наихудшим прогнозом и поэтому должен быть выявлен в первую очередь и как можно раньше. Исходя из этого, авторы отобрали нативные и постконтрастные КТ-серии у пациентов с МРЛ, НМРЛ, а также с доброкачественными и неопухолевыми образованиями. Извлеченные из этих серий показатели радиомики использовались для создания модели дифференцировки между МРЛ и любыми другими образованиями, как злокачественнными, так и доброкачественными.
Наилучшие результаты показал метод случайного леса на основе постконтрастных КТ-серий (ROC-AUC - 0,88). В нашей работе мы не использовали изображения с доброкачественными и неопухолевыми образованиями.
Данное ограничение считаем необходимым, так как вопрос дифференцировки доброкачественных, неопухолевых и злокачественных образований легких является отдельным большим направлением, выходящим за рамки нашего исследования.
Еще один необычный подход встречается в работе J. Qi и соавт., где авторы, используя нативные КТ-серии 417 пациентов, создали единую модель классификации МРЛ, АДК и ПКРЛ c ROC-AUC для каждого гистологического подтипа 0,87, 0,84 и 0,76 соответственно [17]. Хотя эти метрики ниже, чем наши, важно отметить, что данная модель дополнительно обучена локализовать образование на изображении. Этот факт способен значительно упростить ее использование в клинической практике.
В литературе встречаются отдельные примеры исследований, направленных исключительно на дифференцировку АДК и ПКРЛ, в которых ROC- AUC выше, чем у нашей модели [19-21]. Важно отметить, что наша модель классификации АДК и ПКРЛ обладает преимуществом по сравнению с ними, так как она рассчитана на работу в связке c моделью классификации МРЛ и НМРЛ. Хотя в задачи нашего исследования не входила более точная дифференцировка гистологических подтипов НМРЛ, важно отметить, что существует несколько исследований, где, помимо АДК и ПКРЛ, также классифицируются крупноклеточный и недифференцированный рак легкого [22-24]. Данные подтипы встречаются гораздо реже, поэтому не были включены в нашу работу.
Заключение
Нами разработаны модели машинного обучения для дифференцировки НМРЛ и МРЛ c площадью под ROC-кривой 0,973 и дифференцировки АДК и ПКРЛ c площадью под ROC-кривой 0,833. Данные модели классификации обладают высокими метриками диагностической точности, что позволяет говорить о применимости показателей радиомики для дифференцировки различных типов рака легкого уже на этапе диагностического поиска, а также в ситуациях с невозможностью получения материала для гистологического исследования. В дальнейшем планируется расширение выборок с включением более редких форм рака легкого и проведение многоцентровых исследований, что позволит повысить воспроизводимость наших результатов и применимость моделей в клинической практике.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении поисково-аналитической работы и подготовке статьи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов
Солодкий В.А. - ответственность за целостность всех частей статьи, утверждение окончательного варианта статьи.
Нуднов Н.В. - ответственность за целостность всех частей статьи, утверждение окончательного варианта статьи.
Карелидзе Д.Г. -обзор публикаций по теме статьи, концепция и дизайн исследования, сбор и обработка данных, проведение исследования, анализ и интерпретация полученных данных, статистическая обработка данных, подготовка и редактирование текста.
Борисов А.А. - обзор публикаций по теме статьи, концепция и дизайн исследования, сбор и обработка данных, проведение исследования, анализ и интерпретация полученных данных, статистическая обработка данных, подготовка и редактирование текста, подготовка, создание опубликованной работы.
Султанова П.Н. - обзор публикаций по теме статьи, концепция и дизайн исследования, сбор и обработка данных, проведение исследования, анализ и интерпретация полученных данных, статистическая обработка данных, подготовка и редактирование текста, подготовка, создание опубликованной работы.
Иванников М.Е. - обзор публикаций по теме статьи, концепция и дизайн исследования, сбор и обработка данных, проведение исследования, анализ и интерпретация полученных данных, статистическая обработка данных, подготовка и редактирование текста, подготовка, создание опубликованной работы.
Шахвалиева Э.С. - обзор публикаций по теме статьи, концепция и дизайн исследования, сбор и обработка данных, проведение исследования, анализ и интерпретация полученных данных, статистическая обработка данных, подготовка и редактирование текста, подготовка, создание опубликованной работы.
Список литературы
Singh G., Singh A., Dave R. An Update on WHO Classification of Thoracic Tumours 2021-Newly Described Entities and Terminologies. J. Clin. Diagn. Res. 2023; 17 (6):
Рак легкого / Под ред. К.К. Лактионова и В.В. Бредера. М.: “ГРАНАТ”, 2020.
Lung cancer / Eds by K.K. Laktionov, V.V. Breder. M.: “GARNET”, 2020. (In Russian)
Соколов В.В., Соколов Д.В., Пирогов С.С., Каприн А.Д., Рябов А.Б., Рябов А.Б., Кудрявцева Ю.Л., Струнина А.А. Современная бронхоскопическая диагностика раннего центрального рака легкого (обзор литературы). Медицинский совет. 2016; 15: 62-66
Аллахвердиев А.К., Лактионов К.К., Полоцкий Б.Е. и др. Современные возможности видеоторакоскопии в практике торакальной онкологии. Вестник Московского онкологического общества. 2009; 6-8 (559). Allakhverdiev A.K., Laktionov K.K., Polotsky B.E. et al. Modern possibilities of videothoracoscopy in the practice of thoracic oncology. Bulletin of the Moscow Oncological Society. 2009; 6-8 (559). (In Russian)
Бурдюков М.С., Юричев И.Н., Нечипай А.М., Чистякова О.В., Лактионов К.К., Долгушин Б.И., Назлиев П.Б., Маринов Д.Т., Унгиадзе Г.В. Роль тонкоигольной пункции под контролем эндоскопической ультрасонографии в морфологической верификации рака легкого. Клиническая и экспериментальная хирургия. 2015; 4: 63-72.
Burdyukov M.S., Yurichev I.N., Nechipai A.M. et al. The role of fine needle puncture under the control of endoscopic ultrasonography in the morphological verification of lung cancer. Clinical and Experimental Surgery. 2015; 4: 63-72. (In Russian)
Tang Y., Tian S., Chen H. et al. Transbronchial lung cryobiopsy for peripheral pulmonary lesions. A narrative review. Pulmonology. 2024; 30 (5): 475-484.
Lee J.H., Saxena A., Giaccone G. Advancements in small cell lung cancer. Semin. Cancer Biol. 2023; 93: 123-128.
Megyesfalvi Z., Gay C.M., Popper H. et al. Clinical insights into small cell lung cancer: Tumor heterogeneity, diagnosis, therapy, and future directions. CA Cancer J. Clin. 2023; 73 (6): 620-652.
Лагкуева И.Д., Черниченко Н.В., Котляров П.М., Солдатов Д.Г., Солодкий В.А. Диагностика и дифференциальная диагностика очаговых образований легких. Пульмонология. 2024; 34 (4): 533-543.
Lagkueva I.D., Chernichenko N.V., Kotlyarov P.M. et al. Diagnosis and differential diagnosis of focal lung formations. Pulmonology. 2024; 34 (4): 533-543
Haga A., Takahashi W., Aoki S. et al. Classification of early stage non-small cell lung cancers on computed tomographic images into histological types using radiomic features: interobserver delineation variability analysis. Radiol. Phys. Technol. 2018; 11: 27-35.
Yan M., Wang W. A non-invasive method to diagnose lung adenocarcinoma [published correction appears in Front. Oncol. 2020;
Chen B.T., Chen Z., Ye N. et al. Differentiating Peripherally- Located Small Cell Lung Cancer From Non-small Cell Lung Cancer Using a CT Radiomic Approach. Front. Oncol. 2020; 10: 593.
Wang J., Zhong F., Xiao F. et al. CT radiomics model combined with clinical and radiographic features for discriminating peripheral small cell lung cancer from peripheral lung adenocarcinoma. Front. Oncol. 2023; 13: 1157891.
Linning E., Lin L., Li L. et al. Radiomics for Classifying Histological Subtypes of Lung Cancer Based on Multiphasic Contrast-Enhanced Computed Tomography. J. Comput. Assist. Tomogr. 2019; 43 (2): 300-306.
Li H., Gao L., Ma H. et al. Radiomics-Based Features for Prediction of Histological Subtypes in Central Lung Cancer. Front. Oncol. 2021; 11: 658887.
Qi J., Deng Z., Sun G. et al. One-step algorithm for fast- track localization and multi-category classification of histological subtypes in lung cancer. Eur. J. Radiol. 2022; 154: 110443.
Shah R.P., Selby H.M., Mukherjee P. et al. Machine Learning Radiomics Model for Early Identification of Small-Cell Lung Cancer on Computed Tomography Scans. JCO Clin. Cancer. Inform. 2021; 5: 746-757
Liang B., Tong C., Nong J., Zhang Y. Histological subtype classification of non-small cell lung cancer with radiomics and 3D convolutional neural networks. J. Imaging Inform. Med. 2024.
Chen Z., Yi L., Peng Z. et al. Development and validation of a radiomic nomogram based on pretherapy dual-energy CT for distinguishing adenocarcinoma from squamous cell carcinoma of the lung. Front. Oncol. 2022; 12: 949111.
Zhu X., Dong D., Chen Z. et al. Radiomic signature as a diagnostic factor for histologic subtype classification of non-small cell lung cancer. Eur. Radiol. 2018; 28 (7): 2772-2778.
Kuang B., Zhang J., Zhang M. et al. Advancing NSCLC pathological subtype prediction with interpretable machine learning: a comprehensive radiomics-based approach. Front. Med. (Lausanne). 2024; 11: 1413990.
Patil R., Mahadevaiah G., Dekker A. An approach toward automatic classification of tumor histopathology of nonsmall cell lung cancer based on radiomic features. Tomography. 2016; 2 (4): 374-377.
Liu J., Cui J., Liu F. et al. Multi-subtype classification model for non-small cell lung cancer based on radiomics: SLS model. Med Phys. 2019; 46 (7): 3091-3100.
Солодкий Владимир Алексеевич - академик РАН, доктор мед. наук, профессор, директор ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва.
Нуднов Николай Васильевич - доктор мед. наук, профессор, заместитель директора по научной работе, заведующий научноисследовательским отделом комплексной диагностики заболеваний и радиотерапии ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России; профессор кафедры рентгенологии и радиологии ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования” Минздрава России; заместитель директора по научной работе, профессор кафедры онкологии и рентгенорадиологии ФГАОУ ВО “Российский университет дружбы народов имени Патриса Лумумбы” Минобрнауки России, Москва.\
Карелидзе Давид Георгиевич - клинический ординатор по специальности “рентгенология” ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России, Москва
Борисов Александр Александрович - младший научный сотрудник ГБУЗ “Научно-практический клинический центр диагностики и телемедицинских технологий ДЗ города Москвы”, Москва.
Султанова Пери Назимовна - клинический ординатор по специальности “рентгенология” ФГБУ “Российский научный центр рентгенорадиологии” Минздрава России”, Москва.
Иванников Михаил Евгеньевич - врач-рентгенолог ГБУЗ города Москвы “Городская клиническая больница имени А.К. Ерамишанцева ДЗ города Москвы”, Москва.
Шахвалиева Элина Саид-Аминовна - врач-рентгенолог ГБУЗ города Москвы “Детская городская клиническая больница № 9 им. Г.Н. Сперанского ДЗ города Москвы”, Москва.
Vladimir A. Solodkiy - Academician of the Russian Academy of Sciences, Doct. of Sci. (Med.), Professor, Director of the Russian Scientific Center of Roentgenoradiology of the Ministry of Healthcare of the Russian Federation, Moscow.
Nikolay V. Nudnov - Doct. of Sci. (Med.), Professor, Deputy Director for Scientific Work, Head of the Research Department for Complex Diagnostics of Diseases and Radiotherapy, Russian Scientific Center of Roentgenoradiology of the Ministry of Healthcare of the Russian Federation;
Professor, Department of Roentgenoradiology and Radiology, Russian Medical Academy of Continuous Professional Education of the Ministry of Healthcare of the Russian Federation; Professor, Department of Oncology and Radiology, Peoples' Friendship University of Russia named after Patrice Lumumba of the Ministry of Science and Higher Education of the Russian Federation, Moscow,
David G. Karelidze - clinical resident in the specialty “Radiology” of the Russian Scientific Center of Roentgenoradiology of the Ministry of Healthcare of the Russian Federation, Moscow.
Aleksandr A. Borisov - Junior researcher at the Scientific and Practical Center for Diagnostics and Telemedicine Technologies, Moscow.
Peri N. Sultanova - clinical resident in the specialty “Radiology” of the Russian Scientific Center of Roentgenoradiology of the Ministry of Healthcare of the Russian Federation, Moscow.
Mikhail E. Ivannikov - radiologist at the A.K. Yeramishantsev City Clinical Hospital of Moscow Healthcare Department, Moscow
Elina S.-A. Shakhvalieva - radiologist at the G.N. Speransky Children's City Clinical Hospital No. 9 of Moscow Healthcare Department, Moscow.
Теги: рак легкого
234567 Начало активности (дата): 01.06.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: рак легкого; виртуальная биопсия; радиомика
12354567899
Похожие статьи
Роль изменений ремоделирования костной ткани в патогенезе остеопении у больных хроническим лимфоцитарным лейкозомРентген на дому 8 495 22 555 6 8
Остеопороз
Внебольничная пневмония у взрослых
Результаты хирургического лечения немелкоточного рака легкого у пациентов, перенесших COVID-19



