 10.04.2025
10.04.2025
Повторные реконструктивные операции при инфекции синтетических протезов в аорто-подвздошно-бедренной позиции
Методом выбора при инфицировании синтетических протезов и эндопротезов в аорто-подвздошно-бедренной позиции является использование принципов активного хирургического лечения, с полным удалением инфицированного синтетического протеза с одномоментной заменой in-situ аутовенозными шунтами из поверхностных бедренных вен, активной до- и послеоперационной антибиотикотерапией.
Введение
Оперативные вмешательства на инфраренальном отделе брюшной аорты и подвздошных артериях считаются наиболее распространенными в практике сосудистых отделений страны. Среди всех видов операций ведущее место занимает аорто-бедренное бифуркационное шунтирование (АББШ) или протезирование (АББП) с применением синтетических протезов различных производителей. Результаты лечения при тотальном инфицировании аортобедренно-бифуркационного протеза неутешительны, общая летальность по данным разных авторов составляет при этом 16,8-88,0 % [1, 2]. В случае возникновения осложнений в раннем периоде смертность достигает 43-50 %, поздних -28,6 % [3].
Цель – улучшение результатов хирургического лечения пациентов с инфекцией аортобедренно-бифуркационного протеза
Активная тактика лечения данной группы больных предусматривает обязательное раннее, до развития аррозивного кровотечения и сепсиса, удаление/резекцию инфицированного протеза с одномоментной или отсроченной реваскуляризацией конечности или ампутацией. Сторонников этой тактики большинство [4, 5]. Удаление инфицированного эксплантата большинством авторов считается обязательным [6].
Самым актуальным вопросом при хирургическом лечении больных с инфицированным аорто-бедренным синтетическим эксплантантом остается выбор материала нового протеза. Так, Torsello и соавторы [7] использовали дакроновый протез, пропитанный желатином с рифампицином, для протезирования аневризм, вызванных золотистым стафилококком.
Также встречаются сообщения об удачном решунтировании через очаг воспаления с использованием аллотрансплантатов [8, 9]. Авторы, использующие эту методику, сообщают о недостаточной стойкости аллографтов к инфекции [9, 10].
Использование эндартерэктомированных аутоартерий для замены инфицированного синтетического протеза встречается как самостоятельный метод [11], так и в случае невозможности использовать аутовены нижних конечностей [12]. Для замены инфицированных в паховой области протезов аорто- и подвздошно-бедренного сегментов используют эверсированные поверхностные бедренные артерии этой же зоны.
Использование аутовен при наличии гнойной раны в условиях клиники и эксперимента позволяет избежать аррозивных кровотечений почти полностью, вплоть до 100 % успеха [2, 3]. Использование аутовен следует разделить на варианты: во- первых, применяются подкожные вены, во-вторых, - глубокие вены бедра: в частности, поверхностные бедренные вены.
Большие подкожные вены имеют больший диаметр, но их использование для замены аорты и подвздошно-бедренных инфицированных протезов также осложняет их выраженное несоответствие диаметров. Поверхностная бедренная вена в этом отношении более предпочтительна [13].
Также различаются мнения о порядке выполнения этапов хирургического лечения при замещении инфицированного протеза: через очаг инфекции аутотрансплантатом или экс- транатомически синтетическим шунтом. Так, Леменев В.Л. и соавторы [3] осуществляли внеочаговое шунтирование и по возможности перевязывали на протяжении сосуды, с которыми анастомозирован вовлеченный в гнойный процесс синтетический имплантат. Вторым этапом, который производят через 2-3 недели с момента прекращения кровотока по эксплантату, подлежащему удалению, захватывают стенку протеза в гнойной ране и путем тракции просто отрывают его от проксимального и дистального анастомозов.
Некоторые авторы настаивают на одновременной эктраанатомической реконструкции и удалении инфицированного синтетического имплантата [14].

Но внеанатомическое шунтирование несет опасность развития синдрома перетока в той или иной степени [3]. После удаления инфицированного синтетического аортобифеморального протеза для внеанатомического шунтирования использовали протез Goore- tex из политетрафлюороэтилена. В 16 описанных случаях неудач не было.
Однако, при лучших результатах в раннем послеоперационном периоде отдаленные результаты экстраанатомических шунтирований уступают анатомическим реконструкциям [15, 16, 17].
Oбобщая немногочисленные данные литературы по данному вопросу можно сделать вывод, что лучшие результаты получены при замене in situ на новый синтетический протез.
Но, имеющиеся в отдаленном периоде повторные инфицирования, несмотря на антибиотикотерапию, заставляют искать новые пути. Экстраанатомические шунтирования характеризуется высокой частотой тромбозов протезов в ближайшем и отдаленном послеоперационном периодах. У трети выживших пациентов из-за ишемии требуется ампутация конечности. Наиболее стойкими к реинфицированию являются аутогенные материалы, а при их расположении in situ ишемических осложнений меньше.
L. Kubicek с соавторами на ежегодной конференции ESVS в Гамбурге (2019 г.) поделились опытом 35 повторных операций АББП с использование поверхностных бедренных вен. Благодаря этой тактики авторам удалось снизить послеоперационную летальность до 6,3 %, а частоту высоких ампутаций до 7,8 %.
Инфекция эндотрнасплантатата - редкое осложнение, заболеваемость <1% [15, 16]. Частота инфекции сосудистого трансплантата брюшной аорты у пациентов с аневризмой аорты, перенесших открытую операцию и эндоваскулярное лечение аневризмы, не имеет существенной разницы. Большинство авторов считают, что одной из ведущих причин развития инфекции эндопротезов становится формирование аорто-кишечных фистул, которые выявляются в 1 %-2 % до 23,9 % случаях [15, 17, 18]. В многоцентровом реестре в США, включающем 180 инфицированных стент-графтов, сообщалось о 43 инфекций эндотронсплантата (23,9 %) с аорто-кишечной фистулой [18].
Развитие инфекции приводит к таким осложнениям, как кровотечение, что стало наиболее частым симптомом (71,7 %), сепсис (39,7 %) и геморрагический шок (33,1 %). В связи с чем, актуальность проблемы не вызывает сомнения. Безусловно, достигнуты большие успехи в лечении инфекции синтетических протезов в условиях общей воспалительной реакции организма благодаря новейшим антибактериальным препаратам, применению различных гомографтов, аутографтов и протезов с ионами серебра, но опыт их применения в отдельности пока еще недостаточен, а результаты нельзя считать удовлетворительными, чтобы рекомендовать их к широкому применению[3, 6, 7, 12, 13]. Что касается лечения инфекции эндопротезов, то в литературе встречаются единичные сообщения, свидетельствующие о высокой хирургической летальности и неудовлетворительных результатах [15, 16, 17].
Материалы и методы
В отделении сосудистой хирургии городской клинической больницы им. В.В. Вересаева в период с 2002 года по 2022 г. были повторно оперированы на аорто-подвздошно-бедренной зоне 70 пациентов (66 мужчин и 4 женщины) в связи с инфицированием аорто-бедренных бифуркационных протезов (68 больных) и эндографтов (2 больных). 15 (21,4 %), включая эндопротезирование, пациентам первичные операции были выполнены по поводу аневризм инфраренальной аорты, остальным в связи с окклюзионно-стенотическими поражениями брюшной аорты и подвздошных артерий.
42 (60 %) пациентов были реоперированы в ближайшем послеоперационном периоде, 28 - в отдаленные сроки после первичной операции. Из них 3 пациента уже были повторно оперированы в связи с инфекцией бифуркационных протезов с повторным замещением синтетическими протезами, импрегнированными ионами серебра. У 37 (84 %) пациентов первичные операции были выполнены по поводу окклюзион- но-стенотических поражений аорто-подвздошной зоны. У 13 (18, 5%) больных выполнялась резекция аневризм инфраренального отдела брюшной аорты и подвздошных артерий. 38 (69 %) из 55 больных с окклюзионно-стенотическими поражениями брюшной аорты и артерий конечностей были оперированы в связи с хронической ишемией 3-й и 4-й степени по классификации Фонтейна-Покровского.
Таким образом, большинство пациентов были оперированы с использованием синтетических протезов в условиях гнойнонекротических процессов на дистальных отделах конечностей, т.е. при состояниях высокой угрозы потери конечностей.
Следует отметить, что при первичной операции использовались синтетические протезы всех известных производителей, как тканные и вязаные, так и ПТФЭ.
По данным анализов инфицирование бифуркационных протезов из ПТФЭ наблюдались только в ближайшем послеоперационном периоде.
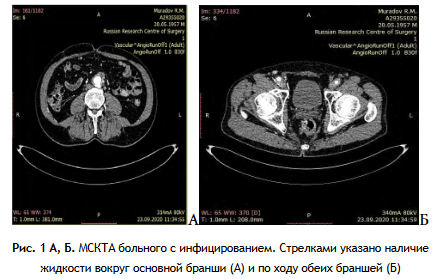
Диагностика инфицирования синтетических протезов основывались на клинической картине, данных ультразвукового исследования, мультиспиральной КТ, двукратного микробиологического исследования содержимого парапротезного пространства и крови, маркеров сепсиса.
Инфекция сосудистых протезов, как правило, характеризовалась сочетанием трех постоянных признаков: жидкость в парапротезном пространстве по данным УЗИ и МСКТА, гнойные свищи в области послеоперационных ран, положительный микробиологический анализ отделяемого из ран (табл. 1).
Микробиологическое исследование парапротезной жидкости и содержимого из области дистальных анастомозов показало, что доминирующим инфекционным агентом стал MRSA (метициллинрезистентный золотистый стафилококк), который выявлен у 41 (58,5 %) пациентов, S. Epidermidis был высеян у 9 (12,8 %) больных, Proteus Vulgaris также у 9 (12,8 %) больных, Pseudomonas aeruginosa у 7 (10 %), E.Coli у 4, сочетание 2 микроорганизмов было отмечено в 7 (10 %) наблюдениях.
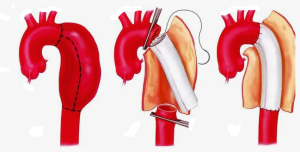
После проведения предоперационной подготовки все 70 пациентов были оперированы в объеме удаления синтетического аорто-бедренного бифуркационного протеза, аортобедренное бифуркационное аутовенозное репротезирование (ре-шунтирование - 4) «in situ».
Операция состоит из 3 основных этапов.
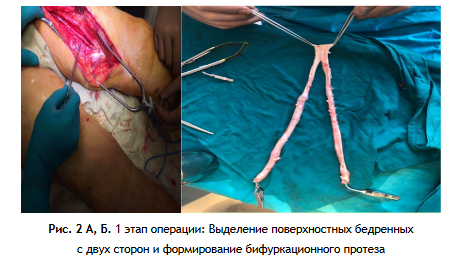
1-й этап: забор поверхностной бедренной вены (ПБВ) и подколенной вены (ПКВ) на обеих нижних конечностях от устья глубокой вены бедра (ГВБ) до уровня щели коленного сустава. Длина каждой забранного аутовенозного трансплантата составляла в среднем 28-33 см (рис. 2 А, Б).
Следует отметить зависимость от диаметра инфраренального отдела аорты и необходимой длины браншей аутовенозного протеза для дистальных анастомозов с общими или глубокими бедренными артериями (рис. 3).
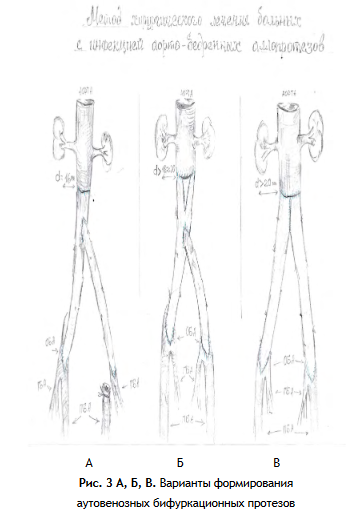
Вариант А формируется при диаметре аорты до 16 мм и дистальных анастомозах на глубокие артерии бедра или с отдельной реконструкции ПБА и ГБА, вариант Б с клиновидной аутовенозной вставкой применяется при диаметре аорты до 20 мм и пролонгированных дистальных анастомозах, вариант В, как наиболее универсальный использовался при любом диаметре аорты и дистальных анастомозах на общие бедренные артерии. И в 2 наблюдениях, в связи с недостаточной длиной поверхностных бедренных вен, использовалась в качестве основной бранши внутренняя яремная вена.
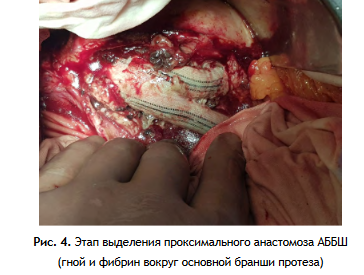
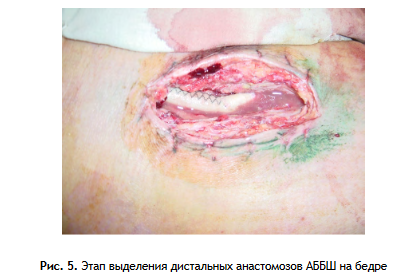
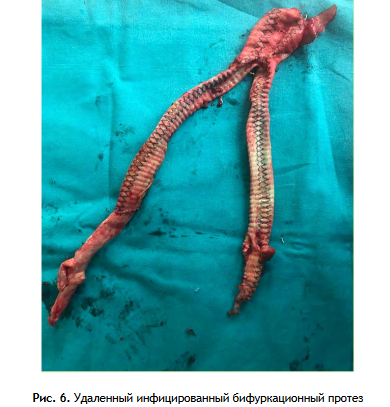
2 этап: Релапаротомия или лапаротомия (если при первой операции был использован забрюшинный доступ), выделение проксимального анастомоза (рис. 4), с последующим выделением дистальных анастомозов АББШ на бедре (рис. 5). Этап завершается полным удалением бифуркационного протеза (рис. 6.).
Основной задачей при выделении проксимального анастомоза является выделение аорты в ее неизмененном участке для надежного контроля и профилактики массивного кровотечения, а лишь затем выполнение удаления протеза. Очень важно после удаления бифуркационного протеза произвести тщательную механическую, физическую и химическую санацию ложа инфицированного графта
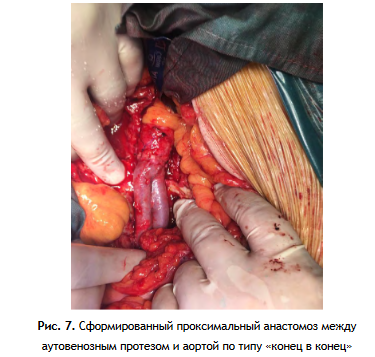
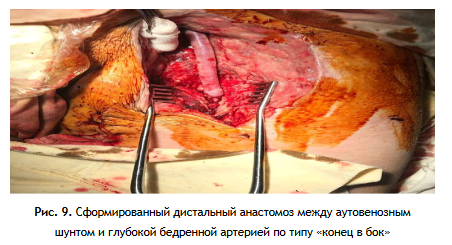
3 этап: Формирование проксимального анастомоза аутовенозного шунта (протеза) с аортой по типу «конец в конец» или «конец в бок», проведение браншей протеза на бедра и формирование дистальных анастомозов (рис. 7, 8 А, Б, 9).
 .Необходимо отметить, что шунтирующие операции вНеобходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде.озможны при инфицировании протезов в раннем послеоперационном периоде. НеобходимНеобходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде.о отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном п Необходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периодеНеобходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде
.Необходимо отметить, что шунтирующие операции вНеобходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде.озможны при инфицировании протезов в раннем послеоперационном периоде. НеобходимНеобходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде.о отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном п Необходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периодеНеобходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде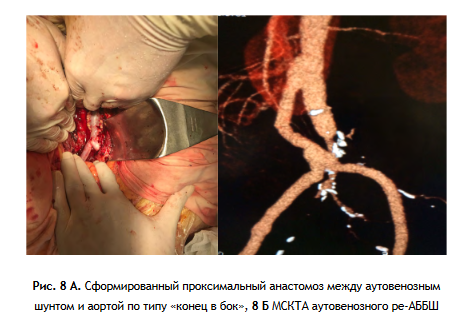
Необходимо отметить, что шунтирующие операции возможны при инфицировании протезов в раннем послеоперационном периоде
Оперативное вмешательство завершается дренированием брюшной полости, бедренных ран, отдельно ложа после поверхностных бедренных вен и области дистальных анастомозов. Для профилактики послеоперационной лимфорреи используется препарат «Лимфоблок» в дозировке по 25 мл на рану.
Результаты
В ближайшем послеоперационном периоде погибло 7 (10%) больных. Анализ показал, что основной причиной летального исхода был сепсис с развитием полиорганной недостаточности - 6 и лишь у 1 пациента причиной летального исхода стал инфаркт миокарда на 12-е сутки после операции.
Характер послеоперационных осложнений представлен в таблице 2.
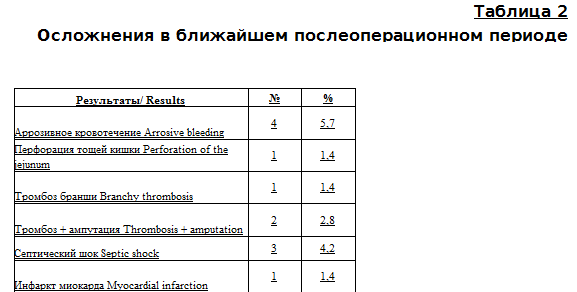
Как видно из таблицы, наиболее частым осложнением послеоперационного периода стало аррозивное кровотечение на фоне сепсиса - 3 (4,2 %), без сепсиса - 1 (1,5 %). В одном наблюдении у пациента с сепсисом на 4-е сутки после операции развилась клиническая картина перитонита, причиной которого стали острые язвы тощей кишки с перфорацией.
Тромбоз одной из браншей протеза развился в 3 (4,2 %) наблюдениях: одному пациенту успешно была выполнена тромбэктомия, в 2 других в связи с безуспешностью восстановления кровообращения - ампутация на уровне бедра. Следует отметить, что в послеоперационном периоде не было клинических проявлений острой венозной недостаточности ни в одном наблюдении, но во всех наблюдениях отмечалась лимфоррея в течение 2-4 недель. С 2021 года для профилактики лимфорреи успешно применяется препарат «Лимфоблок».
В послеоперационном периоде всем пациентам проводилась комплексное лечение: антибактериальная в соответствии с результатами посева, коррекция гомеостаза и сопутствующей патологии. С целью контроля аутовенозных трансплантатов перед выпиской проводилась МСКТ-ангиография.
Отдаленные результаты прослежены у 57 пациентов в сроки от 8 месяцев до 13 лет.
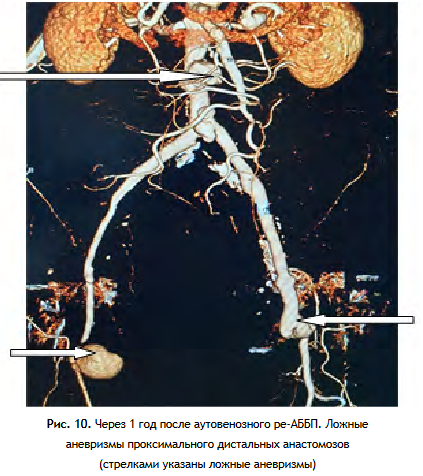
В течение года после операции у 2 больных образовались аневризмы дистальных и проксимального анастомозов (рис. 14) и у 2 развился тромбоз одной из браншей протеза. Эти больные были оперированы: резекция аневризм с реконструкцией дистальных анастомозов аллонадставками, тромбэктомия с реконструкцией дистальных анастомозов аллонадставкой - 1, аутовенозной надставкой - 1. Ложная аневризма проксимального анастомоза имела размеры до 3,0-2,5-2,8 см, не увеличивалась в течение длительного времени (6 лет), поэтому было решено не проводить активных эндоваскулярных процедур.
Во всех наблюдениях кровообращение в конечностях было восстановлено. У 3 пациентов тромбоз бранши бифуркационного протеза развился через 4, 5 и 9 лет соответственно вследствие неудовлетворительного дистального русла. Из них двум пациентам была выполнена ампутация на уровне бедра, у одного больного симптомы острой ишемии регрессировали на фоне консервативного лечения.
Таким образом, проходимость аутовенозных протезов в отдаленные сроки составила 92,5 %, что подтверждалось выполнением МСКТ-ангиографии (рис. 11 А, Б).
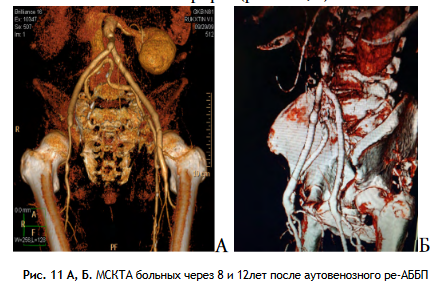
Таким образом, проходимость аутовенозных протезов в отдаленные сроки составила 92,5 %, что подтверждалось выполнением МСКТВсего за время наблюдения в отдаленном послеоперационном периоде умерло 3 больных от причин, несвязанных с оперативным вмешательством и инфекцией: ОНМК по геморрагическому типу - 1, онкология - 1, цирроз печени - 1.
Использование в качестве бифуркационного протеза аутоматериала из поверхностных бедренных вен является рутинным в нашей клинике при замене инфицированных синтетических бифуркационных или линейных аорто-бедренных протезов.
Следует лишь подчеркнуть, что выделение брюшной аорты, а точнее шейки аневризмы характеризовалось выраженными трудностями из-за инфильтративного процесса, который распространялся на почечные и висцеральные сосуды чего мы не наблюдали при стандартных инфекциях синтетических протезов.
Заключение
Таким образом, по нашему мнению, методом выбора при инфицировании синтетических протезов и эндопротезов в аорто-подвздошно-бедренной позиции является использование принципов активного хирургического лечения, с полным удалением инфицированного синтетического протеза с одномоментной заменой in-situ аутовенозными шунтами из поверхностных бедренных вен, активной до- и послеоперационной антибиотикотерапией.
Список литературы
Клиническая ангиология. Руководство для врачей. Под редакцией академика РАМН Покровского А.В. М. : Медицина, 2009. Т. 1, 2. 808 с.
Белов Ю.В., Степаненко А.Б. Повторные реконструктивные операции на аорте и магистральных артериях. М. : МИА. 2009. 175 с.
Щербюк А.Н., Индербиев Т.С., Ульянов Д.А., Васильев СВ. Повторные реконструктивные операции на аорте и артериях нижних конечностей. Хирургия, 2002. № 9. С. 64-69.
Леменев В. Л., Михайлов И.П. Хирургическая тактика при инфицировании сосудистого протеза. Хирурги, 1997. № 3. С. 10-12.
Hart J.P., Eginton M.T., Brown K.R., Seabrook G.R., Lewis B.D., Ed- miston C.E., Jr., et al. Operative strategies in aortic graft infections: is complete graft excision always necessary? Ann Vasc Surg., 2005, Mar; № 19(2), рр. 154-160.
Biro G., Szeberin Z., Nemes A., Acsady G. Cryopreserved homo-graft and autologous deep vein replacement for infrarenal aorto and iliaco-fem- oral graft infection: early and late results. J Cardovasc Surg (Torino), 2011, № 52(2), рр. 169-176.
Pupka A., Skora J., Janczak D., et al. In situ revascularization with silver coated polyester prosthesis and arterial homografts in patients with aortic graft infection - a prospective, comparative, single-centre study. Europen Journal of Vascular et Endovascular Surgery, 2011, Jan; № 41(1), р^ 61-67.
Seeger, J.M., Pretus, H.A., Welborn, M.B., Ozaki, C.K., Flynn, T.C., and Huber, T.S. Long-term outcome after treatment of aortic graft infection with staged extra-anatomic bypass grafting and aortic graft removal. (discussion 459-60). J Vasc Surg., 2000, № 32, рр. 451-459.
McKinsey J.F. Extra-Anatomic Reconstruction. Surgical Clinics of North America, 1995, № 75, (4,5), рр. 731-740.
Oderich, G.S., Panneton, J.M., Bower, T.C., Cherry, K.J. Jr, Rowland, C.M., Noel, A.A. et al. Infected aortic aneurysms: aggressive presentation, complicated early outcome, but durable results. J Vasc Surg., 2001, № 34, рр. 900-908.
Frankini A.D.; Lichtenfels E.; Frankini A.; Frankini T. Extra-anatomical arterial bypass of the aortoiliac segment: 15-year experience. J. vasc. bras., 2007, vol. 6, № 3, рр. 240-210.
Torsello G., Sandmann W In situ replacement of infected vascular prostheses with rifampin-soaked vascular grafts: Early results. J VAsc Surg., 1993, № 17, рр. 768-73.
Gabriel M., Pukacki F., Dzieciuchowicz L., Oszkinis G., Checins- ki P. Cryopreserved arterial allografts in the treatment of prosthetic graft infections. European Journal of Vascular and Endovascular Surgery, 2004, № 27(6), рр. 590-596.
Benjamin M.E., Cohn E.J. Jr, Purtill W.A., Hanna D.J., Lilly M.P., Flinn WR. Arterial reconstruction with deep leg veins for the treatment of mycotic aneurysms. J Vasc Surg., 1999, Dec; № 30(6), рр. 1004-1015.
.Argyriou C., Georgiadis G.S., Lazarides M.K., Georgakarakos E., Antoniou G.A. Endograft infection after endovascular abdominal aortic aneurysm repair: a systematic review and meta-analysis. J Endovasc Ther., 2017, № 24, рр. 688-697.
Smeds M.R., Duncan A.A., Harlander-Locke M.P., Lawrence P.F., Lyden S., Fatima J. et al. Treatment and outcomes of aortic endograft infection. J Vasc Surg., 2016, № 63, рр. 332-340.
Vogel T.R., Symons R., Flum D.R. The incidence and factors associated with graft infection after aortic aneurysm repair. J Vasc Surg., 2008, № 47, рр. 264-269.
Kakkos S.K., Bicknell C.D., Tsolakis I.A., Bergqvist D. Hellenic Cooperative Group on Aortic Surgery. Editor’s Choice - Management of secondary aorto-enteric and other abdominal arterio- enteric fistulas: a review and pooled data analysis. Eur J Vasc Endovasc Surg., 2016, № 52, рр. 770-786.
Сведения об авторах
Хамитов Феликс Флюрович - д.м.н., профессор, заведующий отделением сосудистой хирургии ГБУЗ ГКБ им. В.В. Вересаева ДЗМ. 127644, Россия, Москва, ул. Лобненская, д. 10
Маточкин Евгений Александрович - к.м.н., сердечно-сосудистый хирург отделения сосудистой хирургии ГБУЗ ГКБ им. В.В. Вересаева ДЗМ 127644, Россия, Москва, ул. Лобненская, д. 10
Чельдиев Казбек Валерьевич - к.м.н., врач хирург ГБУЗ ГКБ им. В.В. Вересаева ДЗМ. 127644, Россия, Москва, ул. Лобненская, д. 10
Фомин Владимир Сергеевич - к.м.н., доцент, хирург ГБУЗ ГКБ им. В.В. Вересаева. 127644, Россия, Москва, ул. Лобненская, д. 10
Белышев Сергей Юрьевич - врач, к.м.н., заместитель главного врача по анестезиологии и реанимации ГБУЗ г. Москвы «Городская клиническая больница им. В.В. Вересаева ДЗМ». 127644, Россия, Москва, ул. Лобненская, д. 10
Теги: сепсис
234567 Начало активности (дата): 10.04.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: аорто-бедренное бифуркационное шунтирование, синтетические протезы, сепсис, аутовенозные шунты
12354567899
Похожие статьи
Повреждения тазового кольцаРентген на дому 8 495 22 555 6 8
Переломы лодыжек
Переломы дистального отдела костей голени
Внебольничная пневмония у взрослых



