 20.11.2024
20.11.2024
Влияние цинксодержащего кальций-фосфатного покрытия на остеоинтеграцию чрескожных имплантатов для протезирования конечностей
Повышение интеграции чрескожных имплантатов является важной задачей для их применения в клинической практике
ВВЕДЕНИЕ
Чрескожное остеоинтеграционное протезирование является развивающимся методом лечения пациентов с потерей конечностей [1, 2]. К настоящему времени параллельно с двухэтапной технологией протезирования развивается одноэтапная процедура [3, 4], требующая новых решений для улучшения остеоинтеграции имплантируемой части, т.к. проблема стабильности имплантата в условиях одноэтапного процесса является ключевой [5].
Ранее нами показано, что эффективная остеоинтеграция чрескожных имплантатов при одноэтапной процедуре может достигаться за счёт применения дополнительных фиксирующих имплантат устройств в совокупности с возможностью этих устройств обеспечивать механическую компрессию имплантата [6]. Другой вариант для реализации одностадийного ускоренного протокола остеоинтеграции — использование имплантатов типа Press-Fit [7].
Однако такие подходы являются недостаточными для оптимальной остеоинтеграции имплантатов в условиях одноэтапности процесса. Поэтому возникла необходимость разработки дополнительных технологий, стимулирующих процесс интеграции чрескожных имплантатов, в том числе за счет модификации поверхности имплантируемой части [8, 9]. Так, одним из способов повышения остеоинтеграции имплантатов является нанесение на его поверхность биоинертного оксидного или биоактивного кальций-фосфатного покрытия [10]. Среди методов нанесения покрытий на имплантаты на основе титана следует выделить метод микродугового оксидирования, который позволяет импрегнировать в состав покрытия дополнительные эссенциальные микроэлементы, обеспечивающие положительные для остеогенеза эффекты. В ряде работ продемонстрировано положительное влияние на остеоинтеграционные процессы внедрения в состав кальций-фосфатного покрытия ионов цинка, стронция и кремния [11-13].
Цель работы — оценка остеоинтеграции титановых чрескожных имплантатов с кальций-фосфатным покрытием, содержащим ионы цинка.
МАТЕРИАЛЫ И МЕТОДЫ
Изделия. В работе использованы имплантаты из сплава Ti6Al4V для протезирования культей трубчатых костей [14] (рис. 1, а). На рабочую поверхность имплантата наносили цинксодержащее кальцийфосфатное (КФ) покрытие (Zn-КФ) с помощью метода дугового оксидирования (рис. 1, б). Имплантаты изготавливали из порошка Ti6Al4V со средним размером частиц 23,5 мкм производства фирмы Advanced Powders&Coatings Inc. (Канада) методом селективного лазерного сплавления на 3D-принтере EOS EOSINT M 280 (Германия). Нанесение покрытий на имплантаты проводили на полупромышленной установке Micro-Arc 3.0.

Для нанесения покрытий имплантаты погружали в ванну с электролитом. Осаждение покрытий проводили в электролите-суспензии состава (мас. %): H3PO4 — 27; CaCO3 — 7; синтетический цинк- замещенный гидроксиапатит (Zn-ГА) (Ca10Zn9(PO4)6(OH)2) — 5; остальное — дистиллированная вода. Zn-ГА в нанокристаллическом состоянии со средним размером зерен 30-50 мкм синтезирован механохимическим методом в Институте химии твердого тела и механохимии СО РАН [15]. Параметры нанесения покрытий: анодное напряжение — 200 В, длительность импульсов — 100 мкс, частота импульсов — 50 Гц, длительность обработки — 5 минут. Толщину покрытий определяли с помощью цифрового микрометра Зубр (точность измерений 1 мкм). Массу покрытий измеряли на аналитических весах CAS CAUX-220 (точность измерений 1 мг). Шероховатость поверхности определяли с помощью контактного «Профилометра-296» по параметру Ra, как среднеквадратичное отклонение профиля в пределах базовой длины. Масса сформированных на имплантатах покрытий составила (29,3 ± 2,1) мг, толщина — (33,5 ± 2,8) мкм, шероховатость Ra — (2,3 ± 0,5) мкм (рис. 1, б). Морфология, структура, состав и свойства сформированных покрытий описаны ранее [11, 13].
Все изделия для имплантации поступали в индивидуальных упаковках не стерильными. Перед применением имплантаты проходили стерилизационную обработку в сухожаровом шкафу при температуре 180 °С в течение 1 ч.
Максимальный срок хранения изделий перед применением составил 6 мес.
Дизайн исследований in vivo. Эксперимент проводили на 12 кроликах-самцах породы шиншилла в возрасте от 8 до 9 мес., средний вес кроликов — (3,4 ± 0,2) кг. Всем кроликам осуществляли удаление большеберцовой кости на границе верхней и средней трети. После чего обрабатывали сверлом костномозговой канал, вкручивали имплантат в культю большеберцовой кости. Мягкие ткани послойно ушивали внутренними швами, формировали лоскут из кожи, в котором выполняли отверстие для выхода части имплантата наружу.
Далее на кость устанавливали удерживающее компрессионное устройство [16] с протезом из фторопласта. Кость подвергали компрессионной нагрузке 3,5Н в течение 5 нед.
Длительность наблюдения — 26 недель. Животные разбиты на две группы: группа 1 (п = 6) — животным имплантировали изделие без покрытия (контроль); группа 2 (п = 6) —животным имплантировали изделие с цинк-замещенным кальций-фосфатным покрытием (основная группа). Клинический контроль осуществляли во время всего послеоперационного периода. Обращали внимание на состояние животных, термометрию, пульс, дыхание, локальный статус конечности, состояние мягких тканей, а также послеоперационных ран.
Регулирующие стандарты. Исследование выполнено в соответствии со стандартами ISO 10993-1-2021. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска; ISO 10993-6-2021. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации.
Этические принципы. Исследование проведено при соблюдении принципов гуманного обращения с лабораторными животными в соответствии с требованиями Европейской конвенции по защите позвоночных животных, используемых для экспериментов и других научных целей, и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. До начала исследования получено одобрение локального этического комитета (протокол № 1 (71) от 28.04.2022).
Эвтаназия. Плановую эвтаназию животных производили после миорелаксации раствором димедрола 1 % (0,02 мг/кг) и рометара 2 % (5 мг/кг), далее вводили летальную дозу барбитуратов.
Для определения эффективности остеоинтеграции осуществляли рентгенологические, гистологические и биохимические исследования.
Рентгенологическое исследование. Для рентгенографии использовали рентгеновский аппарат Compact (Италия). Рентгенологическое исследование оперированной конечности животного выполняли в краниокаудальной и латеромедиальной проекциях. Рентгенографию проводили до и после оперативного вмешательства, на 5, 12, 26 нед. после имплантации.
Гистологическое исследование. У эвтаназированных животных осуществляли послойную препарацию от мягких тканей культи большеберцовой кости с интрамедуллярно интегрированным имплантатом. Фиксацию материала проводили в 10 % растворе нейтрального формалина не менее 10 сут. Затем костно-имплантационный блок продольно распиливали, оставляя имплантат в одной из половин.
Фрагмент кости без имплантируемого изделия деминерализовывали в смеси растворов муравьиной и соляной кислот, дегидратировали в этиловом спирте. После этапов пропитки в нескольких порциях «жидкого» 5 % целлоидина заливали в густой 40 % целлоидин и уплотняли блоки в хлороформе.
Срезы готовили при помощи санного микротома Reichard (Германия) и окрашивали их гематоксилином и эозином, пикрофуксином и по методу Массона по технологии плавающих срезов. Гистологические препараты изучали с использованием стереомикроскопа AxioScope.A1, цифровые изображения получали с помощью цифровой камеры AxioCam ICc 5.
Другую часть костно-имплантационного блока культи большеберцовой кости дегидратировали, заливали в камфен и высушивали на воздухе до полной его возгонки. Высушенные препараты напыляли Pt в специальном напылителе IB-6 (EICO, Japan).
Количественное определение содержания Са и Р (W, в весовых %) в различных участках костно-имплантационных блоков выполняли методом энергодисперсионного рентгеновского микроанализа с использованием спектрометра BRUKER OUANTAX 200 - XFlash 6/10 (Bruker Nano GmbH, Германия), в комплекте со сканирующим микроскопом (СЭМ) Zeiss EVO MA18 (Carl Zeiss Group, Германия). Анализ количественных показателей осуществлялся в программе ESPRIT (Bruker Nano GmbH, Германия).
Биохимическое исследование включало определение в сыворотке крови животных концентрации общего белка, мочевины, креатинина, глюкозы, лактата, общего кальция, неорганического фосфата, калия, натрия, хлоридов, С-реактивного белка (СРБ), а также активности щелочной фосфатазы (ЩФ) и тартратрезистентного (костного) изофермента кислой фосфатазы (ТрКФ), креатинкиназы, трансаминаз.
Исследования выполнены на автоматическом биохимическом анализаторе Hitachi/BM 902 (Италия) с использованием наборов реагентов Витал Диагностикс, Вектор-Бест (Россия).
Статистические методы исследования. Результаты в таблицах представлены в зависимости от характеристик сравниваемых выборок (нормальность оценивали по критерию Шапиро - Уилка) либо в виде среднего арифметического и стандартного отклонения (Xi ± SD), либо в виде медианы, 1-3 квартиля (Me, 01-03). Процедуру статистической оценки значимости отличий показателей на сроках эксперимента с дооперационными значениями проводили с использованием W-критерия Вилкоксона. Достоверность различий между группами на сроках наблюдения оценивали с помощью непараметрического Т-критерия Манна - Уитни. Минимальный уровень значимости (р) принимали равным 0,05.
РЕЗУЛЬТАТЫ
Клинический контроль животных в послеоперационном периоде показал, что состояние у кроликов всех групп было удовлетворительным, внеплановой гибели не выявлено. В первые трое суток во всех наблюдениях определяли отеки в области культи, отмечали снижение аппетита. Динамическая функция конечности у всех животных восстанавливалась на 4-5 сутки после операции. Воспаления мягких тканей не отмечено. В течение первой недели после демонтажа специального устройства (6 нед. после имплантации) отмечено выпадение имплантата в одном случае у животного группы 1, в опытной группе таких случаев не выявлено.
Рентгенологическое исследование показало, что у животных первой группы через 5 нед. после имплантации имелись участки резорбции на стыке кость / имплантат, у животных группы 2 эти признаки не определялись (рис. 2).
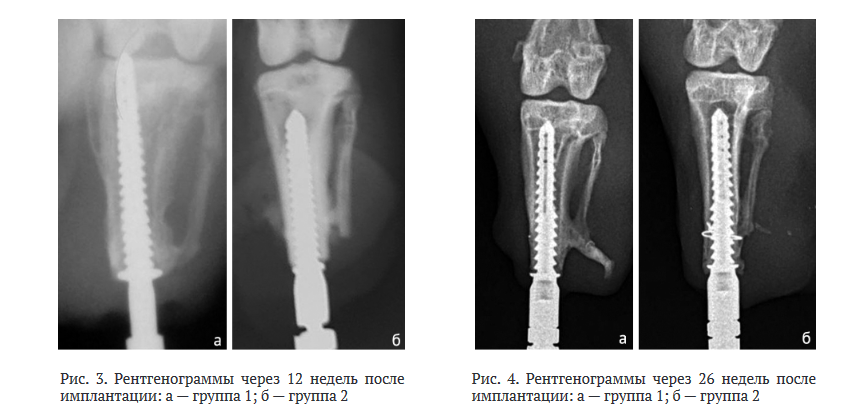
После 12 недель имплантации в обеих группах отмечены признаки остеоинтеграции, резорбцию не визуализировали, определяли незначительные периостальные наслоения в стадии компактизации (рис. 3). К 26 чнед. после имплантации отмечена полная органотипическая перестройка кости в периимплантной зоне (рис. 4). Однако у животных группы 2 костные напластования были в стадии компактизации, располагались за ограничительным кольцом, что свидетельствовало об активном костном интегративном процессе на границе кость-имплантат (рис. 4, б).
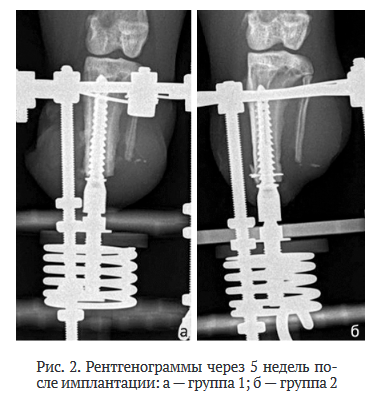
Таким образом, у животных группы 2 рентгенологическая картина на всех этапах эксперимента определялась наличием стабильности и отсутствием резорбции, что оценивается как положительные признаки остеоинтеграционных свойств изделия.
Гистологические исследования. В группе 1 через 26 недель эксперимента между поверхностью имплантата и костной тканью наблюдали плотный контакт, был сформирован единый костно-имплантационный блок. На всем протяжении культи кости сохранялась непрерывная компактная пластинка. Выраженных периостальных напластований не обнаруживали. В дистальной и средней частях культи большеберцовой кости отмечали врастание костной ткани в резьбовые межреберные углубления имплантата (рис. 5).
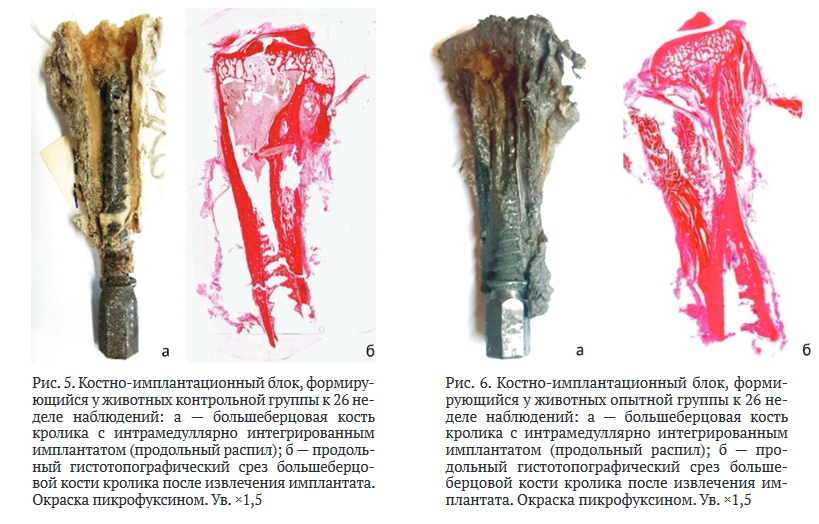
Гистоструктурная характеристика культи большеберцовой кости при интеграции имплантатов в опытной группе через 26 недель эксперимента обнаруживала в ложе культи большеберцовой кости сохранность метафизарно-эпифизарной части и непрерывную компактную пластинку, которая объединялась с поверхностью имплантата в метаэпифизарной области и в проксимальных участках диафиза с эндостально образованной костной тканью среднеячеистого трабекулярного строения. В дистальной части компактная пластинка плотно прилегала к имплантату. Наличие костной ткани обнаруживалось в резьбовых углублениях имплантата (рис. 6).
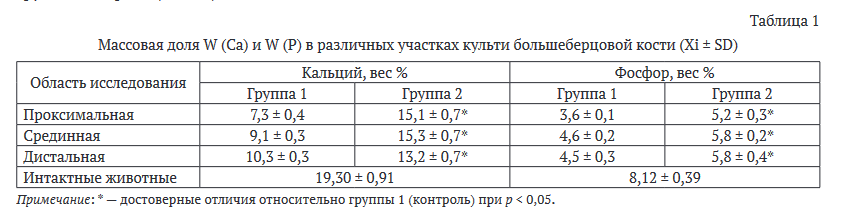
Таким образом, проведенное гистологическое исследование показало, что изделие с кальций-фосфат- ным покрытием обладало более выраженными остеоинтегративными характеристиками в изученных группах. В дистальной части культи отмечено наползание плотной соединительной ткани на ограничивающую кольцевую конструкцию и структуры имплантата, предшествующие ей, что способствовало формированию наружного барьера и предотвращению развития внутрикостной инфекции. Отрицательным моментом является имбибиция частиц имплантата в пограничные с ним ткани.
Лабораторные исследования. Изменения активности фосфатаз и концентрации кальция и фосфатов в сыворотке крови экспериментальных животных представлены в таблице 2.
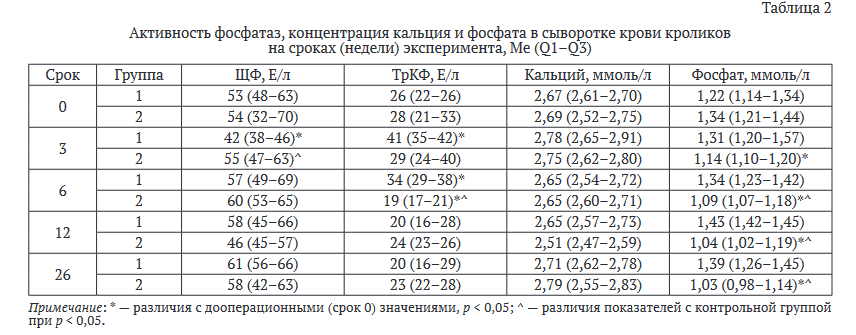
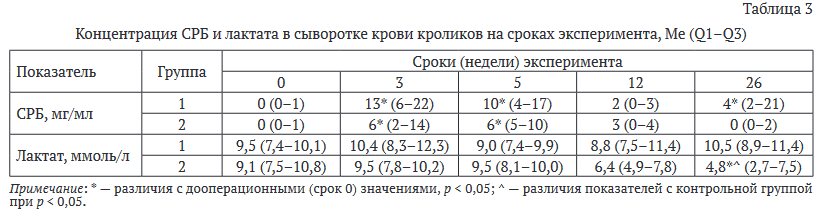
Отмечены значительные отличия в динамике С-реактивного белка (СРБ) (табл. 3). Так, достоверно повышенные значения СРБ в контрольной группе (группа 1) наблюдали до 26 недели эксперимента, в группе 2 — до 5 недели. В группе 2 на 26 неделе эксперимента отмечали статистически значимое снижение концентрации лактата как относительно исходных, дооперационных значений, так и относительно значений группы контроля. Другие биохимические показатели не имели достоверных отличий в обеих группах.
ОБСУЖДЕНИЕ
Развитие технологии одноэтапной остеоинтеграции чрескожных имплантатов является перспективным методом для решения задач протезирования костей, при этом ряд работ указывает, что переход к такой процедуре способствует улучшению результатов лечения целевых пациентов [17, 18]. Развитие этого варианта технологии чрескожного остеоинтеграционного протезирования лежит в направлении повышения остеоинтеграции имплантата, обеспечивающей его стабильность, устойчивость к инфицированию и достаточную герметизацию мягких тканей вокруг внешней части имплантата [19, 20].
Учитывая имеющиеся данные, в рамках развития способов стимуляции остеоинтеграции нами оценён новый имплантат для протезирования культей трубчатых костей с модифицированной поверхностью. Обнаружено, что применение имплантата с Zn-содержащим КФ покрытием имеет признаки улучшенной интеграции в отличие от изделия без покрытия. Кроме того, имплантация изделий с кальций-фос- фатным покрытием не вызывала у животных признаков отторжения, интоксикации (как локальной, так и системной), системной воспалительной реакции в течение всего срока наблюдения. Отсутствие серьезных нежелательных реакций на тестируемые изделия позволяет заключить, что все исследуемые имплантаты имели приемлемую переносимость и безопасность.
Литературные данные по оценке возможностей повышения интегративных свойств имплантатов с Zn-содержащим КФ покрытием достаточно скудны. Имеется работа, в которой также отмечается способность такого покрытия улучшать остеоинтеграцию металлических чрескожных имплантатов [21]. Тем не менее, перспективность применения такого покрытия очевидна, о чем свидетельствуют многочисленные данные по улучшенной остеоинтеграции дентальных имплантатов с КФ покрытием [22-24]. Дополнительным фактором в пользу применения изделий с КФ покрытием является то, что отдельные исследования указывают на способность таких покрытий снижать воспалительную реакцию и инфицирование зоны имплантации [25, 26].
Дальнейшее совершенствование остеоинтегративных характеристик разработанного изделия может быть связано с увеличением числа дополнительных микроэлементов в составе КФ покрытия [27, 28], применением имплантатов с быстро рассасывающимися гидрогелями, загруженными антибиотиками [29]. Интересным выглядит возможность нанесения на металлические имплантаты покрытий из биополимеров, особенно части поверхности имплантатов, интегрируемых с мягкими тканями [30], а также использование искусственных полимеров вместо титана [31, 32].
Очевидно, что полученные нами результаты имеют ограничения в части объемов выборок экспериментальных животных. Экстраполяция результатов исследования для клинической практики возможна, т.к. использованная экспериментальная модель приближена к модели клинического применения (одноэтапное протезирование), в том числе за счет достаточно длительного срока наблюдения после имплантации.
ЗАКЛЮЧЕНИЕ
Применение имплантатов с цинк-модифицированным кальций-фосфатным покрытием обнаруживало признаки более эффективной остеоинтеграции по сравнению с изделием без дополнительного покрытия. Такие имплантаты с модифицированной КФ поверхностью в разработанном дизайне на основе полученных данных по их эффективности и безопасности могут быть применимы для задач протезирования культей мелких костей в рамках одноэтапной технологии протезирования.
Финансирование. Исследование выполнено в рамках государственного задания НМИЦ ТО имени академика Г.А. Илизарова на осуществление научных исследований и разработок на период 2021-2023 и 2024-2026 годов.
Получение покрытий на опытных образцах имплантатов и изучение их характеристик выполнено в рамках государственного задания ИФПМ СО РАН (проект № FWRW-2021-0007) и при финансовой поддержке Минобрнауки России в рамках Программы развития УрФУ в соответствии с программой стратегического академического лидерства «Приоритет-2030».
СПИСОК ИСТОЧНИКОВ
Overmann AL, Forsberg JA. The state of the art of osseointegration for limb prosthesis. BiomedEng Lett. 2019;10(1):5-16. doi: 10.1007/s13534-019-00133-9
Rehani M, Stafinski T, Round J, et al. Bone-anchored prostheses for transfemoral amputation: a systematic review of outcomes, complications, patient experiences, and cost-effectiveness. Front Rehabil Sci. 2024;5:1336042. doi: 10.3389/fresc.2024.1336042
Aschoff HH, Orgel M, Sass M, et al. Transcutaneous Osseointegrated Prosthesis Systems (TOPS) for Rehabilitation After Lower Limb Loss: Surgical Pearls. JBJSEssent Surg Tech. 2024;14(1):e23.00010. doi: 10.2106/JBJS.ST.23.00010
Zaid MB, O’Donnell RJ, Potter BK, Forsberg JA. Orthopaedic Osseointegration: State of the Art. J Am Acad Orthop Surg. 2019;27(22):e977-e985. doi: 10.5435/JAAOS-D-19-00016
Rennie C, Rodriguez M, Futch KN, Krasney LC. Complications Following Osseointegrated Transfemoral and Transtibial Implants: A Systematic Review. Cureus. 2024;16(3):e57045. doi: 10.7759/cureus.57045
Еманов А.А., Горбач Е.Н., Стогов М.В. и др. Выживаемость чрескожных имплантатов в условиях различной механической нагрузки на кость. Гений ортопедии. 2018;24(4):500-506. doi: 10.18019/1028-4427-2018-24-4-500-506.
Haque R, Al-Jawazneh S, Hoellwarth J, et al. Osseointegrated reconstruction and rehabilitation of transtibial amputees: the Osseointegration Group of Australia surgical technique and protocol for a prospective cohort study. BMJ Open. 2020; 10(10) :e038346. doi: 10.n36/bmjopen-2020-038346
Liu Y, Rath B, Tingart M, Eschweiler J. Role of implants surface modification in osseointegration: A systematic review. J Biomed Mater Res A. 2020;108(3):470-484. doi: 10.1002/jbm.a.36829
Стогов М.В., Еманов А.А., Кузнецов В.П. и др. Сравнительная оценка остеоинтеграции новых чрескожных имплантатов из ультрамелкозернистого сплава Ti Grade 4. Гений ортопедии. 2023;29(5):526-534. doi: 10.18019/1028- 4427-2023-29-5-526-534. EDN: ELJGET.
Li TT, Ling L, Lin MC, et al. Recent advances in multifunctional hydroxyapatite coating by electrochemical deposition. J Mater Sci. 2020;55:6352-6374. doi: 10.1007/s10853-020-04467-z
Komarova EG, Sharkeev YP, Sedelnikova MB, et al. Zn- or Cu-Containing CaP-Based Coatings Formed by Micro-arc Oxidation on Titanium and Ti-40Nb Alloy: Part I-Microstructure, Composition and Properties. Materials (Basel). 2020; 13(18) :4116. doi: 10.3390/ma13184116
Sedelnikova MB, Komarova EG, Sharkeev YP, et al. Modification of titanium surface via Ag-, Sr- and Si-containing micro-arc calcium phosphate coating. Bioact Mater. 2019;4:224-235. doi: 10.1016/j.bioactmat.2019.07.001
Sedelnikova MB, Komarova EG, Sharkeev YP, et al. Zn-, Cu- or Ag-incorporated micro-arc coatings on titanium alloys: Properties and behavior in synthetic biological media. Surf Coat Technol. 2019;369:52-68. doi: 10.1016/j. surfcoat.2019.04.021
Кузнецов В.П., Губин А.В., Корюков А.А., Горгоц В.В. Имплант культи трубчатой кости. Патент РФ на полезную модель № 152558. 10.06.2015. Бюл. № 16.
Bulina NV, Khvostov MV, Borodulina IA, et al. Substituted hydroxyapatite and (3-tricalcium phosphate as osteogenesis enhancers. Ceram Int. 2024. doi: 10.1016/j.ceramint.2024.06.136
Кузнецов В.П., Губин А.В., Горгоц В.В., и др. Устройство для остеоинтеграции имплантата в кость культи нижней конечности. Патент РФ на полезную модель № 185647. 13.12.2018. Бюл. № 35.
Al Muderis M, Lu W, Tetsworth K, et al. Single-stage osseointegrated reconstruction and rehabilitation of lower limb amputees: the Osseointegration Group of Australia Accelerated Protocol-2 (OGAAP-2) for a prospective cohort study. BMJ Open. 2017;7(3):e013508. doi: 10.1136/bmjopen-2016-013508
Evans AR, Tetsworth K, Quinnan S, Wixted JJ. Transcutaneous osseointegration for amputees. OTA Int. 2024;7(2 Suppl):e326. doi: 1071097/OI9.0000000000000326
Hoellwarth JS, Tetsworth K, Rozbruch SR, et al. Osseointegration for Amputees: Current Implants, Techniques, and Future Directions. JBJSRev. 2020;8(3):e0043. doi: 10.2106/JBJS.RVW.19.00043
Shrivas S, Samaur H, Yadav V, Boda SK. Soft and Hard Tissue Integration around Percutaneous Bone-Anchored Titanium Prostheses: Toward Achieving Holistic Biointegration. ACS Biomater Sci Eng. 2024;10(4):1966-1987. doi: 10.1021/ acsbiomaterials.3c01555
Zastulka A, Clichici S, Tomoaia-Cotisel M, et al. Recent Trends in Hydroxyapatite Supplementation for Osteoregenerative Purposes. Materials (Basel). 2023;16(3):1303. doi: 10.3390/ma16031303
Ghanem A, Kellesarian SV, Abduljabbar T, et al. Role of Osteogenic Coatings on Implant Surfaces in Promoting Bone-To-Implant Contact in Experimental Osteoporosis: A Systematic Review and Meta-Analysis. Implant Dent. 2017;26(5):770-777. doi: 10.1097/ID.0000000000000634
Lu M, Chen H, Yuan B, et al. Electrochemical Deposition of Nanostructured Hydroxyapatite Coating on Titanium with Enhanced Early Stage Osteogenic Activity and Osseointegration. Int J Nanomedicine. 2020;15:6605-6618. doi: 10.2147/IJN.S268372
Sotova C, Yanushevich O, Kriheli N, et al. Dental Implants: Modern Materials and Methods of Their Surface Modification. Materials (Basel). 2023;16(23):7383. doi: 10.3390/ma16237383
Kaspiris A, Vasiliadis E, Pantazaka E, et al. Current Progress and Future Perspectives in Contact and Releasing-Type Antimicrobial Coatings of Orthopaedic Implants: A Systematic Review Analysis Emanated from In Vitro and In Vivo Models. InfectDisRep. 2024;16(2):298-316. doi: 10.3390/idr16020025
Van den Borre CE, Zigterman BGR, Mommaerts MY, Braem A. How surface coatings on titanium implants affect keratinized tissue: A systematic review. J Biomed Mater Res B Appl Biomater. 2022;110(7):1713-1723. doi: 10.1002/ jbm.b.35025
Li K, Xue Y, Yan T, et al. Si substituted hydroxyapatite nanorods on Ti for percutaneous implants. Bioact Mater. 2020;5(1):116-123. doi: 10.1016/j.bioactmat.2020.01.001
Wang S, Zhao X, Hsu Y, et al. Surface modification of titanium implants with Mg-containing coatings to promote osseointegration. Acta Biomater. 2023;169:19-44. doi: 10.1016/j.actbio.2023.07.048
Corona PS, Vargas Meouchi EA, Garda Hernandez JM, et al. Single-stage transcutaneous osseointegrated prosthesis for above-knee amputations including an antibiotic-loaded hydrogel. Preliminary results of a new surgical protocol. Injury. 2024;55(4):111424. doi: 10.1016/j.injury.2024.111424
Wang X, Lei X, Yu Y, et al. Biological sealing and integration of a fibrinogen-modified titanium alloy with soft and hard tissues in a rat model. Biomater Sci. 2021;9(15):5192-5208. doi: 10.1039/d1bm00762a
Chen Z, Chen Y, Wang Y, et al. Polyetheretherketone implants with hierarchical porous structure for boosted osseointegration. Biomater Res. 2023;27(1):61. doi: 10.1186/s40824-023-00407-5
Chen T, Jinno Y, Atsuta I, et al. Current surface modification strategies to improve the binding efficiency of emerging biomaterial polyetheretherketone (PEEK) with bone and soft tissue: A literature review. J Prosthodont Res. 2023;67(3):337-347.
Информация об авторах:
Максим Валерьевич Стогов — доктор биологических наук, доцент, руководитель отдела
Андрей Александрович Еманов — кандидат ветеринарных наук, ведущий научный сотрудник
Виктор Павлович Кузнецов — доктор технических наук, профессор, заведующий лабораторией, профессор кафедры
Екатерина Геннадьевна Комарова — кандидат технических наук, научный сотрудник
Елена Николаевна Горбач — кандидат биологических наук, ведущий научный сотрудник
Елена Анатольевна Киреева — кандидат биологических наук, старший научный сотрудник
Татьяна Викторовна Толкачева — ведущий технолог
Теги: протезирование
234567 Начало активности (дата): 20.11.2024
234567 Кем создан (ID): 989
234567 Ключевые слова: протезирование, чрескожный имплантат, остеоинтеграция, кальций-фосфатное покрытие
12354567899



