 03.11.2024
03.11.2024
Эндопротезирование головки таранной кости при лечении болезни Мюллера - Вейса: три клинических случая
Болезнь Мюллера - Вейса — сравнительно редкое заболевание, которое характеризуется аваскулярным некрозом ладьевидной кости и проявляется грубой деформацией стопы с выраженным болевым синдромом и значительным снижением активности пациента.
ВВЕДЕНИЕ
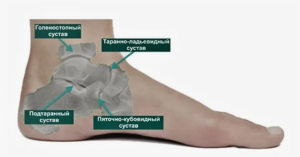
Таранно-ладьевидный сустав входит в состав так называемого трёхсуставного комплекса — сустава Шопара — и является одним из ключевых суставов, обеспечивающих функцию всей стопы в целом. Он играет существенную роль в цикле шага, обеспечивая распределение векторов нагрузки и обеспечения пронационно-супинационных движений стопы [1].
Выраженные дегенеративные изменения суставов среднего и заднего отдела стопы значительно снижают качество жизни пациента, а также негативно влияют на функцию всей стопы в целом [2].
Остеонекроз суставных поверхностей таранно-ладьевидного сустава ведёт к стойкому нарушению его функции. Среди причин возникновения остеонекроза можно выделить последствия перенесенной травмы, ревматоидный артрит, болезнь Келлера. Особое место в этом списке занимает болезнь Мюллера - Вейса. Это редкое заболевание, которое проявляется аваскулярным некрозом ладьевидной кости [3].
Консервативные методы лечения болезни Мюллера - Вейса применимы на начальных стадиях и, согласно данным литературы, не всегда эффективны [4].
Существующие хирургические методики при лечении выраженных степеней разрушения суставных поверхностей таранно-ладьевидного сустава направлены на его блокирование [5, 6]. Известно, что ар- тродезирование функционально значимых суставов приводит к неудовлетворительным функциональным результатам, что особенно выраженно в долгосрочной перспективе.
С целью сохранения функции таранно-ладьевидного сустава при его выраженных деформациях и деструкции нами предложена оригинальная модель эндопротеза головки таранной кости и способ ее имплантации [7].
Цель работы — представить краткосрочные результаты лечения трёх пациентов с остеонекрозом ладьевидной кости и локальным некрозом головки таранной кости методом эндопротезирования головки таранной кости керамическим имплантом, пластикой и металлоостеосинтезом ладьевидной кости, а также сопутствующими хирургическими техниками.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено в соответствии с этическими нормами Хельсинкской декларации 1975 г., пересмотренными в 2013 г., одобрено этическим комитетом учреждения. Пациенты дали добровольное информированное согласие на публикацию результатов исследования без раскрытия личности.
Описаны результаты трёх клинических случаев лечения пациентов с выраженным остеонекрозом ладьевидной кости и локальным некрозом головки таранной кости, которым был установлен диагноз болезнь Мюллера - Вейса, методом гемиэндопротезирования головки таранной кости в комбинации с пластикой и металлоостеосинтезом ладьевидной кости.
Модель гемипротеза головки таранной кости является оригинальной отечественной разработкой, выполненной из циркониевой оксидной керамики, стабилизированной иттрием.
Имплант содержит суставную головку с гладкой суставной поверхностью и четырехлопастную ножку. Пресс-фит фиксация происходит за счёт самозаклинивания ножки гемиэндопротеза в подготовленном канале таранной кости.
Для оценки объективного состояния пациентов в пред- и послеоперационном периоде выполнены рентгенография стоп с нагрузкой, мультиспиральная компьютерная томография (МСКТ). Для оценки субъективного состояния пациентам перед оперативным вмешательством и через 12 мес. выполнено анкетирование по шкалам ВАШ (визуальная аналоговая шкала боли) и AOFAS AH (англ.: American Orthopedic Foot and Ankle Society — Ankle Hindfoot Scale).
РЕЗУЛЬТАТЫ
Случай 1
Пациент 70 лет обратился с жалобами на боль в среднем и заднем отделах правой стопы в покое, усиливающуюся во время ходьбы и после физической нагрузки. В анамнезе около одного года назад травма — подвернул правую стопу. За медицинской помощью не обращался. С течением времени стал отмечать выраженный болевой синдром с отрицательной клинической динамикой.
При осмотре отмечен умеренный отёк мягких тканей в среднем и заднем отделах правой стопы. Также определены уплощение внутреннего продольного свода и варусное отклонение пяточной кости. При пальпации обнаружена выраженная болезненность в проекции таранно-ладьевидного сустава правой стопы. Супинационно-пронационные движения правой стопы невозможны. При анкетировании пациента до операции получены результаты: 22 балла по шкале AOFAS AH и 10 баллов по ВАШ.
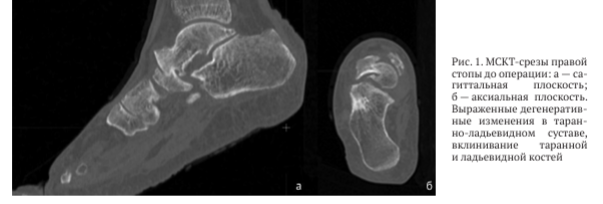
По данным компьютерной томографии выявлены грубая деформация и дислокация суставных поверхностей таранно-ладьевидного сустава, фрагментация ладьевидной кости, сцепленное вклинивание головки таранной кости и фрагмента ладьевидной кости (рис. 1)
Пациенту поставлен диагноз: Остеоартрит таранно-ладьевидного сустава 3 стадии, остеонекроз ладьевидной кости и головки таранной кости правой стопы, блокада таранно-ладьевидного сустава.
Основываясь на анамнезе заболевания и результатах обследования, можно сделать вывод о стрессовом переломе ладьевидной кости, который, в свою очередь, способствовал деструкции головки таранной кости, фрагментации ладьевидной кости и дальнейшему развитию болезни Мюллера - Вейса.
Пациенту выполнено оперативное вмешательство: некрэктомия, костная пластика дефекта ладьевидной кости из переднего суставного отростка пяточной кости, металлоостеосинтез (МОС) ладьевидной кости винтами, гемиэндопротезирование головки таранной кости керамическим имплантом, удлиняющий резекционный артродез пяточно-кубовидного сустава с пластикой губчатым аллотрансплантатом и скобой, ахиллопластика по Страйеру.
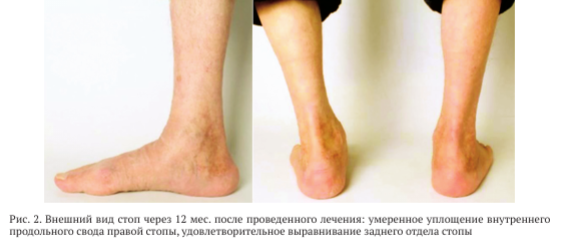
На момент контрольного осмотра через 12 мес. после проведенного хирургического вмешательства пациент ходил с полной опорой на правую нижнюю конечность, не хромал. Не отмечено отёка мягких тканей области заднего отдела правой стопы. Определено умеренное уплощение внутреннего продольного свода правой стопы, выравнивание заднего отдела стопы удовлетворительное (рис. 2).
Послеоперационные рубцы — состоятельные, без признаков воспаления. Пальпация таранно-ладьевидного сустава безболезненная. Объём движений в правом голеностопном суставе полный, безболезненный. Объём безболезненных супинационно-пронационных движений правой стопы в суставе Шопара: 10°-0°-10°. При тестировании пациента по шкале AOFAS AH получено 72 балла, по ВАШ — 2 балла.
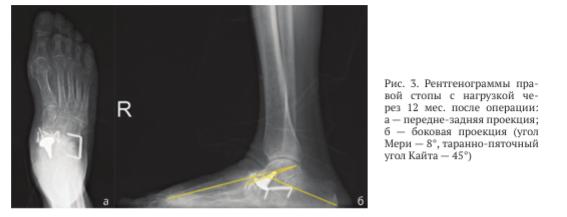
На рентгенограммах правой стопы с полной нагрузкой через 12 мес. после операции: МОС ладьевидной кости состоятелен, отмечены состоявшийся пяточно-кубовидный анкилоз (рис. 3), умеренное уплощение продольного свода, однако функция стопы восстановлена.
Случай 2
Пациентка 43 лет обратилась с жалобами на острые боли в среднем и заднем отделах правой стопы, появившиеся без видимых причин около одного года назад. Проходила консервативное лечение без положительной динамики.
При клиническом обследовании выявлен выраженный отёк мягких тканей области среднего и заднего отделов правой стопы, уплощение внутреннего продольного свода, варусное отклонение пяточной кости правой стопы (рис.4)
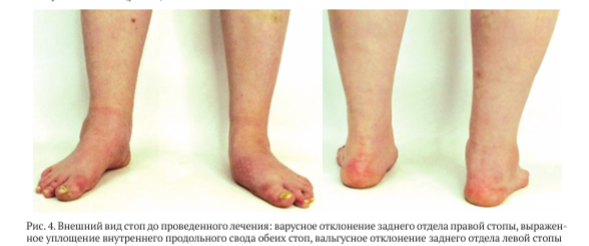
При пальпации правой стопы — выраженная болезненность в проекции таранно-ладьевидного сустава. Су- пинационно-пронационные движения правой стопы не отмечены. Неврологического дефицита не выявлено. При тестировании пациентки до операции по шкале AOFAS AH получено 24 балла, результат по шкале ВАШ — 10 баллов.
На левой стопе отмечены выраженное уплощение внутреннего продольного свода, вальгусная деформация заднего отдела и отведение переднего отдела стопы. Однако, несмотря на наличие выраженной деформации, стопа опорная, и болевой синдром отсутствовал.
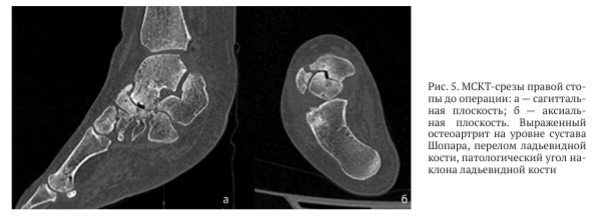
По данным компьютерной томографии правой стопы выявлены грубые дегенеративные изменения суставных поверхностей таранно-ладьевидного сустава, остеонекроз и фрагментация ладьевидной кости, сцепленное вклинивание между головкой таранной кости и фрагментом ладьевидной кости (рис. 5).
Пациентке поставлен диагноз: Болезнь Мюллера - Вейса, остеонекроз ладьевидной и головки таранной кости правой стопы, блокада таранно-ладьевидного сустава.
Первым этапом оперативного вмешательства произведена некрэктомия ладьевидной кости. Далее выполнен МОС ладьевидной кости, выделена зона ложного сустава ладьевидной кости. При помощи осцилляторной пилы осуществлена его резекция до кровоточащих участков костной ткани. После этого произведена репозиция фрагментов ладьевидной кости, фиксация стягивающим винтом, затем — опорной мини-пластиной с угловой стабильностью.
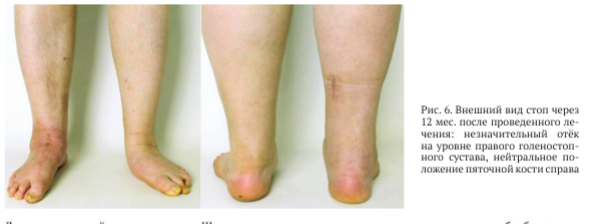
При физикальном обследовании через 12 мес. после проведенного оперативного вмешательства выявлен незначительный отёк мягких тканей области заднего отдела правой стопы, ось пяточной кости — в нейтральном положении (рис. 6).
Случай 3
Пациентка 24 лет обратилась с жалобами на острые боли в среднем отделе правой стопы. В анамнезе — травма, около 7 лет назад подвернула правую стопу, однако костно-травматических повреждений на момент травмы не выявлено.
При физикальном обследовании определен умеренный отёк мягких тканей области среднего и заднего отделов правой стопы, уплощение внутреннего продольного свода правой стопы, варусное отклонение пяточной кости (рис. 8).
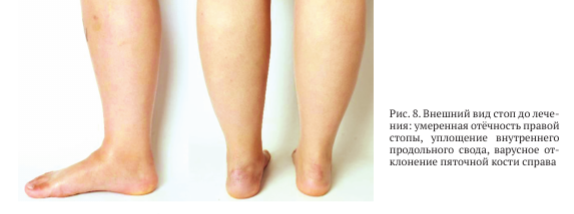
Определяется выраженная болезненность правой стопы при пальпации в проекции таранно-ладьевидного сустава. Супинационно-пронационные движения правой стопы качательные и резко болезненные. При тестировании пациента до операции по шкале AOFAS AH — 39 баллов, по шкале ВАШ — 9 баллов.
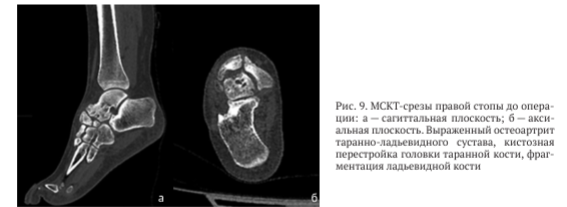
По данным компьютерной томографии выявлена грубая деформация суставных поверхностей таранно-ладьевидного сустава, остеонекроз и фрагментация ладьевидной кости, локальный аваскулярный некроз головки таранной кости (рис. 9).
Пациентке был поставлен диагноз: Болезнь Мюллера - Вейса, остеонекроз ладьевидной кости и головки таранной кости правой стопы.
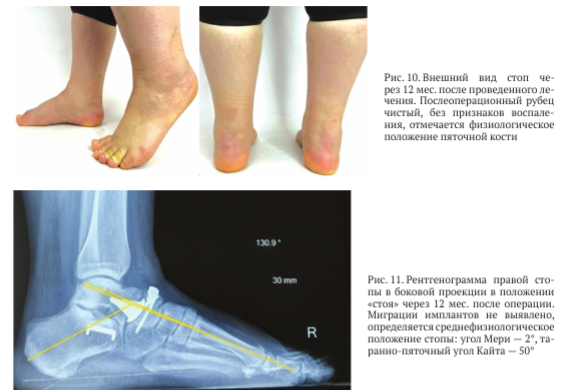
Выполнено оперативное вмешательство: некрэктомия ладьевидной кости, МОС мини-пластиной, гемиэндопротезирование головки таранной кости, удлиняющая остеотомия пяточной кости по Эванс с пластикой костным губчатым аллотрансплантатом и фиксацией скобой-коннектором.При обследовании через 12 мес. после операции выявлен незначительный отёк мягких тканей области заднего отдела правой стопы, физиологическое положение пяточной кости (рис. 10).
Объём безболезненных супинационно-пронационных движений правой стопы в суставе Шопара через 12 мес. после проведенного лечения составил 10°-0°-10°. Пальпация таранно-ладьевидного сустава — безболезненная. При тестировании пациента по шкале AOFAS AH получено 87 баллов, по шкале ВАШ — 1 балл.
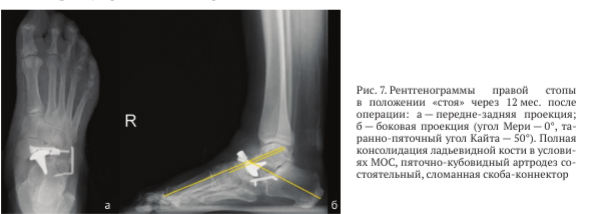
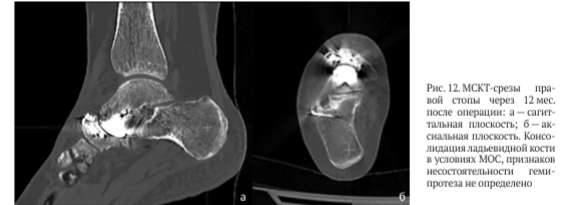
На рентгенограммах правой стопы с весовой нагрузкой через 12 мес. после операции: МОС ладьевидной кости состоятелен (рис. 11). По данным МСКТ нестабильности гемиэндопротеза не выявлено (рис. 12).
ОБСУЖДЕНИЕ
Разрушение суставных поверхностей таранно-ладьевидного сустава может происходить под воздействием ряда причин: вследствие первичного остеонекроза, перенесенной травмы, остеохондрита, болезни Келлера, стрессового перелома ладьевидной кости, ревматоидного артрита или болезни Мюллера - Вейса.
Травматические переломы ладьевидной кости являются достаточно редким повреждением, и в настоящее время их диагностика представляет трудности. При этом до 30 % всех стрессовых переломов стопы составляют повреждения ладьевидной кости [8].
Также из-за сложной анатомии и кровоснабжения ладьевидная кость подвержена остеонекрозу, и её повреждение может привести к посттравматическому остеоартриту окружающих суставов. В детском возрасте аваскулярный некроз ладьевидной кости представлен болезнью Келлера, которая наиболее часто встречается в возрасте 2-10 лет [9]. У взрослых данное состояние называется болезнью Мюллера - Вейса и проявляется коллапсом и фрагментацией ладьевидной кости.
Впервые болезнь Мюллера - Вейса была описана в 1927 г. немецким хирургом Walther Muller и австрийским рентгенологом Konrad Weiss. Однако также существует мнение, что первым данное состояние описал Schmidt в 1925 году [10].
В настоящее время общепринятого мнения о причине возникновения болезни Мюллера - Вейса нет [11]. Однако существует несколько теорий, среди которых упоминаются остеонекроз, остеохон- дрит, посттравматический некроз или последствие биомеханических нарушений, остеоартрит (ОА) на фоне дисплазии ладьевидной кости, врождённая мальформация, повторяющиеся стресс-переломы ладьевидной кости и другие. В недавнее время была широко распространена этиопатогенетическая теория, в которой участвуют диспластические, механические и социально-экономические факторы окружающей среды [12]. Однако T. Doyle et al. не нашли данной взаимосвязи [13].
Кровоснабжение ладьевидной кости представлено медиальной подошвенной артерией, тыльной артерией стопы и артерией тарзального канала [14]. В центральной части ладьевидной кости отмечается худшее кровоснабжение, которое также имеет тенденцию к уменьшению с возрастом [15]. A. Tan et al. провели единственное на сегодняшний день патологоанатомическое исследование, результаты которого определили остеонекроз в исследуемом материале [16]. Тем не менее, другие авторы отмечают нормальную костную ткань [17].
В 2004 г. E. Maceira, R. Rochera пришли к выводу о наличии дисплазии костей предплюсны и ладьевидной кости, которая приводит к отложенной оссификации, и связанным с этим патологическим распределением нагрузки [12].
Данное состояние проявляется значительным увеличением давления на латеральный край ладьевидной кости. Также предрасполагающими факторами можно считать варусную деформацию стопы на уровне подтаранного сустава и короткую первую плюсневую кость.
Распространенность данного заболевания в популяции неизвестна. Это может быть вызвано тем, что заболевание начинает протекать бессимптомно и часто диагностируется уже при выраженном остеоартрите таранно-ладьевидного сустава, когда поставить точный диагноз является затруднительным. Данное состояние наиболее распространено у женщин 40-46 лет, при этом частота встречаемости в сравнении с мужчинами составляет 6:1 или 2:1. В 50 % случаев отмечается двусторонняя локализация [18].
Чаще всего пациенты с данным состоянием испытывают боль по тыльно-медиальной поверхности среднего или заднего отдела стопы, при этом имеется тенденция к отрицательной динамике. Деформация имеет свои особенности: на фоне уплощения внутреннего продольного свода и отводящей деформации среднего отдела стопы у пациента определяют варусную деформацию её заднего отдела, так называемую парадоксальную плоскую стопу (Pes planovarus, paradoxical flatfoot deformity). При этом наблюдают проявления остеоартрита в смежных с ладьевидной костью суставах. В патогенезе данного заболевания отмечают прогрессирующую фрагментацию ладьевидной кости и коллапс на её латеральной поверхности, смещение головки таранной кости по направлению к латеральной клиновидной кости.
Критерии рентгенологической диагностики предложены Maceira и Rochera в 2004 году и обобщены в таблице 1 [12].
При МРТ визуализируется снижение интенсивности сигнала от ладьевидной кости на Т1 взвешенных изображениях (Т1ВИ), гиперинтенсивный диффузный отек и гиперинтенсивная периартикулярная жидкость на Т2 взвешенных изображениях (Т2ВИ).
Несмотря на то, что консервативные методы лечения применимы на начальных стадиях заболевания (стадии 1 и 2 по классификации Maceira и Rochera), и, по данным авторов, не всегда эффективны, данная тактика лечения считается терапией первой линии [3, 4].
Консервативное лечение включает в себя использование ортопедических стелек, ограничение физической активности, иммобилизацию, приём НПВС и анальгетиков и продолжается минимум 3 мес. Результаты использования ортопедических стелек с полужесткой поддержкой внутреннего продольного свода являются удовлетворительными, однако эффективность лечения имеет зависимость от угла наклона пяточной кости и отведения стопы [20].
Арсенал существующих хирургических методов лечения достаточно велик. Некоторые авторы рекомендуют изолированные артродезы таранно-ладьевидного сустава. Общепринятыми методами оперативного лечения являются различные комбинации артродезирующих вмешательств, при этом превалируют двойные и тройные артродезы [5, 6, 21]. Одним из обязательных условий достижения удовлетворительных результатов лечения некоторые авторы считают коррекцию ротационного смещения таранной кости с последующим выполнением таранно-ладьевидного или таранно-ладьевидноклиновидных артродеза [22]. Артродезы применяют в комбинации с костной аутопластикой из крыла подвздошной кости [23]. Есть сообщение о резекции ладьевидной кости с последующей реконструкцией медиальной колонны с использованием аллотрансплантата головки бедренной кости для артродеза пластиной [16]. Известно, что блокирование функционально значимых суставов приводит к неудовлетворительным результатам, что особенно выражено в долгосрочном периоде, поэтому необходимо избегать артродеза таранно-ладьевидного сустава [24, 25].
В литературе есть единичные сообщения о суставсберегающих вмешательствах при лечении болезни Мюллера - Вейса. Они включают в себя такие хирургические техники как чрескожная декомпрессия ладьевидной кости на начальных стадиях заболевания, некрэктомия ладьевидной кости и замена ее костным губчатым трансплантатом из подвздошной кости [26, 27], дебридмент ладьевидной кости и костная пластика васкуляризированным трансплантатом из медиального мыщелка бедренной кости [28]. Сделать вывод об эффективности этих вмешательств не представляется возможным из-за небольшого количества наблюдений.
Одной из важных задач в лечении является выравнивание заднего отдела стопы, которая может быть достигнута остеотомией пяточной кости [20]. Удлиняющая остеотомия пяточной кости разгружает латеральные отделы ладьевидной кости, корригирует деформацию, приводит к снижению болевого синдрома и улучшает функцию стопы. Удлинение и стабилизация латеральной колонны может происходить и за счёт удлиняющего пяточно-кубовидного артродеза с пластикой аллотрансплантатом [29]. По данным N. Wulker, пяточно-кубовидный артродез снижает объём движений в таранно-ладьевидном суставе на 19 % и после операции составляет (32,95 ± 5,14)° [30]. На наш взгляд, это не является критичным для функции стопы и позволит остановить прогрессирование деформации и уменьшить нагрузку на контактные поверхности таранно-ладьевидного сустава.
Также очень важным является сохранение подвижности непосредственно таранно-ладьевидного сустава. Перспективным направлением в лечении остеонекроза ладьевидной и головки таранной костей может быть использование имплантов, выполненных методом 3D-печати. В литературе есть сообщение о применении индивидуального титанового эндопротеза ладьевидной кости. S.B. Adams и R.M. Danilkowicz сообщили об успешных результатах лечения пациента с остеонекрозом ладьевидной кости после имплантации индивидуального титанового эндопротеза ладьевидной кости при сроке послеоперационного наблюдения 4 года [24].
Однако известно, что циркониевая керамика в меньшей степени повреждает противоположную хрящевую поверхность, чем металл и, соответственно, более предпочтительна для гемиэндопротезирования [31, 32]. Методику гемипротезирования головки таранной кости сустава мы выполняем с 2021 г., всего на момент публикации проведено более 20 оперативных вмешательств, направленных на замещение суставной поверхности головки таранной кости. Наиболее часто данное хирургическое вмешательство мы использовали при остеоартрите таранно-ладьевидного сустава, сопровождая его сопутствующими хирургическими техниками.
Данные импланты являются оригинальной отечественной разработкой, на модель эндопротеза головки таранной кости и способ его имплантации был получен патент № 2788474 [7]. Линейка имплантов представлена 4 типоразмерами, которые позволяют подобрать необходимый имплант вне зависимости от размера стопы пациента. Нами проводится дальнейшая работа по оценке применения данной хирургической техники у пациентов с
поражением таранно-ладьевидного сустава различного генеза.
ЗАКЛЮЧЕНИЕ
Полученные краткосрочные данные демонстрируют, что гемиэндопротез позволил восстановить подвижность таранно-ладьевидного сустава при сохранении стабильной фиксации таранной кости.
СПИСОК ИСТОЧНИКОВ
Savory KM, Wulker N, Stukenborg C, Alfke D. Biomechanics of the hindfoot joints in response to degenerative hindfoot arthrodeses. Clin Biomech (Bristol, Avon). 1998;13(1):62-70. doi: 10.1016/s0268-0033(97)00016-8
Golightly YM, Gates LS. Foot Osteoarthritis: Addressing an Overlooked Global Public Health Problem. Arthritis Care Res (Hoboken). 2021;73(6):767-769. doi: 10.1002/acr.24181
Angthong C, Younger ASE, Chuckpaiwong B, et al. A Novel Update on the Management of Muller-Weiss Disease: Presentation of a Treatment Algorithm. Cartilage. 2024;15(1):65-71. doi: 10.1177/19476035231205684
Harnroongroj T, Tharmviboonsri T, Chuckpaiwong B. Muller-Weiss Disease: The Descriptive Factors of Failure Conservative Treatment. Foot Ankle Int. 2021;42(8):1022-1030. doi: 10.1177/10711007211002826
Fornaciari P, Gilgen A, Zwicky L, et al. Isolated talonavicular fusion with tension band for Muller-Weiss syndrome. Foot Ankle Int. 2014;35(12):1316-1322. doi: 10.1177/1071100714548197
Bai W, Li Y, Shen G, et al. Talonavicular-cuneiform arthrodesis for the treatment of Muller-Weiss: mid-term results of 15 cases after 5 years. BMCMusculoskeletDisord. 2023;24(1):178. doi: 10.1186/s12891-023-06293-1
Карлов А. В., Скребцов В.В., Процко В.Г. Способ лечения деформирующих повреждений подтаранного сустава и гемиэндопротез подтаранного сустава для его осуществления. Патент РФ на изобретение № 2788474. 19.01.23.
Chan JY, Young JL. Kohler Disease: Avascular Necrosis in the Child. Foot Ankle Clin. 2019;24(1):83-88. doi: 10.1016/j. fcl.2018.09.005
Muller W. On an odd double-sided change of the tarsal navicular. Dtsch. Z. Chir. 1927;201:84-89. doi: 10.1007/ BF02793918
AhmedAA, Kandil MI, Tabl EA, ElgazzarAS. Muller-Weiss Disease: A Topical Review. FootAnkle Int. 2019;40(12):1447-1457. doi: 10.1177/1071100719877000
Maceira E, Rochera R. Muller-Weiss disease: clinical and biomechanical features. Foot Ankle Clin. 2004;9(1):105-125. doi: 10.1016/S1083-7515(03)00153-0
Doyle T, Napier RJ, Wong-Chung J. Recognition and management of Muller-Weiss disease. Foot Ankle Int. 2012;33(4):275-281. doi: 10.3113/FAI.2012.0275
Kelikian AS, Sarrafian SK. Sarrafian’s Anatomy of the Foot and Ankle: Descriptive, Topographic, Functional. 4th ed. Wolters Kluwer Publ.; 2023.
Ramadorai MU, Beuchel MW, Sangeorzan BJ. Fractures and Dislocations of the Tarsal Navicular. J Am Acad Orthop Surg. 2016;24(6):379-389. doi: 10.5435/JAAOS-D-14-00442
Tan A, Smulders YC, Zophel OT. Use of remodeled femoral head allograft for tarsal reconstruction in the treatment of muller-weiss disease. J Foot Ankle Surg. 2011;50(6):721-726. doi: 10.1053/j.jfas.2011.04.043
Welck MJ, Kaplan J, Myerson MS. Muller-Weiss Syndrome: Radiological Features and the Role of Weightbearing Computed Tomography Scan. Foot Ankle Spec. 2016;9(3):245-251. doi: 10.1177/1938640016630055
Zhang H, Li J, Qiao Y, et al. Open triple fusion versus TNC arthrodesis in the treatment of Mueller-Weiss disease. J Orthop Surg Res. 2017;12(1):13. doi: 10.1186/s13018-017-0513-3
Hetsroni I, Nyska M, Ayalon M. Plantar pressure distribution in patients with Muller-Weiss disease. Foot Ankle Int. 2007;28(2):237-241. doi: 10.3113/FAI.2007.0237
Li SY, Myerson MS, Monteagudo M, Maceira E. Efficacy of Calcaneus Osteotomy for Treatment of Symptomatic Muller- Weiss Disease. Foot Ankle Int. 2017;38(3):261-269. doi: 10.1177/1071100716677741
Lee TY, Wu CC, Yang KC, et al. Midterm outcomes of midfoot and hindfoot arthrodesis with strut allograft for Muller- Weiss disease. BMC Musculoskelet Disord. 2022;23(1):715. doi: 10.1186/s12891-022-05629-7
Yuan C, Wang C, Zhang C, et al. Derotation of the Talus and Arthrodesis Treatment of Stages II-V Muller-Weiss Disease: Midterm Results of 36 Cases. Foot Ankle Int. 2019;40(5):506-514. doi: 10.1177/1071100719829457
Cao HH, Tang KL, Xu JZ. Peri-navicular arthrodesis for the Stage III Muller-Weiss disease. Foot Ankle Int. 2012;33(6):475-478. doi: 10.3113/FAI.2012.0475
Adams SB, Danilkowicz RM. Talonavicular Joint-Sparing 3D Printed Navicular Replacement for Osteonecrosis of the Navicular. Foot Ankle Int. 2021;42(9):1197-1204. doi: 10.1177/10711007211002807
Zhang K, Chen Y, Qiang M, Hao Y. Effects of five hindfoot arthrodeses on foot and ankle motion: Measurements in cadaver specimens. Sci Rep. 2016;6:35493. doi: 10.1038/srep35493
Tosun B, Al F, Tosun A. Spontaneous osteonecrosis of the tarsal navicular in an adult: Mueller-Weiss syndrome. J Foot Ankle Surg. 2011;50(2):221-224. doi: 10.1053/j.jfas.2010.10.019
Janositz G, Sisak K, Toth K. Percutaneous decompression for the treatment of Mueller-Weiss syndrome. Knee Surg Sports Traumatol Arthrosc. 2011;19(4):688-690. doi: 10.1007/s00167-010-1305-z
Levinson H, Miller KJ, Adams SB Jr, Parekh SG. Treatment of Spontaneous Osteonecrosis of the Tarsal Navicular With a Free Medial Femoral Condyle Vascularized Bone Graft: A New Approach to Managing a Difficult Problem. Foot Ankle Spec. 2014;7(4):332-337. doi: 10.1177/1938640013514270
Gutteck N, Lebek S, Wohlrab D, et al. Calcaneocuboid distraction arthrodesis with allogenic bone grafting for correction of pes planovalgus. Acta OrthopBelg. 2013;79(5):559-64.
Wulker N, Stukenborg C, Savory KM, Alfke D. Hindfoot motion after isolated and combined arthrodeses: measurements in anatomic specimens. Foot Ankle Int. 2000;21(11):921-927. doi: 10.1177/107110070002101106
Waldorff EI, Roessler BJ, Zachos TA, et al. Preclinical evaluation of a novel implant for treatment of a full-thickness distal femoral focal cartilage defect. JArthroplasty. 2013;28(8):1421-1429. doi: 10.1016/j.arth.2012.11.020
Vanlommel J, De Corte R, Luyckx JP, et al. Articulation of Native Cartilage Against Different Femoral Component Materials. Oxidized Zirconium Damages Cartilage Less Than Cobalt-Chrome. J Arthroplasty. 2017;32(1):256-262. doi: 10.1016/j.arth.2016.06.024
. Информация об авторах:
Владимир Владимирович Скребцов — кандидат медицинских наук, врач травматолог-ортопед
Виктор Геннадьевич Процко — доктор медицинских наук, доцент кафедры, врач травматолог-ортопед
Теги: таранно-ладьевидный сустав
234567 Начало активности (дата): 03.11.2024
234567 Кем создан (ID): 989
234567 Ключевые слова: таранно-ладьевидный сустав, аваскулярный некроз, ладьевидная кость, болезнь Мюллера - Вейса, эндопротезирование, керамический имплант
12354567899



