 18.06.2024
18.06.2024
Ухудшение течения прогрессирующего интерстициального заболевания легких у пациентки с болезнью Стилла взрослых после перенесенной новой коронавирусной инфекции
Болезнь Стилла взрослых представляет собой редкое системное заболевание неизвестной этиологии. Ее течение нередко осложняется развитием интерстициальной пневмонии и фульминантного гепатита
Болезнь Стилла взрослых представляет собой редкое системное заболевание неизвестной этиологии. Она диагностируется на основании критериев M. Yamaguchi и соавт. (1992) [цит. по [1]]. Течение заболевания нередко осложняется развитием интерстициальной пневмонии, перикардита, миокардита, синдрома активации макрофагов, острого респираторного дистресс-синдрома, синдрома диссеминированного внутрисосудистого свертывания и фульминантного гепатита [1]. В 2020 г. опубликованы данные, свидетельствующие об общих механизмах развития воспалительного процесса у пациентов с системными заболеваниями соединительной ткани и новой коронавирусной инфекцией (COVID-19). Показано, что у пациентов с аутоиммунными заболеваниями увеличивается риск тяжелого течения и неблагоприятного прогноза COVID-19, а также наблюдается прогрессирование аутоиммунных заболеваний [2].Мы представляем клиническое наблюдение 74-летней пациентки, у которой ведущими синдромами на фоне длительного течения болезни Стилла после перенесенной новой коронавирусной инфекции были прогрессирование неспецифической интерстициальной пневмонии и развитие тяжелого поражения печени.
Клиническое наблюдение
Пациентка Е., 74 года, заболела остро в 1998 г., когда появились зудящая сыпь, артралгии, повысилась температура. В ходе проведенного обследования в крови выявлено повышение уровня лейкоцитов (25 х 109/л), нейтрофилов (22 х 109/л), ферритина (394 мкг/л), скорости оседания эритроцитов (СОЭ, 43 мм/ч) и С-реактивного белка (СРБ, 115 мг/л). При проведении рентгенографии органов грудной клетки (ОГК) наблюдалось усиление легочного рисунка. В ходе обследования заподозрено системное заболевание соединительной ткани, был назначен преднизолон в дозе 30 мг с положительным эффектом. Через 6 месяцев вновь повысилась температура, возобновились артралгии, развился синдром Рейно, потеря массы тела за 1 месяц составила около 6 кг. Выявлено увеличение шейных, подмышечных и паховых лимфатических узлов до 2-3 см.
Госпитализирована в ревматологическое отделение, где проведено обследование. Ревматоидный фактор (РФ), антитела к циклическому цитруллинсодержащему пептиду (ACPA), антитела к ядерным антигенам (ANA), антинейтрофильные цитоплазматические ауто антитела (ANCA), антитела к антигенам Scl-70, PM-Scl, PCNA, Jo-1, SS-A (Ro), к двуспиральной ДНК отрицательные. При ультразвуковом исследовании и биопсии лимфатических узлов определяется реактивный лимфаденит. На рентгенограммах ОГК отмечены изменения, расцененные как ограниченный пневмосклероз. Спирография: форсированная жизненная емкость легких (ФЖЕЛ) - 89%; объем форсированного выдоха за 1 секунду (ОФВ1) - 78%, ОФВ1/ ФЖЕЛ - 79%, проба с сальбутамолом 400 мкг - отрицательная. При проведении эхокардиографии (ЭхоКГ) патологии не выявлено. Пациентке поставлен диагноз «болезнь Стилла взрослых». Проведена пульс-терапия метилпреднизолоном с переходом на дексаметазон. После выписки из стационара было рекомендовано продолжить прием дексаметазона. Однако в дальнейшем пациентка принимала его короткими курсами только при возникновении суставного синдрома.
Ухудшение состояния отмечено с 2017 г., когда появилась одышка при умеренных физических нагрузках, сухой кашель. Была госпитализирована в пульмонологическое отделение. В анализах крови: лейкоциты 8,5 х 109/л, СОЭ 28 мм/ч, СРБ 11 мг/л; ферритин 25 мкг/л, щелочная фосфатаза (ЩФ) 855 Ед/л, аспартатаминотрансфе- раза 69 Ед/л, аланинаминотрансфераза 59 Ед/л, общий билирубин 30,2 мкмоль/л, прямой билирубин 27,3 мк- моль/л.
Повышение уровней лактатдегидрогеназы, кре- атинфосфокиназы, РФ, антител к нативной ДНК, ANA, ACPA, ANCA, антител к миелопероксидазе, протеиназе, антигенам Scl-70, Jo-1, антител к микросомальной фракции печени и почек, антимитохондриальных антител, криоглобулинов и иммуноглобулинов (Ig) A, M, G не выявлено. При проведении ультразвукового исследования органов брюшной полости обнаружена умеренная спленомегалия (14 х 10 х 9 см), диффузные изменения печени, признаки хронического калькулезного холецистита. Бодиплетизмография: жизненная емкость легких (ЖЕЛ) 65%, ФЖЕЛ 69%, ОФВ1/ФЖЕЛ 70%; общая емкость легких 68%, остаточный объем легких 63%, DLCO 53%. Бронхоскопия выявила эрозивный бронхит, трансбронхиальная биопсия - признаки эндобронхита.
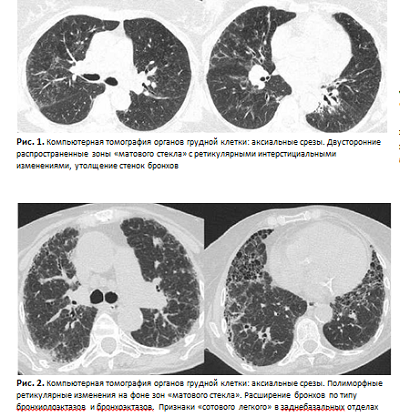
При компьютерной томографии (КТ) ОГК наблюдались зоны «матового стекла», диффузные пневмосклеротические изменения в плащевых зонах обоих легких (рис. 1).
ЭхоКГ: камеры сердца не расширены, фракция выброса - 60%, систолическое давление в легочной артерии - 45 мм рт. ст. При выписке поставлен диагноз «болезнь Стилла взрослых, интерстициальное заболевание легких без морфологической верификации». Рекомендована терапия метилпреднизолоном в дозе 20 мг с повторной консультацией ревматолога и пульмонолога. Пациентка к врачам не обращалась и через 10-12 месяцев самостоятельно отменила препарат.
Состояние стойко стабилизировалось. В ходе обследования, проведенного в феврале 2020 г., респираторные симптомы не прогрессировали. Одышка по шкале mMRC 2 балла. На контрольной КТ ОГК - без отрицательной динамики. При проведении бодиплетиз- мографии и исследовании диффузионной способности легких: ЖЕЛ 64%, ФЖЕЛ 70% (падение ФЖЕЛ в течение 3 лет - менее 5%), ОФВ1/ЖЕЛ 72%, общая емкость легких 66%, остаточный объем легких 65%, DLCO 61%, СРБ 6,2 мг/л, ферритин 8 мкг/л, РФ 7 ЕД/мл, SatO2 97%.
В мае 2020 г. пациентка заболела COVID-19, заболевание проявлялось главным образом в виде усиления одышки (по шкале mMRC 3 балла). Лечилась амбулаторно, принимала фавипиравир, антикоагулянты, левофлоксацин. В связи с появлением одышки при минимальной физической нагрузке и в покое, а также появлением отеков нижних конечностей в сентябре 2020 г. были рекомендованы формотерол/будесо- нид 12/400 мкг, тиотропия бромид 18 мкг, фуросемид. Выполнена КТ ОГК, при которой описана отрицательная динамика (рис. 2). SatO2 92%. От предложенной госпитализации пациентка отказалась. К врачу до марта 2021 г. не обращалась, не обследовалась, продолжала принимать рекомендованную ингаляционную терапию.
В марте 2021 г. пациентка госпитализирована в больницу в тяжелом состоянии. Частота дыхательных движений 24 в минуту, SpO2 90%, артериальное давление 90/50 мм рт. ст., частота сердечных сокращений 110 в минуту.
Гемоглобин 81 г/л, эритроциты 3,62 х 1012/л, лейкоциты 5,6 х 109/л, нейтрофилы 2,3 х 109/л, тромбоциты 174 х 109/л, общий билирубин 78 мкмоль/л, прямой билирубин 62 мкмоль/л, ЩФ 556 ЕД, аспартатаминотранс- фераза 448,5 Ед/л, аланинаминотрансфераза 433,6 Ед/л, ферритин 35 мкг/л, СОЭ 32 мм/ч, СРБ 27 мг/л, креатинин 100 мкмоль/л.
Повышения уровней креатинфосфокиназы, РФ, антител к нативной ДНК, ANA, ACPA, ANCA, антител к антигену Scl-70 не выявлено. Впервые отмечено повышение криоглобулинов и IgM, IgG.
Ультразвуковое исследование органов брюшной полости: печень не увеличена, структура мелкозернистая, селезенка не увеличена, незначительное количество жидкости в брюшной полости.
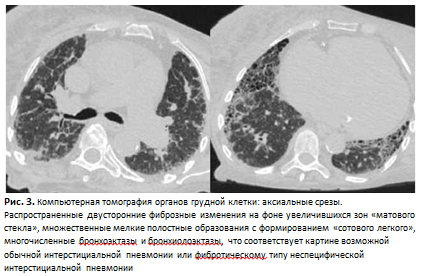
КТ ОГК с контрастированием: КТ-картина интерстициального заболевания легких в стадии формирования «сотового легкого» (рис. 3), малый двусторонний гидроторакс, кардиомегалия. Данных за тромбоэмболию легочной артерии не получено.
ЭхоКГ: расширение правого предсердия (6,2 х 6,8 см) и правого желудочка (4,4 см), сократительная способность левого желудочка снижена (фракция выброса 30%), систолическое давление в легочной артерии 65 мм рт. ст., нижняя полая вена 2,3 см, расширена, кол- лабирует менее 50%.
Ультразвуковая доплерография сосудов нижних конечностей - данных за тромбоз не получено.
Эндоскопическая ретроградная холангиопанкреато- графия: данных за патологию холедоха и панкреатического протока не выявлено.
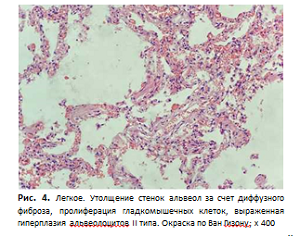
На фоне нарастающей полиорганной недостаточности пациентка скончалась. При патоморфологическом исследовании выявлена обычная интерстициальная пневмония с формированием «сотового легкого». Осложнениями стали хроническое легочное сердце, декомпенсация (толщина стенки правого желудочка - 0,8 см, желудочковый индекс - 0,8 (отношение массы правого желудочка к массе левого желудочка в норме 0,4-0,6)), хроническая сердечная недостаточность, двусторонний гидроторакс (по 400 мл в правой и левой плевральных полостях), дистрофия печени, почек, миокарда; признаки портальной гипертензии - спленоме- галия (масса 350 г), асцит (1500 мл), гепаторенальный синдром. Данные аутопсии (гистологического исследования) представлены на рис. 4, 5.
Обсуждение
У пациентки с прогрессирующим течением синдрома Стилла на КТ ОГК выявлены изменения в легочной ткани, соответствующие картине возможной обычной интерстициальной пневмонии или фибротическому типу неспецифической интерстициальной пневмонии. Патоморфологически в легочной ткани отмечен паттерн обычной интерстициальной пневмонии с формированием «сотового легкого», а также изменения в печени с явлениями дуктопении и пролиферации дуктулярного эпителия.
Согласно данным литературы, у пациентов с синдромом Стилла взрослых без развития острого респираторного дистресс-синдрома наиболее часто регистрируют следующие варианты поражения легочной ткани: неспецифическую интерстициальную пневмонию, респираторный бронхиолит и организующиеся интерстициальные пневмонии [3-5], что соотносится с характером поражения легочной ткани, выявленного у нашей пациентки.
В представленном клиническом наблюдении у больной кроме поражения легочной ткани имел место синдром холестаза (с 2017 г.), а впервые выявленное в 2021 г. повышение криоглобулинов определило необходимость проведения дифференциального диагноза с другими системными заболеваниями соединительной ткани, аутоиммунным поражением печени или присоединением после перенесенной COVID-19 лимфопролиферативного заболевания. Этот дифференциально-диагностический ряд обычно требует проведения биопсии лимфатических узлов, печени и/или легких. Однако исследование не было выполнено в связи с крайне тяжелым состоянием пациентки.
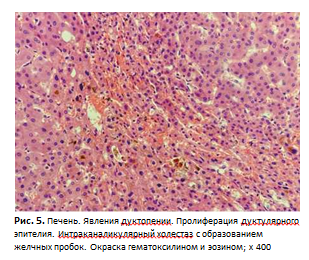
Развитие прогрессирующего холестатического и цитолитического синдромов может иметь следующие объяснения. Поражение печени при болезни Стилла взрослых обычно проявляется признаками цитолиза и печеночно-клеточной недостаточности [5-7]. Холестатическая желтуха возникает у 3% из этих больных [8]. В нашем клиническом наблюдении по данным посмертного патогистологического исследования отмечены явления дук- топении, пролиферации дуктулярного эпителия и интраканаликулярный холестаз с образованием желчных пробок в отсутствие признаков подпеченочного холестаза, что могло быть проявлением холангиоцеллюлярного холестаза, вероятно связанного с развитием вторичного склерозирующего холангита в рамках основного заболевания. Мы также могли бы рассматривать проявления холестаза как холестатический тип при застойной гепатопатии на фоне хронической сердечно-сосудистой недостаточности. Но этой версии противоречат высокие цифры ЩФ, которые регистрировали до появления сердечной недостаточности, что подтверждается данными ЭхоКГ и низким уровнем proBNP в 2017 г. [9]. При сравнении результатов обследований пациентки в 2017 и начале 2020 г. данных об активности системного заболевания соединительной ткани и прогрессировании фиброзирующего заболевания легких не получено. Таким образом, в проведении терапии метотрексатом или генно-инженерными биологическими препаратами больная не нуждалась.
Ухудшение состояния пациентки, учитывая возникновение смешанной криоглобулинемии, отсутствие отрицательной динамики заболевания с 2017 по 2020 г., отмеченное при КТ ОГК появление и увеличение зон «матового стекла» расценивалось нами как рецидив системного заболевания соединительной ткани после перенесенной новой коронавирусной инфекции. По данным литературы, эти заболевания имеют общие патогенетические механизмы. Наиболее тяжелыми осложнениями COVID-19, так же как и аутоиммунных заболеваний, выступают синдром «цитокинового шторма» и синдром активации макрофагов [10]. Предположительно, именно общность механизмов определяет то, что у пациентов с системными заболеваниями соединительной ткани наблюдается увеличение риска тяжелого течения COVID-19 и летальности [2, 11-15] и что новая коронавирусная инфекция выступает фактором риска развития широкого спектра аутоиммунных заболеваний. Это подтверждается высокой частотой выявления у данной группы пациентов антинуклеарного фактора и специфических антиядерных антител, часто без развития клинической симптоматики [11-15]. Представленные данные могут объяснить прогрессирование болезни Стилла взрослых у нашей пациентки, которое через 7 месяцев после перенесенного легкого течения COVID-19 привело к летальному исходу.
Заключение
Описанное нами клиническое наблюдение иллюстрирует то, что изменения в легочной ткани, сохраняющиеся после перенесенной новой коронавирусной инфекции у пациентов с аутоиммунными заболеваниями, могут быть расценены и как резидуальные постковидные изменения, и как манифестировавшие или прогрессирующие на фоне COVID-19 поражения легких при системном заболевании. В этом случае проведение дифференциального диагноза может стать сложной задачей для врача. На примере данного клинического наблюдения мы хотели показать, что ключевым фактором, позволяющим правильно установить диагноз, служит сохраняющееся полиорганное поражение на фоне прогрессирующего фиброзного поражения легких. Наличие таких проявлений диктует необходимость исследования иммунологических маркеров для исключения обострения или дебюта аутоиммунного заболевания, а целью клинициста должна стать быстрая диагностика и своевременное начало специфического лечения.
Литература / References
1. Gerfaud-Valentin M, Jamilloux Y, Iwaz J, Seve P. Adult-onset Still's disease. Autoimmun Rev. 2014;13(7):708-722. doi: 10.1016/j.au- trev.2014.01.058.
2. Liu M, Gao Y, Zhang Y, Shi S, Chen Y, Tian J. The association between severe or dead COVID-19 and autoimmune diseases: A systematic review and meta-analysis. J Infect. 2020;81 (3):e93-e95. doi: 10.1016/j. jinf.2020.05.065.
3. Gerfaud-Valentin M, Cottin V, Jamilloux Y, Hot A, Gaillard-Coadon A, Durieu I, Broussolle C, Iwaz J, Seve P. Parenchymal lung involvement in adult-onset Still disease: A STROBE-compliant case series and literature review. Medicine (Baltimore). 2016;95(30):e4258. doi: 10.1097/ MD.0000000000004258.
4. Mehta MV, Manson DK, Horn EM, Haythe J. An atypical presentation of adult-onset Still's disease complicated by pulmonary hypertension and macrophage activation syndrome treated with immunosuppression: a case-based review of the literature. Pulm Circ. 2016;6(1):136-142. doi: 10.1086/685112.
5. Chi H, Wang Z, Meng J, Han P, Zhai L, Feng T, Teng J, Sun Y, Hu Q, Zhang H, Liu H, Cheng X, Ye J, Shi H, Wu X, Zhou Z, Jia J, Wan L, Liu T, Qiao X, Wang M, Wang F, Chen X, Yang C, Su Y. A Cohort Study of Liver Involvement in Patients With Adult-Onset Still's Disease: Prevalence, Characteristics and Impact on Prognosis. Front Med (Lausanne). 2020;7:621005. doi: 10.3389/fmed.2020.621005.
6. Giacomelli R, Ruscitti P, Shoenfeld Y. A comprehensive review on adult onset Still's disease. J Autoimmun. 2018;93:24-36. doi: 10.1016/j. jaut.2018.07.018.
7. Zhu G, Liu G, Liu Y, Xie Q, Shi G. Liver abnormalities in adult onset Still's disease: a retrospective study of 77 Chinese patients. J Clin Rheumatol. 2009;15(6):284-288. doi: 10.1097/ RHU.0b013e3181b57199.
8. Andres E, Kurtz JE, Perrin AE, Pflumio F, Ruellan A, Goichot B, Dufour P, Blickle JF, Brogard JM, Schlienger JL. Retrospective monocentric study of 17 patients with adult Still's disease, with special focus on liver abnormalities. Hepatogastroenterology. 2003;50(49):192-195.
9. Bechade D, Berthelet O, Desrame J, Lecoules S, Coutant G, Algayres JP. Ictere cholestatique recidivant au cours d'une maladie de Still del'adulte [Recurrent cholestatic jaundice in adult-onset Still's disease]. Rev Med Interne. 2002;23(12):1034-1035. French. doi: 10.1016/ s0248-8663(02)00733-6.
10. Кобалава ЖД, Виллевальде СВ, Соловьева АЕ. Сердечно-печеночный синдром при сердечной недостаточности: распространенность, патогенез, прогностическое значение. Кардиология. 2016;56( 12):63-71.
12. СтрутынскаяА.Д., Карнаушкина М.А., Овсянников Д.Ю., Филиппов С.А., Тюрин И.Е. Ухудшение течения прогрессирующего интерстициального заболевания легких у пациентки с болезнью Стилла взрослых после перенесенной новой коронавирусной инфекции
13. Zulfiqar AA, Lorenzo-Villalba N, Hassler P, Andres E. Immune Thrombocytopenic Purpura in a Patient with Covid-19. N Engl J Med. 2020;382(18):e43. doi: 10.1056/NEJMc2010472.
14. Toscano G, Palmerini F, Ravaglia S, Ruiz L, Inv- ernizzi P, Cuzzoni MG, Franciotta D, Baldanti F, Daturi R, Postorino P, Cavallini A, Micieli G. Guil- lain-Barre Syndrome Associated with SARS- CoV-2. N Engl J Med. 2020;382(26):2574-2576. doi: 10.1056/NEJMc2009191.
15. Dalakas MC. Guillain-Barre syndrome: The first documented COVID-19-triggered autoimmune neurologic disease: More to come with myositis in the offing. Neurol Neuroimmunol
Neuroinflamm. 2020;7(5):e781. doi: 10.1212/ NXI.0000000000000781.
16. Wallace ZS, Bhana S, Hausmann JS, Robinson PC, Sufka P, Sirotich E, Yazdany J, Grainger R. The Rheumatology Community responds to the COVID-19 pandemic: the establishment of the COVID-19 global rheumatology alliance. Rheumatology. 2020;59(6):1204-1206. doi: 10.1093/rheumatology/keaa191.
Авторы:
Струтынская Анастасия Дмитриевна – аспирант кафедры рентгенологии и радиологии
Карнаушкина Мария Александровна – д-р мед. наук, профессор кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева
Овсянников Дмитрий Юрьевич – д-р мед. наук, заведующий кафедрой педиатрии2
Филиппов Сергей Александрович – врач-патологоанатом отделения патологической анатомии
Тюрин Игорь Евгеньевич – д-р мед. наук, заведующий кафедрой рентгенологии и радиологии
Карнаушкина Мария Александровна – д-р мед. наук, профессор кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева
Овсянников Дмитрий Юрьевич – д-р мед. наук, заведующий кафедрой педиатрии2
Филиппов Сергей Александрович – врач-патологоанатом отделения патологической анатомии
Тюрин Игорь Евгеньевич – д-р мед. наук, заведующий кафедрой рентгенологии и радиологии
Теги: болезнь Стилла
234567 Начало активности (дата): 18.06.2024 16:34:00
234567 Кем создан (ID): 989
234567 Ключевые слова: болезнь Стилла взрослых, неспецифическая интерстициальная пневмония, «сотовое легкое», COVID-19, системные заболевания соединительной ткани
12354567899
Похожие статьи
Дифференциальный диагноз при суставном синдромеРентген на дому 8 495 22 555 6 8
Классификация ревматоидного артрита
Синдром Стилла у взрослых
Диагностика ревматоидного артрита. Критерии диагностики



