 27.07.2023
27.07.2023
Некоронарогенные причины повышения тропонинов в клинической практике
Повышенные уровни тропонинов указывают на повреждение миокарда, но не определяют причину и механизм повреждения
ВВЕДЕНИЕ
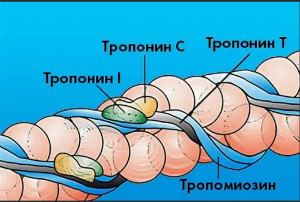
Тропониновый комплекс состоит из трех субъединиц — T, I, C, которые регулируют сократительную деятельность миокарда (рис. 1).
Сердечный тропонин Т — тропомиозинсвязывающая субъединица — закрепляет тропониновый комплекс на тонких актиновых филаментах. Тропонин С — кальцийсвязывающая субъединица — связывает ионы кальция, поступающие в цитоплазму из саркоплазматического ретикулума при стимуляции сокращения. Тропонин I — ингибирующая субъединица — блокирует гидролиз аденозинтрифос- фата, необходимого для взаимодействия актина и миозина. В отсутствии ионов кальция в цитоплазме (фаза расслабления) тропонин I препятствует взаимодействию актина и миозина. Оптимальное функционирование тропониновых белков определяется правильным аминокислотным строением.
Даже незначительные генетические аномалии, вызывающие изменения одной или нескольких аминокислот в составе тропонинов, сопровождаются выраженными нарушениями сократительной деятельности миокарда.
Так, на данный момент открыто более 100 мутаций в генах, кодирующих аминокислотную последовательность тропонинов, которые приводят к развитию сократительной дисфункции миокарда и кардиомиопатиям [1]. Кроме того, в цитоплазме кардиомиоцита находится примерно 4-6% тропониновых белков (от всей массы тропонинов внутри кардиомиоцита), которые не входят в состав тропонинового комплекса и не участвуют в сокращении миокарда — цитозольная фракция тропонинов (рис. 1). Молекулярная масса тропониновых белков довольно мала: тропонин I — 23,8 кДа, тропонин Т — 37 кДа, тропонин С — 20 кДа. Тропонины T и I считаются идеальными биомаркерами для выявления повреждения миокарда, поскольку являются кардиоспецифическими изоформами [2, 3].
До недавнего времени считалось, что тропонины высвобождаются из кардиомиоцитов после гибели кардиомиоцитов. Обнаружение повышенных концентраций тропонинов при длительных и интенсивных нагрузках (марафонский бег, триатлон) [4, 5], а также после психоэмоциональных стрессов [6] поставило под сомнение гипотезу о том, что тро- понин высвобождается только при необратимом повреждении клеток миокарда.
Появление новых, более чувствительных методов (высоко- и ультрачувствительных иммуноанализов) изменило некоторые представления о биологии тропонинов. Кардиальные тропони- ны определяются в крови всех здоровых людей при использовании современных ультрачувствительных анализов в концентрации менее установленного 99-го перцентиля («тропонинот- рицательных» больше нет), в связи с чем могут считаться продуктами нормального метаболизма миокарда. Механизмы высвобождения тропонинов в кровоток из миокарда здоровых людей неизвестны. Предположительно, это происходит в ходе процессов регенерации/обновления кардиомиоцитов, повышения проницаемости клеточных мембран, незначительных некротических и апоптотических процессов при субклиническом течении воспалительных и ишемических заболеваний, избыточных физических нагрузках и стрессах [5-7].
Высоко- и ультрачувствительные методы позволяют определять очень низкие концентрации тропонинов в сыворотке крови: нижний предел определения для высокочувствительных иммуноанализов составляет 2-5 нг/л, а для ультрачувствительных иммуноанализов — 0,01-0,2 нг/л. В 2012 г. эксперты Международной федерации клинической химии и лабораторной медицины (The International
Federation of Clinical Chemistry and Laboratory Medicine, IFCC) обозначили высокочувствительными иммуноанализами такие, которые способны определять тропонин более чем у 50% здоровых людей. В дальнейшем производители продолжили работу над повышением чувствительности своих иммуноанализов и добились количественного определения сердечных тропонинов в сыворотке крови 95-100% здоровых индивидуумов. Такие иммуноанализы называют ультрачувствительными. Применение высоко- и ультрачувствительных иммуноанализов для ранней диагностики острого инфаркта миокарда (одно- и трехчасовые алгоритмы) регламентировано в руководящем документе «Четвертое универсальное определение инфаркта миокарда» (Европейское общество кардиологов, 2018) [2].
Современные высоко- и ультрачувствительные методы детекции сердечных тропонинов позволяют регистрировать даже очень незначительные повреждения сердечной мышцы, увеличивая число пациентов с повышенными концентрациями тропонинов, затрудняя тем самым интерпретацию лабораторных результатов [2]. В клинической практике трудно интерпретировать динамические изменения концентрации тропонинов при таких состояниях, как тахикардии/тахиаритмии, воспаление сердечных оболочек (эндокардиты, миокардиты, перикардиты), тромбоэмболия легочной артерии и др. (рис. 2). Повышение тропонинов при данных заболеваниях свидетельствует о повреждении кардиомиоцитов.
В некоторых случаях (например, при нарушении почечной фильтрации вследствие почечной недостаточности, ложноположительные результаты) наблюдается подъем сывороточных уровней сердечных тропонинов даже при отсутствии повреждения кардиомиоцитов.
Ниже мы обсуждаем механизмы повышения и диагностическое значение тропонинов при данных некоронарогенных состояниях.
МЕХАНИЗМЫ ПОВЫШЕНИЯ УРОВНЯ ТРОПОНИНОВ И ИХ ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
Механизмы элиминации тропонинов из крови
Тропонины при почечной недостаточности
Концентрация сердечных тропонинов в крови зависит не только от механизмов высвобождения их из кардиомиоцитов, но и от механизмов элиминации из крови. На данный момент установлены следующие способы удаления тропонинов из кровотока:
1) внутриклеточное расщепление специфическими протеазами (в клетках ретикулоэндотели- альной системы);
2) почечная фильтрация;
3) внеклеточное расщепление тропонинов под действием протеаз.
Процессы внутри- и внеклеточного расщепления изучались в нескольких работах. По данным отечественных биохимиков I. Katrukha с соавт., фермент тромбин специфически расщепляет кардиальный тропонин Т на несколько пептидных фрагментов [8]. Исследователи отмечают необходимость дальнейшего изучения процессов внутри- и внеклеточной деградации тропонинов для совершенствования иммуноанализов [8-10].
Участие почек в элиминации сердечных тропо- нинов из кровотока является спорным. Некоторые исследователи отрицали данный механизм удаления тропонинов ввиду того, что не удавалось определить тропонины в моче [11, 12]. Тем не менее в клинической практике нередко отмечались повышенные тропонины у пациентов с почечной недостаточностью, что является косвенным свидетельством участия почек в удалении тропонинов. Наиболее значительным доказательством роли почечной фильтрации в повышении сывороточных тропонинов является исследование CRIC (Chronic Renal Insufficiency Cohort), включившее 2464 пациента с хронической почечной недостаточностью, но без явных признаков сердечно-сосудистых заболеваний. Более низкая скорость клубочковой фильтрации (СКФ) ассоциировалась с более высокими концентрациями тропонина Т: у пациентов с СКФ <30 мл/мин уровни тропонина были в 3 раза выше, чем у пациентов с СКФ >60 мл/мин. Связь между более низкими значениями СКФ и более высокими уровнями тропонина Т частично объясняется уменьшением почечного клиренса тропонина Т. Целостный белок является слишком крупной молекулой, чтобы пройти через клубочковый фильтр, однако фрагменты тропонина Т достаточно маленькие и, предположительно, могут фильтроваться почками. Тем не менее в данном исследовании у некоторых пациентов с низкой СКФ концентрация тропонина Т была в норме, а это свидетельствует о том, что нарушение почечного клиренса не является единственной причиной подъема тропонинов у пациентов с хронической почечной недостаточностью [13].
Недавно хорватские исследователи P. Pervan и соавт. представили прямые доказательства важной роли почек в удалении тропонинов. При помощи высокочувствительного иммуноанализатора Abbott Architect i1000SR (США) hs-cTnI (тропонин I высокочувствительный) был обнаружен в моче у всех пациентов, причем в утренней порции мочи нормотензивных пациентов концентрации hs-cTnI составили 14,95 пг/мл по сравнению с мочевыми уровнями hs-oTnI 26,59 пг/мл у пациентов с повышенным артериальным давлением (p<0,05). Авторы считают, что определение уровня hs-cTnI в моче может использоваться в диагностике и мониторинге гипертонической болезни [14].
Другим предполагаемым механизмом, ответственным за повышение сердечных тропонинов при хронической почечной недостаточности, является «скелетная гипотеза», подтверждением которой служат сообщения об экспрессии кардиальных изоформ тропонинов в скелетных мышцах. При хронической почечной недостаточности происходит альтерация скелетных мышц (уремическая скелетная миопатия), после чего следуют процессы репаративной регенерации, при которых происходит экспрессия кардиальных изоформ тропонинов. В некоторых работах показано, что экспрессия кардиоспецифических тропонинов в скелетных мышцах является нормой для эмбрионального периода. V. Ricchiutti и F. Apple сообщили об обнаружении мРНК кардиального тропонина Т в биоптатах скелетных мышц у 50% пациентов с хронической почечной недостаточностью [15].
Однако в исследовании C. Haller с колл. не обнаружено кардиальных изоформ тропонина Т в биоптатах мышц передней стенки живота у пациентов с терминальной хронической почечной недостаточностью [16]. Таким образом, данные об экспрессии кардиальных изоформ в скелетных мышцах при уремической миопатии отличаются противоречивостью.
Стоит отметить, что элиминация тропонинов также происходит через гистогематические барьеры (гематосаливарный, гематоликворный). Об этом свидетельствуют исследования, в которых кардиальные тропонины были обнаружены в ликворе и ротовой жидкости [17-19]. При этом у пациентов с острым инфарктом миокарда (ОИМ) концентрации тропонинов в сыворотке крови и ротовой жидкости коррелировали. По мнению исследователей, слюна может использоваться в качестве биоматериала для неинвазивной диагностики ОИМ [19].
Тропонины при тахикардии/тахиаритмии
В клинической практике иногда отмечается повышение сывороточных уровней кардиальных тропонинов у пациентов с суправентрикулярными тахиаритмиями (СВТ). Наиболее возможным механизмом, ответственным за элевацию тропонинов при СВТ, считается укорочение диастолы [20]. В соответствии с анатомическими особенностями, кровоснабжение сердца осуществляется в диастолу. Во время систолы створки клапана аорты занимают аортальные синусы и закрывают тем самым устья коронарных артерий.
Во время диастолы клапан аорты закрывается, что приводит к открытию устий коронарных артерий, в которые устремляется кровь. Таким образом, уменьшение диастолы приводит к нарушению равновесия между потребностью и доставкой кислорода. В работе M. Zellweger и соавт. описано четыре клинических случая повышения тропонина I у пациентов с СВТ. Частота сердечных сокращений составляла 170— 250 уд./мин, а продолжительность — 1,5-22 ч. Ишемическая болезнь сердца была исключена по данным стресс-эхокардиографии и коронарографии. У пациентов также отмечено повышение активности креатинфосфокиназы. Степень увеличения тропонина I и креатинфосфокиназы не зависела от частоты сердечных сокращений и продолжительности тахикардии [21]. T. Bakshi с колл. обнаружили не связанное с ишемической болезнью сердца повышение тропонина I у 21 пациента. Поражение коронарных артерий исключено по данным коро- нарографии. При этом у 6 пациентов причиной повышения тропонина была тахикардия (у 4 — СВТ, а у 2 — вентрикулярная тахикардия). У 5 пациентов причинами повышения тропонина I были физическая нагрузка, перикардит и сердечная недостаточность. У 10 пациентов причина элевации тропо- нина I так и не была установлена [22].
В более крупном исследовании, включившем 104 пациента с СВТ, повышенные уровни тропонина I зарегистрированы у 48% [23]. N. Ben Yedder с колл. провели ретроспективное исследование, включившее 73 пациента с СВТ и без признаков ишемической болезни сердца. Тропонин Т был повышен у 24 пациентов (32,9%). У пациентов с повышенными тропонином Т максимальная частота сердечных сокращений была достоверно выше, чем у тропониннегативных (190,8 против 170,3 уд./мин; р=0,008). Кроме того, обнаружена корреляция между максимальной частотой сердечных сокращений во время СВТ и уровнем подъема тропонина Т (r=0,637, p=0,001) [24].
Поскольку у многих пациентов с СВТ возникают симптомы боли в груди, часто ошибочно им диагностируется ОИМ и назначается неподходящее лечение в виде антиагрегантных и тромболитических препаратов. Только коронарная ангиография позволяет исключить у пациентов с СВТ признаки поражения коронарных артерий [24, 25]. В работе F. Xue и соавт. описывается 2 случая, когда у пациентов с СВТ ошибочно диагностирован ОИМ.
У обоих пациентов при поступлении с жалобами на боль в груди был повышен тропонин I (соответственно 0,09 и 0,16 нг/мл при норме 0,08). Через несколько часов после госпитализации произошло еще более значимое повышение концентрации тропонина I — до 0,52 и 2,28 соответственно, в результате чего пациентам ошибочно был поставлен диагноз ОИМ и назначено соответствующее лечение. В течение нескольких дней после госпитализации пациентам проведена коронаро- графия, которая не выявила никаких признаков обструкции венечных сосудов [25].
Тропонины при миокардитах, эндокардитах и перикардитах
Основной механизм повышения кардиомаркеров при миокардитах, в частности тропонинов, связан с прямым цитотоксическим действием инфекционных агентов (вирусов, бактерий и др.), токсинов, аутоантител на кардиомиоциты. Концентрации сердечных тропонинов при миокардитах, их чувствительность и специфичность варьируют в широких пределах. По данным нескольких работ, тропонины, определяемые умеренно чувствительными методами для диагностики миокардита, имели чувствительность 34-71% и специфичность 86-94% [26-28].
Из-за высокой летальности новорожденных младенцев и детей от миокардита, составляющей в среднем 75 и 25% соответственно, своевременная диагностика и адекватная степени тяжести терапия имеют наиважнейшее значение [29]. Клиническая картина детского миокардита часто протекает бессимптомно или малосимптомно под маской других заболеваний, чаще всего острых респираторных вирусных инфекций. Поиск биомаркеров для ранней диагностики миокардита и оценки прогноза считается приоритетной задачей.
Крупный ретроспективный анализ медицинских карт Y. Chang с соавт., включивший 94 педиатрических пациента с острым миокардитом, выявил, что летальные случаи гораздо чаще встречались у детей с повышенными уровнями сердечного тро- понина I, креатинкиназы МВ-изоформы; при этом повышенные концентрации данных биомаркеров были связаны с аритмией, гипотензией, ацидозом и сниженной фракцией выброса левого желудочка. Подавляющее большинство пациентов погибало в первые 72 ч. В многомерном анализе очень высокие уровни cTnI (>45нг/мл) и снижение фракции выброса левого желудочка (<42%) были связаны c высоким риском смерти, особенно в первые 24 ч. По мнению авторов, лицам с высокими концентрациями cTnl оправдано назначение более интенсивной терапии [30].
Высокочувствительные тропонины имеют преимущества перед умеренно чувствительными тропонинами, а также рядом других биомаркеров и методов диагностики миокардита.
Так, в исследовании C. Ukena с колл. измеряли концентрацию hs- сТпТ, копептина и N-терминального предшественника натрийуретического гормона (NT-proBNP) у пациентов с подозрением на миокардит (n=70). Все поступившие пациенты на основании данных эндомиокардиальной биопсии («золотой стандарт») были поделены на 3 группы: а) острый миокардит, б) хронический миокардит, в) отсутствие воспалительного процесса в миокарде. Наиболее высокие средние и диапазон концентраций hs-сТпТ (262,9 [61,4-884,2] пг/мл) наблюдались у пациентов с острым миокардитом, и они превосходили значения hs-сТпТ как у пациентов с хроническим миокардитом (20,4 [15,6-20,4] пг/мл; р<0,0001), так и у пациентов без воспаления миокарда (19,5 [13,8-50,7] пг/мл; р<0,0001). В то же время уровни копептина и NT-proBNP достоверно не различались между данными группами и, соответственно, оказались неэффективными в диагностике миокардита [31].
Патогенетическое значение вирусного перси- стирования в миокарде до конца не изучено. Ученые при помощи метода полимеразной цепной реакции исследовали вирусный геном [энтеровирусы (Коксаки), парвовирус В19, аденовирус, герпес-вирусы (Эпштейна-Барр)] у пациентов с подозрением на миокардит. Примечательно, что уровни hs-сТпТ оказались достоверно выше (р=0,042) у пациентов с обнаруженным вирусными геномом (37,4 [21,9163,6] пг/мл) по сравнению с теми пациентами, у которых вирусные нуклеиновые частицы отсутствовали (20 [14-44,4] пг/мл) [31]. Это, весьма вероятно, свидетельствует о токсическом действии вирионов на клетки миокарда, которое невозможно обнаружить эндомиокардиальной биопсией, особенно при слабой активности воспалительного процесса.
В некоторых работах у многих
пациентов с миокардитами не было зарегистрировано повышения сывороточных
концентраций кардиальных тропонинов, что поставило важный вопрос перед исследователями:
почему тропонины, имеющие высокую чувствительность (90-100%) при ишемическом повреждении
миокарда (ОИМ), показывают гораздо более низкую эффективность для диагностики воспалительного повреждения кардиомиоцитов (миокардита)
Подобное обстоятельство объясняется несколькими факторами. Во-первых, аналитические характеристики тропониновых иммунотестов значительно отличаются, и в сыворотке крови одного и того же пациента концентрации тропонинов при использовании разных иммунохимических тест-систем будут сильно отличаться. Это объясняется тем, что в тест-системах разных производителей могут быть антитела к разным эпитопам (антигенным детерминантам) молекулы тропонина, а сами молекулы кардиальных тро- понинов находятся в крови в виде гетерогенной фракции (фрагменты молекул тропонинов, свободные молекулы, олигомерные комплексы), каждая из которых может циркулировать в окисленном или фосфорилированном виде [32]. Согласно другому предположению, в ложноотрицательном снижении сывороточных уровней тропонинов при миокардитах играют роль аутоантитела к сердечным тропо- нинам. По данным A. Matsumori с соавт., в крови больных миокардитом происходит значительное повышение титра аутоантител к тропонинам [33]. Аутоантитела к тропонинам играют роль в патофизиологии повреждения кардиомиоцитов и, кроме того, являются источниками аналитических помех при определении тропонинов, связывая эпитопы циркулирующих молекул тропонинов, что делает их недоступными для диагностических антител, входящих в состав тест-системы [34].
Клетки эндокарда и эпикарда не содержат сердечных тропонинов, однако эндокардиты и перикардиты нередко сопровождаются повышением их сывороточного уровня, что, вероятно, обусловлено вовлечением ткани миокарда в воспалительный процесс. Так, Р. Tsenovoy с колл. зафиксировали повышение уровня тропонина выше нормальных величин (>0,4 нг/мл) у 57% пациентов с инфекционным эндокардитом. Примечательно, что среди тропонинположительных пациентов внутрибольничная смертность или операции по замене клапана происходили чаще (51 против 15%; p<0,005) [35]. По данным другого ретроспективного исследования, тропонин I был повышен у 65% пациентов с инфекционным эндокардитом. Повышенные уровни тропо- нина I также ассоциировались с плохим прогнозом (сочетанием неблагоприятных событий): летальным исходом, абсцессом миокарда и поражением центральной нервной системы (p<0,001) [36].
По данным исследования М. Imazio и соавт., тропонин I превышал верхнюю референтную границу (1,5 нг/мл) у 38 (32%) из 118 пациентов с острым вирусным или идиопатическим перикардитом. У некоторых пациентов кинетика сывороточных уровней тропонина при перикардите соответствовала кинетике тропонинов при инфаркте. Также отмечено повышение концентрации креатинкиназы-МВ и аномалии регионарной сократимости стенки левого желудочка по данным эхокардиографии. Эти особенности приводили к неправильным предварительным диагнозам на этапе поступления. Завышенный тропонин I у пациентов с острым перикардитом достоверно ассоциировался с более молодым возрастом (р<0,001), мужским полом (p=0,007), подъемом сегмента ST (р<0,001) и наличием выпота в полости перикарда (p=0,007). В то же время в данном исследовании положительный cTnI не был связан с плохим прогнозом при остром перикардите [37], в отличие от вышеописанных исследований, посвященных прогностической ценности сердечных тропонинов при миокардите и эндокардите.
Тропонины при системном воспалении (сепсисе)
Кардиоспецифические тропонины очень часто повышаются при системном воспалении, и механизмы их повышения многообразны. Одним из них считается ишемия миокарда, которая возникает вследствие нарушения баланса между потребностью кардиомиоцитов в кислороде и его доставкой при интактных венечных артериях. Дисбаланс обусловлен несколькими патофизиологическими путями, наиболее значимыми из них являются лихорадка, гипотония, дыхательная недостаточность (респираторная гипоксия), нарушения кислотно-основного, водно-электролитного балансов, а также нарушения микроциркуляции, что ведет к снижению гемоперфузии всех органов, в том числе и миокарда. Так, на фоне лихорадки и гипотонии возрастает тахикардия, в условиях которой кардиомиоциты нуждаются в большем количестве кислорода и субстратах метаболизма (глюкозы, жирных кислот и др.), однако их доставка по венечным артериям снижается. Кислотно-основные нарушения, в свою очередь, сопровождаются нарушением работы ферментов, обеспечивающих энергетические процессы миокарда. Усиление гликолиза в миокарде приводит к дополнительному производству лактата, прогрессированию ацидоза, гипоксии и нарушению метаболических процессов, замыкая тем самым порочный патогенетический круг. В подобных условиях происходит обратимое или необратимое повреждение (гибель) клеток миокарда, что и приводит к высвобождению тропонинов [38, 39].
Есть мнение, что ведущую роль в альтерации кардиомиоцитов при сепсисе играют медиаторы воспаления: фактор некроза опухоли альфа (tumor necrosis factor, TNFa), интерлейкины (interleukin, IL) 1 и 6, бактериальные экзо- и эндотоксины и др., которые обладают прямым цитотоксическим действием. Это доказывается экспериментальным исследованием A. Kumar с соавт. Введение сыворотки, полученной от пациентов с сепсисом и содержащей медиаторы воспаления (TNFa, IL1 и др.), снижало амплитуду и скорость сокращения сердечных миоцитов [40]. Дополнительными механизмами повышения сердечных тропонинов у пациентов с сепсисом могут быть микротромбозы сосудов миокарда и усиление процессов апоптоза кардиомиоцитов. Кроме того, следует учитывать, что тяжелый сепсис и септический шок зачастую сопровождаются полиорганными нарушениями, в том числе почечной недостаточностью, при которой элиминация тропонинов из крови снижается. Об этом свидетельствует работа J. Wilhelm с соавт., в которой отмечена корреляция между hs-TnT и креатинином в сыворотке крови (r=0,554; p<0,001) [41]. Учитывая вышесказанное, очевидно, что механизмы повышения сердечных тропонинов при сепсисе многообразны, возможен их комплексный вклад с преобладанием какого-то определенного механизма в конкретной ситуации (причина сепсиса, степень тяжести).
Тропонины являются ценными прогностическими маркерами при сепсисе. Так, крупный метаанализ F. Bessiere с колл., объединивший в себе 13 оригинальных работ с 1227 пациентами с сепсисом, выявил, что повышенный уровень тропонина достоверно связан с повышенным риском смерти: отношение шансов (ОШ) 1,91; доверительный интервал (ДИ) 1,62-2,24 [38].
В нескольких исследованиях проводилось измерение высокочувствительных тропонинов у пациентов с сепсисом [41, 42]. Н. Rosjo с соавт. исследовали концентрацию cTnT и hs-cTnT у 207 пациентов с сепсисом, из них у 166 (80%) пациентов концентрация hs-cTnT была выше 99-го перцентиля, в то время как уровни умеренно чувствительного тро- понина (cTnT) оказались повышенными только у 86 (42%) человек. Наблюдалась корреляция уровней hs-cTnT с тяжестью заболевания (по шкале SAPS II, r=0,27, p<0,001), полиорганной дисфункцией (по шкале SOFA, r=0,30, p<0,001), концентрацией креатинина (r=0,32, p<0,001). Медианный уровень hs- cTnT был выше в группе умерших пациентов, чем в группе выживших (0,054 [0,022-0,227] против 0,035 [0,015-0,111] мкг/л; р=0,047), в то же время умеренно чувствительный тропонин Т достоверно не отличался в данных группах (р=0,14). Концентрации hs-cTnT у пациентов с септическим шоком оказались достоверно выше, чем у пациентов без шока (0,044 [0,0240,171] против 0,033 [0,012-0,103] мкг/л; р=0,03), тогда как уровни cTnT у пациентов с шоком и без шока не отличались [42]. Исходя из вышесказанного, можно заключить, что hs-cTnT гораздо лучше подходит для оценки степени тяжести и выживаемости пациентов с сепсисом, чем cTnT. Однако из-за столь частого повышения hs-cTnT могут возникнуть трудности при проведении дифференциальной диагностики.
Тропонины при нейрогенных патологиях (ишемическом инсульте, субарахноидальных, внутримозговых кровоизлияниях)
Во многих работах сообщалось о повышении сердечных тропонинов при инсультах и субарахноидальных кровоизлияниях.J. Jensen и соавт. обнаружили повышение тропонина Т у 25 (10%) из 244 пациентов с ишемическим инсультом. Пациенты с повышенным уровнем тропонина Т имели значительно повышенный риск (в 3,39 раза) смерти при 19-месячном наблюдении [43]. R. Sandhu с соавт. изучили взаимосвязь уровней кардиального тро- понина I с внутрибольничной смертностью пациентов с ишемическим инсультом, внутримозговым и субарахноидальным кровоизлиянием. Пациенты с ишемическим инсультом и повышенным уровнем тропонина I умирали гораздо чаще, чем пациенты с ишемическим инсультом и нормальными значениями тропонина I (65 против 4%; р<0,001). Летальные случаи у пациентов с внутримозговым кровоизлиянием и повышенным тропонином I встречались значительно чаще, чем у пациентов с внутримозговым кровоизлиянием и нормальными концентрациями тропонина I (64 против 24%; р<0,005). При субарахноидальном кровоизлиянии внутрибольничная смертность наблюдалась у 40% пациентов с повышенным уровнем тропонина I по сравнению с 11% с нормальным уровнем ингибирующей субъединицы (р<0,005). Тем самым исследователи пришли к выводу, что у пациентов с данными нейрогенными патологиями повышенные уровни тропонина I определяют прогноз [44].
Согласно крупному систематическому обзору, включившему 15 исследований (2901 пациент с инсультом), 18,1% участников имели повышенный уровень тропонина.
Распространенность в отдельно взятых исследованиях варьировала от 0 до 35%, скорее всего, из-за разных критериев исключения и разных тест-систем для определения тропонина и пороговых значений. Кроме того, тропонинположительные пациенты с большей вероятностью имели ишемические изменения на электрокардиограмме (ОШ 3,0; 95% ДИ 1,5-6,2) и повышенный риск смерти (ОШ 2,9; 95% ДИ 1,7-4,8) по сравнению с теми пациентами, у которых повышение тропонина отсутствовало [45].
Механизмы повышения кардиальных тропони- нов при инсультах и субарахноидальных кровоизлияниях до конца не установлены. Было выдвинуто предположение, что повышенные уровни сывороточного тропонина при остром инсульте обусловлены повреждением миокарда, вызванным сим- патоадреналовой активацией. Для проверки этой гипотезы M. Barber с соавт. провели исследование, в котором у пациентов с острым ишемическим инсультом (n=222) определяли концентрацию тропонина I и адреналина в сыворотке крови. У 20% пациентов наблюдалось повышение тропонина I выше референтного предела (>0,2 мкг/л). Тропонин- позитивные пациенты имели более высокие уровни адреналина (в среднем 0,27 против 0,17 нмоль/л; р=0,0002), и их электрокардиограммы с большей вероятностью имели признаки ишемии, напоминающие ОИМ. Тем самым авторы пришли к заключению, что активация симпатоадреналовой системы при остром инсульте является важным фактором повреждения миокарда [46].
Частота инсультов заметно увеличивается после ОИМ, особенно в ранние сроки. Степень ишемического повреждения головного мозга и локализация инсульта влияет на прогноз пациентов. У пациентов, выживших после инсульта, сердечно-сосудистые заболевания являются основными причинами долгосрочной смерти [47]. Некоторые исследователи полагают, что основным механизмом повышения тропонинов при инсульте является ишемия миокарда [48]. Однако, по данным других исследований, указанный механизм не может в полной мере объяснить повышение тропонинов при инсульте. Так, нарушения кровоснабжения по данным перфузионной сцинтиграфии миокарда не были более частыми/ выраженными у пациентов с инсультом и повышенными уровнями тропонинов при сравнении с темирым инсультом, у которых концентрация тропонинов была в норме.
Другие исследователи считают, что основными механизмами повышения тропонинов при инсульте являются почечная и сердечная недостаточность [49].
При инсультах и субарахноидальных кровоизлияниях отмечается систолическая дисфункция левого желудочка. У пациентов с субарахноидальными кровоизлияниями и нарушениями движения стенок не наблюдалось дефектов перфузии при сцинтиграфии миокарда и не отмечено никаких нарушений на коронарографии. Нарушения движения стенок были обратимыми [50, 51]. Систолическая дисфункция левого желудочка у людей с субарахноидальными кровоизлияниями связана с нормальной перфузией миокарда и аномальной симпатической иннервацией. Эти результаты могут быть объяснены чрезмерным выделением норэпи- нефрина из симпатических окончаний миокарда, которые могут повредить как кардиомиоциты, так и сами нервные окончания [51].
Основной причиной ишемического инсульта считается мерцательная аритмия. По данным I. Beaulieu-Boire и соавт., повышенные уровни тро- понина I являются предикторами возникновения фибрилляции предсердий у пациентов с острым ишемическим инсультом или транзиторными ишемическими атаками. У тропонинположительных пациентов при 24-часовом мониторировании электрокардиограммы по Холтеру фибрилляция возникала чаще, чем у лиц с нормальными уровнями тропонина (34,7 против 9,7%; р=0,004) [52].
Постоянно повышенные сывороточные уровни высокочувствительных тропонинов, превышающие 99-й перцентиль, могут свидетельствовать о хроническом повреждении миокарда. Исследователи L. Ryden и соавт. изучили связь между хроническим повреждением миокарда и инсультом. Из 19 640 человек хроническое повреждение миокарда (hs-TnT >14 нг/л) было зарегистрировано в 7,9% случаев. У пациентов с хроническим повреждением миокарда (hs-TnT >14 нг/л) риск инсульта увеличивается в 4 раза по сравнению с лицами, имеющими концентрацию hs-TnT менее 5 нг/л [53].
Тропонины при тромбоэмболии легочной артерии
Легочная эмболия является нередкой причиной элевации тропонинов. При этом примерно у 50% пациентов возникают «коронароподобные» боли, что обусловливает трудности и ошибки дифференциальной диагностики [54].
Основной механизм высвобождения тропонинов из кардиомиоцитов при тромбоэмболии легочной артерии (ТЭЛА) окончательно не установлен. Острые деформации правого желудочка в ответ на увеличенное сопротивление легочной артерии могут приводить к повышению тропонинов при ТЭЛА. Так, T. Meyer с соавт. отметили, что 62,5% пациентов с дилатацией правого желудочка имели повышенный уровень тропони- на I, в то время как 28,6% тропонинположительных пациентов имели нормальный диаметр правого желудочка. Повышенный тропонин был значительно связан с дилатацией правого желудочка (p=0,009). Кроме того, у пациентов с повышенным тропони- ном I оказалось значительно большее количество сегментарных дефектов при сканировании легких при помощи вентиляционно-перфузионной сцинти- графии по сравнению с тропонинотрицательными пациентами (p=0,0002) [55].
Другим объяснением повышенного уровня тро- понинов при ТЭЛА может быть гипоксемия из-за несоответствия перфузии и вентиляции. У некоторых пациентов, умерших от массивной ТЭЛА, при вскрытии были обнаружены изолированные инфаркты правого желудочка с интактными коронарными артериями [56].
В исследовании [57] показано, что кинетика высвобождения тропонина Т при инфаркте миокарда и ТЭЛА значительно отличается. Так, пиковые концентрации тропонина Т были ниже, чем при ОИМ. Тропонин Т циркулировал в повышенных концентрациях при ТЭЛА гораздо менее продолжительное время (30-40 ч), чем при ОИМ (более 120 ч). На основании этих данных исследователи предположили, что механизм повреждения миокарда и выхода тропонинов у пациентов с ТЭЛА отличаются от такового у пациентов с ОИМ [57].
Некоторые исследователи считают, что механизм высвобождения тропонинов при ТЭЛА зависит от степени ее тяжести. При легкой ТЭЛА высвобождение тропонинов осуществляется из цитозольного пула, тогда как при среднетяжелой и массивной ТЭЛА возникает необратимая ишемия и гибель кардиомиоцитов. По данным E. Giannitsis c соавт., повышение сердечных тропонинов зависит от объема поражения сосудистого русла легких: при массивной ТЭЛА тропонин повышен у 50% пациентов, при субмассивной — примерно у 35%, а при немассивной ТЭЛА — практически не происходит. Смертность в стационаре, кардиогенный шок и необходимость в реанимации были более распространены у пациентов с повышенным значением cTnT. Тропонинпозитивные пациенты чаще нуждались в инотропной поддержке и искусственной вентиляции легких [58].
Согласно объемному метаанализу C. Becattini с соавт. (20 исследований; 1985 пациентов), повышенные уровни тропонинов были в значительной степени связаны со смертностью в краткосрочный период (в стационаре или в течение последующих 30 дней) (ОШ 5,24; 95% ДИ 3,28-8,38), смертью в результате ТЭЛА (ОШ, 9,44; 95% ДИ 4,14-21,49) и с неблагоприятными исходами (ОШ 7,03; 95% ДИ 2,42-20,43) [59].
В другом метаанализе (9 исследований; 1366 нормотензивных пациентов с острой симптоматической ТЭЛА) повышенные уровни тропонинов у пациентов увеличивали вероятность смерти в краткосрочный период в 4,26 раза [60].
Исследователи J. Kim и соавт. предлагают использовать соотношение D-димеры / тропонин I для дифференциальной диагностики ТЭЛА и ОИМ. Авторами проведено ретроспективное исследование, которое включило 771 пациента с инфарктом миокарда и 233 — с острой ТЭЛА. Повышение D-димеров зафиксировано примерно у половины (49,5%) пациентов с инфарктом миокарда, а концентрация cTnl была повышена у 38,6% пациентов с ТЭЛА.
Пороговые значения для дифференциации ТЭЛА и инфаркта миокарда составили 1,12 мг/л для D-димера (чувствительность 81,1%, специфичность 70,2%) и 0,72 нг/мл для cTnl (чувствительность 80,6%, специфичность 78,9%). А при использовании значения отношения D-димеры / cTnl >1,82 в дифференциальной диагностике ТЭЛА от инфаркта миокарда чувствительность и специфичность были значительно выше диагностической ценности отдельных маркеров и составили 93,3 и 86,6% соответственно. При использовании данного соотношения можно избежать такого инвазивного исследования, как коронарография [61].
Ложноположительные тропонины
В некоторых случаях повышенные концентрации тропонинов не могут быть объяснены, несмотря даже на тщательное клиническое обследование. Такие случаи называются ложноположительными и чаще всего связаны со следующими причинами: гетерофильными антителами, ревматоидным фактором, щелочной фосфатазой, перекрестными реакциями с тропонинами скелетных мышц и др. [62-65].
Гетерофильные антитела генерируются В-лимфоцитами в ответ на воздействие антигенов: контакт с животными антигенами (мыши, кролики и др.), переливание крови, вакцинация и использовании моноклональных антител в лечении онкологических заболеваний. В систематическом литературном анализе G. Lippi и соавт. дается описание 16 оригинальных работ, в которых продемонстрировано влияние гетерофильных антител на концентрацию сердечных тропонинов. Частота интерференции колеблется от 0,1 до 3,0% и является практически непредсказуемой, может затронуть как тропонин I, так и тропонин Т тест-системы любого производителя [62]. Механизм ложного повышения тропонинов при действии гетерофильных антител обусловлен их способностью перекрестно взаимодействовать с диагностическими антителами, входящими в состав иммуноанализа. Ложноположительный результат определения тропонина является напоминаем о том, что, хотя тропонин и играет важную роль в диагностике ОИМ, он не должен быть единственным критерием для установления данного диагноза. В клиническом случае сообщается о значительном завышении тропонина I (Beckman Access, США) у пациента, поступившего с болью в груди (41 нг/мл при норме 0,5). При тщательном клиническом обследовании врачи- клиницисты исключили у пациента ОИМ и предположили наличие ложноположительнего результата. В пользу данного предположения также свидетельствовали отрицательные значения тропони- на I, измеренные на нескольких других коммерческих наборах (Abbott, Bayer, Roche). Впоследствии в лаборатории производителей Beckman Coulter (США) окончательно установлен факт влияния на результат анализа гетерофильных антител. После добавления реагента-блокатора гетерофильных антител произошло снижение концентрации тропо- нина I до нормальных значений [63].
У пациентов с аутоиммунными заболеваниями (ревматоидный артрит, системная красная волчанка и др.) основной причиной ложнозавышенных тропонинов является ревматоидный фактор. По данным А. Al-Awadhi и соавт., у 5 из 50 пациентов с серопозитивным ревматоидным артритом концентрация тропонина I была выше 0,1 нг/мл (диагностический порог для ОИМ), тогда как ни у одного пациента с серонегативным ревматоидным артритом концентрация тропонина I не превышала референтного предела.
Однофакторный регрессионный анализ показал наличие взаимосвязи между концентрациями тропонина I и ревматоидного фактора (r=0,35; p<0,02) [64].
Иммуноанализы, использующие щелочную фосфатазу в качестве компонента иммунохимической реакции, подвержены влиянию эндогенной щелочной фосфатазы [65]. Впервые о влиянии щелочной фосфатазы на концентрацию тропонина сообщили A. Dasgupta и соавт. При активности щелочной фосфатазы 46 Ед/л концентрация тропонина I в образце сыворотки крови была 0,5 нг/мл. Затем исследователи добавляли к сыворотке растворы с щелочной фосфатазой, чтобы повысить активность данного фермента и оценить влияние на концентрацию тро- понина. При активности щелочной фосфатазы 129 Ед/л концентрация тропонина I повысилась до 4,3 нг/ мл. Дальнейшее повышение активности щелочной фосфатазы до 222,913 Ед/л также сопровождалось ростом концентрации тропонина I до 9,4 и 40,1 нг/ мл соответственно [66]. Другие тест-системы, в которых щелочная фосфатаза не используется в качестве компонента иммунохимической реакции, не подвержены данному влиянию. В недавнем исследовании R. Marinheiro и соавт. также доказано, что причиной ложноположительного результата тропонина I у пациента была щелочная фосфатаза [67].
Перекрестные реакции коммерческих (диагностических) антител к кардиальным тропонинам со скелетными изоформами тропонинов считались частым явлением для самых первых иммунотестов I и II поколения, которые на данный момент практически не используются в клинической практике. Недавно группа австрийских исследователей под руководством J. Schmid сообщила о повышении высокочувствительных тропонинов Т и I у пациентов со скелетными миопатиями. Hs-cTnT оказался повышен у 68,9% пациентов с миопатиями, а hs- cTnI — у 4,1%. Значения hs-cTnT тесно коррелировали с креатинкиназой и миоглобином (r=0,679 и 0,786 соответственно; p<0,001).
Экспрессию сердечных изоформ тропонинов в скелетных мышцах, о которых сообщали в некоторых работах, данные ученые не обнаружили. Наиболее вероятной причиной повышения hs-cTnT и hs-cTnT, по мнению авторов, была перекрестная реакция [68].
ЗАКЛЮЧЕНИЕ
У пациентов с некоронарогенными заболеваниями (почечная недостаточность, миокардиты, эндокардиты, сепсис, инсульт, субарахноидальные кровоизлияния, тромбоэмболия легочной артерии) повышение сердечных тропонинов происходит очень часто, что следует учитывать в клинической практике при проведении дифференциальной диагностики.
При неправильной интерпретации результата пациенту может быть нанесен вред в виде некорректного лечения и его последствий. Кардиальные тропонины при данных некоронарогенных патологиях являются ценными прогностическими биомаркерами. Конкретные механизмы повышения тропонинов окончательно не установлены, что нуждается в дальнейшем изучении. Отдельного внимания также заслуживают ложноположительные причины повышения сердечных тропонинов. Устранение механизмов, ведущих к ложноположительным результатам, является предметом дальнейших исследований.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Исследование и публикация статьи осуществлены на личные средства авторского коллектива.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы данной статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
УЧАСТИЕ АВТОРОВ
А.М. Чаулин — получение и анализ литературных данных, написание статьи, редактирование статьи, утверждение окончательной версии для публикации, полная ответственность за содержание; Л.С. Карслян, Д.В. Дупляков — редактирование статьи, утверждение окончательной версии для публикации, полная ответственность за содержание.
СПИСОК ЛИТЕРАТУРЫ
1. Дупляков Д.В., Чаулин А.М. Мутации сердечных тропонинов, ассоциированные с кардиомиопатиями // Кардиология: новости, мнения, обучение. — 2019. — Т.7. — №3. — С. 8-17. [Duplyakov DV, Chaulin AM. Mutations of heart troponines, associated with cardiomyopathies. Cardiology: News, Opinions, Training. 2019;7(3):8-17. (In Russ.)]. doi: 10.24411/2309-1908-2019-13001.
2. Thygesen K, Alpert J, Jaffe A, et al.; ESC Scientific Document Group. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40(3):237-269. doi: 10.1093/eurheartj/ehy462.
3. Вельков В. В. Революция в кардиологии; высокочувствительное измерение кардиальных тропонинов: «тропонин- отрицательных» больше нет // Клинико-лабораторный консилиум. — 2011. — №4. — С. 24-43. [Velkov VV. The revolution in cardiology — high sensitive measurement of the cardiac troponins: no any “troponin negative”. Kliniko-laboratornyy konsilium. 2011;(4):24-43. (In Russ.)]
4. Lazzarino AI, Hamer M, Gaze D, et al. The association between cortisol response to mental stress and high sensitivity cardiac troponin T plasma concentration in healthy adults. J Am Coll Cardiol. 2013;62(18):1694-1701. doi: 10.1016/j.jacc.2013.05.070.
5. Rifai N, Douglas PS, O’Toole M, et al. Cardiac troponin T and I, echocardiographic [correction of eclectrocardiographic] wall motion analyses, and ejection fractions in athletes participating in the Hawaii Ironman Triathlon. Am J Cardiol. 1999;83(7):1085-1089. doi: 10.1016/s0002-9149(99)00020-x.
6. Richardson AJ, Leckie T, Watkins ER, et al. Post marathon cardiac troponin T is associated with relative exercise intensity. J Sci Med Sport. 2018;21(9):880-884. doi: 10.1016/j.jsams.2018.02.005.
7. White HD. Pathobiology of troponin elevations: do elevations occur with myocardial ischemia as well as necrosis? J Am Coll Cardiol. 2011;57(24):2406-2408. doi: 10.1016/j.jacc.2011.01.029.
8. Katrukha IA, Kogan AE, Vylegzhanina AV, et al. Thrombin- mediated degradation of human cardiac troponin T. Clin Chem. 2017;63(6):1094-1100. doi: 10.1373/clinchem.2016.266635
9. Zahran S, Figueiredo VP, Graham MM, et al. Proteolytic digestion of serum cardiac troponin I as marker of ischemic severity. J Applied Laboratory Med. 2018;3(3):1-6. doi: 10.7939/R30K26R76.
10. Katrukha IA, Kogan AE, Vylegzhanina AV, et al. Full-size cardiac troponin I and its proteolytic fragments in blood of patients with acute myocardial infarction: antibody selection for assay development. Clin Chem. 2018;64(7):1104-1112. doi: 10.1373/ clinchem.2017.286211.
11. Ziebig R, Lun A, Hocher B, et al. Renal elimination of troponin T and troponin I. Clin Chem. 2003;49(7):1191-1193. doi: 10.1373/49.7.1191.
12. Ellis K, Dreisbach AW, Lertora J. Plasma elimination of cardiac troponin I in end-stage renal disease. South Med J. 2001;94(10):993-996. doi: 10.1097/00007611-200194100-00011.
13. Dubin
RF, Li Y, He J, et al. Predictors of high sensitivity cardiac troponin T in
chronic kidney disease patients: a cross-sectional study in the chronic renal
insufficiency cohort (CRIC). BMC Nephrol. 2013;14:229.
14. Pervan P, Svagusa T, Prkacin I, et al. Urine high-sensitive troponin I measuring in patients with hypertension. Signa Vitae. 2017;13(3):62-64. doi: 10.22514/SV133.062017.13.
15. Ricchiutti V, Apple FS. RNA expression of cardiac troponin T isoforms in diseased human skeletal muscle. Clin Chem. 1999;45(12):2129-2135.
16. Haller C, Zehelein J, Remppis A, et al. Cardiac troponin T in patients with end stage renal disease: Absence of expression in truncal skeletal muscle. Clin Chem. 1998;44(5):930-938.
17. Wang Q, Michiue T, Ishikawa T, et al. Combined analyses of creatine kinase MB, cardiac troponin I and myoglobin in pericardial and cerebrospinal fluids to investigate myocardial and skeletal muscle injury in medicolegal autopsy cases. Leg Med (Tokyo). 2011;13(5):226-232. doi: 10.1016/j.legalmed.2011.05.002.
18. Бунин В.А., Козлов К.Л., Линькова Н.С., Пальцева Е.М. Повышение концентрации тропонина-1 в слюне пациентов с ишемической болезнью сердца коррелирует со стадией развития заболевания // Комплексные проблемы сердечно-сосудистых заболеваний. — 2017. — Т.6. — №S4. — С. 13-14. [Bunin VA, Kozlov KL, Linkova NS, Paltseva EM. An increase in troponin-I concentration in the saliva of patients with coronary heart disease correlates with the stage of disease development. Kompleksnyye problemy ser- dechno-sosudistykh zabolevaniy. 2017;6(S4):13-14. (In Russ.)].
19. Mirzaii-Dizgah I, Riahi E. Salivary troponin I as an indicator of myocardial infarction. Indian J Med Res. 2013;138(6):861-865.
20. Jeremias A, Gibson CM. Narrative review: alternative causes for elevated cardiac troponin levels when acute coronary syndromes are excluded. Ann Intern Med. 2005;142(9):786-791. doi: 10.7326/0003-4819-142-9-200505030-00015.
21. Zellweger MJ, Schaer BA, Cron TA, et al. Elevated troponin levels in absence of coronary artery disease after supraventricular tachycardia. Swiss Med Wkly. 2003;133(31-32):439-441. doi: 2003/31/smw-10288. heart rate. Can J Cardiol. 2011;27(1):105-109. doi: 10.1016/j. cjca.2010.12.004.
25. Xue F, Jiang TB, Jiang B, et al. Cardiac troponin I elevation with supraventricular tachycardia: two case reports and review of the literature. BMC Res Notes. 2014;7:136. doi: 10.1186/1756-0500-7-136.
26. Lauer B, Niederau C, Kuhl U, et al. Cardiac troponin T in patients with clinically suspected myocarditis. J Am Coll Cardiol. 1997;30(5):1354-1359. doi: 10.1016/S0735-1097(97)00317-3.
27. Soongswang J, Durongpisitkul K, Nana A, et al. Cardiac troponin T: a marker in the diagnosis of clinically suspected acute myocarditis and chronic dilated cardiomyopathy in children. Pediatr Cardiol. 2005;26(1):45-49.
28. Soongswang
J, Durongpisitkul K, Ratanarapee S, et al. Cardiac troponin T: its role in the
diagnosis of clinically suspected acute myocarditis and chronic dilated
cardiomyopathy in children. Pediatr Cardiol. 2002;23(5):531-535.
29. Dancea AB. Myocarditis in infants and children: a review for the paediatrician. Paediatr Child Health. 2001;6(8):543-545. doi: 10.1093/pch/6.8.543.
30. Chang YJ, Hsiao HJ, Hsia SH, et al. Analysis of clinical parameters and echocardiography as predictors of fatal pediatric myocarditis. PLoS One. 2019;14(3):e0214087. doi: 10.1371/journal. pone.0214087.
31. Ukena C, Kindermann M, Mahfoud F, et al. Diagnostic and prognostic validity of different biomarkers in patients with suspected myocarditis. Clin Res Cardiol. 2014;103(9):743-751. doi: 10.1007/s00392-014-0709-z.
32. Чаулин А.М., Карслян Л.С., Григорьева Е.В., Нурбалтаева Д.А., Дупляков Д.В. Особенности метаболизма сердечных тропонинов (обзор литературы) // Комплексные проблемы сердечно-сосудистых заболеваний. — 2019. — Т.8. — №4. — С. 103-115. [Chaulin AM, Karslyan LS, Grigorieva EV, Nurbaltaeva DA, Duplyakov DV. Metabolism of cardiac troponins (literature review). Complex Issues of Cardiovascular Diseases. 2019;8(4):103- 115. (In Russ.)]
33. Matsumori A, Shimada T, Hattori H, et al. Autoantibodies against cardiac troponin I in patients presenting with myocarditis. CVD Prevention Control. 2011;6(2):41-46. doi: 10.1016/j.cv- dpc.2011.02.004.
34. Eriksson S, Hellman J, Pettersson K. Autoantibodies against cardiac troponins. N Engl J Med. 2005;352(1):98-100. doi: 10.1056/ N EJM200501063520123.
35. Tsenovoy P, Aronow WS, Joseph J, Kopacz MS. Patients with infective endocarditis and increased cardiac troponin I levels have a higher incidence of in-hospital mortality and valve replacement than those with normal cardiac troponin I levels. Cardiology. 2009;112(3):202-204. doi: 10.1159/000149573.
36. Purcell JB, Patel M, Khera A, et al. Relation of troponin elevation to outcome in patients with infective endocarditis. Am J Cardiol. 2006;101(10):1479-1481. doi: 10.1016/j.amjcard.2008.01.031.
37. Imazio M, Demichelis B, Cecchi E, et al. Cardiac troponin I in acute pericarditis. J Am Coll Cardiol. 2003;42(12):2144-2148. doi: 10.1016/j.jacc.2003.02.001.
38. Bessiere F, Khenifer S, Dubourg J, et al. Prognostic value of troponins in sepsis: a meta-analysis. Intensive Care Med. 2013;39(7):1181-1189. doi: 10.1007/s00134-013-2902-3.
39. Sharma AC. Sepsis-induced myocardial dysfunction. Shock. 2007;28(3):265-269. doi: 10.1097/01.shk.0000235090.30550.fb.
40. Kumar A, Kumar A, Paladugu B, et al. Transforming growth factor-beta 1 blocks in vitro cardiac myocyte depression induced by tumour necrosis factor-alpha, interleukin-1 beta, and human septic shock serum. Crit Care Med. 2007;35(2):358-364. doi: 10.1097/01.
22. Bakshi TK, Choo MK, Edwards CC, et al. Causes of elevated troponin I with a normal coronary angiogram. Intern Med J. 2002;32(11):520-525. doi: 10.1046/j.1445-5994.2002.00270.x.
23. Bukkapatnam RN, Robinson M, Turnipseed S, et al. Relationship of myocardial ischemia and injury to coronary artery disease in patients with supraventricular tachycardia. Am J Cardiol. 2010;106(3):374-377. doi: 10.1016/j.amjcard.2010.03.035.
24. Ben Yedder N, Roux JF, Paredes FA. Troponin elevation in supraventricular tachycardia: primary dependence on CCM.0000254341.87098.A4.
41. Wilhelm J, Hettwer S, Schuermann M, et al. Elevated troponin in septic patients in the emergency department: frequency, causes, and prognostic implications. Clin Res Card. 2014;103(7):561-567. doi: 10.1007/s00392-014-0684-4.
42. Rosjo H, Varpula M, Hagve TA, et al. Circulating high-sensitive troponin T in severe sepsis and septic shock: distribution, associated factors, and relation to outcome. Int Care Med. 2011;37(1):77- 85. doi: 10.1007/s00134-010-2051-x.
43. Jensen JK, Kristensen SR, Bak S, et al. Frequency and significance of troponin T elevation in acute ischemic stroke. Am J Cardiol. 2007;99(1):108—112. doi: 10.1016/j.amjcard.2006.07.071.
44. Sandhu R, Aronow WS, Rajdev A, et al. Relation of cardiac troponin I levels with in-hospital mortality in patients with ischemic stroke, intracerebral hemorrhage, and subarachnoid hemorrhage. Am J Cardiol. 2008;102(5):632-634.
45. Kerr G, Ray G, Wu O, et al. Elevated troponin after stroke: a systematic review. Cerebrovasc Dis. 2009;28(3):220-226. doi: 10.1159/000226773.
46. Barber M, Morton JJ, Macfarlane PW, et al. Elevated troponin levels are associated with sympathoadrenal activation in acute ischaemic stroke. Cerebrovasc Dis. 2007;23(4):260-266. doi: 10.1159/000098325.
47. Dixit S, Castle M, Velu RP, et al. Cardiac involvement in patients with acute neurologic disease: confirmation with cardiac troponin I. Arch Intern Med. 2000;160(20):3153-3158. doi: 10.1001/ archinte.160.20.3153.
48. Fure B, Bruun Wyller T, Thommessen B. Electrocardiographic and troponin T changes in acute ischaemic stroke. J Intern Med. 2006;259(6):592-597. doi: 10.1111/j.1365-2796.2006.01639.x.
49. Jensen JK, Atar D, Mickley H. Mechanism of troponin elevations in patients with acute ischemic stroke. Am J Cardiol. 2007;99(6):867-870. doi: 10.1016/j.amjcard.2006.10.052.
50. Banki NM, Kopelnik A, Dae MW, et al. Acute neurocardiogenic injury after subarachnoid hemorrhage. Circulation. 2005;112(21):3314- 3319. doi: 10.1161/CIRCULATIONAHA.105.558239.
51. Kono T, Morita H, Kuroiwa T, et al. Left ventricular wall motion abnormalities in patients with subarachnoid hemorrhage: neurogenic stunned myocardium. J Am Coll Cardiol. 1994;24(3):636- 640. doi: 10.1016/0735-1097(94)90008-6.
52. Beaulieu-Boire I, Leblanc N, Berger L, Boulanger JM. Troponin elevation predicts atrial fibrillation in patients with stroke or transient ischemic attack. J Stroke Cerebrovasc Dis. 2013;22(7):978- 983. doi: 10.1016/j.jstrokecerebrovasdis.2012.01.008.
53. Ryden L, Roos A, Holzmann MJ. Chronic myocardial injury and risk for stroke. Am J Med. 2019;132(7):833-839. doi: 10.1016/j. amjmed.2019.01.027.
54. Разин В.А., Сапожников А.Н., Мазурова О.В., Гимаев Р.Х. Тромбоэмболия легочной артерии: особенности диагностики и лечения в условиях отделения острого коронарного синдрома // Ульяновский медико-биологический журнал. — 2012. — №1. — С. 13-16. [Razin VA, Sapozhnikov AN, Mazurova OV, Gimaev RH. Pulmonary embolism: features diagnosis and treatment in the office of acute coronary syndrome. Ulyanovsk Medico-Biological Journal. 2012;(1):13-16. (In Russ.)]
55. Meyer T, Binder L, Hruska N, et al. Cardiac troponin I elevation in acute pulmonary embolism is associated with right ventricular dysfunction. J Am Coll Cardiol. 2000;36(5):1632-1636. doi: 10.1016/s0735-1097(00)00905-0.
56. Coma-Canella I, Gamallo C, Martinez Onsurbe P, Lopez-Sendon J. Acute right ventricular infarction secondary to massive pulmonary embolism. Eur Heart J. 1988;9(5):534-540. doi: 10.1093/oxfordjournals.eurheartj.a062540.
57. Muller-Bardorff M, Weidtmann B, Giannitsis E, et al. Release kinetics of cardiac troponin T in survivors of confirmed severe pulmonary embolism. Clin Chem. 2002;48(4):673-675.
58. Giannitsis E, Muller-Bardorff M, Kurowski V, et al. Independent prognostic value of cardiac troponin T in patients with confirmed pulmonary embolism. Circulation. 2000;102:211-217. doi: 10.1161/01.CIR.102.2.211.
59. Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation. 2007;116(4):427-433. doi: 10.1161/CIRCULATIONAHA.106.680421.
60. Jimenez D, Uresandi F, Otero R, et al. Troponin-based risk stratification of patients with acute nonmassive pulmonary embolism: systematic review and metaanalysis. Chest. 2009;136(4):974- 982. doi: 10.1378/chest.09-0608.
61. Kim JY, Kim KH, Cho JY, et al. D-dimer/troponin ratio in the differential diagnosis of acute pulmonary embolism from non-ST elevation myocardial infarction. Korean J Intern Med. 2019;34(6):1263- 1271. doi: 10.3904/kjim.2018.153.
62. Lippi G, Aloe R, Meschi T, et al. Interference from het- erophilic antibodies in troponin testing. Case report and systematic review of the literature. Clin Chim Acta. 2013;426:79-84. doi: 10.1016/j.cca.2013.09.004.
63. Lum G, Solarz DE, Farney L. False positive cardiac troponin results in patients without acute myocardial infarction. Lab Med. 2006;37(9):546-550. doi: 10.1309/T94UUXTJ3TX5Y9W2.
64. Al-Awadhi AM, Olusi S, Hasan EA, Abdullah A. Serum concentrations of cardiac troponin-I in patients with rheumatoid arthritis, systemic lupus erythematosus, primary Sjogren’s syndrome and Graves’ disease. Singapore Med J. 2007;48(9):847-849.
65. Чаулин А.М., Карслян Л.С., Григорьева Е.В., Нурбалтае- ва Д.А., Дупляков Д.В. Клинико-диагностическая ценность кардиомаркеров в биологических жидкостях человека // Кардиология. — 2019. — Т.59 — №11. — С. 66-75. [Chaulin AM, Karslyan LS, Bazyuk EV, Nurbaltaeva DA, Duplyakov DV. Clinical and Diagnostic Value of Cardiac Markers in Human Biological Fluids. Kardi- ologiia. 2019;59(11):66-75. (In Russ.)]. DOI:10.18087/cardio.2019.11. n414
66. Dasgupta A, Chow L, Wells A, Datta P. Effect of elevated concentration of alkaline phosphatase on cardiac troponin I assays. J Clin Lab Anal. 2001;15(4):175-177. doi: 10.1002/jcla.1023.
67. Marinheiro R, Amador P, Parreira L, et al. False positive troponin I rendering two admissions for “recurrent acute myopericarditis”. Open Cardiovasc Med J. 2018;12:55-58. doi: 10.2174/1874192401812010055.
68. Schmid J, Liesinger L, Birner-Gruenberger R, et al. Elevated cardiac troponin T in patients with skeletal myopathies. J Am Coll Cardiol. 2018;71(14):1540-1549. doi: 10.1016/j.jacc.2018.01.070.
КОНТАКТНАЯ ИНФОРМАЦИЯ
Чаулин Алексей Михайлович аспирант/ассистент кафедры Самарского государственного медицинского университета; врач Самарского областного клинического кардиологического диспансера; адрес: 443045, Самара, ул. Аэродромная, д. 43,
Карслян Лиля Степановна к.м.н., доцент Самарского государственного медицинского университета, тел.: +7 (846) 373-70-64
Дупляков Дмитрий Викторович д.м.н., профессор Самарского государственного медицинского университета, тел.: +7 (846) 373-70-64
Теги: тропонины
234567 Начало активности (дата): 27.07.2023 11:41:00
234567 Кем создан (ID): 989
234567 Ключевые слова: тропонины, почечная недостаточность, эндокардит, миокардит, сепсис, инсульт, субарахноидальное кровоизлияние, тромбоэмболия легочной артерии, ложноположительные результаты
12354567899
Похожие статьи
Популярные витамины портят результаты анализовРентген на дому 8 495 22 555 6 8
COVID-19 и сердечно-сосудистая система. Часть 1 Патофизиология, патоморфология, осложнения, долгосрочный прогноз
Тромбоэмболия легочной артерии: алгоритмы диагностики и лечения
Тромбоэмболия легочной артерии: принципы диагностики, антитромботическая терапия и профилактика



