 03.07.2023
03.07.2023
Непосредственные изменения пульсового кровенаполнения в суставных концах подвздошной и бедренной костей после их туннелирования при болезни Пертеса
При болезни Пертеса I-II стадии в головке бедренной кости из-за нарушений венозного оттока повышается внутрикостное давление тканевой жидкости (ВКД), микроциркуляторное русло сдавливается, и пульсовое кровенаполнение ограничивается.
ВВЕДЕНИЕ
При болезни Пертеса в I—II стадии вследствие нарушений оттока крови по центральной огибающей вене в головке бедренной кости повышается венозное давление и, соответственно, внутрикостное давление тканевой жидкости (ВКД), микроциркуляторное русло полостей кости сдавливается тканевой жидкостью и ограничивает ток крови [1-13].
Чтобы вторичная недостаточность кровообращения не замедляла регенерацию тканей, появились рекомендации туннелировать проксимальный отдел бедренной кости для декомпрессии его сосудов и обеспечения пересадки в головку бедренной кости костного мозга или ангиогенных и остеогенных клеток-предшественников с факторами активации восстановления тканей [14-21]. В ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» у пациентов с болезнью Пертеса для разгрузки тазобедренного сустава применяют аппарат внешней фиксации, перед наложением которого при фрагментации головки бедренной кости туннелируют спицами проксимальный отдел этой кости и надверт-лужную область подвздошной кости, а затем в головку бедренной кости через туннели вводят аспират из крыла подвздошной кости как среду для факторов, активирующих восстановление тканей [22-27]. Изначально концы костей, образующих тазобедренный сустав, туннелировали в произвольном порядке, однако была замечена зависимость пульсовой волны кровенаполнения в головке бедренной кости от порядка их туннелирования, и было проведено исследование.
Цель исследования: у пациентов с болезнью Пертеса изучить зависимость пульсовой волны кровенаполнения в головке бедренной кости от последовательности туннелирования надвертлужной области подвздошной кости и проксимального отдела бедренной кости.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено с соблюдением этических норм - при письменном согласии родителей на оперативное вмешательство и публикацию результатов без идентификации личности. Всего в исследовании участвовало 47 пациентов в возрасте 6-9 лет, 13 (29 %) из которых были девочки.
Критерии включения в исследование: болезнь Пертеса II стадии (фрагментации) по Waldenstrom, III— IV группа по Catterall, группы В/С и С по Herring.
Критерии исключения: асептический некроз головки бедренной кости другой этиологии, I, III, IV стадии болезни Пертеса, болезнь Пертеса II стадии I-II групп по Catterall, группы A и B по Herring.
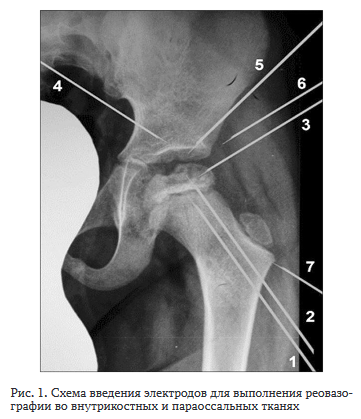
Пульсовую волну кровенаполнения регистрировали с помощью Реографа-полианализатора РГПА-6/12 ”РЕ-АН-ПОЛИ” (МЕДИКОМ-МТД, г. Таганрог) при силе зондирующего электрического тока 1,5 мА и частоте 56 Гц одновременно во внутрикостных и параоссаль-ных тканях сначала головки бедренной кости, затем снаружи от проксимальной зоны роста бедренной кости и после этого в надвертлужной области подвздошной кости. В условиях операционной перед планируемым оперативным вмешательством в изучаемые участки кости вводили спицы для чрескостного остеосинтеза диаметром 1,8 мм, которые служили электродами и положение которых после установки не меняли (рис. 1).
С помощью спиц 1—3 выявляли пульсовую волну кровенаполнения во внутрикостных тканях снаружи от проксимальной зоны роста бедренной кости, спиц 2—3 — во внутрикостных тканях головки бедренной кости, спиц 4—5 — во внутрикостных тканях надверт-лужной области подвздошной кости, спиц 3—7 — в параоссальных тканях над проксимальным отделом бедренной кости, спиц 4—6 — в параоссальных тканях над надвертлужной областью подвздошной кости. Относительное снижение импеданса (сопротивления зондирующему переменному току) внутрикостных тканей, необходимое для замыкания электрического тока, определяли на мониторе. Об изменениях реографического индекса (РИ) судили на основании достоверности различий средних с помощью Ехсе! и Т-критерия Вилкоксона для связанных выборок.
У 6 пациентов, 1 группа, сначала туннелировали надвертлужную область подвздошной кости, затем головку и шейку бедренной кости, после чего водили аспират в головку бедренной кости. У 41 пациента, 2 группа, сначала туннелировали головку бедренной кости, затем надвертлужную область подвздошной кости, и после этого у 27 пациентов вводили аспират в головку бедренной кости.
РЕЗУЛЬТАТЫ
У пациентов первой группы до туннелирования РИ в головке бедренной кости имел минимальную величину. После туннелирования надвертлужной области подвздошной кости РИ уменьшился во всех изучаемых внутрикостных тканях. В головке бедренной кости его уменьшение было наименее выражено (табл. 1).
Последующее туннелирование проксимального отдела бедренной кости привело к увеличению РИ во всех изучаемых тканях. В надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости увеличение было компенсаторным, в головке бедренной кости показатель превысил величину до туннелирования, однако превышение было статистически недостоверно (табл. 2).
После введения аспирата в головку бедренной кости РИ компенсаторно увеличился в надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости и уменьшился в головке бедренной кости, вследствие чего распределение его величин стало соответствовать таковому до начала туннелирования: в головке бедренной кости его величина стала минимальной (табл. 3).
У пациентов второй группы до туннелирования РИ в головке бедренной кости имел минимальную величину. После туннелирования головки и шейки бедренной кости РИ статистически достоверно увеличился только в головке бедренной кости (табл. 4). Последующее туннелирование надвертлужной области подвздошной кости привело к уменьшению РИ во внутрикостных тканях этой области, увеличению снаружи от проксимальной зоны роста и дополнительному увеличению в головке бедренной кости (табл. 5).
После введения аспирата в головку бедренной кости распределение РИ стало соответствовать таковому до начала туннелирования у пациентов второй группы: в головке бедренной кости его величина стала меньше, чем во внутрикостных тканях надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости (табл. 6).
ОБСУЖДЕНИЕ
Движущаяся кровь - электролит, оказывающий поэтому при реовазографии замыкание зондирую-наиболее низкое сопротивление электрическому току, щего электрического тока реографа происходит преимущественно по крови, и изменения импеданса (комплексное сопротивление тканей зондирующему току) пропорциональны изменениям кровенаполнения пульсовой волны. Реографический индекс (РИ) - отношение амплитуды пульсовой волны кровенаполнения к высоте стандартного калибровочного сигнала, признан эквивалентом пульсового кровенаполнения сосудов межэлектродного пространства [28, 29].
Вещество кости имеет высокое электрическое сопротивление [30]. Разделяя внутрикостные и параоссальные ткани, оно создаёт возможность раздельного замыкания зондирующего электрического тока в этих тканях. Чтобы замыкание шло во внутрикостных тканях, снижали их импеданс: уменьшали расстояние между концами введенных в кость спиц относительно расстояния между участками этих же спиц в параос-сальных (внекостных) тканях.
Изначальное и сохраняющееся в течение исследования снижение импеданса внутрикостных тканей обеспечивало возможность применения спиц-электродов без изолирующего покрытия [31, 32].
У пациентов обеих групп изначально пульсовое кровенаполнение тканей головки бедренной кости было меньше, чем надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости.
У пациентов 1 группы туннелирование надвертлужной области подвздошной кости приводило к уменьшению пульсового кровенаполнения изучаемых тканей. Известна типичная реакция на травму - посттравматический ангиоспазм (преходящее повышение тонуса стенок сосудов) [30]. Следовательно, от надвертлужной области подвздошной кости ангиоспазм распространялся на ткани проксимального отдела бедренной кости и был причиной уменьшения пульсового кровенаполнения внутрикостных тканей в суставных концах костей.
Последующее туннелирование головки бедренной кости приводило к увеличению пульсового кровенаполнения её тканей и компенсаторному увеличению пульсового кровенаполнения во внутрикостных тканях надвертлужной области и снаружи от проксимальной зоны роста бедренной кости. Туннели обеспечивали отток тканевой жидкости из головки бедренной кости. Вероятно, вследствие снижения давления тканевой жидкости извне, под давлением крови микроциркуляторное русло расширялось, и увеличивалась фильтрация жидкости во внесосудистое пространство. Соответственно увеличению ёмкости и объёма фильтрации давление крови в микроциркуляторном русле снижалось, для его заполнения увеличивался приток крови из артерий, и их пульсовое кровенаполнение увеличивалось. Декомпрессионная вазодилатация микроциркуляторного русла препятствовала развитию посттравматического ангиоспазма в головке бедренной кости, а увеличение пульсового кровенаполнения артерий головки бедренной кости уменьшало его выраженность в надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости.
Введение аспирата повышало ВКД в головке бедренной кости, и пульсовое кровенаполнение менялось противоположно таковому после туннелирования: во внутрикостных тканях головки бедренной кости РИ стал меньше, чем во внутрикостных тканях надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости. Восстановившееся соотношение величины РИ подтвердило зависимость пульсового кровенаполнения тканей от ВКД.
У пациентов второй группы изначально туннелировали головку бедренной кости, и так же, как у пациентов первой группы, получали увеличение пульсового кровенаполнения её тканей вследствие декомпрессии сосудов микроциркуляторного русла.
Последующее туннелирование надвертлужной области подвздошной кости приводило к уменьшению пульсового кровенаполнения тканей подвздошной кости, увеличению снаружи от проксимальной зоны роста бедренной кости и дополнительному увеличению в головке бедренной кости. Из этого следует, что при ВКД в диапазоне физиологической нормы (подвздошная кость) туннелирование приводило к развитию посттравматического ангиоспазма, а при повышенном ВКД (головка бедренной кости) развитие ангиоспазма останавливалось из-за декомпрессионной дилатации микроциркуляторного русла. Кроме этого, вероятно, вследствие уменьшения ёмкости сосудистого русла внутрикостных тканей подвздошной кости порции крови, предназначенные для этих тканей, по сосудистым взаимосвязям перемещались во внутрикостные ткани проксимального отдела бедренной кости - к микроциркуляторному руслу в состоянии дилатации.
Введение аспирата повышало ВКД в головке бедренной кости, и распределение РИ в изучаемых внутрикостных тканях стало соответствовать таковому до туннелирования: во внутрикостных тканях головки бедренной кости его величина стала меньше, чем во внутрикостных тканях надвертлужной области подвздошной кости и снаружи от проксимальной зоны роста бедренной кости.
Таким образом, туннелирование спицами суставного конца кости приводило к появлению посттравматического ангиоспазма, распространяющегося на внутрикостные ткани суставного конца другой кости: в тазобедренном суставе сосудистое русло внутрикостных тканей суставных концов костей реагировало на травму взаимосвязано.
Посттравматический ангиоспазм, как реакция на туннелирование спицами, получал развитие при адекватном для суставного конца кости ВКД и служил причиной снижения пульсового кровенаполнения. При повышенном ВКД декомпрессия микроциркуляторного русла способствовала увеличению пульсового кровенаполнения внутрикостных тканей и этим препятствовала развитию посттравматического ангиоспазма.
Туннелирование надвертлужной области подвздошной кости после туннелирования головки бедренной кости приводило к перераспределению кровообращения, вследствие которого дополнительно увеличивалось пульсовое кровенаполнение головки бедренной кости.
Введение аспирата импульсно повышало ВКД в головке бедренной кости, и распределение величины РИ в изучаемых тканях менялось до соответствия таковому при изначально повышенном ВКД: становилось минимальным в головке бедренной кости, что подтверждало зависимость реакции сосудов внутрикостных тканей на туннелирование от изначальной величины ВКД
При болезни Пертеса для улучшения кровообращения в головке бедренной кости следует соблюдать последовательность туннелирования суставных концов костей: сначала туннелировать головку бедренной кости для снижения ВКД, обеспечивающего декомпрессионную вазодилатацию её микроциркуляторного русла, за-зависимость реакции сосудов внутрикостных тканей на туннелирование от изначальной величины ВКД.
ВЫВОДЫ
При болезни Пертеса для улучшения кровообращения в головке бедренной кости следует соблюдать последовательность туннелирования суставных концов костей: сначала туннелировать головку бедренной кости для снижения ВКД, обеспечивающего декомпрессионную вазодилатацию её микроциркуляторного русла, затем туннелировать надвертлужную область подвздошной кости для дополнительного увеличения притока крови к головке и проксимальной зоне роста бедренной кости за счёт перераспределения кровообращения и только после этого, при необходимости, вводить в головку бедренной кости факторы активации восстановления тканей.
СПИСОК ИСТОЧНИКОВ
1. The haemodinamics of Perthes' disease. An intraosseous venographic study combined with measurement of the intramedullary pressure / K. Iwasaki, R. Suzuki, T. Okazaki, S. Ikeda, Y. Inoue, R. Shimauchi // Int. Orthop. 1982. Vol. 6, No 3. P. 141-148. DOI: 10.1007/BF00267723.
2. Liu S.L., Ho T.C. The role of venous hypertension in the pathogenesis of Legg-Perthes disease. A clinical and experimental study // J. Bone Joint Surg. Am. 1991. Vol. 73, No 2. P. 194-200.
3. Herrin J.A., Tachdjian M.O. Tachdjian's pediatric orthopaedics. 4th edition. Philadelphia: Saunders/Elsevier. 2008. Vol. 1. P. 771-837.
4. Hungerford D.S., Lennox D.W. The importance of increased intraosseous pressure in the development of osteonecrosis of the femoral head: implications for treatment // Orthop. Clin. North. Am. 1985. Vol. 16, No 4. P. 635-654.
5. Местные отёки. Этиология, Патогенез процессов экссудации и транссудации / Н.П. Чеснокова, В.В. Моррисон, Г.А. Афанасьева, Н.В. По-лутова // Научное обозрение. Медицинские науки. 2016. № 1. С. 69-73.
6. Мустафин Р.Н., Хаснутдинова Э.К. Аваскулярный некроз головки бедренной кости // Тихоокеанский медицинский журнал. 2017. № 1. С. 27-35.
7. Лечение асептического некроза головки бедренной кости. Клинические рекомендации / А.Н. Торгашин, С.С. Родионова, А.А. Шумский, М.А. Макаров, А.В. Торгашина, И.Ф. Ахтямов, А.Н. Коваленко, Н.В. Загородний, С.П. Миронов // Научно-практическая ревматология. 2020. Т. 58, № 6. С. 637-645.
8. Protein-c deficiency in a patient with Legg-Calve-Perthes disease and recurrent deep vein thrombosis / P.E. Beaule, J.G. Jarvis, W.G. Castle, J. Bormanis // Orthopedics. 2002. Vol. 25, No 5. P. 541-543. DOI: 10.3928/0147-7447-20020501-10.
9. Green N.E., Griffin P.P. Intra-osseous venous pressure in Legg-Perthes disease // J. Bone Joint Surg. Am. 1982. Vol. 64, No 5. P. 666-671.
10. Shah H. Perthes disease: evaluation and management // Orthop. Clin. North Am. 2014. Vol. 45, No 1. P. 87-97. DOI: 10.1016/j.ocl.2013.08.005.
11. Kim H.K. Pathophysiology and new strategies for the treatment of Legg-Calve-Perthes disease // J. Bone Joint Surg. Am. 2012. Vol. 94, No 7. P. 659669. DOI: 10.2106/JBJS.J.01834.
12. Aetiology of Legg-Calve-Perthes disease: A systematic review / V. Pavone, E. Chisari, A. Vescio, C. Lizzio, G. Sessa, G. Testa // World J. Orthop. 2019. Vol. 10, No 3. P. 145-165. DOI: 10.5312/wjo.v10.i3.145.
13. Guerado E., Caso E. The physiopathology of avascular necrosis of the femoral head: an update // Injury. 2016. Vol. 47, No Suppl. 6. P. S16-S26. DOI: 10.1016/S0020-1383(16)30835-X.
14. Core decompression with bone marrow injection for the treatment of femoral head osteonecrosis / A. Chotivichit, E. Korwutthikulrangsri, C. Pornrattanamaneewong, C. Achawakulthep // J. Med. Assoc. Thai. 2014. Vol. 97, No Suppl. 9. P. S139-S143.
15. The effect of core decompression on local expression of BMP-2, PPAR-П and bone regeneration in the steroid-induced femoral head osteonecrosis / W. Wang, L. Liu, X. Dang, S. Ma, M. Zhang, K. Wang // BMC Musculoskelet. Disord. 2012. Vol. 13. P. 142. DOI: 10.1186/1471-2474-13-142.
16. Stem cell therapy for treating osteonecrosis of the femoral head: From clinical applications to related basic research / R. Li, Q.X. Lin, X.Z. Liang, G.B. Liu, H. Tang, Y. Wang, S.B. Lu, J. Peng // Stem Cell Res. Ther. 2018. Vol. 9, No 1. P. 291. DOI: 10.1186/s13287-018-1018-7.
17. Сравнительная характеристика результатов лечения ранних стадий остеонекроза головки бедренной кости различными методами декомпрессии / Р.М. Тихилов, И.И. Шубняков, А.А. Мясоедов, А.А. Иржанский // Травматология и ортопедия России. 2016. Т. 22, № 3. С. 7-21.
18. Herrera-Soto J.A., Price C.T. Core decompression for juvenile osteonecrosis // Orthop. Clin. North Am. 2011. Vol. 42, No 3. P. 429-436, ix. DOI: 10.1016/j.ocl.2011.04.004.
19. A Comparison of Transphyseal Neck-Head Tunneling and Multiple Epiphyseal Drilling on Femoral Head Healing Following Ischemic Osteonecrosis: An Experimental Investigation in Immature Pigs / O. Aruwajoye, F. Monte, A. Kim, H.K.W. Kim // J. Pediatr. Orthop. 2020. Vol. 40, No 4. P. 168175. DOI: 10.1097/BPO.0000000000001219.
20. Drilling Combined with Adipose-derived Stem Cells and Bone Morphogenetic Protein-2 to Treat Femoral Head Epiphyseal Necrosis in Juvenile Rabbits / Z.L. Wang, R.Z. He, B. Tu, J.S. He, X. Cao, H.S. Xia, H.L. Ba, S. Wu, C. Peng, K. Xiong // Current Medical Science. 2018. Vol. 38. P. 277-288.
21. Craveiro Lopes N. Doen^a de Legg-Calve-Perthes. Revisao do conceito atual // Rev. Port. Ortop. Traum. 1994. Vol. 2. No 1. P.75-79.
22. Ibrahim Y.H., Kersh M.A.A.L., Fahmy H. Arthrodiastasis in the management of Perthes disease: a systematic review // J. Pediatr. Orthop. B. 2020. Vol. 29, No 6. P. 550-555. DOI: 10.1097/BPB.0000000000000690.
23. Arthrodiastasis and surgical containment in severe late-onset Perthes disease: an analysis of 14 patients / P. Sudesh, K. Bali, A.K. Mootha, M.S. Dhillon, R. Saini // Acta Orthop. Belg. 2010. Vol. 76, No 3. P. 329-334.
24. Макушин В.Д., Тепленький М.П., Парфенов Э.М. Новый способ лечения остеохондропатии тазобедренного сустава с эпифизарной имплантацией суспензии костного мозга // Гений ортопедии. 2013. № 2. С. 109-111.
25. Тёпленький М.П., Парфенов Э.М. Хирургическое лечение детей с тяжелыми формами болезни Пертеса // Гений ортопедии. 2013. № 1. С. 32-35.
26. Бунов В.С., Тепленький М.П., Олейников Е.В. Особенности гемодинамики в шейке бедренной кости у детей с асептическим некрозом головки бедра // Гений ортопедии. 2016. № 4. С. 50-55.
28. Зенков Л.Р, Ронкин М.А. Функциональная диагностика нервных болезней : руководство для врачей. 5-е изд. М. : МЕДпресс-информ, 2013. С. 313-380.
29. Реограф-полианализатор шестиканальный для комплексного исследования параметров кровообращения РГПА-6/12 "РЕАН-ПОЛИ" : руководство пользователя. Таганрог, 2005. 173 с.
30. Вицлеб Э. Функции сосудистой системы // Физиология человека : в 3-х томах : пер. с англ. / под ред. Р. Шмидта, Г. Тевса. М. : Мир, 1996. Т. 2. С. 498-566.
31. Тёпленький М.П., Макушин В.Д. Лечение дисплазии тазобедренного сустава у детей: монография. [Б. м.] : Lambert Academic Publishing, 2017. 375 c.
32. Особенности кровообращения в мыщелках бедренной и большеберцовой костей при гонартрозе 2 степени / А.С. Свириденко, В.С. Бунов, М.Ю. Бирюкова, С.В. Люлин, И.А. Мещерягина // Международный журнал прикладных и фундаментальных исследований. 2016. № 3-1. С. 94-99.
Информация об авторах:
1. Вячеслав Сергеевич Бунов - кандидат медицинских наук
2. Михаил Павлович Тепленький - доктор медицинских наук
3. Евгений Владимирович Олейников - кандидат медицинских наук
Теги: болезнь Пертеса
234567 Начало активности (дата): 03.07.2023 19:08:00
234567 Кем создан (ID): 989
234567 Ключевые слова: болезнь Пертеса, внутрикостное кровообращение, туннелирование, реовазография
12354567899



