 17.03.2023
17.03.2023
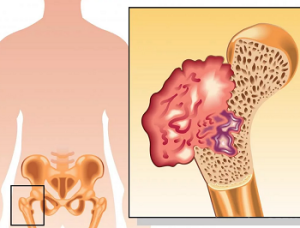
Саркомы костей
В России заболеваемость первичными злокачественными опухолями костей составляет 1,03 случая на 100 тыс. населения, что соответствует данным по заболеваемости в других странах
Клинические рекомендации
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: С40, С41
Год утверждения (частота пересмотра): 2020
Возрастная категория: Взрослые
Год окончания действия: 2022
ID:532
Разработчик клинической рекомендации
• Ассоциация онкологов России
• Автономная некоммерческая организация "Восточно-Европейская группа по изучению сарком"
• Общероссийская общественная организация «Российское общество клинической онкологии»
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ЖКТ - желудочно-кишечный тракт
ИГХ - иммуногистохимия
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
ПНЭТ (PNET) - примитивная нейроэктодермальная опухоль
ПЭТ - позитронно-эмиссионная томография
СМТ - саркомы мягких тканей
УЗИ - ультразвуковое исследование
ЭКГ - электрокардиография
ПХТ - полихимиотерапия
I
MRT - intensity-modulated radiation therapy
КСФ-поддержка - применение колониестимулирующих факторов (ATX - L03AA)
Термины и определения
Безрецидивная выживаемость - от момента наступления ремиссии до момента возникновения рецидива.
Бессобытийная выживаемость - от начала лечения до момента прекращения ремиссии независимо от причины, приведшей к ней.
Общая выживаемость - от начала лечения до окончания исследования или смерти пациента.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Саркома кости - опухоль неэпителиального происхождения. Развивается из клеток производных мезодермы, в частности мезенхимы (первичной соединительной ткани)
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
К факторам риска развития сарком костей можно отнести предшествующую лучевую терапию, состояние иммунодефицита, болезнь Педжета, болезнь Олье, доброкачественные опухолевые поражения кости также могут приводить к злокачественной трансформации. Однако у большинства пациентов специфических этиологических факторов не выявляется [1-3].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Первичные злокачественные опухоли костей составляют 0,001 % от всех впервые выявленных злокачественных новообразований. В России заболеваемость первичными злокачественными опухолями костей составляет 1,03 случая на 100 тыс. населения, что соответствует данным по заболеваемости в других странах [4].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Злокачественное новообразование костей и суставных хрящей (С40):
С40.0 - лопатки и длинных костей верхней конечности;
С40.1 - коротких костей верхней конечности;
С40.2 - длинных костей нижней конечности;
С40.3 - коротких костей нижней конечности;
С40.8 - поражение костей и суставных хрящей конечностей, выходящее за пределы одной и более вышеуказанных локализаций;
С40.9 - костей и суставных хрящей конечности неуточненной локализации.
Злокачественное новообразование костей и суставных хрящей других и неуточненных локализаций (С41):
С41.0 - костей черепа и лица;
С41.1 - нижней челюсти;
С41.2 - позвоночного столба;
С41.3 - ребер, грудины и ключицы;
С41.4 - костей таза, крестца и копчика;
С41.8 - поражение костей и суставных хрящей, выходящее за пределы одной и более вышеуказанных локализаций;
С41.9 - костей и суставных хрящей неуточненное.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Международная классификация болезней - онкология (ВОЗ 2017)
Остеосаркома, БДУ (С40._, С41._) Остеогенная саркома, БДУ (С40._, С41._) Остеобластическая саркома (С40._, С41._) Остеохондросаркома (С40._, С41._) 9180/3
Хондробластическая остеосаркома (С40._, С41._) 9181/3
Фибробластическая остеосаркома (С40._, С41._) Остеофибросаркома (С40._, С41._) 9182/3
Телеангиэктатическая остеосаркома (С40._, С41._) 9183/3
Остеосаркома при болезни Педжета костей (С40._, С41._) 9184/3
Мелкоклеточная остеосаркома (С40._, С41._) Круглоклеточная остеосаркома (С40._, С41._) 9185/3
Центральная остеосаркома (С40._, С41._) Обычная центральная остеосаркома (С40._, С41._) Медуллярная остеосаркома (С40._, С41._) 9186/3
Внутрикостная высокодифференцированная остеосаркома (С40._, С41._) Внутрикостная остеосаркома низкой степени злокачественности (С40._, С41._) 9187/3
Паростальная остеосаркома (С40._, С41._) Юкстакортикальная остеосаркома (С40._, С41._) 9192/3
Периостальная остеосаркома (С40._, С41._) 9193/3
Поверхностная остеосаркома высокой степени злокачественности (С40._, С41._) 9194/3
Интракортикальная остеосаркома (С40._, С41._) 9195/3
Хондросаркома, БДУ (С40._, С41._) Фиброхондросаркома (С40._, С41._) 9220/3
Юкстакортикальная хондросаркома (С40._, С41._) Периостальная хондросаркома (С40._, С41._) 9221/3
Хондробластома, злокачественная (С40._, С41._) 9230/3
Миксоидная хондросаркома 9231/3
Мезенхимальная хондросаркома 9240/3
Светлоклеточная хондросаркома (С40._, С41._) 9242/3
Дедифференцированная хондросаркома (С40._, С41._) 9243/3
Гигантоклеточная опухоль костей, злокачественная (С40._, С41._) Гигантоклеточная саркома костей (С40._, С41._) Остеобластокластома, злокачественная (С40._, С41._) 9250/3
Саркома Юинга Опухоль Юинга 9260/3
Адамантинома длинных костей (С40._) Адамантинома большеберцовой кости (С40.2) 9261/3
Периферическая нейроэктодермальная опухоль Нейроэктодермальная опухоль, БДУ Периферическая примитивная нейроэктодермальная опухоль, БДУ ППНЭО (PPNET, Peripheral Primitive NeuroEctoderma! Tumor) 9364/3
Одонтогенная опухоль, злокачественная Одонтогенная саркома 9270/3
Амелобластическая одонтосаркома Амелобластическая сЬиброодонтосаркома Ам е л обл астическая фибродентиносаркома 9290/3
Амелобластома, злокачественная Адамантинома, злокачественная (за исключением длинных костей МП9261/3) 9310/3
Амелобластическая фибросаркома Амелобластическая саркома Одонтогенная фибросаркома 9330/3
Хордома, БДУ 9370/3
Хондроидная хордома 9371/3
Дедифференцированная хордома 9372/3
Стадирование
Стадирование первичных злокачественных опухолей кости по классификации TNM AJCC/UICC 7-го пересмотра (2010 г.) (TNM AJCC/UICC 8-го пересмотра (2019 г.)
Система стадирования первичных злокачественных опухолей кости по TNM № 7 положена в основу алгоритма выбора тактики лечения, вида операции, оценки прогноза выживаемости
пациента. Стадирование сарком кости включает определение степени злокачественности опухоли, объема местного распространения опухоли, наличия отдаленных метастазов.Стадия (AJCC, 7th, 2010):
• G - степень злокачественности (G1-2 - низкая степень злокачественности; G3-4 -высокая степень злокачественности);
• Т - местная распространенность (табл. 1) (Т1 - опухоль ограничена кортикальным слоем; Т2 - опухоль распространяется за кортикальный слой);
• М - отдаленные метастазы (МО - без метастазов; Ml - отдаленные метастазы).
Критерий Т - местная распространенность.
Клинические проявления заболевания имеют определенную стадийность и в значительной степени зависят от локализации опухоли. Первым симптомом болезни является боль, которую нередко пытаются связать с травмированием соответствующей области в недавнем прошлом. Может быть субфебрильная температура тела. Болезнь быстро прогрессирует и через 2-3 месяца появляется припухлость и гиперемия кожных покровов. Если опухоль локализуется вблизи сустава, возникает нарушение функции. При отсутствии радикального лечения через 5-7 месяцев появляются выраженные явления интоксикации (слабость, резкое похудание, повышение температуры тела, лейкоцитоз, увеличенная СОЭ) которые постепенно нарастают.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Дифференциальная диагностика саркомы кости проводится с доброкачественными и метастатическими опухолями костей, остеомиелитом, артритом и другими дегенеративнодистрофическими изменениями суставов [2]. Как правило, ошибочный диагноз остеомиелита, артрита и другими дегенеративно-дистрофических изменений суставов приводит к неправильной диагностике на начальном этапе, неправильному лечению и как следствие приводит к прогрессированию болезни и зачастую невозможности выполнения органосохраняющего лечения.
Критерии установления диагноза:
Современный подход к диагностике сарком костей должен иметь оптимизированный алгоритм. Он включает:
• анализ жалоб пациента;
• осмотр;
• данные инструментальных и лабораторных исследований;
• морфологическая верификация диагноза.
2.1 Жалобы и анамнез
• Рекомендуется тщательный сбор анамнеза, в том числе наследственного и онкологического, у пациента с подозрением на саркому кости, у пациентов старше 40 лет необходимо исключить метастатическое поражение костей скелета [1,2, 5,19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: уточняют начало развития заболевания, наличие болевого синдрома, изменения функции, оценивают влияние клинических проявлений на качество жизни пациента.
2.2 Физикальное обследование
• Рекомендуется у пациентов с подозрением на саркому кости оценить состояние области пораженной кости, проверить функцию работы сустава, исключить риск развития патологического перелома, провести пальпацию периферических лимфатических узлов с целью оценки состояния пациента и определения тактики лечения [6,19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.3 Лабораторные диагностические исследования
• Рекомендуется всем пациентам с подозрением на саркому кости и с установленным диагнозом проводить следующие исследования - общий (клинический) анализ мочи, общий (клинический) анализ крови, анализ крови биохимический общетерапевтический (с определением содержания белка, билирубина, мочевины, креатинина, аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), лактатдегидрогеназы (ЛДГ), щелочная фосфотазы (ЩФ), натрия, калия, хлоридов, общего кальция), а также коагулограмму (ориентировочное исследование системы гемостаза) - в целях оценки состояния пациента, выбора и контроля алгоритма лечения пациента[19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2.4 Инструментальные диагностические исследования• Рекомендуется всем пациентам с подозрением на саркому кости выполнение на первом этапе диагностики рентгенографии пораженной области и близлежащего сустава в двух проекциях с линейкой с целью оценки вовлечения костной ткани и прогнозирования при необходимости органосохраняющего вида реконструкции [1,19,20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: позволяет провести первичную диагностику и спрогнозировать при необходимости органосохраняющий вид реконструкции.
• Рекомендуется при подозрении на диссеминированную форму заболевания выполнение сцинтиграфии костей всего тела с 99Тс в целях исключения множественных поражений скелета и оценки степени накопления радиофармпрепарата в очаге поражения [1,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется всем пациентам с подозрением на саркому кости выполнение на первом этапе диагностики магнитно-резонансной томографии (МРТ) пораженного отдела скелета с целью оценки наличия мягкотканого компонента опухоли, поражения мышц, вовлечения сосудов и нервов в опухолевый процесс, оценки распространенности образования по костномозговому каналу [1,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется всем пациентам с саркомами костей выполнение компьютерной томографии (КТ) органов грудной клетки с целью исключения патологии органов грудной клетки, в том числе метастазов [1,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется при подозрении на диссеминированную форму заболевания УЗИ органов брюшной полости, забрюшинного пространства, периферических лимфатических узлов для исключения метастазов и патологии [6,20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с диагнозом саркома Юинга рекомендовано выполнить биопсию костного мозга с последующим патолого-анатомическим исследованием и цитологическим исследованием мазка костного мозга (миелограмма) [8,12.15,16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Примечание: Больные саркомой Юинга и PNET, вне зависимости от первичной локализации или размера опухоли, могут иметь изолированное поражение костного мозга при отсутствии метастазов в костях. Подобные особенности опухолевого процесса делают выполнение билатеральной трепан биопсии костного мозга необходимым условием для полноценного анодирования заболевания.
2.5. Иные диагностические исследования
• Рекомендуется всем пациентам с подозрением на саркому кости выполнить с целью верификации диагноза биопсию опухоли [1,2, 9,19,20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: правильное проведение биопсии опухоли позволяет в короткие сроки верифицировать диагноз и начать лечение. Вне зависимости от способа проведения биопсии (трепанобиопсия или хирургический) выполнение забора материала должно производиться наименее травматично для пациента. При выборе места забора материала необходимо учитывать предполагаемый доступ последующего хирургического лечения, что позволит в дальнейшем удалить биопсийный рубец, без изменения стандартного хирургического доступа.
Учитывая, что нарушение целостности кости может спровоцировать патологический перелом, биопсию внутрикостного фрагмента опухоли необходимо проводить только в случаях, когда внекостный компонент опухоли отсутствует или слабо выражен.
Стандарты выполнения биопсии опухоли:
1. Биопсия должна выполняться под контролем сертифицированного онкоортопеда или радиолога.
2. Морфологическая верификация полученного биопсийного материала должна проводиться в крупных учреждениях онкологического профиля, при наличии морфолога соответствующей подготовки.
3. Предпочтительным способом получения опухолевой ткани для патоморфологического исследования является толстоигольная биопсия.
4. Проведение биопсии опухоли открытым доступом возможно: 1) при анатомически трудной локализации очага опухоли; 2) как второй этап, при отрицательном результате после проведенной трепанобиопсии, скудности и малой информативности полученного с помощью трепанобиопсии материала.
5. При выполнении биопсии опухоли открытым доступом основополагающим топографическим критерием ее проведения является стандартный оперативный доступ предстоящего оперативного лечения, с учетом локализации опухоли.
6. Определение тактики дальнейшего лечения должно проводиться совместно с участием хирурга онкоортопеда, химиотерапевта и, при необходимости, лучевого терапевта.
7. Неправильный выбор места биопсии или нарушение техники ее выполнения, ставит под угрозу адекватный локальный контроль, ограничивает выбор способа мышечной пластики, значительно повышает риск рецидива после
выполнения последующей органосохранной операции.
• Рекомендуется провести патолого-анатомическое исследование биопсийного материала с целью верификации диагноза и определения тактики лечения и прогноза [1,2,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется проводить патолого-анатомическое исследование операционного материала -удаленной кости или иных удаленных органов и тканей - с целью оценки краев резекции, а также лечебного патоморфоза в случаях, когда проводилась неоадъювантная химиотерапия, что необходимо для определения дальнейшей тактики лечения и прогноза [1,2, 7,8,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.5 Иные диагностические исследования
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощи, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Выбор тактики лечения определяется в зависимости от возраста пациента, стадии заболевания, размера и локализации опухоли, степени дифференцировки опухоли [1, 2,6].
• Рекомендуются следующие тактики лечения в зависимости от формы остеосаркомы:
1. Паростальная (юкстакортикальная) остеосаркома - только радикальное хирургическое лечение (вне зависимости от степени распространения опухоли).
2. Периостальная остеосаркома - радикальное хирургическое лечение. В зависимости от размера первичного очага и степени распространения опухоли на консилиуме в составе врача травматолога-ортопеда и врача онколога принимается решение о целесообразности консервативного лечения. Применяемая терапия в ряде случаев может уменьшить размеры первичного очага и метастазов опухоли, способствовать ее отграничению псевдокапсулой и перевести в резектабельное состояние.
3. Остеосаркома высокой степени злокачественности - проведение комбинированного лечения: блока неоадъювантной терапии, радикальное хирургическое лечение, блок адъювантной терапии [1,2,19,20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.1. Хирургическое лечение
3.1.1. Хирургическое лечение пациентов с остеосаркомой кости
• Рекомендуется выполнение органосохранных операций для пациентов с диагнозом саркома кости в целях улучшения отдаленных результатов лечения и качества жизни пациента. Главным условием операбельности пациентов с диагнозом саркома кости является радикальность и абластичность удаления опухоли, что гарантирует отсутствие местного рецидива [6,10,11,21,22,23].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 1).
Комментарии: в первую очередь следует рассматривать возможность выполнения органосохранных операций. Размер первичного очага опухоли, степень распространения внекостного компонента не могут использоваться как самостоятельные независимые критерии в решении вопроса о проведении калечащей операции. Костные резекции при наличии минимального необходимого отступа от предполагаемого края опухоли не менее 3-5 см (при условии отсутствия распространения опухоли в костномозговом канале оставшейся части кости).
При невозможности выполнения органосохранных операций необходимо выполнение калечащих операций в радикальном объеме. Ампутация или экзартикуляция конечности выполняются в следующих случаях:
• обширное первично-множественное распространение опухоли;
• вовлечение в опухолевый процесс магистрального сосудисто-нервного пучка, технически исключающее проведение реконструктивно-пластического этапа операции;
• прогрессирование на фоне предоперационной терапии;
• отказ пациента от органосохранной операции;
• жизненные показания к экстренной хирургии - распад опухоли, кровотечения.
В специализированных центрах операции с сохранением конечности удается выполнить у 80% пациентов. Широкое отступление от опухоли важно для профилактики местных рецидивов вне зависимости от опухолевого ответа.
• Рекомендуется использование модульных систем эндопротезирования, что признано наиболее актуальным и современным, отвечающим основным требованиям реконструкции костных дефектов при саркомах костей [6,21,22,23,70].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: выделяют следующие виды реконструктивных операций в объеме эндопротезирования:
1) стандартные первичные операции у взрослых;
2) стандартные первичные операции у детей и подростков;
3) эндопротезирование редких анатомических зон;
4) ревизионное эндопротезирование.
Требования, предъявляемые к конструкции эндопротеза при первичном эндопротезировании у взрослых:
1) модульность конструкции эндопротеза;
2) максимальная надежность и ремонтопригодность эндопротеза;
3) универсальность компонентов эндопротеза;
4) максимальный срок службы;
5) стабильная фиксация эндопротеза;
6) хороший функциональный результат;
7) короткий срок изготовления эндопротеза.
Особенности эндопротеза при первичном эндопротезировании у детей и подростков:
1) наличие бесцементного способа фиксации эндопротеза;
2) раздвижной механизм эндопротеза (инвазивный и неинвазивный).
• Рекомендуется реэндопротезирование у пациентов со злокачественными новообразованиями костей, вне зависимости от их причин, проводить в медицинских организациях с подготовленной командой врачей-онкологов, врачей-травматологов-ортопедов и врачей-хирургов, обладающих опытом выполнения данного вида операций и владеющих методиками ревизионного эндопротезирования, а также при условии наличия в медицинской организации специализированного высокотехнологического оборудования (в том числе хирургического инструментария), позволяющего обеспечить пациента безопасным и эффективным лечением в необходимом объеме [6]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: в современной онкоортопедии рост числа первичного эндопротезирования, успехи в терапии костных сарком приводят к ежегодному увеличению числа пациентов, требующих проведения повторных ортопедических операций, связанных с нестабильностью или поломкой эндопротеза.
Каждый ревизионный эндопротез изготавливается индивидуально. Применение модульной системы эндопротезирования упрощает выполнение последующих ревизионных операций, увеличивает биологический резерв кости.
Возможность изготовления индивидуальных компонентов эндопротеза для ревизионных операций при развитии нестабильности позволяет, не удаляя весь эндопротез, заменить его часть.
• Рекомендуется при локализации опухоли в костях таза, позвоночнике или других сложных анатомических локализациях применять индивидуальные системы онкологического протезирования, персонализированный инструментарий, прототипы операций, в том числе созданные при помощи компьютерного моделирования и 3D-печати [68, 72].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: в случаях когда у пациента выявляется опухоль в костях таза, позвоночнике или других анатомически сложных локализациях (кости лучезапястного, голеностопного суставов, грудины и др.), могут быть применены индивидуальные онкологические импланты для замещения пострезекционных дефектов которые изготавливаются при помощи компьютерного моделирования и 3D печати (аддитивные технологии). Данные технологии позволяют с анатомической точностью воспроизвести участок костного дефекта который был резецирован в результате опухолевого поражения. Для выполнения точных, радикальных резекций могут быть использованы персональный инструментарий, а также модели прототипирования оперируемой анатомической области, создаваемые посредстовом аддитивных технологий (68,72).
• Рекомендуется при использовании онкологических эндопротезов применение длительных режимов профилактической антибактериальной терапии [69]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: в случаях высокого риска развития инфекционных осложнений у пациентов которым выполнены операции с установкой онкологических имплантов рекомендовано проводить профилактическую антибактериальную терапию высокого риска. Одной из рекомендуемых схем антибактериальной терапии высокого риска является применение цефалоспоринов третьего поколения в комбинации с клиндомицином или ванкомицином в течении всего периода нахождения пациента в стационаре, обычно от 10 до 14 дней с последующим продолжением приема пероральных антибиотиков в течении последующих 4 недель (69). Факторами риска являются высокозлокачественные опухоли, глубокое расположение опухоли, иммуносупрессия от неоадъювантной химиотерапии, предшествующая лучевая терапия, неадекватная антибиотикопрофилактика, прием кортикостероидов, большая раневая поверхность, продолжительное время операции (более Зх часов),массивная кровопотеря более 0,5 объема церкулирующй крови, вторичное заживление раны, некрозы кожи, дополнительные хирургические манипуляции, сопутствующие заболевания (анемия, сахарный диабет и т.д.)
• Рекомендуется выполнение калечащих операций (ампутации, экзартикуляции и др.) только в тех случаях, когда достигнуть радикальности RO (R1) технически невозможно или по витальным показаниям. [70,71, 76]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: показания к калечащим операциям определяются индивидуально, в каждом конкретном случае, основываясь на принцыпах радикальности (70,71). Показаниями к выполнению калечащих операций могут быть:
Высокозлокаечственные саркомы костей, которые не подлежат органосохранному лечению R0, обширное поражение мягких тканей, массивное вовлечение сосудистых и нервных структур, выраженный инфекеционный процесс в мягких тканях и костных структур, распад опухоли и опухолевая интоксикация.3.1.2. Хирургическое лечение пациентов с саркомой Юинга
Рекомендуемая хирургическая тактика лечения пациентов с саркомой Юинга кости и остеосаркомой не имеет принципиальных различий и проводится с соблюдением онкологических и ортопедических правил выполнения такого вида операций, описанных в разделе 3.1.1.3.2. Консервативное лечение
5.2.1. Химиотерапия пациентов с остеосаркомой кости
• Рекомендуется проводить комбинированное лечение пациентов с локализованной формой остеосаркомы, которое включает предоперационную химиотерапию, операцию, послеоперационную химиотерапию [1, 8,12,13,24-27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: только хирургическое лечение нецелесообразно, так как у 80-90 % пациентов в течение 1,5 лет после операции диагностируются метастазы в легких и локальные рецидивы. Химиотерапия как часть комплексного лечения значительно улучшает 5-летнюю выживаемость у пациентов с локализованным процессом (с 20 % до 60 %).
• Рекомендуется всем пациентам проводить предоперационную химиотерапию в целях улучшения результатов лечения. Преимущества предоперационной химиотерапии заключаются в возможности оценки in vivo активности химиотерапевтических препаратов и облегчении выполнения операции [8,13,14,25,26,27]
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: обычно проводится 3-4 цикла предоперационной химиотерапии. Степень некроза опухоли после предоперационной химиотерапии - надежный независимый прогностический фактор. При выраженном ответе опухоли на проводимое лечение (некроз опухоли 90 % и более) имеется большая вероятность увеличения безрецидивной и общей выживаемости. У пациентов с отсутствием эффективности послеоперационная химиотерапия не приводит к улучшению выживаемости
• Рекомендуется при лечении локализованного опухолевого процесса применять неоадъювантную интенсивную химиотерапию на основе комбинации доксорубицина** и цисплатина** - режим #АР:
• #Доксорубицин** 90 мг/м2 в/в, 96-часовая инфузия;
• #Цисплатин** 120 мг/м2 в/в или внутриартериальная инфузия в 1-й день каждые 4 недели 4 цикла [66-67].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• Рекомендуется всем пациентам проводить послеоперационную химиотерапию в целях улучшения результатов лечения. [8,24].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется режим послеоперационной химиотерапии определять исходя из степени лекарственного патоморфоза:
• при III—IV степени (более 90 % опухолевой ткани некротизировано в результате предоперационной химиотерапии) послеоперационно рекомендовано повторение схемы АР, также 4 цикла химиотерапии без замены цитостатических препаратов [66-67],
• при меньшей степени некроза (некроз опухоли менее 90 %) длительность лечения составляет около 12 месяцев с использованием альтернирующих многокомпонентных схем,:
о HD I: ифосфамид** 2 г/м2 (с месной**) в/в инфузия в 1-7-й дни, 4 цикла с интервалом 3 недели, применение колониестимулирующих факторов (далее - КСФ-поддержка) в 8-16-й Дни [8];
о через 3 недели - HD МТХ: метотрексат** 12 г/м2 в/в, последующая инфузия кальция фолинат**, 4 введения с интервалом в 14 дней только для пациентов молодого возраста [46].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Оценка степени лечебного патоморфоза должна проводиться только опытным врачом-патологоанатомом, специализирующимся на костной онкопатологии в специализированных центрах.
Использование меторексата• ** более оправдано у пациентов молодого возраста, считается, что эффективность у пациентов старше 25-30 лет сомнительна [1, 7]. Проведение высокодозной химиотерапии возможно только в специализированных центрах, при наличии оборудования для контроля концентрации препаратов в сыворотке крови и отделений интенсивной терапии и реанимации.
• Рекомендована при явной низкой клинической и рентгенологической эффективности после двух курсов смена схемы лечения - проводятся два курса высокодозного ифосфамида или высокие дозы метотрексата** с кальция фолинатом**, при крайне низкой степени лечебного патоморфоза также используется комбинация гемцитабина** и доцетаксела**. Продолжительность химиотерапии варьирует от 7 до 12 месяцев. [8]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Обязательным условием проведения химиотерапии должно быть строгое соблюдение методики введения высоких доз метотрексата, ифосфамида, цисплатина**.
Схемы химиотерапии:
о HD I (используется при низкой эффективности после 2 циклов АР):
¦ Ифосфамид**2000мг.м2 + месна** 100% от дозы ифосфамида в/в в 1-7-й дни, 2 цикла;
¦ КСФ-поддержка в 8-16-й дни [8,12].
о HD МТХ: метотрексат** 12 г/м2 в/в инфузия с последующим введением кальция фолината** начиная с 24 часов от начала инфузии метотрексата и продолжая до тех пор, пока уровень метотрексата в сыворотке крови не станет менее 1 х 10 ~7 моль / л (100 нмоль / л), 4 введения с интервалом в 14 дней только для пациентов молодого возраста; [46]
° #GemTax: #Гемцитабин** 900мг/м2 в 1-й, 8-й дни введения + #Доцетаксел** 100мг/м2 в/в в 8-й день введения + #филграстим** 5мкг/кг п/к в 9-19-й дни 2 цикла [12]
Использование меторексата** более оправдано у пациентов молодого возраста, считается, что эффективность у пациентов старше 25-30 лет сомнительна [1, 7]. Проведение высокодозной химиотерапии возможно только в специализированных центрах, при наличии оборудования для контроля концентрации препаратов в сыворотке крови и отделений интенсивной терапии и реанимации.
• Рекомендовано применение при нерезектабельной остеосаркоме в рамках второй и последующих линий химиотерапии следующих режимов:
• # GemTax - #Гемцитабин** 900мг/м2 в 1-й, 8-й дни введения + #Доцетаксел** 100мг/м2 в/в в 8-й день введения + #филграстим** 5мкг/кг п/к в 9-19-й дни) 2 цикла [12]
• #Сорафениб - #Сорафениб** по 400 мг, 2 раза в день, ежедневно во время еды в течение 3 месяцев [48,49]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Протонная терапия рекомендована как самостоятельный метод лечения при саркомах костей черепа, позвоночника, саркомах орбиты и в составе комплексных и комбинированных методов лечения при R1 и R2 краях резекции после хирургического лечения. [8 19,40,41,42,43,44,45, 74,75]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарии: Протонная терапия способствует повышению эффективности лечения за счет подведения более высоких доз излучения к опухоли. Протонная терапия наиболее предпочтительный вид лучевого лечения в случае близости критических структур и невозможности соблюсти рекомендуемые лучевые нагрузки. Протонная терапия может эффективно применяться при необходимости проведения повторных курсов облучения по поводу рецидивов хордом и хондросарком, демонстрируя высокие показатели локального контроля и выживаемости в тех ситуациях, когда выбор лечебных методик ограничен [42].
5.2.2. Консервативное лечение пациентов с саркомой Юинга
Саркомы семейства Юинга/PNET являются редкими опухолями, преимущественно молодого возраста, характеризующимися повышенной чувствительностью к лучевой и химиотерапии,
лечение их требует комплексного подхода и должно проводиться в специализированных центрахСтадирование не отличается от общепринятой классификации для первичных опухолей костей, детально описанной в разделе остеосарком. При внекостной форме стадирование проводится по системе для опухолей мягких тканей [1,2].
С учетом высокой частоты метастазирования в кости и костный мозг рекомендуемое локальное лечение (операция или лучевая терапия) должно обязательно сопровождаться комбинированной химиотерапией, т.к. при клинически локализованной форме заболевания к моменту установления диагноза 90 % пациентов имеют микрометастазы. Комбинация химиотерапии, операции и/или лучевой терапии повысила уровень 5-летней выживаемости с 10 % до 60 %. После биопсии опухоли и тщательного обследования проводится от 4 до 6 циклов индукционной химиотерапии в течение 12-24 недель, далее следует локальный метод лечения с последующим назначением от 6 до 10 циклов химиотерапии с 3-недельным интервалом. Продолжительность лечения составляет 12 месяцев. Наиболее активными цитостатиками являются доксорубицин• ** циклофосфамид**, ифосфамид** винкристин** дактиномицин и этопозид**. Фактически все режимы лечения основаны на комбинациях из 4-6 перечисленных препаратов. Наиболее эффективные режимы лечения включали как минимум один алкилирующий химиопрепарат (ифосфамид** или циклофосфамид**) и доксорубицин**. Добавление ифосфамида** и этопозид а** в программу лечения значительно улучшило результаты терапии у пациентов с неметастатической саркомой Юинга/ПНЭТ.
Радикальная операция в тех случаях, когда она выполнима, расценивается как наилучшая возможность локального контроля.
Лучевая терапия показана при невозможности выполнения радикального оперативного вмешательства и обсуждается в тех случаях, когда при патолого-анатомическом исследовании удаленного материала определяется недостаточный лечебный патоморфоз (то есть выявляется более 10 % жизнеспособных опухолевых клеток). Нерадикальная операция с последующей лучевой терапией не более эффективна, чем только лучевая терапия.
Лучевая терапия проводится в дозах 40-45 Гр при микроскопических остаточных опухолях и 50-60 Гр при наличии макроскопических изменений [16,17].
• Рекомендуется применять дистанционную 3-D и интенсивно модулированную (IMRT) лучевую терапию в комбинации с химиотерапией при отказе от операции или нерадикально выполненной операции в качестве локального лечения. РОД = 2-2,5 Гр, СОД = 60 Гр. При метастазах в легкие - крупнопольная лучевая терапия РОД = 2 Гр, СОД = 20 Гр [7,15,16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется в рамках химиотерапии чередование режимов IE и VAC каждые 3-4 недели:
• IE:
- этопозид** 100 мг/м2 в/в в 1-5-й дни;
- ифосфамид** 1,8 г/м2 в/в инфузия в 1-5-й дни с месной.
• #VAC:
- винкристин** 2 мг/м2 в/в в 1-й день;
- циклофосфамид** 1200 мг/м2 в/в в 1-й день [15, 50].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2)
• Рекомендуются следующие режимы химиотерапии при раннем прогрессировании опухолевого процесса (менее 1 года после завершения комбинированного лечения).
• Циклофосфамид** 250 мг/м2 в/в в 1-5-й дни; #топотекан 0,75 мг/м2 в/в в 1-5-й дни; повторение цикла каждые 3-4 недели. [51, 52,53,54]
• Этопозид** 100 мг/м2 в/в в 1-5-й дни; #топотекан 0,75 мг/м2 в/в в 1-5-й дни; повторение цикла каждые 3-4 недели [12]
• #Иринотекан• ** 250 мг/м2 в/в в 6-й день; #темозоломид** 150 мг/м2 внутрь или в/в в 1-5-й дни; повторение цикла каждые 4 недели. [12]
• #GemTax: #гемцитабин** 900 мг/м2 в 1, 8-й дни в виде 90-минутной инфузии; #доцетаксел** 100 мг/м2 в 8-й день; КСФ-поддержка п/к в 9-19-й дни. [12]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.3. Лечение при метастатическом и рецидивном опухолевом
процессе• Рекомендуется при лечении метастатических форм заболевания применять комбинированную химиотерапию в сочетании с возможным оперативным лечением. Выбор второй линии химиотерапии зависит от первичного
лечения [8,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: чаще всего используются высокие дозы метотрексата** ифосфамид. Использование этопозида** неоправдано, так как не доказана его эффективность в лечении остеосарком. Если метастазы появились более чем через 6 месяцев после комплексного лечения, возможно повторение ранее используемого режима химиотерапии. При более раннем прогрессировании следует применять другие комбинации цитостатиков.
• Рекомендуется при метастатическом поражении легких обсудить возможность оперативного вмешательства: метастазэктомии, повторной торакотомии в комплексе с химиотерапией [8,12,18,35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: при метастазах в легких полное хирургическое удаление метастазов может обеспечить достижение 40-процентной 5-летней выживаемости.
• Рекомендуется использовать те же режимы химиотерапии в такой же последовательности, как и для лечения первичной опухоли [8,12,36].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при наличии только легочных метастазов у нелеченых пациентов химиотерапия должна проводиться не с паллиативной, а лечебной целью с соблюдением режимов, сроков и дозировок, так как в 20 % случаев можно достичь 5-летней выживаемости без признаков заболевания. Кроме стандартных режимов, в качестве третьей и более линий терапии возможно применение сорафениба (Нексавар) по 400 мг перорально 2 раза в сутки ежедневно.
• При рецидиве саркомы Юинга рекомендуется терапия паллиативного характера, за исключением пациентов с ограниченным рецидивом после длительного безрецидивного периода [19,20,37,38,39].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5). Комментарии:
• Единственным прогностическим фактором, имеющим значение при рецидиве, является время его возникновения: пациенты, у которых рецидив возник позже, чем через 2 года после установки диагноза, имеют лучшие результаты.
• Пациенты с метастатической формой заболевания должны получать такую же стандартизированную химиотерапию, как и пациенты с локализованным процессом, с соответствующим локальным воздействием на метастазы (в основном с помощью лучевой терапии).
• У пациентов с метастазами остеогенной саркомы в легкие повышение выживаемости может быть достигнуто путем резекции остаточных метастазов только после эффективной химиотерапии и тотальным облучением легкого.
• Пациенты с метастазами в кости или костный мозг имеют плохой прогноз (5-летняя выживаемость менее 20 %). При наличии костных метастазов показано проведение лучевой терапии.
• Применение интенсивных и высокодозных режимов химиотерапии с последующей аутологичной трансплантацией костного мозга оправдано у отдельных пациентов после тщательного обследования.
• Рекомендуется при местно-распространенной и/или метастатической гигантоклеточной опухоли кости применение таргетной терапии по следующей схеме:
о Деносумаб** 120мг подкожно в 1, 8, 15 и 28 дни первого месяца, далее 1 раз в 28 дней. [81]
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
Комментарии: гигантоклеточная опухоль является доброкачественным остеолитическим образованием костей, обладающим местно-агрессивным характером и не предсказуемым клиническим поведением, часто приводящим к инвалидизации. Хирургическое лечение является предпочтительным, однако сопровождается высоким риском местного рецидива. Нередко первичная локализация гигантоклеточной опухоли или наличие в анамнезе нескольких хирургических вмешательств по поводу рецидива заболевания резко ограничивает возможные варианты лечения. Деносумаб** снижает потребность в инвалидизирующем хирургическом вмешательстве, ассоциируется с быстрым и клинически значимым облегчением боли, а в случае метастатического процесса ассоциируется с регрессией и/или стабилизацией метастазов в легкие [73, 74, 75].
3.4. Сопроводительная терапия
Принципы лечения и профилактики тошноты и рвоты у пациентов соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (Коллектив авторов: Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. DOI: 10.18027/2224-5057-2018-8-3s2-502-511
Принципы лечения и профилактики костных осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (Коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., СемиглазоваТ.Ю.
Принципы профилактики и лечения гепатотоксичности у пациентов соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (Коллектив Ткаченко П.Е., Ивашкин В.Т., Маевская М.В.
.
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (Коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А. DOI: 10.18027/2224-5057-2018-8-3s2-545-563;
Принципы профилактики и лечения кожных осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (Коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова RB.
Принципы нутритивной поддержки у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (Коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж.
Принципы профилактики и лечения нефротоксичности у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендаци по коррекции нефротоксичности противоопухолевых препаратов» (Коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. DOI: 10.18027/2224-5057-2018-8-3s2-591-603
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (Коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А.
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (Автор: Буйденок Ю.В. DOI: 10.18027/2224-5057-2018-8-3s2-610-616
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» (Коллектив авторов: Проценко С.А., Антимоник Н.Ю., Берштейн Л.М., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Чубенко В.А., Юдин Д.И.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Для контроля тошноты и рвоты, возникающих на фоне ПХТ, рекомендуется применение антагонистов серотонина (блокаторов серотониновых 5-НТз-рецепторов) [8,28,77].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
• Рекомендуются следующие реабилитационные мероприятия:
1) экзопротезирование для пациентов, перенесших калечащие операции;
2) проведение курсов ранней и отсроченной реабилитации пациентов после органосохраняющего лечения в специализированных стационарах и центрах реабилитации [29,30,31,32].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
• Пациентам, закончившим этап комбинированного лечения, рекомендуется динамическое наблюдение с обследованием каждые 3 месяца в течение первых 2 лет, далее раз в 6 месяцев до 5 лет. Минимальным объемом обследования является КТ грудной клетки [19, 34].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, профилактика ортопедических осложнений, выявление нестабильности эндопротеза в ранних сроках. Информация по данному разделу представлена в Приложении Г1.
• Пациентам с остеосаркомой дополнительно рекомендуется рентгенография зоны костного поражения [1,6,8,10,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на саркому у пациента или ее выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических
исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на саркому или ее выявлении в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
1. наличие осложнений саркомы, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т. д.) саркомы.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/ или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Медицинские процедуры, которые могут быть оказаны в рамках первичной специализированной медицинской помощи (т. е. амбулаторно) под контролем врача - онколога:
1. тонкоигольная аспирационная биопсия поверхностно-расположенных органов (лимфатических узлов, новообразований в мягких тканях);
2. соге-биопсия поверхностно-расположенных органов (лимфатических узлов, новообразований в мягких тканях).
Показания для направления пациента в другую медицинскую организацию:
• исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациентам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи, рекомендуется воспользоваться системой маршрутизации в другие медицинские организации, в том числе за пределы субъекта федерации, в том числе в федеральные центры, имеющие соответствующую оснащенность и кадры;
• клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения и т. д.), рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения;
выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению данного этапа лечения (например, острый инфаркт миокарда, острое нарушение мозгового кровообращения и др.) требует маршрутизации в профильные медицинские организации.
6. Организация оказания медицинской помощи
Неблагоприятные факторы, влияющие на исход лечения:
1) присоединение инфекционных осложнений;
2) развитие нестабильности при протезировании;
3) наличие патологического перелома;
4) развитие анемического, тромбоцитопенического синдромов, требующие трансфузий компонентов крови;
5) удлинение интервалов между введениями химиопрепаратов;
6) редукция доз химиопрепаратов;
7) несоблюдение пациентом рекомендаций, как в ходе лечения, так и при динамическом наблюдении.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критерии оценки качества медицинской помощи
1. Алиев М.Д. Злокачественные опухоли костей. Саркомы костей, мягких тканей и опухоли кожи 2010;2:3-8.
2. Malawer М.М., Helman L.J., O’Sullivan В. Sarcomas of bone. In: DeVita V.T., Heilman S., Rosenberg S.A. Cancer: Principles & Practice of Oncology. 8th edn. Vol. 2. 2008. Pp. 1794-1833.
3. Kalra S., Grirner R.J., Spooner D. et al. Radiation-induced sarcomas of bone: factors that affect outcome. J Bone Joint Surg Br 2007;89(6):808-13.
4. Алиев М.Д., Сушенцов E.A. Современная онкоортопедия. Саркомы костей, мягких тканей и опухоли кожи 2012;4:3-10.
5. Тепляков В.В., Карпенко В.Ю., Бухаров А.В., Державин В.А., Урлова А.Н., Рубцова Н.А. Результаты хирургического лечения пациентов с метастазами в длинные трубчатые кости. Саркомы костей, мягких тканей и опухоли кожи 2010;3:10-15.
6. Алиев М.Д. Эндопротезирование как основа онкоортопедии. Саркомы костей, мягких тканей и опухоли кожи 2010;4:7-12.
7. La ТН, Meyers РА, Wexler LH, et al. Radiation therapy for Ewing"s sarcoma: results from Memorial Sloan-Kettering in the modern era. Int J Radiat Oncol Biol Phys 2006; 64:544.
8. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Bone Cancer Version 1.2020
9. Gogna A., Peh W.C., Munk P.L. Image-guided musculoskeletal biopsy. Radiol Clin North Am 2008;46(3):455-73.
10. Курильчик A.A., Зубарев А.Л., Кудрявцева F.T., Стародубцев А.Л. Интраоперационная лучевая терапия (ИОЛТ) в комбинированном лечении остеосаркомы. Саркомы костей, мягких тканей и опухоли кожи 2010;3:30-33.
11. Fiorenza F., Abudu A., Grirner R.J. et al. Risk factors for survival and local control in chondrosarcoma of bone. J Bone Joint Surg Br 2002;84:93-99.
12. Практические рекомендации Российского общества клинической онкологии. Злокачественные опухоли. Том9 №3s2. 2019.с-265
13. Bernstein М., Kovar Н., Paulussen М. et al. Ewing’s sarcoma family of tumors: current management//The Oncol. - 2006-Vol. 11 (5). - P.503.
14. Bernthal N.M., Federman N., Eilber F.R. et al. Long-term results (>25 years) of a randomized, prospective clinical trial evaluating chemotherapy in patients with highgrade, operable osteosarcoma. Cancer 2012;118(23):5888-93.
15. Casey DL, Meyers PA, Alektiar KM, et al. Ewing sarcoma in adults treated with modern radiotherapy techniques. Radiother Oncol 2014; 113:248.
16. Rodl RW, Hoffmann C, Gosheger G, et al. Ewing"s sarcoma of the pelvis: combined surgery and radiotherapy treatment. J Surg Oncol 2003; 83:154.
17. Koontz BF, Clough RW, Halperin EC. Palliative radiation therapy for metastatic Ewing sarcoma. Cancer 2006; 106:1790.18. Kager L., Zoubek A., Potschger U. et al. Primary metastatic osteosarcoma: presentation and outcome of patients treated on neoadjuvant Cooperative Osteosarcoma Study Group protocols. J Clin Oncol 2003;21(10):2011-8.
19. Casali P. G. et al. Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up //Annals of Oncology. - 2018. - T. 29. - №. Supplement 4. - C. iv79-iv95.
20. Redondo, A., Cruz, J., Lopez-Pousa, A., & Baron, F. (2013). SEOM clinical guidelines for the treatment of osteosarcoma in adults-2013. Clinical and Translational Oncology, 15(12), 1037-1043.doi: 10.1007/sl2094-013-1087-0
21. Han G. et al. Amputation versus limb-salvage surgery in patients with osteosarcoma: a rneta-analysis //World journal of surgery. - 2016. - T. 40. - №. 8.
22. He X. et al. A nreta-analysis of randomized control trials of surgical methods with osteosarcoma outcomes //Journal of orthopaedic surgery and research. - 2017. - T. 12. - №. 1. - C. 5.
23. Mei J. et al. Functional outcomes and quality of life in patients with osteosarcoma treated with amputation versus limb-salvage surgery: a systematic review and nreta-analysis //Archives of orthopaedic and trauma surgery. - 2014. - T. 134. - №. 11. - C. 1507-1516.
24. Anninga J. K. et al. Chemotherapeutic adjuvant treatment for osteosarcoma: where do we stand? //European journal of cancer. - 2011. - T. 47. - №. 16. - C. 2431-2445.
25. Yu D. et al. Methotrexate, doxorubicin, and cisplatinum regimen is still the preferred option for osteosarcoma chemotherapy: A nreta-analysis and clinical observation//Medicine. - 2019. - T. 98. - №. 19.
26. Su W. et al. Clinical efficacy of preoperative chemotherapy with or without ifosfamide in patients with osteosarcoma of the extremity: nreta-analysis of randomized controlled trials //Medical Oncology. - 2015. - T. 32. - №. 2. - C. 19.
27. Zhang T. et al. Efficacy Comparison of Six Chemotherapeutic Combinations for Osteosarcoma and Ewing"s Sarcoma Treatment: A Network Meta-Analysis //Journal of cellular biochemistry. -2018. - T. 119. - №. 1. - C. 250-259.
28. Протоколы клинических рекомендаций поддерживающей терапии в онкологии под ред. Академика РАН М.И. Давыдова 2-е издание, 2018 год
29. Моисеенко Е. И., Майкова С. А.. Проблемы детей, излеченных от онкологических заболеваний. В кн.: «Медицинская, психологическая и социальная адаптация детей, излеченных от онкологических заболеваний». Под редакцией М.Д. Алиева. М. «Практическая медицина». 2012, с. 27-57.
30. Ерушина Т.И. «Реабилитация в онкологии: физиотерапия». М. «ЕЭОТАР-Медиа». 2006, с. 134-138.
31. Быстрова О.В., Калугина А. С., Цыбатова Е. В., Тапильская Н. И., соавт. Способы восстановления фертильности онкологических больных. Практическая онкология. 2009, № 4, с. 245-253.
32. Бакалова А. А., Королёва Т. Ю., Психологическая помощь детям с онкологическими заболеваниями. СПб., 2006.
33. Navid F, Willert JR, McCarville MB, et al. Combination of gemcitabine and docetaxel in the treatment of children and young adults with refractory bone sarcoma. Cancer 2008;113:419-425
34. Lee FY, Mankin HJ, Fondren G, et al. Chondrosarcoma of bone: an assessment of outcome. J
37. Barker L.M., Pendergrass T.D., Sanders J.E. et al. Survival after recurrence of Ewing’s sarcoma family of tumors // J.Clin.Oncol.- 2005 - Vol.23. - P.4354.
38. Hawkins D., Barnett T., Bensinger W. et al. Busulfan, melphalan, and thiotepa with or without total marrow irradiation with hematopoietic stem cell rescue for poor$risk Ewing sarcoma family tumors // Med. Pediatr. Oncol. - 2000 - Vol.34. -P.328.
39. Hunold A., Weddeling N., Paulussen M. et al. // Topotecan and cyclophosphamide in patients with refractory or relapsedEwing tumors // Pediatr.Blood.Cancer. - 2006 - Vol.47. - P.79S.
40. Amichetti M, Anrelio D, Cianchetti M, et al. A systematic review of proton therapy in the treatment of chondrosarcoma of the skull base. Neurosurg Rev 2010;33(2):155-165.
41. Ciernik IF, Niemierko A, Harmon DC, et al. Proton-based radiotherapy for unresectable or incompletely resected osteosarcoma. Cancer 2011 ;117(19):4522-4530.
42. McDonald MW, Linton OR, Shah MV. Proton therapy for reirradiation of progressive or recurrent chordoma // Int J Radiat Oncol Biol Phys. 2013. Vol. 87. P. 1107-1114.
43. Rutz HP, Weber DC, Goitein G, et al. Postoperative spot-scanning proton radiation therapy for chordoma and chondrosarcoma in children and adolescents: Initial experience at Paul Scherrer Institute // Int J Radiat Oncol Biol Phys. 2008. Vol. 71. P. 220-225.
44. Rornbi B, DeLaney TF, MacDonald SM, et al. Proton radiotherapy for pediatric Ewing"s sarcoma: initial clinical outcomes. Int J Radiat Oncol Biol Phys 2012;82(3):1142-1148.
45. Munzenrider JE, Liebsch NJ. Proton therapy for tumors of the skull base // Strahlenther Onkol. 1999. Vol. 175(Suppl 2). P. 57-63
46. Zalupski M.M., Rankin C., Ryan J.R. et al. Adjuvant therapy of osteosarcoma. A Phase II trial: Southwest Oncology Group study 9139 // Cancer. - 2004, Feb. 15 - Vol.100(4). - P. 818 825
47. Navid F, Willert JR, McCarville MB, et al. Combination of gemcitabine and docetaxel in the treatment of children and young adults with refractory bone sarcoma. Cancer 2008;113:419-425.
48. Grignani G, Palmerini E, Dileo P, et al. A phase II trial of sorafenib in relapsed and unresectable high-grade osteosarcoma after failure of standard multimodal therapy: an Italian Sarcoma Group study. Ann Oncol 2012; 23:508-516.
49. Grignani G, Palmerini E, Ferraresi V, et al. Sorafenib and everolinrus for patients with unresectable high-grade osteosarcoma progressing after standard treatment: a non-randomised phase 2 clinical trial. Lancet Oncol 2015;16(1):98-107.
50. Wonrer RB, West DC, Krailo MD, et al. Randomized controlled trial of interval-compressed chemotherapy for the treatment of localized Ewing sarcoma: A report from the Children’s Oncology Group. J Clin Oncol 2012 Nov 20;30(33):4148-4154.
51. Bernstein ML, Devidas M, Lafreniere D, et al. Intensive therapy with growth factor support for patients with Ewing tumor metastatic at diagnosis: Pediatric Oncology Group/Children"s Cancer Group Phase II Study 9457--a report from the Children"s Oncology Group. J Clin Oncol 2006;24:152-159.
52. Hunold A, Weddeling N, Paulussen M, et al. Topotecan and cyclophosphamide in patients with refractory or relapsed Ewing tumors. Pediatr Blood Cancer 2006;47:795-800.
53. Kushner BH, Kramer K, Meyers PA, et al. Pilot study of topotecan and high-dose cyclophosphamide for resistant pediatric solid tumors. Med Pediatr Oncol 2000;35:468-474.
55. Casey DA, Wexler LH, Merchant MS, et al. Irinotecan and tenrozolomide for Ewing sarcoma: the Memorial Sloan-Kettering experience. Pediatr Blood Cancer 2009;53:1029-1034.
56. Wagner LM, Crews KR, Iacono LC, et al. Phase I trial of tenrozolomide and protracted irinotecan in pediatric patients with refractory solid tumors. Clin Cancer Res 2004;10:840-848.
57. Wagner LM, McAllister N, Goldsby RE, et al. Tenrozolomide and intravenous irinotecan for treatment of advanced Ewing sarcoma. Pediatr Blood Cancer 2007;48:132-139.
58. McNall-Knapp RY, Williams CN, Reeves EN, et al. Extended phase I evaluation of vincristine, irinotecan, tenrozolomide, and antibiotic in children with refractory solid tumors. Pediatr Blood Cancer 2010;54:909-915.
59. Blaney S, Berg SL, Pratt C, et al. A phase I study of irinotecan in pediatric patients: a pediatric oncology group study. Clin Cancer Res 2001;7:32-37.
60. Furman WL, Stewart CF, Poquette CA, et al. Direct translation of protracted irinotecan schedule from a xenograft model to a phase I trial in children. J Clin Oncol 1999;17:1815-1824.
61. McGregor LM, Stewart CF, Crews KR, et al. Dose escalation of intravenous irinotecan using oral cefpodoxinre: A phase I study in pediatric patients with refractory solid tumors. Pediatr Blood Cancer 2012;58:372-379.
62. Reed DR, Hayashi M, Wagner L, et al. Treatment pathway of bone sarcoma in children, adolescents, and young adults. Cancer 2017;123(12):2206-2218.
63. Raciborska A, Bilska K, Drabko K, et al. Vincristine, irinotecan, and tenrozolomide in patients with relaspsed and refractory Ewing sarcoma. Pediatr Blood Cancer 2013;60(10):1621-1625.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Алиев Мамед Джавадович, д.м.н., профессор, академик РАН, советник генерального директора ФГБУ «НМИЦ радиологии» Минздрава России, президент «Восточно-европейской группы по изучению сарком».
2. Анисеня Илья Иванович, к.м.н., старший научный сотрудник НИИ онкологии Томского НИМЦ, эксперт «Восточно-европейской группы по изучению сарком».
3. Бухаров Артем Викторович, к.м.н., старший научный сотрудник ФГБУ «НМИЦ радиологии» Минздрава России.
4. Бохян Бениамин Юрикович, к.м.н., старший научный сотрудник отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», координатор «Восточно-европейской группы по изучению сарком».
5. Валиев Аслан Комраддинович, к.м.н., заведующий отделом общей онкологии НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», эксперт «Восточно-европейской группы по изучению сарком».
6. Гафтон Георгий Иванович, д.м.н., профессор, заведующий научным отделением, ведущий научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком».
7. Егоренков Виталий Викторович, к.м.н., заместитель директора по медицинской части ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», эксперт «Восточно-европейской группы по изучению сарком».
8. Жеравин Александр Александрович, к.м.н., руководитель центра онкологии и радиотерапии ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком».
9. Конев Андрей Андреевич, врач-онколог отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н. Н. Блохина», эксперт «Восточноевропейской группы по изучению сарком».
10. Курильчик Александр Александрович, к.м.н, ведущий научный сотрудник МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, эксперт «Восточноевропейской группы по изучению сарком».
11. Мусаев Эльмар Расимович, д.м.н., профессор, член-корреспондент РАН, заведующий отделением вертебральной хирургии НИИ КО ФГБУ «НМИЦ онкологии им. Н. Н. Блохина», эксперт «Восточно-европейской группы по
изучению сарком».
12. Сафин Ильдар Рафаилович, к.м.н., старший научный сотрудник ГАУЗ «Республиканский клинический онкологический диспансер М3 РТ», эксперт «Восточноевропейской группы по изучению сарком».
13. Соколовский Анатолий Владимирович, к.м.н., научный сотрудник отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н. Н. Блохина», эксперт «Восточно-европейской группы по изучению сарком».
14 Соколовский Владимир Александрович, д.м.н. ведущий научный сотрудник отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н. Н. Блохина», эксперт «Восточно-европейской группы по изучению сарком».
15. Софронов Денис Игоревич, к.м.н., научный сотрудник отделения опухолей опорнодвигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н. Н. Блохина», эксперт «Восточно-европейской группы по изучению сарком»..
16. Сушенцов Евгений Александрович, к.м.н., старший научный сотрудник отделения опухолей опорно-двигательного аппарата НИИ КО ФГБУ «НМИЦ онкологии им. Н. Н. Блохина», ученый секретарь «Восточно-европейской группы по изучению сарком».
17. Тепляков Валерий Вячеславович, д.м.н., профессор, заведующий отделением онкологической ортопедии комбинированных методов лечения ФГБУ «РНЦРР» Минздрава России, эксперт «Восточно-европейской группы по изучению сарком».
18. Феденко Александр Александрович, д.м.н., заведующий отделом химиотерапии ФГБУ «НМИЦ радиологии» Минздрава России, исполнительный директор «Восточно-европейской группы по изучению сарком».
19.. Гуменецкая Юлия Васильевна, Заведующая отделения радиотерапии МРНЦ им. А.Ф. Цыба-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
20. Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба ? филиал ФГБУ «НМИЦ радиологии» Минздрава России.
21. Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба ? филиал ФГБУ «НМИЦ радиологии» Минздрава России.
22. Хайлова Жанна Владимировна, д.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба ? филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Конфликт интересов. Все члены рабочей группы заявляют об отсутствии конфликта интересов
Приложение А2. Методология разработки клинических рекомендации
Целевая аудитория данных клинических рекомендаций:
1) врачи - онкологи, врачи-травматологи-ортопеды, врачи-хирурги, врачи общей практики, врачи-радиологи, врачи-педиатры;
2) преподаватели и студенты медицинских образовательных учреждений, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме диагностики и лечения сарком в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Экономический анализ: анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание метода валидизации рекомендаций. Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций. Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и итации пациентов с саркомами костей, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Решение об обновлении принимает М3 РФ на основе предложений, представленных медицинскими профессиональными сообществами. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение АЗ. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1. Приказ Минздрава России от 7 июля 2015 г. № 422ан «Об утверждении критериев оценки качества медицинской помощи».
2. Перечень жизненно необходимых и важнейших лекарственных препаратов на 2016 г. Распоряжение Правительства РФ от 26.12.2015 № 2724-р.
3. Постановление Правительства Российской Федерации «О порядке и условиях признания лица инвалидом» от 20 февраля 2006 г. № 95 (в ред. Постановлений Правительства РФ от 07.04.2008 № 247, от 30.12.2009 № 1121, от 06.02.2012 № 89, от 16.04.2012 № 318, от 04.09.2012 № 882).
4. Изменения, которые вносятся в Правила признания лица инвалидом, утвержденные Постановлением Правительства Российской Федерации от 7 апреля 2008 г. № 24.
5. Приказ Министерства Здравоохранения и Социального развития Российской Федерации от 17 декабря 2015 г. № 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
6. Федеральный закон от 9 декабря 2010 г. № 351-ФЗ «О внесении изменений в Федеральный закон «О ветеранах» и статьи 11 и 11.1 Федерального закона «О социальной защите инвалидов в Российской Федерации».
7. Порядок выплаты компенсации за самостоятельно приобретенное инвалидом техническое средство реабилитации и (или) оказанную услугу, включая порядок определения ее размера и порядок информирования граждан о размере указанной компенсации (Приказ Минздравсоцразвития России № 57н от 31 января 2011 г.).
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
1. Пациенты с любой формой саркомы кости с диспансерного учета не снимаются.
2. Рекомендации при осложнениях химиотерапии ? связаться с врачом-онкологом:
1) при повышении температуры тела 38 °С и выше:
• проконсультироваться с лечащим врачом-онкологом;
2) при стоматите:
• диета - механическое, термическое щажение;
• частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
• обрабатывать полость рта по рекомендации врача-онколога;
3) при диарее:
• диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
• принимать препараты по назначению врача-онколога;
4) при тошноте:
• принимать препараты по назначению врача-онколога.
Приложение П-Ш. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Теги: саркома
234567 Начало активности (дата): 17.03.2023 21:20:00
234567 Кем создан (ID): 989
234567 Ключевые слова: саркома, кости, пациенты, череп, нижние конечности
12354567899
Похожие статьи
Рак уретрыРентген на дому 8 495 22 555 6 8
05.03.2023
Рак мочевого пузыря
Рак желудка



