 03.05.2019
03.05.2019
Практические рекомендации по лекарственному лечению меланомы кожи
Диагноз МК основывается на данных осмотра, результатах инструментальных исследований и патоморфологическом заключение.
В настоящее время стадирование меланомы кожи (МК) проводится согласно TNM/AJCC (8-е издание
Классификации злокачественных опухолей 2017 г.)(табл. 1). В соответствии с требованиями этой классификации для определения стадии должны использоваться следующие критерии:
• для первичной МК — толщина первичной опухоли, наличие или отсутствие её изъязвления, митотический индекс (количество митозов на 1 мм2 при толщине опухоли менее 1 мм;
• для метастазов в регионарных лимфоузлах — количество поражённых лимфоузлов, характер поражения (макро-/микро-), наличие или отсутствие изъязвления первичной опухоли;
• для отдалённых метастазов — их локализация и уровень ЛДГ.
Таблица 1. Классификация и определение стадии меланомы кожи TNM/AJCC
Классификации злокачественных опухолей 2017 г.)
|
Первичная опухоль (T) |
||
|
Категория T |
Толщина, мм |
Изъязвление |
|
TX |
Оценить первичную опухоль невозможно (например, после удаления кюреткой или |
|
|
Т0 |
Признаков первичной опухоли нет |
|
|
Tis (меланома |
Не применимо |
Не применимо |
|
T1 |
<1,0 мм |
|
|
• T1a |
<0,8 мм |
Без изъязвления |
|
• T1b |
<0,8 мм |
С изъязвлением |
|
0,8-1,0 мм |
С изъязвлением или |
|
|
Т2 |
1,01-2,0 |
a: без изъязвления |
|
b:с изъязвлением |
||
|
T3 |
2,01-4,0 |
a: без изъязвления |
|
b:с изъязвлением |
||
|
T4 |
>4,0 |
a: без изъязвления |
|
b:с изъязвлением |
||
|
Регионарные лимфоузлы (N) |
||
|
Категория N |
Количество поражённых лимфатических узлов |
Наличие |
|
NX |
Регионарные лимфоузлы не могут быть оценены (например, |
Отсутствуют |
|
N0 |
Нет признаков поражения регионарных лимфоузлов |
Отсутствуют |
|
N1 |
Один поражённый регионарный лимфатический узел ИЛИ наличие транзиторных, |
|
|
• N1a |
Один поражённый клинически не определяемый регионарный |
Отсутствуют |
|
• N1b |
Один поражённый клинически определяемый регионарный |
Отсутствуют |
|
• N1c |
Нет метастазов в регионарных лимфоузлах |
Присутствуют |
|
N2 |
Два или три поражённых регионарных лимфатических узла ИЛИ один поражённый |
|
|
• N2a |
Два или три поражённых клинически не определяемых регио- |
Отсутствуют |
|
• N2b |
Два или три поражённых определяемых клинически регионар- |
Отсутствуют |
|
• N2c |
Один поражённый клинически не определяемый или опреде- |
Присутствуют |
|
N3 |
Четыре и более поражённых регионарных лимфатических узла или два и более |
|
|
• N3a |
Четыре и более поражённых клинически не определяемых |
Отсутствуют |
|
• N3b |
Четыре и более поражённых регионарных лимфатических узла, |
Отсутствуют |
|
• N3c |
Два или более клинически не определяемых или определяе- |
Присутствуют |
|
|
Отдалённые метастазы (M) |
|||
|
Категория М |
Анатомическая локализация метастазов |
Уровень ЛДГ |
|
|
M0 |
Нет признаков отдалённых метастазов |
Не применимо |
|
|
M1 |
Есть отдалённые метастазы |
|
|
|
• M1a |
Отдалённые метастазы в коже, мягких тканях (включая мышеч- |
Не указан или не |
|
|
- M1a (0) |
|
Не повышен |
|
|
- M1a (1) |
|
Повышен |
|
|
• M1b |
Отдалённые метастазы в лёгких в сочетании или без метаста- |
Не указан или не |
|
|
- M1b (0) |
|
Не повышен |
|
|
- M1b (1) |
|
Повышен |
|
|
• M1c |
Отдалённые метастазы во внутренних органах за исключением |
Не указан или не |
|
|
- M1c (0) |
|
Не повышен |
|
|
- M1c (1) |
|
Повышен |
|
|
• M1d |
Отдалённые метастазы в ЦНС в сочетании или без метастазов, |
|
|
|
- M1d (0) |
|
Не повышен |
|
|
- M1d (1) |
|
Повышен |
|
|
Группировка по стадиям |
|||
|
T |
N |
M |
Стадия |
|
Tis |
N0 |
M0 |
0 |
|
T1a |
N0 |
M0 |
IA |
|
T1b |
N0 |
M0 |
|
|
T2a |
N0 |
M0 |
IB |
|
T2b |
N0 |
M0 |
IIA |
|
T3a |
N0 |
M0 |
|
|
T3b |
N0 |
M0 |
IIB |
|
T4a |
N0 |
M0 |
|
|
T4b |
N0 |
M0 |
IIC |
|
T0 |
N1b, N1c |
M0 |
IIIB |
|
T0 |
N2b, N2c, N3b или N3c |
M0 |
IIIC |
|
T1a/b-T2a |
N1a или N2a |
M0 |
IIIA |
|
T1a/b-T2a |
N1b/c или N2b |
M0 |
IIIB |
* ЗЛОКАЧЕСТВЕННЫЕ ; издание)
Том 8, #3, 2018, спецвыпуск 2
216
Практические рекомендации
RUSSCO
|
T2b/T3a |
N1a-N2b |
M0 |
IIIC |
|
T1a-T3a |
N2c или N3a/b/c |
M0 |
|
|
T3b/T4a |
Любая категория N > N1 |
M0 |
|
|
T4b |
N1a-N2c |
M0 |
|
|
T4b |
N3a/b/c |
M0 |
IIID |
|
Любая категория |
Любая категория N |
M1 |
IV |
2. ДИАГНОСТИКА
2.1. Диагноз МК
Основывается на данных осмотра, результатах инструментальных исследований и патоморфологическом заключении:
• физикальный осмотр, тщательное исследование кожных покровов и видимых слизистых оболочек, пальпация периферических лимфатических узлов;
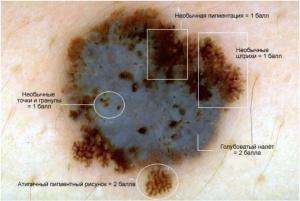
• дерматоскопия с целью дифференциальной диагностики может быть использована специалистами, имеющими соответствующую квалификацию и опыт интерпретации полученных данных;
• R-графия органов грудной клетки в прямой и боковой проекциях (флюорография недопустима!);
• УЗИ периферических лимфоузлов, органов брюшной полости, забрюшинного пространства и малого таза;
• определение уровня ЛДГ при метастатической меланоме;
• КТ органов грудной полости;
• КТ/МРТ органов брюшной полости с в/в контрастированием;
• КТ/МРТ органов малого таза с в/в контрастированием (при локализации первичной опухоли на коже нижней половины туловища или на нижних конечностях);
• КТ/МРТ головного мозга с в/в контрастированием;
• радиоизотопное исследование костей скелета;
• ПЭТ, ПЭТ/КТ с ^F-ФДГ в режиме «все тело» для выявления отдалённых метастазов (начиная с III стадии).
2.2. Морфологическое подтверждение диагноза «меланома»
Является обязательным.
2.2.1. Гистологическое исследование первичной опухоли
• Определение максимальной толщины опухоли в мм по Бреслоу;
• определение уровня инвазии по Кларку;
• указание о наличии или отсутствии изъязвления первичной опухоли;
• определение митотического индекса (количество митозов на 1 мм2) при толщине опухоли до 1 мм включительно;
• наличие транзиторных или сателлитных метастазов;
• нейротропизм;
• десмоплазия;
• оценка краёв резекции на наличие опухолевых клеток.
2.2.2. Гистологическое исследование метастазов меланомы в регионарных лимфоузлах
• Количество удалённых лимфатических узлов;
• количество поражённых лимфатических узлов;
• характер поражения лимфатических узлов:
- частичное поражение (количество лимфатических узлов);
- полное поражение (количество лимфатических узлов);
- прорастание капсулы (количество лимфатических узлов)
3. ЛЕЧЕНИЕ
3.1. Лечение пациентов с локальными стадиями МК (HI стадии)
Радикальное иссечение первичной опухоли в пределах здоровых тканей является обязательным этапом лечения локальной МК. Выбор хирургического отступа формируется на основании результатов морфологического исследования, а именно — толщины опухоли. В настоящее время общепринятыми отступами для уже установленной стадии являются:
• 0,5 см — для меланомы in situ;
• 1,0 см — при толщине опухоли по Бреслоу <2 мм;
• 2,0 см — при толщине опухоли >2 мм.
Модифицированные варианты резекции возможны для сохранения функции при МК пальцев или кожи ушной раковины.
Для определения толщины опухоли возможно на первом этапе использование эксцизионной биопсии пигментного образования с отступом не более 0,5 см. В случае подтверждения диагноза МК рубец после биопсии иссекается с большим отступом в сроки 4-8 нед. Если эксцизионная биопсия не проводится из-за очевидности диагноза, отступы от видимых краёв опухоли никогда не следует расширять более, чем на 3 см, так как без точных знаний микростадии это будет приводить к излишним манипуляциям, связанным с закрытием послеоперационной раны (например, различным видам сложной пластики).
Не рекомендуется рутинное выполнение профилактической лимфаденэктомии или предоперационной ЛТ регионарных лимфатических узлов и зоны первичной опухоли. БСЛУ с последующей регионарной лимфаденэктомией при его поражении при толщине опухоли > 1 мм является необходимой процедурой,которая должна выполняться в специализированных учреждениях. Особое внимание рекомендуется уделить морфологическому исследованию удалённого (ых) сторожевого (ых) лимфатического (их) узла (ов) при БСЛУ: настоятельно рекомен дуется выполнить как можно больше срезов, а также, помимо окраски гематоксилином и эозином, использовать ИГХ окрашивание на специфические для МК маркёры (Melan A, тирозиназа, S100, HMB45). ИГХ окрашивание рекомендуется рутинно выполнять, в том числе и при отсутствии признаков метастатического
поражения по данным окрашивания гематоксилином и эозином. При отсутствии возможности БСЛУ следует максимально тщательно исследовать регионарные лимфоузлы, используя УЗИ для навигации на подозрительный лимфатический узел с последующей тонкоигольной пункцией и цитологическим исследованием.
Не рекомендуется проводить адъювантную терапию ИФНа при МК благоприятного прогноза, имеющей низкий риск прогрессирования заболевания (IA, IB, 11A стадии), а также в том случае, если риски, связанные с развитием
нежелательных явлений на фоне применения ИФН, перевешивают ожидаемую пользу. Назначение ИФНа оправдано только для изъязвлённых форм 11B и 11C стадии (табл. 2). Адъювантную иммунотерапию рекомендуется начинать не позднее 9 нед. с момента хирургического лечения, после полного заживления
послеоперационной раны. Не рекомендуется начинать адъювантное лечение ИФН в том случае, если с момента операции прошло более 9 нед.
Таблица 2. Рекомендуемые режимы применения ИФНа в адъювантной терапии меланомы кожи1
|
|
Индукционная фаза |
Поддерживающая фаза |
|
Высокие дозы |
ИФНа 20 млн. Ед./м2 в/в |
ИФНа 10 млн. Ед./м2 п/к |
|
Низкие дозы |
ИФНа 3-5 млн. Ед. п/к х 3 раза в нед. х 12 мес. |
|
1 Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии такой возможности.
3.2. Лечение пациентов с метастазами МК в регионарных лимфатических узлах (III стадия)
Меланома кожи III стадии представляет собой неоднородную группу и подразделяется на резектабельный и нерезектабельный местнораспространенный процесс (включая конгломераты лимфоузлов и/или транзиторные или сателлитные метастазы, т.е. клинические стадии IIIB или IIIC стадии). Обязательное лечение при резектабельном процессе включает:
• адекватное иссечение первичной опухоли (если не было выполнено ранее);
• регионарную лимфаденэктомию (у всех пациентов);
• адъювантную терапию, которую рекомендуется начинать не позднее 3 мес. после оперативного лечения (табл. 3);
• приоритетным является участие пациентов в клинических исследованиях;
• адъювантная ХТ не рекомендуется.
С целью снижения частоты локальных рецидивов (без влияния на общую выживаемость) возможно проведение адъювантной ЛТ с воздействием на зону удалённых регионарных лимфоузлов при их массивном поражении, которое характеризуется поражением:
• одного и более околоушного лимфатического узла;
• двух и более шейных или подмышечных лимфатических узлов (или при размерах лимфоузла более 3 см);
• трёх и более пахово-бедренных лимфатических узлов (или при их размерах более 4 см).
Дистанционная лучевая терапия проводится в следующих режимах:
• РОД 2 Гр, СОД 50-66 Гр 5-6 нед.;
• РОД 2,4 Гр, СОД 48 Гр за 4 нед.;
• РОД 6 Гр, СОД 30 Гр (2 раза в нед.).
Использование новых методик дистанционной лучевой терапии, таких как IMRT VMAT, позволяет снижать степень повреждения здоровых тканей.
Рекомендации по лечению больных нерезектабельной меланомой кожи IIIB-C будут рассмотрены в разделе 3.4. Рекомендуемый алгоритм первичного обследования и лечения при меланоме представлен на рис. 1.
Таблица 3. Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания и мутационного статуса1
|
Стадия |
Наличие |
Оптимальный объём лечения2 |
Минимальный объём |
|
IIIA |
BRAF V600 |
Ингибиторы BRAF/MEK:
дабрафениб 150 мг внутрь х 2 раза в сут. + тра- анти-PD1 терапия:
пембролизумаб 2 мг/кг (но не более 200 мг) |
ИФНа 3-5 млн. Ед. п/к х
ИФНа-2Ь 20 млн. Ед./м2 |
|
IIIA |
BRAF V600 |
Анти-PD1 терапия:
пембролизумаб 2 мг/кг (но не более 200 мг) |
|
|
IIIB, IIIC |
BRAF V600 |
Ингибиторы BRAF/MEK:
дабрафениб 150 мг внутрь х 2 раза в сут. + тра- анти-PD1 терапия:
пембролизумаб 2 мг/кг (но не более 200 мг) |
ИФНа 3-5 млн. Ед. п/к х |
|
Стадия |
Наличие |
Оптимальный объём лечения2 |
Минимальный объём |
|
IIIB, IIIC |
BRAF V600 |
Анти-PDI терапия:
пембролизумаб 2 мг/кг (но не более 200 мг) |
ИФНа 3-5 млн. Ед. п/к х
ИФНа-2Ь 20 млн. Ед./м2 |
|
IV (после |
|
Анти-PDI терапия:
ниволумаб 3 мг/кг (но не более 240 мг) |
|
1 Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии такой возможности;
2 Назначение адъювантной терапии блокаторами PD1 или ингибиторами BRAF/MEK должно проводиться по решению врачебной комиссии.
3.3. Лечение рецидивов заболевания
После оценки распространения опухолевого процесса проводится соответствующее лечение (рис. 2).
3.4. Лечение меланомы кожи III (нерезектабельной) и IV стадий
Приоритетным является участие пациентов в клинических исследованиях.
При выборе тактики лечения метастатической МК рекомендуется молекулярно-генетическое исследование опухоли с целью выявления BRAF-мутации. При отсутствии BRAF-мутации (в меланоме коже и слизистых оболочек) возможно проведение молекулярно-генетического исследования опухоли на наличие мутации c-KIT. Определение мутаций в опухолевой ткани должно проводиться только в сертифицированных лабораториях. Для анализа предпочтительно использование метастатической опухоли.
3.4.1. Иммунотерапия
Вне зависимости от наличия мутации BRAF V600 (и других мутаций) приоритетным лечением I и последующих линий терапии в отсутствие висцерального криза является назначение ингибиторов контрольных точек иммунного ответа:
• комбинированная иммунотерапия «анти-CTLA4 (ипилимумаб) + анти-PD1 (ниволумаб)» при метастатической МК улучшает показатели выживаемости без прогрессирования и частоты объективных ответов независимо от уровня экспрессии PD—L1 на опухолевых клетках и наличия мутации
в гене BRAF (табл. 2);
• анти-PDI терапия ниволумабом и пембролизумабом, по данным рандо-мизированных исследований, у пациентов с III нерезектабельной и IV стадиями болезни увеличивает общую и безрецидивную выживаемости независимо от уровня экспрессии PD—L1 на опухолевых клетках и наличия мутации в гене BRAF) (табл. 2);
• анти-С^А4 терапия: при медленно прогрессирующей метастатической и/или местнораспространенной МК (III неоперабельная и IV стадии), ожидаемой продолжительности жизни не менее 12-24 нед. и отсутствии
противопоказаний в I и последующих линиях терапии возможно использование ипилимумаба независимо от мутации BRAF (в том числе, после прогрессирования на фоне блокаторов рецептора PD1) (табл. 4).
Таблица 4. Рекомендуемые режимы иммунотерапии распространённой меланомы кожи
|
Схема лечения |
Оценка эффекта |
|
Комбинированная иммунотерапия (анти-PDI + анти-С^А-4) |
|
|
Ниволумаб 1 мг/кг в/в капельно + ипилимумаб 3 мг/кг в/в капельно 1 раз |
На 12-й неделе, далее — |
|
Анти-PD1 терапия |
|
|
Ниволумаб 3 мг/кг (но не более 240 мг) в/в капельно 1 раз в 2 нед., длитель- |
На 12-й неделе, далее — |
|
Пембролизумаб 2 мг/кг (но не более 200 мг) в/в капельно 1 раз в 3 нед., |
На 12-й неделе, далее — |
|
Анти-ОгА-4 |
|
|
Ипилимумаб 3 мг/кг в/в капельно 1 раз в 3 нед., 4 введения |
На 12-й неделе, далее — |
1 Терапию ниволумабом или пембролизумабом прекращают при наступлении одного из следующих событий:
• доказанное прогрессирование заболевания (исключить явления псевдопрогрессии);
• развитие тяжёлых нежелательных явлений (в том числе иммунноопосредованных, т.е., связанных с применением препарата);• достижение полной регрессии опухоли, подтверждённой двумя последовательными инструментальными исследованиями (МСКТ, МРТ или ПЭТ/КТ с ISF-ФДГ в режиме «все тело»), выполненными с интервалом не менее 3 мес.;
• длительно существующая частичная регрессия, при которой терапию рекомендуется проводить в общей сложности в течение 1 года.
2В исследованиях III фазы медиана длительности терапии пембролизумабом составила 24-28 нед. (от 0.1 до 111.1 нед.).
Необходимо своевременное выявление и лечение в соответствии с общепринятыми алгоритмами аутоиммунных нежелательных явлений (диарея, колит, гепатит, эндокринопатии, дерматит и др.).
3.4.2. Ингибиторы BRAF/MEK
При наличии в опухоли мутации в гене BRAF V600 в I или последующих линиях рекомендуется назначение комбинации ингибитора BRAF (вемурафениба или дабрафениба) с ингибитором MEK (кобиметинибом или траметинибом).
Одновременное назначение ингибитора BRAF и ингибитора МЕК обладает большей эффективностью по сравнению с монорежимами этих препаратов, однако при невозможности комбинированной терапии «ингибитор BRAF + ингибитор MEK» возможно проведение монотерапии ингибитором BRAF. Траметиниб, относящийся к группе ингибиторов МЕК, обладает большей эффективностью по сравнению со стандартной ХТ (см. раздел 3.4.4.) при мутации гена BRAF, однако его использование в монорежиме не рекомендуется в связи с меньшей эффективностью по сравнению с ингибиторами BRAF. Не рекомендуется также добавлять ингибиторы МЕК при прогрессировании на фоне BRAF ингибиторов. Рекомендуемые режимы применения ингибиторов BRAF и МЕК
представлены в табл. 5.
Таблица 5. Рекомендуемые режимы применения ингибиторов BRAF и МЕК при распространённой меланоме кожи
|
Схема лечения |
Оценка эффекта |
|
Монотерапия |
|
|
Вемурафениб 960 мг внутрь х 2 раза в сут. ежедневно, длительно1 |
На 8-10-й неделе, далее — |
|
Дабрафениб 150мг внутрь х 2 раза в сут. ежедневно, длительно1 |
|
|
Комбинированная терапия |
|
|
Вемурафениб 960 мг внутрь х 2 раза в сут. ежедневно + кобиметиниб 60 мг |
На 8-10-й неделе, далее — |
|
Дабрафениб 150мг внутрь х 2 раза в сут. ежедневно +траметиниб 2 мг |
|
'Лечение проводится до прогрессирования заболевания или развития неприемлемых токсических явлений.
Учитывая особый профиль дерматологических нежелательных явлений, в частности риск развития плоскоклеточного рака и других опухолей кожи (включая новую МК), в процессе лечения необходимо регулярно проводить осмотр кожных покровов. При подозрении на развитие плоскоклеточного рака или кератоакантомы необходимо их хирургическое удаление с последующим гистологическим исследованием, при этом терапия ингибиторами BRAF может быть продолжена без перерыва в лечении и/или редукции дозы.
Следует отметить, что комбинированные режимы обладают меньшей кожной токсичностью и способностью индуцировать развитие плоскоклеточного рака.
3.4.3. Ингибиторы c-KIT
При мутации в гене KIT по решению врачебной комиссии возможно назначение иматиниба 800 мг/сут. (по 400 мг 2 раза в день). Лечение проводят до прогрессирования заболевания или признаков непереносимости терапии.
3.4.4. Химиотерапия
При недоступности ингибиторов BRAF, MEK (в виде комбинированных режимов и монотерапии) и ингибиторов контрольных точек иммунного ответа (длительность ожидания начала терапии более 28 дней), а также в случае
доказанного прогрессирования на фоне их применения или при наличии противопоказаний к их использованию для лечения диссеминированной МК могут быть использованы стандартные режимы ХТ (табл. 6).
Таблица 6. Рекомендуемые режимы химиотерапии диссеминированной меланомы кожи
Дакарбазин 1000 мг/м2 в/в в 1-й день, каждые 3-4 нед.
Дакарбазин 250 мг/м2 в/в в день 1-5-й дни, каждые 3-4 нед.
Темозоломид 200 мг/м2 внутрь или в/в в 1-5-й дни, каждые 3-4 нед.
Ломустин 80 мг/м2 в/в в 1-й день, каждые 3 нед.
При первой возможности вне зависимости от эффекта ХТ пациента следует перевести на терапию ингибиторами BRAF и MEK, монотерапию ингибиторами BRAF или терапию ингибиторами контрольных точек иммунного ответа (если не получал их ранее), поскольку все вышеперечисленные препараты обладают большей непосредственной эффективностью и обеспечивают более высокие показатели общей выживаемости.
3.5. Лечение больных с метастазами меланомы в головном мозге
Алгоритм тактики лечения больных с метастазами МК в головном мозге должен опираться на следующие критерии:
• экстракраниальное распространение заболевания и возможность его контроля;
• размер метастазов в головном мозге (больше или меньше 3 см);
• количество метастазов в головном мозге (солитарный метастаз, олигометастатическое поражение, множественные метастазы);
• общее состояние по шкале Карновского (более 70%, менее 70%);
• расположение метастазов в функционально значимых зонах мозга;
• наличие или отсутствие неврологических симптомов.
Открытая хирургическая операция имеет преимущества перед стереотаксической ЛТ у пациентов с очагами >3 см, расположенными в функционально не значимых отделах мозга, при ожидаемой продолжительности жизни (без учёта влияния метастатического поражения головного мозга) >3 мес. После хирургического лечения дополнительно возможно проведение сеанса стереотаксической ЛТ на операционную полость для улучшения локального контроля.
При поражении функционально значимых отделов головного мозга предпочтение может быть отдано стереотаксической ЛТ. При олигометастатическом поражении головного мозга (3-10 очагов размерами до 3 см каждый) стереотаксическая ЛТ может иметь преимущества в сравнении с лекарственным лечением или с облучением всего головного мозга.
Сообщения о роли ЛТ при множественном поражении головного мозга или его оболочек противоречивы. Эта процедура может быть предложена для облегчения неврологических симптомов при множественных метастазах в головном мозге. Для лекарственного лечения пациентов с метастатическим поражением головного мозга могут использоваться те же режимы и комбинации, которые применяются для лечения больных с экстракраниальными метастазами. При метастазах в головном мозге ХТ менее эффективна, чем ингибиторы BRAF ± ингибиторы MEK, а также ингибиторы контрольных точек иммунного ответа.
Комбинированная иммунотерапия (анти-С^А4 (ипилимумаб) + анти-PDI ниволумаб)) при лечении пациентов с метастазами меланомы в головном мозге улучшает показатели выживаемости без прогрессирования и частоты
объективных ответов по сравнению с монотерапией анти-PDI или монотерапией анти-С^А4.
Среди химиопрепаратов целесообразно отдать предпочтение липофильным: темозоломиду и производным нитрозомочевины (ломустин).
Сведения о целесообразности назначения лекарственного лечения после хирургического или лучевого воздействия на солитарный метастаз в головном мозге противоречивы. Тщательный контроль и начало терапии в случае появления признаков прогрессирования заболевания может быть более целесообразным, чем назначение терапии в условно «адъювантном» режиме.
При возникновении единичных метастатических поражений головного мозга на фоне таргетной терапии «ингибиторы BRAF ± ингибиторы MEK» таргетная терапия может быть продолжена после локального лечения метастазов в головном мозге и при отсутствии прогрессирования в других органах.
3.6. Лечение отдельных категорий больных метастатической и нерезектабельной меланомой кожи
3.6.1. Хирургическое удаление или стереотаксическая ЛТ метастазов
Могут быть проведены в отдельных случаях у больных в удовлетворительном общем состоянии с изолированным опухолевым поражением. Возможно также удаление оставшихся опухолевых очагов после эффективной системной терапии.
3.6.2. Паллиативная ЛТ
Может быть назначена при множественном поражении головного мозга или при симптомном поражении костей, мягких тканей и лимфоузлов.
3.6.3. Для пациентов с особым типом изолированного метастазирования в виде поражения кожи и/или мягких тканей конечности
Может быть рекомендован метод изолированной перфузии конечности мелфаланом,который выполняется в специализированных центрах(ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России, ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России).
3.6.4. Использование режимов полихимиотерапии
Может увеличить частоту объективных ответов, но не приводит к увеличению безрецидивной и общей выживаемости. Такой вариант лечения рекомендуется при наличии симптомов, обусловленных опухолевым ростом, у отдельных больных в удовлетворительном общем состоянии (по шкале ECOG <2 балла).
Рекомендуемые режимы полихимиотерапии представлены в табл. 7. Одновременное использование ХТ (дакарбазина, цисплатина, винкаалкалоидов, препаратов нитрозомочевины) и иммунотерапии (ИФНа, ИЛ-2)
обеспечивает большую частоту объективных эффектов и увеличивает время до прогрессирования, но не влияет на продолжительность жизни. Ввиду сравнительно высокой токсичности подобное лечение должно проводиться
в специализированных центрах по индивидуальным программам.
Таблица 5. Рекомендуемые режимы комбинированной химиотерапии меланомы кожи
Дакарбазин 800 мг/м2 в/в в 1-й день + винбластин 2 мг/м2 в/в в 1-4-й дни + цисплатин 20мг/м2 в/в в 1-4-й дни, каждые 3-4 нед.
Паклитаксел 175-225 мг/м2 в/в в 1-й день + карбоплатин AUC 5-6 в/в в 1-й день, каждые 3 нед.
Темозоломид 150 мг/м2 внутрь или в/в в 1-5-й дни + цисплатин 20мг/м2 в/в в 1-5-й дни, каждые 4 нед.
4. НАБЛЮДЕНИЕ
В настоящее время нет единого мнения относительно оптимального графика наблюдения за больными МК. Всем больным рекомендуется избегать солнечных ожогов, проводить регулярное самообследование и своевременно
обращаться к врачу при выявлении каких-либо изменений. График и объём обследования зависит от стадии заболевания и степени риска рецидива:
• стадия 0: ежегодный физикальный осмотр с тщательной оценкой состояния кожных покровов;
• стадии I—IIA: физикальный осмотр с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 6 мес. в течение 5 лет, затем — ежегодно; инструментальное обследование — только по показаниям;
• стадии IIB — III и IV (после удаления солитарных метастазов): обследование при отсутствии признаков заболевания — не реже 1 раза в 3 мес. в течение 2 лет, затем — каждые 6 мес. в течение 3 лет, затем — ежегодно;
обследование включает в себя:
- физикальный осмотр с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов;
- R-графию органов грудной клетки, УЗИ органов брюшной полости, периферических и отдалённых лимфоузлов; по показаниям — КТ органов грудной клетки, КТ/МРТ органов брюшной полости и малого таза с в/в контрастированием, ПЭТ/КТ с ^F-ФДГ в режиме «все тело» для выявления отдалённых метастазов и оценки ответа на лечение (подтверждения полного ответа);
- КТ или МРТ головного мозга с в/в контрастированием у пациентов с впервые выявленными отдалёнными метастазами для исключения метастатического поражения головного мозга; скрининг метастазов в головном мозге у пациентов с отдалёнными экстракраниальными метастазами без неврологических симптомов следует проводить каждые 6-12 мес.
Теги: меланома кожи
234567 Начало активности (дата): 03.05.2019 16:59:00
234567 Кем создан (ID): 989
234567 Ключевые слова: меланома кожи, мутация в гене BRAF, иммунотерапия, анти-PDl, анти- CTLA4
12354567899



