ГЛАВА 18 НЕОТЛОЖНАЯ МЕДИЦИНСКАЯ ПОМОЩЬ БОЛЬНЫМ С ХИРУРГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ И ТРАВМАМИ
18.1. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЕ
18.1.1. ТРАВМА ГОЛОВЫ
Травма головы (ТГ) - понятие, объединяющее два слагаемых: 1) повреждение механической энергией только мягких покровов головы (скальпа) без повреждений костей черепа и вещества мозга; 2) повреждение механической энергией черепа и головного мозга (как при наличии сопутствующих повреждений мягких покровов головы, так и без них). Избирательное повреждение мягких покровов обозначается как ушиб головы и составляет 80% всех ТГ. Повреждение механической энергией черепа и внутричерепного содержимого (головного мозга, мозговых оболочек, сосудов, черепных нервов) обозначается как черепномозговая травма (ЧМТ).
Примечание. В биомеханике деструктивного воздействия на ткани мозга участвует комплекс первичных факторов. Среди них ведущие: 1) ударная волна, распространяющаяся от места приложения травмирующего агента к голове через мозг к противоположному полюсу с быстрыми перепадами давления в местах удара и противоудара; резонансная кавитация; ударный эффект деформации черепа, а также гидродинамический удар цереброспинальной жидкости (ЦСЖ); 2) перемещение и ротация массивных полушарий большого мозга относительно более фиксированного ствола мозга при травме ускорения-замедления (Л.Б. Лихтерман, 1994).
При тяжелой ЧМТ как в ЦНС, так и во всем организме развиваются сложные патофизиологические реакции. Прежде всего это все формы гипоксии. Из них главное значение имеет циркуляторная церебральная гипоксия. Она обусловлена несколькими факторами: первичным повреждением сосудистой сети мозга; давлением гематом, гидром; повышением сосудистого тонуса артериол (первые трое суток); атонией венозных сосудов; отеком - набуханием мозга (с первых 10- 15 мин от момента ЧМТ); выраженными нарушениями микроциркуляции (гиперкоагуляция, синдром вутрисосудистого диссеминированного свертывания (ДВСсиндром), агрегация форменных элементов крови, повышение вязкости крови). Кроме того, происходят нарушения ликвородинамики и ликворопродукции, кровоизлияние в спинномозговое пространство с образованием кровяных тромбов, возрастает проницаемость гематоэнцефалического барьера.
К очень серьезным осложнениям следует отнести рвоту, регургитацию и аспирационный синдром (каждый четвертый из погибших от ЧМТ умирает именно от этого осложнения).
18.1.2. ОБЩИЕ ВОПРОСЫ ДИАГНОСТИКИ ЧМТ
При ЧМТ могут наблюдаться общемозговые, очаговые, дислокационные, оболо-
чечные и другие симптомы и синдромы.
Симптомы общемозговые (СО) при ЧМТ являются клиническими признаками органного поражения головного мозга. К ним относят количественные и качественные изменения сознания, симптомы внутричерепной гипертензии и гипотензии, симптомы, обусловленные гипоксией, ишемией или интоксикацией мозга, а также головную боль, тошноту и рвоту, головокружение, церебральную астению (адинамию) и изменения на глазном дне.
Головная боль наблюдается у абсолютного большинства больных. По своему характеру она обычно диффузная, степень ее выраженности и длительность зависят от тяжести повреждения. Локализованной и очень интенсивной головная боль становится при субарахноидальном кровоизлиянии и гематомах. Для тошноты и рвоты на фоне ЧМТ характерно отсутствие взаимосвязи с приемом пищи и наступлением субъективного облегчения после нее. Церебральная астения (адинамия) проявляется повышенной истощаемостью, нарушением мышления, памяти и изменением тонуса мышц в первые сутки после травмы.
СО тем продолжительнее, чем тяжелее повреждение головного мозга. Повышение внутричерепного давления (ВЧД) обычно сопровождает сдавление мозга, а также очаги размозжения, особенно лобных долей. Понижение ВЧД обычно сопровождает переломы основания черепа с носовой или ушной ликвореей. Посттравматическая гидроцефалия, возникающая вследствие нарушений ликвороциркуляции, также может лежать в основе СО. Развитие общемозговой симптоматики тесно связано с реакциями мозга на ЧМТ - его отеком, набуханием, а иногда коллапсом. Гипоксия головного мозга при ЧМТ часто развивается вследствие окклюзии дыхательных путей рвотными массами, слюной и др. на фоне выключения сознания в момент травмы.
Примечание. 1. Отек мозга травматический определяется как повышенное содержание воды в тканях мозга после ЧМТ. 2. Набухание головного мозга - увеличение объема мозга за счет повышения его кровенаполнения в остром периоде ЧМТ. 3. Коллапс мозга (КМ) определяется как состояние, наблюдаемое при переломах основания черепа (в 25-40% случаев), особенно сопровождающихся ликвореей, после оперативных вмешательств - удаления внутричерепных гематом, гигром и других объемных процессов, часто при повторной ЧМТ. Основным синдромом КМ является снижение ВЧД.
ОЧАГОВЫЕ СИМПТОМЫ при ЧМТ являются клиническими признаками локального поражения головного мозга. Их появление и структура находятся в тесной зависимости от повреждений тех или иных образований мозга (лобной, височной, теменной, затылочной долей, подкорковых узлов, мозжечка, ствола и др.). В остром периоде ЧМТ очаговые симптомы (двигательные, чувствительные, речевые, зрительные, статокоординаторные и др.) обычно сочетаются с общемозговыми симптомами, которые нередко их затушевывают. Очаговые симптомы лежат в основе топической диагностики ЧМТ и ее последствий.
К очаговым симптомам относят парезы или параличи, расстройства речи, чувствительности, зрения, слуха, эпилептические припадки (могут встречаться как следствие повышенного внутричерепного давления, гипоксии мозга и пр.), а также психопатологические расстройства. Апатико-абулический синдром чаще отмечается при поражении лобных долей; нарушения, связанные со слуховыми восприятиями, - при поражении височной доли и т.д. Очаговые неврологические расстройства - моторная, или сенсорная, афазия, гемипарез (гемиплегия), апраксия и т.д. также указывают на область поражения.
Примечание. 1. Апатико-абулический синдром определяется как сочетание аспонтанности с безразличием к окружающему. 2. Аспонтанность определяется как уменьшение, отсутствие побуждений к двигательной, речевой, психической и др. видов деятельности. 3. Апраксия, или расстройство действия, совершения действий, состоит в нарушении последовательности и правильности целенаправленных движений, в результате чего больной теряет способность выполнять привычные действия, несмотря на полную сохранность мышечной силы и координаторных механизмов.
Нарушения зрачковых реакций отражают степень тяжести повреждения в диапазоне от вялости зрачковых реакций при легкой ЧМТ до их полного отсутствия при тяжелой травме. Устойчивая анизокория является одним из признаков гематомы. К очаговым симптомокомплексам относят также дислокационный синдром.
ДИСЛОКАЦИОННЫЙ СИНДРОМ (ДС) ПРИ ЧМТ - представляет собой очаговые симптомокомплексы, возникающие в результате нарушения функции участка головного мозга, находящегося на определенном расстоянии, порой значительном, от первичного патологического очага. Дислокации обусловлены разницей в давлении, складывающемся в различных полостях краниовертебрального пространства, и процессом его выравнивания. Такие ситуации могут возникнуть при ЧМТ, опухолях мозга, воспалительных, сосудистых, паразитарных заболеваниях, водянке головного мозга и т.д., т.е. при любом ограничивающем пространство патологическом процессе. Причиной ДС в острой стадии ЧМТ могут быть острая интракраниальная гематома любой локализации, контузионные очаги с бурным перифокальным отеком, вызывающие непосредственное сдавление мозга и др. Клиническое проявление ДС зависит, в первую очередь, от темпов развития дислокаций, а также от наличия сопутствующих патологических процессов - отека мозга, сосудистых нарушений, воспалительных реакций, в том числе асептических, водянки мозга и т.д. Существенную роль играет также преморбидное состояние как организма в целом, так и ЦНС. Отдельные виды ДС могут проявляться бульбарным синдромом, среднемозговым синдромом при ЧМТ, синдромом моста мозга.
Оболочечные симптомы при ЧМТ обычно появляются при субарахноидальном кровоизлиянии и внутричерепных гематомах. Наиболее часто встречаются ригидность мыщц затылка и симптом Кернига.
18.1.3. ЧАСТНЫЕ ВОПРОСЫ ДИАГНОСТИКИ ЧМТ
Клинически выделяют: 1) закрытую, 2) открытую и 3) сочетанную ЧМТ. По степени тяжести - легкую, среднюю и тяжелую.
Легкая ЧМТ включает сотрясение и ушиб мозга легкой степени, средняя - ушиб мозга средней степени, тяжелая - ушиб мозга тяжелой степени и сдавление мозга. По данным А.Н. Коновалова и соавт. (1982), для оценки тяжести состояния больных следует использовать как минимум три параметра: состояние сознания, состояние витальных функций и состояние локализованных неврологических функций. На основании этих параметров авторы выделяют пять градаций состояния больных с ЧМТ: удовлетворительное, средней тяжести, тяжелое, крайне тяжелое, терминальное.
Закрытая ЧМТ
Закрытая ЧМТ (ЗЧМТ) определяется как повреждение черепа и головного мозга, при котором отсутствуют нарушения целости покровов головы, либо имеются ушибы и раны мягких тканей головы без повреждения апоневроза. К ЗЧМТ также относят переломы костей свода черепа, не сопровождающиеся ранением прилежащих мягких тканей и апоневроза. При ЗЧМТ могут наблюдаться различные формы повреждения головного мозга: сотрясение, очаговые ушибы мозга легкой, средней, тяжелой степени, сдавление внутричерепными гематомами и др.
Сотрясение головного мозга (СГМ) отмечается у 70-80% пострадавших с ЧМТ. Патоморфологически выявляются изменения лишь на клеточном и субклеточном уровнях. Макроструктурная патология отсутствует. Клинически СГМ представляет собой единую функционально обратимую форму (без разделения на степени), характеризуется выключением сознания от нескольких с до нескольких минут. Может выявляться выпадение памяти на узкий период событий во время, до и после травмы (ретро-, кон-, антероградная амнезия). Нередко наблюдаются тошнота и рвота. По восстановлении сознания типичны жалобы на головную боль, головокружение, слабость, шум в ушах, приливы крови к лицу, потливость, другие вегетативные явления и нарушения сна. Отмечаются боли при движении глаз, двоение при попытке чтения. Жизненно важные функции без существенных отклонений. В неврологическом статусе могут выявляться лабильная, негрубая асимметрия сухожильных и кожных рефлексов, мелкоразмашистый нистагм, незначительные оболочечные симптомы, исчезающие в течение первых 3-7 сут. Повреждения костей черепа отсутствуют. Давление цереброспинальной жидкости (ЦСЖ) и ее состав без изменений. Общее состояние больных обычно быстро улучшается в течение первой, реже - второй недели после травмы. Компьютерная томография (КТ) при СГМ не обнаруживает отклонений в состоянии вещества мозга и ликворных внутричерепных пространств.
УШИБ ГОЛОВНОГО МОЗГА (УГМ) характеризуется очаговыми макроструктурными повреждениями мозгового вещества различной степени (геморрагия, деструкция), а также субарахноидальными кровоизлияниями, переломами костей свода и основания черепа, частота и выраженность которых во многом коррелирует с тяжестью контузии. При ЧМТ обычно встречаются отек и набухание головного мозга, которые могут быть локальными, долевыми, полушарными и генерализованными. При УГМ наблюдаются те или иные изменения ликворсодержащих пространств (желудочковой системы, базальных цистерн, конвекситальных субарахноидальных щелей), часто в той или иной степени выражен массэффект. Клинически выделяют 3 степени тяжести УГМ.
Ушиб мозга легкой степени тяжести клинически характеризуется выключением сознания после травмы от нескольких до 15-20 мин. По его восстановлении типичны жалобы на головную боль, головокружение, тошноту и др. Как правило, отмечаются ретро-, кон-, антероградная амнезия, рвота, иногда повторная. Жизненно важные функции обычно без выраженных нарушений. Могут встречаться умеренные брадикардия или тахикардия, иногда - артериальная гипертензия. Дыхание и температура тела без существенных отклонений. Неврологическая симптоматика обычно мягкая (нистагм, легкая анизокория, признаки пирамидной недостаточности, менингеальные симптомы и др.), преимущественно регрессирующая на 2-3-й неделе после ЧМТ. При УГМ легкой степени, в отличие от сотрясения, возможны переломы костей свода черепа и субарахноидальное кровоизлияние. КТизменения обнаруживаются уже в первые часы после ЧМТ в виде зоны пониженной плотности (признаки локального отека).
Ушиб мозга средней степени клинически характеризуется выключением сознания после травмы продолжительностью от 15-20 мин до нескольких часов. Выражена кон-, ретро-, антероградная амнезия. Может наблюдаться многократная рвота. Встречаются нарушения психики. Возможны преходящие расстройства жизненно важных функций: брадикардия или тахикардия, повышение АД; тахипноэ без нарушения ритма дыхания и проходимости трахеобронхиального дерева. Часто выражены менингеальные симптомы. Улавливаются и стволовые симптомы: нистагм, диссоциация менингеальных симптомов, мышечного тонуса и сухожильных рефлексов по оси тела, двухсторонние патологические знаки и др. Отчетливо проявляется очаговая симптоматика, определяемая локализацией ушиба мозга: зрачковые и глазодвигательные нарушения, парезы конечностей, расстройства чувствительности, речи и т.д. Нередко наблюдаются переломы костей свода и основания черепа, а также значительное субарахноидальное кровоизлияние.
КТ в большинстве наблюдений выявляет очаговые изменения в виде некомпактно расположенных в гиподенсивной зоне высокоплотных мелких включений либо умеренного гомогенного повышения плотности (что соответствует мелким кровооизлияниям в зоне ушиба или умеренному геморрагическому пропитыванию мозговой ткани без грубой ее деструкции). В части наблюдений КТ выявляет лишь зоны пониженной плотности (локальный отек).
Ушиб мозга тяжелой степени клинически характеризуется выключением сознания после травмы продолжительностью от нескольких часов до нескольких недель. Часто выражено двигательное возбуждение. Наблюдаются тяжелые угрожающие нарушения жизненно важных функций; обычно доминирует стволовая неврологическая симптоматика (плавающие движения глазных яблок, парез взора, тоничный множественный нистагм, нарушения глотания, двусторонний мидриаз или миоз, дивергенция глаз по вертикальной или горизонтальной оси, меняющийся мышечный тонус, горметония, двухсторонние патологические стопные знаки и др.), которая в первые часы или сутки после ЧМТ перекрывает очаговые полушарные симптомы. Могут выявляться парезы конечностей (вплоть до параличей), подкорковые нарушения мышечного тонуса, рефлексы орального автоматизма и т.д. Иногда отмечаются генерализованные или фокальные эпилептические припадки. Очаговые симптомы регрессируют медленно; часты грубые остаточные явления, прежде всего со стороны двигательной и психической сфер. УГМ тяжелой степени часто сопровождается переломами свода и основания черепа, а также массивными субарахноидальными кровоизлияниями.
Примерно в половине случаев УГМ, КТ выявляет значительные по размерам очаги интенсивного гомогенного повышения плотности, а в трети наблюдений очаговые поражения мозга в виде неоднородного повышения плотности.
Сдавление внутричерепными гематомами обычно возникает при наличии посттравматической гематомы над или под твердой мозговой оболочкой, при вдавленных переломах костей черепа и на фоне посттравматического отека головного мозга. Синдром сдавления головного мозга возникает не сразу, для него характерна определенная динамика процесса:
• после травмы головы наступает различная по продолжительности потеря сознания с последующей клиникой сотрясения или ушиба головного мозга;
• после восстановления сознания наступает так называемый «светлый промежуток» различной продолжительности, зависящий от скорости и объема внутричерепного кровотечения и от места его локализации.
Примечание. «Светлый промежуток» может быть развернутым, стертым и даже отсутствовать. Это зависит от фона (отек, ушиб мозга), на котором развивается сдавление. В последующем, по мере развития дислокации мозга, возникает сильная и острая головная боль, рвота, могут появиться эпилептиформные припадки и очаговая симптоматика: расширение зрачка на стороне гематомы, гемипарез или гемиплегия, прогрессирующая утрата сознания. Характерным признаком нарастания дислокации ствола мозга является появление и нарастание брадикардии и артериальной гипотензии. Прогрессирование дислокации вызывает поражение центров регуляции дыхания и кровообращения с последующей смертью пострадавшего.
Открытая ЧМТ
Открытая черепномозговая травма (ОЧМТ) характеризуется нарушением целости мягких покровов головы, включая апоневроз, и костей черепа в условиях повреждения головного мозга.
Различают ОЧМТ непроникающие (с повреждением костей, но с сохранением целости твердой мозговой оболочки) и проникающие (с повреждением костей, твердой мозговой оболочки и мозга).
Сочетанная ЧМТ
ЧМТ является сочетанной (СЧМТ), если механическая энергия, помимо повреждения черепа и внутричерепного содержимого, одновременно вызывает и внечерепные повреждения.
В основу классификации СЧМТ положены два принципа: 1) локализация внечерепных повреждений (лицевой скелет, грудная клетка и ее органы, органы брюшной полости и забрюшинного пространства, позвоночник и спинной мозг, конечности и таз, множественные внечерепные повреждения; 2) соотношение черепно-мозгового и внечерепных повреждений по степени их тяжести.
При СЧМТ одновременно страдают системы, как регулирующие функции организма, так и исполнительные. В основе патогенеза патологических реакций лежит взаимоотягощающее влияние непосредственно повреждения стволовых отделов головного мозга и таких факторов, как болевая афферентация, кровопотеря, жировая эмболия сосудов легких и мозга, дыхательная гипоксия, интоксикация.
СЧМТ более чем в трети наблюдений осложняется шоком. Эректильная фаза бывает удлинена по времени, поэтому ее довольно часто регистрируют в стационаре. Шок вследствие СЧМТ, в отличие от классического травматического шока, может протекать на фоне нарушенного сознания, сопровождаться брадикардией, грубыми нарушениями внешнего дыхания, гипертермией, а также очаговой неврологической симптоматикой и менингеальными знаками.
18.1.4. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ТРАВМАХ ГОЛОВЫ
При УШИБЕ ГОЛОВЫ на месте происшествия следует наложить кровоостанавливающую повязку и доставить больного в травматологический (хирургический) стационар для уточнения диагноза и определения тактики дальнейшего лечения.
При закрытой, открытой или сочетанной ЧМТ помощь на месте происшествия зависит от тяжести травмы и носит, как правило, симптоматический характер. При открытых и проникающих ранениях на догоспитальном этапе мозговую рану закрывают гемостатической губкой с канамицином и накладывают асептическую повязку. Больного необходимо доставить в травматологический (хирургический) стационар для уточнения диагноза и определения тактики дальнейшего лечения. При наличии сознания пострадавшего следует транспортировать на носилках лежа на спине без подушки. При отсутствии сознания больного транспортируют в устойчивом дренажном положении для предупреждения возможной аспирации при рвоте. Очень важным резервом улучшения исходов ЧМТ является признание необходимости распознавания и профилактики вторичных повреждений ЦНС уже на догоспитальном этапе. Хотя терапевтические возможности этого этапа медицинской помощи существенно ограничены, опираясь исключительно на клиническую симптоматику, необходимо обеспечить проведение самых неотложных жизнеспасительных процедур. При этом следует ориентироваться на следующие данные: гипотензия с систолическим АД менее 90 мм рт. ст., даже если это единичный эпизод приводит к удвоению числа летальных исходов! А если гипотензия сочетается с дыхательной гипоксией, то лишь 6% пострадавших имеют шансы на благоприятный исход!
Таким образом, гипотензия и гипоксемия должны быть предотвращены или незамедлительно купированы.
При оказании неотложной помощи пострадавшим с тяжелой ЧМТ на догоспитальном этапе всех больных целесообразно делить на две группы: случаи без признаков отека - набухания мозга и случаи с наличием таковых.
Для первой группы необходимо: 1) профилактика аспирационного синдрома; санация трахеобронхиального дерева; 2) адекватная оксигенация, ИВЛ в режиме нормовентиляции легких; 3) нормализация ОЦК; 4) регулирование АД (оптимальный уровень систолического АД в пределах 90-140 мм рт. ст.); 5) подавление болевой импульсации; 6) применение органопротекторов (антигипоксанты, антиоксиданты); 7) использование кортикостероидных препаратов; 8) нейровегетативная блокада (новокаиновые блокады и др.).
Для второй группы показано активное лечение внутричерепной гипертензии. Дополнительно к рекомендациям для первой группы необходимо: 1) ИВЛ в режи-
ме гипервентиляции; 2) салуретики, осмотические диуретики на фоне восстановленного ОЦК (маннитол 1 г/кг массы тела); 3) сернокислая магнезия 25% 10 мл, 40% глюкоза 20 мл на фоне стабильной гемодинамики.
При психомоторном или двигательном возбуждении используют седативные средства. Часто решающее значение при ЧМТ приобретает срочное оперативное вмешательство.
Примечание. Пострадавших с тяжелой ЧМТ, сопровождающейся грубыми расстройствами сознания, нарастанием очаговой и общемозговой симптоматики, нарушениями жизненно важных функций, госпитализируют в отделения реанимации и интенсивной терапии. В стационаре продолжают мероприятия по нормализации газообмена, гемодинамики, обменных процессов и применяют методы предупреждения и лечения отека мозга, внутричерепной гипертензии, нарушений мозгового крообращения, ликвороциркуляции и метаболизма, а также используют средства и методы защиты мозга от ишемии и гипоксии. Общее обезболивание, управление газообменом, центральной гемодинамикой, купирование отека мозга и внутричерепной гипертензии, коррекция кислотно-щелочного состояния (КЩС), водно-электролитного обмена, нормализация осмотического давления и др. производится по общепринятым методикам (А.А. Потапов, 1994).
Квалифицированная и специализированная медицинская помощь при травмах головы
Данные виды терапии подразделяются на консервативное и оперативное лечение ЧМТ. Оказание квалифицированной и специализированной помощи при травмах головы должно проходить после лучевой диагностики, позволяющей определить объем и глубину поражения. Лучевой алгоритм исследования включает рентгенографию костей черепа в прямой и боковой проекциях и компьютерную рентгеновскую или магнитно-резонансную томографию. Данные исследования позволяют выявить травматические повреждения костей и мягких тканей, выявить гематомы различной локализации, травматические изменения паренхимы мозга.
Консервативное лечение ЧМТ
Объем, интенсивность и длительность консервативного лечения (КЛ) определяются тяжестью и видом ЧМТ, выраженностью отека мозга, внутричерепной гипертензии, нарушений микроциркуляции и ликворотока, а также наличием осложнений ЧМТ, особенностями преморбидного состояния и возрастом пострадавших. Ведущее значение для выбора тактики КЛ имеет оценка клинической формы ЧМТ, что определяет субстрат повреждения и тяжесть состояния больных.
Сотрясение головного мозга. Лечение направлено на снятие избыточных церебральных реакций и восстановление функциональной активности наиболее подверженных микродеформациям стволовых образований мозга. Основные направления при этом: 1) соблюдение постельного режима сроком на 1 неделю; 2) применение седативных (элениум, сибазон), гипосенсибилизирующих (димедрол, пипольфен), вегетотропных (платифиллин, беллоид) препаратов в обычных дозах перорально. При выраженных вегетативных реакциях с целью улучшения церебральной микроциркуляции в/в вводят эуфиллин. Наблюдаемая при сотря-
сении мозга преходящая артериальная гипертензия, а также нарушения функции гемато-энцефалического барьера приводят к умеренному отеку мозга. В связи с этим оправдано применение в остром периоде дегидратирующих средств, главным образом, салуретиков (фуросемид, этакриновая кислота) по 1 таб. в утренние часы в течение 4-6 сут с коррекцией возможного дефицита калия (диета, панангин). При нарушениях сна к отмеченным седативным препаратам добавляют диазепам, фенобарбитал. При сохраняющейся астении целесообразно использовать кофеин (2 мл 10% раствора 2 раза в сут) и другие психостимуляторы (ацефен, сиднокарб, центедрин по 1 таб. утром и днем). В последующем для профилактики посттравматических остаточных явлений назначают ноотропил, пиридитол и другие ноотропы.
Ушиб мозга легкой и средней степени. Лечебные воздействия включают те же компоненты, что и при сотрясении мозга, к которым добавляют более мощные средства. Основные направления терапии: 1) улучшение мозгового кровотока; 2) улучшение энергообеспечения мозга; 3) восстановление функции гематоэнцефалического барьера; 4) устранение патологических сдвигов водных секторов в полости черепа; 5) противовоспалительная; 6) метаболическая терапия.
При наличии субарахноидального кровоизлияния в лечебный комплекс включают гемостатическую антиферментную терапию: 5% аминокапроновой кислоты, контрикал, трасилол, гордокс. Последние три препарата обладают более мощным антигидролазным действием, и их использование блокирует многие патологические реакции, обусловленные выходом ферментов и других биологически активных веществ из очагов разрушения мозга.
Ушиб мозга тяжелой степени и острое его сдавление. При тяжелой ЧМТ происходит грубое нарушение, а затем срыв процессов саморегуляции на церебральном и системных уровнях, коррекция которых требует интенсивной терапии. Ее проводят после устранения компрессии головного мозга или при консервативном ведении пострадавших. Планирование интенсивной терапии предусматривает преимущественное воздействие не на конечные результаты патологических процессов, а на механизмы их развития.
Для восстановления и поддержания регуляторных звеньев необходимо достаточное энергообеспечение мозга, причем в широком смысле: 1) поступление субстрата в организм; 2) доставка субстрата к мозгу; 3) утилизация в мозге; 4) использование энергосберегающих лечебных воздействий. На фоне этих мероприятий можно эффективно корригировать нарушенные внутричерепные объемные соотношения и устранять патологические реакции мозга. В качестве энергетического субстрата используют глюкозу в комплексе с инсулином и ионами калия. Для доставки субстрата в мозг необходим определенный мозговой кровоток, всегда нарушающийся при тяжелой ЧМТ. Направления лечебных действий для коррекции нарушений церебральной микроциркуляции: 1) внутрисосудистые влияния - улучшение реологических свойств крови, поддержание внутрисосудистого давления; 2) нормализация сосудистого тонуса, контролируемая гипервентиляция, использование вазоактивных препаратов; 3) устранение периваскулярного отека и отечности отростков астроцитов, оплетающих мозговые сосуды (осмодиуретики, дигидроэрготамин и др.).
Коррекция гипертермии, увеличивающей потребности мозга в энергетическом субстрате и кислороде, приводящей к тканевой гипоксии и перекисному окислению липидов, нарушению внешнего дыхания и системной гемодинамики
(снижение сердечного выброса, повышение периферического сосудистого сопротивления), является одной из важных мер улучшения жизнеобеспечения мозга и организма в целом. Основные направления терапии:
• снижение чувствительности центра теплопродукции к патологическим воздействиям (литические смеси);
• устранение дефицита объема циркулирующей крови;
• уменьшение периферического сосудистого сопротивления (вазоактивные препараты, глюкокортикоиды);
• физическое охлаждение.
Тактика борьбы с гипоксией: введение антигипоксантов и антиоксидантов (препараты типа эмоксипин, мексидол, убинол и др.), оксибутирата натрия, барбитуратов, гипербарическая оксигенация.
При недостаточной эффективности отмеченных лечебных мер, помимо гибели клеток, сохранившихся после травматического воздействия, резко нарушается функция внутричерепных мембран, что приводит к патологическому перераспределению жидкости в полости черепа. При этом развивающаяся внутричерепная гипертензия (в том числе в послеоперационном периоде) требует проведения так называемой фармакологической декомпрессии. При планировании интенсивной терапии внутричерепной гипертензии нужно учитывать, что имеющиеся внутричерепные объемы (объем клеток мозга, объем межклеточной жидкости, объем церебро-спинальной жидкости, объем внутрисосудистой крови) контролируются различными вне- и внутричерепными факторами, что определяет основные направления избирательной коррекции возникающих нарушений.
Нехирургическая коррекция внутричерепных причин интракраниальной гипертензии: 1) отека мозга - дегидратация, кортикостероиды, антагонисты альдостерона; 2) гиперемии мозга - гипервентиляция, лечебный наркоз, гипотермия; 3) гиперосмолярности - регидратация, кортикостероиды. Коррекция внечерепных причин (нарушение проходимости дыхательных путей, церебрального венозного оттока) также способствует нормализации внутричерепного давления.
Примечание. Гиперемия мозга - острое нарушение мозгового кровообращения, наблюдаемое преимущественно в первые 7-10 сут ЧМТ. Характеризуется выраженным вазопарезом, избыточным кровенаполнением мозга, увеличением его объема, внутричерепной гипертензией, нарушением адекватного соотношения между кровотоком и метаболизмом.
Оперативное лечение ЧМТ
В абсолютном большинстве случаев цель операции при ЧМТ - устранение сдавления мозга, дислокации ствола. Оперативное лечение ЧМТ осуществляется при компрессии мозга эпидуральными, субдуральными, внутримозговыми травматическими гематомами, гигромами, некоторыми формами ушиба - размозжения мозга, при вдавленных переломах черепа, ранениях венозных синусов, посттравматических каротидно-кавернозных и других сосудистых соустьях, инородных телах черепа, ранениях венозных синусов, при наличии трепанационных отверстий, острой и хронической посттравматической гидроцефалии, огнестрельных ранениях черепа и мозга, рубцах, кистах, некоторых формах эпилепсии и др. При острой ЧМТ основным принципом хирургического вмешательства, особенно при внутричерепных гематомах, является быстрота проведения операции - чем быст-
рее с момента травмы произведено вмешательство, тем при прочих равных условиях больше шансов на выживание больного и его реабилитацию. Поэтому больного оперируют сразу после установления диагноза, не производя лишних дополнительных исследований.
Лечение сочетанной ЧМТ
Лечение СЧМТ условно включает три главных звена.
1. Борьба с угрожающими нарушениями витальных функций, кровотечением, травматическим шоком, сдавлением и отеком мозга. Осуществляется неотложно с проведением всех доступных мероприятий, включая оперативные вмешательства. Предпринимается прежде всего лечение того повреждения и нарушений тех функций, которые представляют наибольшую непосредственную опасность для жизни больного или препятствуют лечению других повреждений (осуществляют интубацию, трахеостомию, ИВЛ, переливание крови и кровезаменителей, остановку наружного и внутреннего кровотечения, трепанацию черепа, лапаротомию, торакотомию, ампутацию размозженной конечности и т.д.).
2. Лечение локальных черепных и внечерепных повреждений и профилактика осложнений. Его начинают сразу после установления диагноза с выполнением радикальных хирургических вмешательств (остеосинтез, ламинэктомия, пластические операции и др.) в различные сроки - с учетом переносимости операции в зависимости от общего состояния больного, тяжести повреждения головного мозга и с учетом допустимости временных пределов осуществления операции в зависимости от локализации и характера травматической патологии (переломы костей верхних и нижних конечностей, переломы тел позвонков со сдавлением и без сдавления спинного мозга, переломы челюстей, дефекты мягких тканей лица и т.д.). Проводят комплекс мероприятий, направленных на предупреждение церебрального арахноидита и других последствий СЧМТ.
3. Медицинская и социально-трудовая реабилитация пострадавших с акцентом на нарушенные функции. Начинают осуществлять по окончании острого периода СЧМТ и продолжают во внестационарных условиях.
18.2. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ЧЕЛЮСТНО-ЛИЦЕВЫХ
ПОВРЕЖДЕНИЯХ
18.2.1. ТРАВМЫ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ
Повреждения челюстно-лицевой области делятся на травматические и патологические (самопроизвольные, спонтанные при наличии опухоли, воспалительных процессов). Переломы костей лица в мирное время составляют 3,8% переломов у человека. Классификация, разработанная кафедрой челюстно-лицевой хирургии со стоматологией Военно-медицинской академии, включает:
Механические повреждения верхней, средней, нижней и боковых зон лица.
По локализации:
• А. Травмы мягких тканей с повреждением: языка;
• слюнных желез;
• крупных нервов;
• крупных сосудов. Б. Травмы костей:
• нижней челюсти;
• верхней челюсти;
• скуловых костей;
• костей носа;
• двух костей и более.
По характеру ранения: сквозные, слепые, касательные, проникающие в полость рта, не проникающие в полость рта, проникающие в верхнечелюстные пазухи и полость носа.
По механизму повреждения.
• Огнестрельные: пулевые, осколочные, шариковые, стреловидными элементами.
• Комбинированные поражения.
• Ожоги.
• Отморожения.
Переломы, сопровождающиеся повреждением кожных покровов и слизистой оболочки полости рта, носа, называют открытыми (все переломы в пределах зубного ряда). Переломы без повреждения мягких тканей принято считать закрытыми. Проникающими именуют такие повреждения, когда рана сообщается с полостью рта, носа, околоносовыми пазухами, глоткой, трахеей.
Этиология. Наиболее частые виды травм: бытовая (62%), транспортная (17%), производственная 12% (промышленная и сельскохозяйственная), уличная (5%) и спортивная (4%).
Патогенез. Анатомической особенностью челюстно-лицевой области является мощная сосудистая сеть наряду с наличием большого массива рыхлой подкожной клетчатки. Это обусловливает значительный отек и кровоизлияния в области лица при травме и кажущееся несоответствие между размером раны и объемом кровотечения. Ранения лица часто сочетаются с повреждением ветвей лицевого нерва и околоушной слюнной железы, а ранения нижней челюсти - с повреждением крупных сосудов и нервов гортани, глотки.
Клиника. Резкие боли, полуоткрытый рот, слюнотечение, невнятная речь, расстройства жевания, глотания, изменение формы лица, нарушение прикуса, патологическая подвижность отломков, нарушение функций черепных нервов, болезненная гематома. Возможны осложнения: шок, асфиксия, кровотечение, закрытая или открытая травма головного мозга.
Неотложная помощь. При наличии показаний - купирование признаков острой дыхательно недостаточности (ОДН) и острой сердечно-сосудистой недостаточности (ОССН). С целью предупреждения асфиксии раненого укладывают лицом вниз и поворачивают голову набок. Производят санацию ротовой полости. При угрозе обтурационной асфиксии в ротовую полость устанавливается S-образ- ный воздуховод.
При ушибах мягких тканей накладывают давящую повязку, местно - холод.
Остановка кровотечения достигается при помощи давящей повязки, тугой тампонады раны, наложения кровоостанавливающего зажима или в экстремальной обстановке - пальцевого прижатия артерий. На рану накладывается асептическая повязка. Госпитализация в специализированное учреждение.
18.2.2. ПЕРЕЛОМЫ АЛЬВЕОЛЯРНОГО ОТРОСТКА НИЖНЕЙ ЧЕЛЮСТИ
Клиника. Нарушение прикуса, разрывы слизистой оболочки по линии перелома, кровоизлияния в области преддверия полости рта, патологическая подвижность участка альвеолярного отростка, затруднения при жевании и речи, переломы и вывихи зубов.
Наблюдается носовое кровотечение. Если повреждена верхнечелюстная пазуха - из раны выделяется пенистая кровь.
Неотложная помощь. Из полости рта удаляются кровяные сгустки, обрывки слизистой, свободно лежащие отломки альвеолярного отростка для предупреждения возможной аспирации и асфиксии. Проводится местная анестезия 1-2% раствором новокаина. Госпитализация в специализированное учреждение. Больных с ранением верхнечелюстной пазухи госпитализируют в ЛОР-отделения.
Специализированная помощь. В отделении челюстно-лицевой хирургии производится постоянная фиксация места перелома и принимаются меры по сохранению зубов.
18.2.3. ПОВРЕЖДЕНИЯ ЗУБОВ
Повреждение зуба с нарушением целости его коронковой или корневой части называется переломом. Травма зубов может сопровождаться разрушением лунки зуба, переломами альвеолярного отростка или частей. Клинические варианты:
• переломы без вскрытия пульпы;
• переломы со вскрытием пульпы;
• вывих зуба из лунки;
• вколачивание зубов.
Клиническая картина. Боли в зубе во время травмы, усиливающиеся при нагрузке (острый травматический пульпит), кровоизлияние в пульпу зуба вызывает розовую окраску его коронки; подвижность зуба, дефекты коронки. Вывих зуба является повреждением связочного аппарата зуба, приводящим к его смещению. Чаще других вывиху подвергаются временные и постоянные фронтальные зубы верхней, реже нижней челюсти. Вывих может быть вколоченным. При этом зуб внедряется в губчатое вещество альвеолярного отростка вплоть до полного погружения в лунку.
Неотложная помощь. Инфильтрационная, или проводниковая, анестезия 2% раствором новокаина. Амбулаторное лечение у стоматолога.
Специализированная помощь. При неполном вывихе постоянного зуба показаны его вправление и иммобилизация проволочной или пластмассовой шиной. В случае полного вывиха и выпадения зуба из лунки возможна его реплантация. При внедрении зуба в лунку показаны его репозиция, иммобилизация с последующей трепанацией, лечением и пломбированием зуба.
18.2.4. ПЕРЕЛОМ НИЖНЕЙ ЧЕЛЮСТИ
Переломы нижней челюсти составляют около 70% переломов костей лица. Из них переломы в центральных и боковых отделах, области угла, наблюдаются почти
у 80% больных. Переломы ветви челюсти разделяют на переломы собственно ветви, венечного и мыщелкового отростков. Следует различать одиночные, двойные, множественные переломы нижней челюсти, без смещения и со смещением отломков. Характер перелома, смещения отломков зависит от величины и направления травмирующей силы, действия тяги прикрепленных к челюсти жевательных мышц. Переломы в области зубного ряда обычно открытые.
Клиническая картина. Резкие боли при жевании и разговоре. Разлитая отечность мягких тканей в области перелома. Рот полуоткрыт, слюна окрашена кровью. При осмотре открывание рта ограничено, наблюдается нарушение прикуса, отмечается кровотечение из поврежденной слизистой и обильное слюноотделение. Пальпаторно отломки тела нижней челюсти подвижны. При множественных переломах возможна асфиксия за счет западения языка.
Неотложная помощь. Тщательный осмотр полости рта, удаление инородных тел. При западении языка и угрозе развития ОДН в ротовую полость вставляется S-образный воздуховод или используются другие воздуховоды и методы. Обезболивание производится в/м введением 2-4 мл 50% раствора анальгина, а при его малой эффективности - наркотическими анальгетиками (например, промедол 1 мл 2% раствора п/к или в/м). Временную транспортную иммобилизацию проводят при помощи пращевидной повязки. Госпитализация в отделение челюстно-лицевой хирургии.
18.2.5. ВЫВИХИ НИЖНЕЙ ЧЕЛЮСТИ
В основе вывиха нижней челюсти - смещение головки суставного отростка нижней челюсти за пределы суставной впадины.
Этиология. Вывих нижней челюсти может наступить при сильном открывании рта при крике, зевоте, рвоте, удалении зуба, зондировании желудка, интубации трахеи, откусывании большого куска твердой пищи (яблоко), раздвигании челюстей роторасширителем во время наркоза и т.д.
Клиника. Пострадавший не может закрыть рот, его беспокоит слюнотечение, боль в области височно-нижнечелюстного сустава. При одностороннем вывихе подбородок смещается в здоровую сторону, при двустороннем - книзу.
Неотложная помощь. Больной сидит на низком стуле, голова упирается в подголовник и находится на уровне локтевого сустава врача. После проведения местной анестезии большие пальцы врача устанавливаются в ретромолярной области обеих сторон нижней челюсти, остальные охватывают ее наружную поверхность от угла до подбородка. Большими пальцами нужно отдавить челюсть вниз, а затем остальными пальцами посылают подбородочный отдел кверху. После вправления вывиха на 10-12 дней накладывают фиксирующую пращевидную повязку. Консультация стоматолога.
18.2.6. ПЕРЕЛОМЫ ВЕРХНЕЙ ЧЕЛЮСТИ
Переломы верхней челюсти составляют около 7% переломов костей лица. Отломки смещаются в зависимости от направления травмирующей силы, тяжести самих отломков.
В зависимости от уровня щели различают три типа переломов верхней челюсти. I тип - перелом тела верхней челюсти над альвеолярным отростком от основания грушевидного до крыловидных отростков. II тип - полный отрыв верхней челюсти (щель проходит по лобно-носовому шву, по внутренней стенке глазницы, по скуло-челюстному шву и крыловидным отросткам). III тип характеризуется полным отрывом костей лицевого черепа.
Клиническая картина переломов верхней челюсти тем тяжелее, чем выше расположена линия перелома и чем более значительный костный массив отделяется от основания черепа. Первый тип характеризуется кровотечением из слизистой полости рта и носа; отмечается удлинение средней зоны лица, кровоизлияние в конъюнктиву, веки, нарушение смыкания зубов.
При втором типе наблюдаются те же симптомы, но более выражен симптом «очков», вся верхняя челюсть с корнем носа подвижна без движения скуловых костей. Возможно сочетание данного типа перелома верхней челюсти с переломом основания черепа, в таком случае будут определяться симптомы раздражения твердой мозговой оболочки. Из-за кровоизлияния в ретробульбарную клетчатку возникает экзофтальм.
Третий тип характеризуется тяжелым состоянием пострадавшего с выраженными признаками повреждения основания черепа.
Неотложная помощь. Объем оказываемой помощи зависит от общего состояния больного. Первая помощь - после остановки кровотечения, противошоковых мероприятий и профилактики асфиксии следует попытаться осторожно вправить отломки до установления по возможности правильного прикуса и фиксировать их. При тяжелых состояниях - устранение ОДН и ОССН, местно - холод. Обезболивание 1-2 мл 2% раствора промедола или любого другого наркотического анальгетика. Транспортная иммобилизация достигается с помощью теменноподбородочной или пращевидной повязки. С целью профилактики асфиксии на этапе эвакуации больного транспортируют в положении лежа на боку в специализированное лечебное учреждение.
18.2.7. ПЕРЕЛОМЫ СКУЛОВОЙ КОСТИ И ЕЕ ДУГИ
Этиология. Травма скуловых костей может наступить в результате прямого удара или при сдавливании лицевого скелета. Смещение отломков зависит от направления травмирующей силы и редко от сокращения мышц. Переломы скуловой кости почти у половины больных сопровождаются сочетанными повреждениями верхней челюсти (верхнечелюстная пазуха), костей глазницы и носа.
Клиническая картина. Боль и чувство онемения в области крыла носа и верхней губы пораженной стороны, ощущение давления в глазах. При осмотре отмечается симптом «очков», ограничение движений нижней челюстью, возможно носовое кровотечение. Пальпаторно определяется неровность по нижнему орбитальному краю.
Неотложная помощь. Адекватное обезболивание, местно - холод. Госпитализация в специализированный стационар для рентгенологического контроля и последующего лечения.
18.2.8. ТРАВМЫ НОСА
Травмы кожного покрова носа встречаются в виде ушибов, кровоподтека, ссадины, ранения. При осмотре нужно иметь в виду, что повреждение нередко только на первый взгляд кажется поверхностным, а в действительности проникает более глубоко. В такой ране может находиться инородное тело. Эти повреждения часто сопровождаются сотрясением головного мозга.
Ранения носа бывают проникающими и непроникающими в полость носа и могут сопровождаться дефектом части наружного носа (кончика или крыла). Проникающие раны сопровождаются повреждением костно-хрящевого скелета и слизистой оболочки полости носа. Травмы носа часто сопровождаются повреждениями различных отделов носа - вывихами, трещинами, переломами без смещения и со смещением костей и хрящей его скелета. Огнестрельные раны часто сопровождаются частичным или полным отрывом носа, раздроблением его остова и окружающих отделов лица. Пуля или осколок могут проникнуть через нос в область околоносовых пазух, в полость черепа, шею и др.
Клиническая картина. При осмотре и пальпации определяется болезненная отечная припухлость тканей в области травмы. Внешняя деформация спинки носа со смещением в сторону или кзади определенно указывает на перелом носовых костей. При ошупывании в таких случаях определяются костные выступы на спинке и скатах носа. Значительная травмирующая сила может привести к раздроблению костей носа - в этом случае пальпаторно определяется патологическая подвижность спинки носа, а возможно, и крепитация костных отломков. Наличие подкожной эмфиземы свидетельствует о переломе решетчатой кости с разрывом слизистой оболочки. Воздух при сморкании проникает из носа через травмированную ткань, под кожу лица. О переломе ситовидной (продырявленной) пластинки свидетельствует ликворея - истечение цереброспинальной жидкости из полости носа.
Неотложная помощь. Поскольку ранение покровных тканей при травмах всегда связано с заносом инфекции, показано немедленное введение противостолбнячной сыворотки.
Ушибы и кровоподтеки наружного носа, кроме холодной примочки непосредственно после травмы, в лечении не нуждаются; ссадины обрабатывают 5% настойкой йода.
При открытых переломах со смещением проводят репозицию отломков костей носа и первичную хирургическую обработку раны, остановку носового кровотечения. Показана срочная госпитализация в отоларингологический стационар.
Носовое кровотечение
Носовое кровотечение. Являясь признаком основного заболевания, кровотечение в некоторых случаях может представлять угрозу для жизни и поэтому требует неотложной помощи.
Этиология. Приводим этиологическую классификацию носовых кровотечений по И.А. Курилину:
• кровотечения, вызванные местными нарушениями в сосудистой системе полости носа, в том числе «кровоточащими полипами» носовой перегородки, опухолями, травмами;
• кровотечения как проявления нарушений коагуляционных свойств крови;
• кровотечения, обусловленные сочетанием местных и общих факторов. К ним относятся изменения сосудов носа при атеросклерозе и гипертонической болезни, гепатитах и циррозе печени, геморрагические диатезы, инфекционные и вирусные васкулиты, нейровегетативные и эндокринные вазопатии, гиповитаминоз С и Р, болезнь Ослера, воспалительные и аллергические хронические заболевания кроветворных органов, лучевая болезнь и др.
Наиболее частая причина носовых кровотечений - это травмы носа. Нужно иметь в виду, что кровь в нос может затекать из других отделов верхних дыхательных путей - глотки, гортани, трахеи, легких, в редких случаях - даже из среднего уха через слуховую трубу. Однако при носовом кровотечении кровь чистая, обычного вида, стекание ее по задней стенке глотки хорошо видно, особенно при запрокидывании головы, в то время как кровь из нижних отделов дыхательных путей в той или иной мере вспенена и не стекает по задней стенке глотки. Кровь из желудка, как правило, имеет ржаво-черный оттенок и также не стекает по задней стенке глотки, а как бы бьет фонтаном снизу.
Посттравматические носовые кровотечения характеризуются не только обильностью (200 мл и более), но и рецидивированием через несколько дней, а возможно, даже недель.
Методы остановки носовых кровотечений
При умеренных носовых кровотечениях, когда обозрим кровоточащий сосуд, добиться остановки кровотечения можно, используя следующие способы и методы.
Воздействовать химическими агентами на кровоточащий сосуд:
• сосудосуживающими препаратами (0,1% раствором адреналина гидрохлорида или растворами глазолина 0,1%, нафтизина 0,1%, норадреналина гидротартрата 0,2%, мезатона 1%, эфедрина гидрохлорида 2-5% и т.п.);
• 3% раствором перекиси водорода;
• 5% раствором e-аминокапроновой кислоты;
• трихлоруксусной кислотой;
• 10, 20, 30%, и ли 50% раствором нитрата серебра;
• 7% раствором колларгола;
• 36% водным раствором полиметилен-метакрезолсульфоновой кислоты («Ваготил»).
Воздействовать физическими факторами на кровоточащий сосуд:
• прижать крыло носа к перегородке носа;
• приложить пузырь со льдом на область носа;
• произвести криовоздействие или произвести диатермокоагуляцию;
• произвести ультразвуковую дезинтеграцию (предварительно зону воздействия инфильтрируют раствором новокаина, что создает оптимальные условия для введения ультразвукового зонда);
• под эндоскопическим контролем произвести биполярную коагуляцию кровоточащего сосуда.
При значительных носовых кровотечениях, а также при их рецидивах основным способом остановки является тампонада (передняя или задняя) полости носа, которая может быть осуществлена полноценно только врачом-отоларинго-
логом. Лишь после нее проводят те или иные общие лечебные мероприятия. Перед тампонадой полости носа следует выполнить анестезию слизистой оболочки.
Передняя тампонада. Полость носа заполняют пропитанным вазелиновым маслом длинным марлевым тампоном шириной 1-1,5 см, который вводят носовым корнцангом, изогнутым пинцетом или тонким кровоостанавливающим зажимом с помощью носового зеркала под контролем зрения (рис. 18-1 а). Способом, предотвращающим попадание тампонов в носоглотку, является тампонада носа множественными полосками марли длиной до 10 см по Бенингхаузу. Их укладывают друг на друга, начиная от дна преддверия носа.
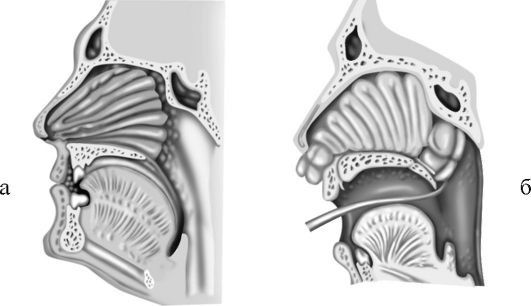 Рис. 18-1. Передняя (а) и задняя (б) тампонада полости носа
Рис. 18-1. Передняя (а) и задняя (б) тампонада полости носа
В случае неэффективности передней тампонады производят заднюю тампонаду. Для этого тонкий резиновый катетер вводят по нижнему носовому ходу в носоглотку. После того как конец катетера покажется в ротоглотке, его захватывают пинцетом и привязывают к нему двумя нитями заранее приготовленный специальный носоглоточный тампон. После этого катетер с нитями выводят из носа, а тампон с помощью пальца заводят за мягкое небо, где его плотно вдавливают в хоаны. Туго натягивают выведенные из носа нити, а затем дополнительно производят переднюю тампонаду носа. Обе нити завязывают над марлевым валиком у входа в нос (см. рис. 18-1 б). Оставленный во рту конец третьей нити обматывают вокруг уха или липким пластырем прикрепляют к щеке (для последующего удаления тампона).
При кровотечениях из носа задний тампон нужен для успешного выполнения максимально тугой передней тампонады и более надежного отграничения носоглотки. Его обязательно применяют для остановки кровотечения из задних концов носовых раковин и возникающих при опухолях задних отделов полости носа. Заднюю тампонаду больные переносят тяжело. Ее следует производить после предварительной премедикации атропином и промедолом (омнопоном). Необходимо следить, чтобы задний тампон находился за язычком, в противном случае существует опасность развития некроза язычка от давления.
Оптимальный срок осуществления тампонады, когда в поврежденном сосуде образуется прочный тромб, 4-6 суток (Невский Б.Н., 1983). Для предотвращения
развития инфекции находящиеся в носу тампоны неоднократно пропитывают растворами антибиотиков или антисептиков.
Для тампонады носа применяют также резиновые пневматические баллоны конструкций Мезрина, Лапченко и Невского, Мазинга (рис. 18-2.) и др. Они обеспечивают герметичность полости носа и носоглотки как при задней, так и передней тампонаде, легче переносятся больными. Из пневматического баллона можно периодически выпускать воздух, давая тем самым «отдых» слизистой оболочке носа и предотвращая возможность ее некротизации.
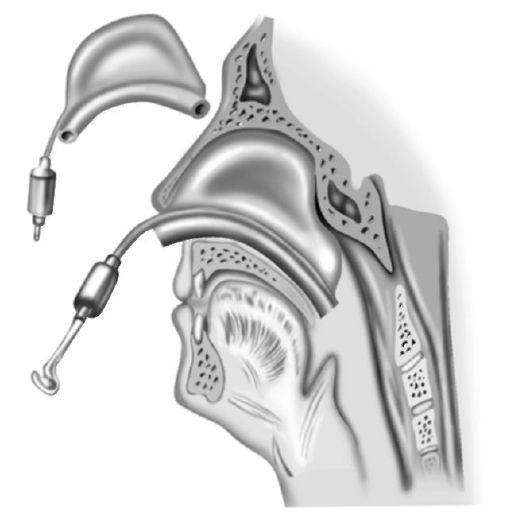 Рис. 18-2. Пневматический тампон Мазинга и тампонада носа с его помощью
Рис. 18-2. Пневматический тампон Мазинга и тампонада носа с его помощью
При носовых кровотечениях происходит активация местного фибринолиза с лизированием образующихся сгустков крови. В связи с этим независимо от причины носового кровотечения во всех случаях рекомендуется пропитывать тампоны 5% раствором e-аминокапроновой кислоты. При нарушениях свертываемости крови целесообразно местно применять тромбин, фибринную пленку и гемостатическую губку.
При гипертонической болезни, если артериальное давление повышено, внутримышечно вводят 10 мл 25% раствора сульфата магния, назначают папаверин и дибазол (препараты, повышающие свертываемость крови, противопоказаны).
При тромбопластических кровотечениях может быть назначен преднизолон.
В случае выявления нарушений свертываемости крови проводят соответствующую патогенетическую трансфузионную терапию.
Если причиной носового кровотечения является лейкоз, то гемостатического эффекта можно добиться с помощью кортикостероидных препаратов, особенно преднизолона, а для тампонады лучше всего применять окисленную целлюлозу в виде марли. Таким больным целесообразно назначать переливание концентрата тромбоцитов, введение препаратов железа, викасола, рутина, желатина, хлорида кальция.
Нередко причиной упорных носовых кровотечений является болезнь Ослера - наследственные геморрагические телеангиоэктазии кожи и слизистых оболочек. При риноскопии, проводимой после анемизации, бывают видны слегка возвышающиеся и приподнимающие эпителий точечные ангиоматозные расширения сосудов. Лечение болезни Ослера в основном симптоматическое.
При тяжелых кровотечениях осуществляют перевязку артерий или их эмболизацию: наружной сонной, внутренней верхнечелюстной или решетчатых артерий, а в исключительных случаях - общей сонной. Чаще всего перевязывают наружную сонную артерию. Однако односторонняя перевязка наружной сонной артерии не является оптимальным способом остановки носового кровотечения. Оно может продолжаться за счет анастомозов. В связи с этим целесообразнее прерывать кровоток ближе к месту кровотечения, поэтому лучший эффект дает перевязка внутренней челюстной артерии.
Перевязка наружной сонной и челюстной артерии эффективна только в том случае, если источник кровотечения находится ниже средней раковины. Если же он расположен выше, то может возникнуть кровотечение из решетчатых артерий, относящихся к системе внутренней сонной артерии.
Обнаружить и перевязать решетчатые артерии легче всего в глазнице, используя подход из киллиановского разреза, применяемый при наружной этмоидэктомии.
Другим способом прекращения кровотечения из решетчатых артерий является этмоидэктомия, которая может быть осуществлена внутренним и наружным способом. В обоих случаях целесообразнее выполнять операцию под интубационным наркозом при наличии герметизирующего носоглоточного тампона.
Для остановки носовых кровотечений из системы наружной сонной артерии в последнее время стали с успехом применять эмболизацию ее конечных разветвлений, в частности при сосудистых опухолях носа, околоносовых пазух, носоглотки и идиопатических кровотечениях. Однако надо учитывать, что при использовании данного метода существует опасность развития осложнений (инфаркты мозга или легкого, некрозы, инфицирование тканей и др.). В настоящее время оптимальным является обнаружение источника кровотечения под эндоскопическим контролем, после чего производится его остановка.
18.3. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ РАНЕНИЯХ ШЕИ
Повреждения шеи наиболее часто встречаются при ушибах, авариях, огнестрельных и других ранениях в виде повреждения сосудов, трахеи и пищевода.
Повреждения сосудов шеи обычно сопровождаются обильным кровотечением в силу хорошей васкуляризации шеи. Травма трахеи проявляется затруднением при дыхании, кровохарканьем, нарушением речи. Быстро появляется и нарастает подкожная эмфизема шеи и лица. Ведущим признаком является боль при глотании.
Неотложная помощь. При ранении сосудов на первоначальном этапе осуществляется их пальцевое прижатие с последующим наложением давящей повязки. При ранении трахеи с развитием признаков асфиксии оптимальным вариантом является ее интубация, а если нет возможности ее произвести - коникотомия. При ранении пищевода - асептическая повязка. При любом повреждении шеи - срочная госпитализация в хирургический стационар.
18.4. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ИНОРОДНЫХ ТЕЛАХ ГОРТАНИ,
ТРАХЕИ И ПИЩЕВОДА
Инородные тела глотки
Этиология. Инородные тела в глотку обычно попадают через рот.
Клиника зависит от характера и локализации травмы. Можно видеть как небольшие царапины, кровоизлияния в слизистую оболочку глотки, так и проникающие раны, находящиеся выше или ниже подъязычной кости, сопровождающиеся ранением корня языка, надгортанника и крупных сосудов. Больные обычно предъявляют жалобы на боль в горле, усиливающуюся при глотании, ощущение постороннего предмета, затруднение проглатывания пищи, саливацию. Крупные инородные тела, застрявшие в нижнем отделе глотки (гортаноглотке), нарушают речь, вызывают кашель и резкое затруднение дыхания.
Диагноз инородных тел глотки ставят на основании жалоб, анамнеза и результата объективного исследования. Осмотр глотки должен быть тщательным, особенно внимательно нужно осмотреть места «излюбленной» локализации инородных тел: небные миндалины, дужки, валлекулы, грушевидные карманы.
Неотложная помощь. Инородные тела глотки подлежат удалению. Иногда инородное тело из грушевидного кармана удаляют с помощью эзофагоскопа.
Инородные тела пищевода
Этиология. Инородные тела пищевода чаще всего встречаются у взрослых, особенно у пожилых людей, попадают они обычно с плохо пережеванной пищей при неосторожной, поспешной еде. Способствующим моментом является отсутствие зубов и ношение съемных протезов, закрывающих твердое небо, вследствие чего снимается его контроль. Наиболее частыми инородными телами у этой категории больных являются мясные, рыбьи и птичьи кости, неисправные зубные протезы, плохо пережеванные куски мяса.
Второй возрастной группой, подверженной этому заболеванию, являются дети, преимущественно дошкольного возраста. Они проглатывают монеты, пуговицы, значки, обломки игрушек и т.д.
Клиника определяется величиной, характером, уровнем задержки инородного тела в пищеводе. 50-60% инородных тел застревает в начальном отделе пищевода, на 2-м месте стоит грудной отдел, на 3-м - кардиальный. Наиболее частой жалобой является затрудненное прохождение пищи по пищеводу, нарушение глотания, усиленная саливация. Нередко бывают боли по ходу пищевода, иррадиирующие в спину.
Диагноз. В диагностике инородных тел пищевода большую роль играет тщательно собранный анамнез. При объективном осмотре выявляются: симптом Джексона - скопление слюны и слизи в грушевидных карманах; симптом Шлиттлера - появление или усиление боли при надавливании на гортань и трахею при остроконечных инородных телах; симптом Денмайера - наблюдается смещение гортани кпереди при расположении крупных инородных тел в области «рта» пищевода.
Важное значение имеет рентгенологическое обследование, обзорное и контрастное, в некоторых случаях - томографическое. При подозрении на инородное тело в шейном отделе пищевода следует проводить рентгенографию по методике
Г.М. Земцова (1948). На рентгенограммах (строго боковая проекция, пленка размером 13x18 см, фокусное расстояние 1,5-2 м) видны даже мельчайшие инородные тела не только в просвете пищевода, но и в подслизистом слое. Кроме того, с помощью этих рентгенограмм можно выявить незначительные травмы и воспалительные изменения в шейном отделе пищевода, вызванные инородным телом.
Окончательным диагностическим и лечебным методом является визуальный осмотр пищевода - эзофагоскопия (с помощью жесткого эзофагоскопа), в некоторых случаях фиброэзофагоскопия.
Неотложная помощь. В случае выявления инородного тела необходимо приступить к его удалению. Удаление инородного тела пищевода является срочным вмешательством. Наименее травматично удаление проводится под эндотрахеальным наркозом с применением миорелаксантов.
Инородные тела нижних дыхательных путей
Этиология. В нижние дыхательные пути инородные тела чаще попадают у детей, что объясняется присущим им стремлением все предметы брать в рот, а также еще мало развитыми у них защитными рефлексами дыхательных путей. Инородные тела бывают самого разнообразного характера: подсолнечные, арбузные, тыквенные семечки, зерна, монеты, пуговицы, горох, бобы, иглы, булавки, мясные и рыбьи кости и многие другие. Причины попадания инородных тел в трахею и бронхи, а также сопутствующие этому факторы аналогичны тем, что и при попадании инородных тел в гортань. Обычно инородные тела, за исключением крупных, в трахее не застревают, а попадают в один из главных бронхов (до 80% случаев в правый бронх, являющийся почти прямым продолжением трахеи). Небольшие инородные тела могут проникать и в мелкие бронхи. Спазм голосовой щели иногда ведет к так называемому баллотированию (хлопанию) инородного тела. Последнее объясняется перемещением струей воздуха достаточно крупных инородных тел в трахее. Во время кашля инородное тело ударяется о нижнюю поверхность рефлекторно смыкающихся голосовых складок, что и дает характерный хлопающий шум, а при вдохе оно вновь опускается вниз до бифуркации, а нередко и попадает в бронх (чаще правый).
Клиника. Симптоматика нахождения инородных тел в нижних дыхательных путях зависит от их размеров и характера (острые, гладкие), локализации (трахея, главные или более мелкие бронхи), продолжительности пребывания инородных тел и реакции дыхательных путей.
Наиболее типичными симптомами являются: характерный судорожный кашель, внезапное затруднение дыхания, слезотечение, цианоз лица и конечностей, рвота, боль за грудиной. После временного успокоения указанные симптомы повторяются. При баллотирующем инородном теле прослушивается (на расстоянии и при аускультации) характерный хлопающий шум. Если инородное тело полностью закрывает один из главных бронхов, долевой или сегментарный бронх, то наступает довольно быстро (в первые часы от начала заболевания) ателектаз соответствующего легкого или его части, что сопровождается эмфиземой другого легкого и смещением органов средостения в пораженную сторону. При неполном (клапанном) закрытии инородным телом просвета бронха развивается эмфизема легкого или его части (зависит от локализации инородного тела) со смещением органов средостения в противоположную сторону.
Течение заболевания при полном и клапанном закрытии бронхов острое или подострое. В этом случае на первый план выступает нарушение проходимости дыхательных путей, а также развитие ателектатической пневмонии. В случаях фиксации инородного тела в трахее или бронхе без выраженного затруднения дыхания, без ателектаза или эмфиземы клиническое течение хроническое. Оно характеризуется воспалительными изменениями на месте фиксации инородного тела и нарушением дренажной функции с развитием пневмонии.
Диагноз ставят на основании анамнеза, жалоб больного, физикальных и рентгенологических симптомов. В сомнительных случаях решающее значение имеет бронхоскопия.
Различают три вида бронхостеноза (классификация CH. Jackson, 1936): полный, вентельный и частичный. Полный бронхостеноз характеризуется развитием ателектаза соответствующего участка легкого. При вентельном стенозе развивается эмфизема легкого на стороне расположения аспирированного инородного тела. У больных с частичным бронхостенозом важное диагностичесое значение имеет симптом Гольцкнехта-Якобсона, при рентгеноскопии у таких больных выявляют смещение средостения при форсированном дыхании на высоте вдоха в сторону бронхостеноза, т.е. инородного тела.
Этот симптом очень показателен и выявляется при всех трех видах бронхостеноза. Выявление данного симптома имеет особенно большое значение в распознавании нерентгеноконтрастных инородных тел.
Неотложная помощь. Больные с подозрением на инородное тело дыхательных путей подлежат срочному направлению в специализированные лечебные учреждения, где должна быть оказана помощь, заключающаяся в удалении инородного тела. Удаляют инородные тела, как правило, при помощи бронхоскопии. В настоящее время в подавляющем большинстве случаев инородные тела бронхов удаляют при верхней бронхоскопии с помощью дыхательного бронхоскопа. Манипуляцию производят под наркозом с применением миорелаксантов короткого действия.
Баллотирующие инородные тела трахеи и даже главных бронхов у детей могут быть удалены при помощи прямой ларингоскопии. Больным, находящимся в состоянии асфиксии, производят срочную трахеотомию с последующим удалением инородного тела путем верхней или нижней (через трахеостому) трахеобронхоскопии.
18.5. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ТРАВМАТИЧЕСКОЙ АСФИКСИИ
Травмы гортани и трахеи
Этиология. Травмы гортани и трахеи возникают под влиянием внешних и внутренних факторов. При прямом воздействии на них тупым предметом, например во время столкновения автомобилей - рулевым колесом, падения на спинку стула, гортань повреждается сильнее, чем при боковом воздействии, так как она прижимается к позвоночнику. В результате у пострадавших обнаруживают открытые и закрытые повреждения этих органов. Об обширности повреждений нельзя судить по величине наружной раны (рис. 18-3).
Резаные раны у самоубийц чаще всего локализуются между подъязычной костью и щитовидным хрящом.
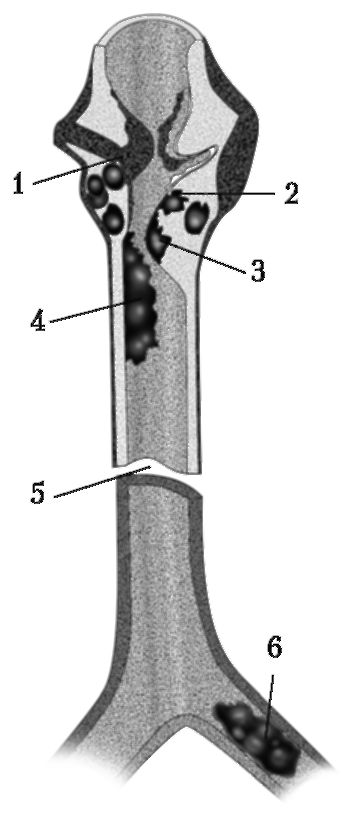 Рис. 18-3. Причины стенозов дыхательных путей вследствие повреждения гортани и трахеи (по L. Kebler F.-W. Oeken, 1986). 1 - перелом хряща; 2 - гематома; 3 - отек; 4 - кровотечение; 5 - отрыв тахеи; 6 - сгусток крови в бронхе
Рис. 18-3. Причины стенозов дыхательных путей вследствие повреждения гортани и трахеи (по L. Kebler F.-W. Oeken, 1986). 1 - перелом хряща; 2 - гематома; 3 - отек; 4 - кровотечение; 5 - отрыв тахеи; 6 - сгусток крови в бронхе
Внутренние повреждения возникают от вдыхания горячего воздуха, газов, ядовитых жидкостей.
Ятрогенные повреждения гортани и трахеи возможны во время струмэктомий, трахеотомий, операций на гортани, интубаций и эндоскопий.
Патогенез. И открытые, и закрытые повреждения часто осложняются развитием острого стеноза дыхательных путей изза образования подкожной эмфиземы, повреждения хрящей, а также аспирации крови. Смертность пострадавших от открытых проникающих ранений гортани высока.
Клиника. Давящие боли в области гортани и трахеи, боль при глотании, удушье, охриплость, крепитация при пальпации горта-
ни, подкожная эмфизема шеи и груди. Путем непрямой ларингоскопии иногда удается обнаружить кровоизлияния, отек, сужение просвета гортани.
Из проникающей раны в области шеи вытекает кровь с пузырьками воздуха. Такие раны, особенно с узким и спавшимся входным отверстием, опаснее непроникающих из-за угрозы аспирации крови, нарастания эмфиземы и развития стеноза дыхательных путей. Если при этом повреждена щитовидная железа или крупные сосуды, опасность для жизни раненого многократно возрастает.
Неотложная помощь. В случае ранения крупных сосудов в первую очередь нужно остановить кровотечение.
Стеноз гортани является показанием к срочной трахеотомии.
В зияющую рану первоначально (до трахеостомии) можно ввести трахеотомическую канюлю и наложить зажимы на кровоточащие сосуды.
Если у оказывающего помощь нет необходимых хирургических навыков и появилась угроза гибели больного, можно ограничиться интубацией или коникотомией.
Вслед за этим отсасывают аспирированную кровь, и пострадавшего немедленно направляют в хирургическое или отоларингологическое отделение, где проводят трахеостомию, ревизию гортани и трахеи с целью ее реконструкции и для предотвращения рубцового стеноза. В раннем послеоперационном периоде проводят нижнюю интубацию - через трахеостому (для создания покоя гортани), больного переводят на зондовое питание, обязательно назначение антибактериальных препаратов для борьбы с вторичной инфекцией.
18.6. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ОТКРЫТОМ, ЗАКРЫТОМ И НАПРЯЖЕННОМ ПНЕВМОТОРАКСАХ
Спонтанный пневмоторакс
Спонтанный пневмоторакс определяется как синдром острой дыхательной недостаточности, возникающий в результате разрыва висцеральной плевры и последующего нарушения дыхательной функции легкого.
Этиология. Наиболее часто данный синдром встречается в молодом возрасте. Причинами спонтанного пневмоторакса являются разрыв висцеральной плевры на фоне различных хронических заболеваний дыхательной системы, ранее не диагносцированных: буллезная форма эмфиземы, реже - абсцесс легкого и крайне редко - распадающаяся опухоль легкого или пищевода.
Патогенез. При возникновении пневмоторакса повышается внутриплевральное давление, происходит коллабирование легкого, в результате чего нарушается его вентиляция и снижается сердечный выброс за счет уменьшения притока крови в малый круг. Тяжесть состояния больного зависит от вида пневмоторакса и от степени повреждения легкого.
Различают 3 вида спонтанного пневмоторакса.
• Открытый.
• Закрытый.
• Напряженный (клапанный).
При открытом пневмотораксе ригидность легочной ткани или спаечный процесс не дают возможности легким спадаться; на фоне этого в плевральной полости постоянно поддерживается давление, равное атмосферному, а количество воздуха в ней не уменьшается, так как он постоянно поступает туда через имеющийся разрыв висцеральной плевры.
При закрытом пневмотораксе отверстие в легком быстро закрывается за счет спадения окружающей легочной ткани, в плевральной полости сохраняется отрицательное давление, а попавший в нее воздух постепенно всасывается. Данный тип пневмоторакса имеет наиболее благоприятное течение и редко представляет серьезную опасность для здоровья больного.
При напряженном (клапанном) пневмотораксе отверстие в легком открывается при вдохе и закрывается во время выдоха, в результате чего в плевральной полости накапливается большое количество воздуха, не имеющего выхода наружу. Данный вариант пневмоторакса всегда требует неотложной помощи.
Клиника. Клиническая картина при любом виде пневмоторакса зависит от объема и скорости поступления воздуха в плевральную полость. Заболевание в типичном случае проявляется появлением спонтанных кратковременных, продолжительностью всего несколько минут, острейших болей в одной из половин грудной клетки; в последующем они могут или полностью исчезнуть, или принять тупой характер. Часто пострадавший с большой точностью может указать время появления болей. После возникновения болевого синдрома появляются резкая одышка, тахикардия, гипотония, бледность кожных покровов, акроцианоз, холодный пот. Температура кожных покровов нормальная или пониженная. Больной занимает вынужденное положение (полусидит, наклонясь в сторону поражения или лежит на больном боку). При напряженном пневмотораксе на стороне поражения тонус грудной клетки повышен, межреберные промежутки сглажены или выбухают (особенно при вдохе). Голосовое дрожание резко ослаблено или отсутствует. Пораженная половина грудной клетки отстает при дыхании, перкуторно определяется тимпанит, нижняя граница легких при дыхании не смещается, определяется смещение средостения и сердца в здоровую сторону и опущение печени при правостороннем или опущение желудка при левостороннем пневмотораксе. Аускультативно определяется значительное ослабление или отсутствие дыхательных шумов на стороне поражения и их усиление над здоровым легким.
Дифференциальный диагноз следует проводить с заболеваниями, вызывающими внезапные боли в грудной клетке и одышку: ОИМ, тромбоэмболией легочной артерии (ТЭЛА), массивные пневмонии, астматический статус, массивный эксудативный плеврит и т.д.
Неотложная помощь. При наличии напряженного пневмоторакса патогенетическим лечением будет проведение декомпрессии плевральной полости, однако если имеются сомнения в правильности диагноза, от пункции плевральной полости следует воздержаться до получения результатов рентгенографии органов грудной клетки и исключения ТЭЛА, ОИМ и других заболеваний. Пунктировать плевральную полость следует толстой иглой во втором межреберье, по среднеключичной линии. К игле присоединяют резиновую трубку, другой ее конец опускают в емкость с фурацилином или физраствором. На часть трубки, опускаемую в жидкость, рекомендуется привязать проколотый палец от резиновой перчатки. Помимо патогенетического лечения могут понадобиться и лечебные мероприятия, носящие симптоматический характер: купирование ОССН, болевого синдрома, кашля, аспирация жидкости, гноя или крови из плевральной полости, противовоспалительная терапия и т.д. Срочная консультация хирурга. Госпитализация в хирургическое отделение.
Симптомы травматического повреждения груди подразделяются на общие, местные и специфические.
Общие признаки проявляются расстройством дыхания и кровообращения и являются следствием механического повреждения грудной клетки (чаще всего переломы ребер), кровотечения, шока.
Местными признаками являются наличие раны, кровотечения, признаки переломов ребер и др.
Специфическими признаками повреждения грудной клетки служат подкожная эмфизема, пневмоторакс, гемоторакс.
Подкожная эмфизема возникает при проникновении воздуха через поврежденный плевральный листок в подкожную клетчатку. В результате анатомической особенности клетчатки - отсутствия фасций - воздух довольно быстро распространяется на грудную клетку, шею, лицо, вызывая специфический вид больного. При пальпации мест эмфиземы слышен характерный звук, напоминающий хруст «сухого» снега. Наличие выраженной эмфиземы делает практически невозможным использование у больного перкуторных и аускультативных методов исследования.
Пневмоторакс определяется как скопление воздуха в плевральной полости в результате проникающего ранения груди или повреждения легкого. Различают четыре вида пневмоторакса: открытый, закрытый, клапанный и напряженный.
Открытый пневмоторакс характеризуется наличием свободного сообщения плевральной полости с внешней средой (рис. 18-4). В условиях нормы в плевральной полости постоянно имеется отрицательное давление - на выдохе минус 5 см, а на вдохе оно увеличивается до минус 10 см водного столба (А. П. Зильбер, 1978), благодаря этому происходит расправление легкого и поступление в него воздуха из атмосферы. При проникающем ранении грудной клетки (непременное условие - повреждение париетального листка плевры) внутриплевральное давление становится равным атмосферному, в результате этого легкое на стороне поражения спадается и уже не может при вдохе расправиться. Возникновение разницы в давлениях в плевральных полостях неповрежденной половины грудной клетки (отрицательное) и поврежденной (равно атмосферному) вызывает смещение сре-
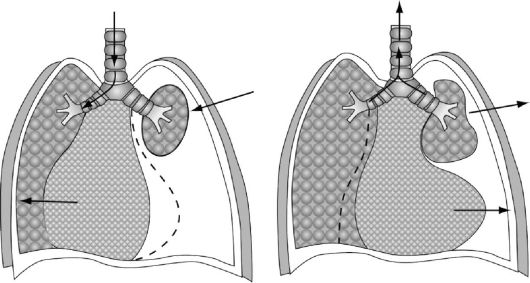 Рис. 18-4. Схема открытого пневмоторакса
Рис. 18-4. Схема открытого пневмоторакса
достения в здоровую сторону (область отрицательного давления) и его баллотирование при дыхании. Это сопровождается смещением сердца и аорты, перегибом и сдавлением крупных кровеносных сосудов и бронхов. Попадание воздуха в плевральную полость вызывает раздражение рецепторов плевры, что усиливает расстройство дыхания и кровообращения.
Кроме того, расстройства газообмена усугубляются в связи с возникновением феномена парадоксального дыхания (рис. 18-5). При вдохе спавшееся легкое перестает, подобно здоровому, насасывать воздух из соответствующего бронха, а в него попадает лишь небольшая часть воздуха, насасываемого здоровым легким. Вместе с тем в здоровое легкое присасывается значительное количество воздуха из спавшегося легкого. Во время выдоха насыщенный СО2 воздух поступает не только в трахею, но и обратно - в спавшееся легкое на стороне повреждения. При каждом вдохе и выдохе воздух, насыщенный СО2, как бы перекачивается из сжатого легкого и обратно. Количество его довольно велико - 150-200 мл при каждом вдохе.
При закрытом пневмотораксе плевральная полость не сообщается с внешней средой и объем воздуха, попавший в плевральную полость в результате травмы
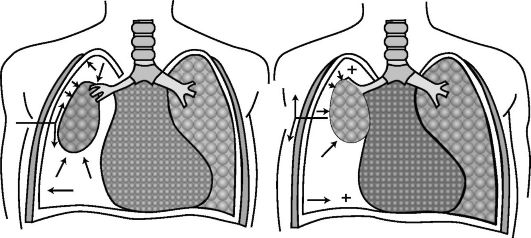 Рис. 18-5. Схема парадоксального дыхания и смещения средостения при открытом пневмотораксе
Рис. 18-5. Схема парадоксального дыхания и смещения средостения при открытом пневмотораксе
груди или повреждения легкого, при дыхании не меняется. Если не происходит образования клапанного механизма, закрытый пневмоторакс протекает относительно доброкачественно: рана довольно быстро закрывается самостоятельно, а имеющееся небольшое количество воздуха в плевральной полости не вызывает угрожающего жизни состояния, однако требует неотложных мер.
При клапанном пневмотораксе воздух на вдохе свободно попадает в плевральную полость, но выход его затрудняется из-за наличия клапанного механизма. Клапанный пневмоторакс может быть наружным и внутренним.
При наружном пневмотораксе клапаном служат края раны грудной клетки. При вдохе рана раскрывается, пропускает воздух в плевральную полость, а при выдохе спадается, и его отток прекращается.
Внутренний клапанный пневмоторакс обычно формируется при одновременном повреждении крупного бронха и лоскутной ране легкого. Данный лоскут начинает выполнять роль клапана. С каждым вдохом воздух поступает в плевральную полость, не имея пути выхода. При выравнивании внутриплеврального давления с атмосферным внутриплевральный клапанный пневмоторакс переходит в напряженный пневмоторакс.
Напряженный пневмоторакс является осложнением клапанного пневмоторакса и по своей сути является закрытым. Его отличием от закрытого пневмоторакса является высокое давление воздуха в плевральной полости. Напряженный пневмоторакс вызывает смещение средостения, коллабирование легких, быстрое нарастание подкожной эмфиземы. Общее состояние пострадавших с данной патологией, как правило, крайне тяжелое.
Гемоторакс определяется скопление крови в плевральной полости. В зависимости от объема крови выделяют малый, средний и большой гемоторакс:
• при малом гемотораксе объем крови до 500 мл (уровень жидкости ниже угла лопатки);
• при среднем объем крови до 1 000 мл (уровень жидкости достигает угла лопатки);
• при большом объем крови более 1 000 мл (кровь занимает всю или почти всю плевральную полость).
При наличии в плевральной полости одновременно воздуха и крови (жидкости) последняя образует видимый рентгенологически горизонтальный уровень. Гемоторакс несет опасность для жизни нарастающим сдавлением легкого и прогрессирующей внутренней кровопотерей.
Диагностика. Ведущими методами исследования, помимо специфических объективных данных, являются рентгенография грудной клетки в различных проекциях, пункция плевральной полости и торакоскопия.
Лучевой алгоритм исследования при повреждении грудной клетки. Рентгенография органов грудной полости демонстрирует повреждения ребер, которые могут сопровождаться или не сопровождаться смещением отломков. Если смещение отломков отсутствует, перелом ребер может быть не диагностирован. Это связано со сложностью выявления линии перелома ребра на фоне подкожной эмфиземы. Следовательно, диагноз «перелом ребер» является прежде всего клиническим и может не быть подтвержден при рентгенологическом исследовании. Травма париетальной, висцеральной плевры и ткани легкого при переломе ребер приводит к развитию подкожной и межмышечной эмфиземы (светлые полоски газа в мягких тканях грудной клетки), пневмо- и/или гидротораксу, поджатию легкого и смещению средостения в сторону неповрежденного легкого.
Показанием к пункции плевральной полости является предполагаемое наличие в ней воздуха или жидкости (кровь, экссудат). При наличии воздуха в плевральной полости место пункции зависит от общего состояния больного. Если больной может сидеть, пункцию проводят во втором межреберье по среднеключичной линии. Если больной сидеть не может, а лежит - то в пятом-шестом межреберье, по среднеподмышечной линии.
Для удаления жидкости или крови пункцию производят в шестом-седьмом межреберье между задней и средней подмышечной линиями (в положении сидя) или ближе к задней подмышечной линии (в положении лежа). Пункцию производят по верхнему краю ребра во избежание повреждения межреберных сосудов.
Торакоскопия используется при закрытых повреждениях, осложненных травматическим пневмотораксом, для уточнения характера повреждения и выбора рациональной лечебной тактики.
Закрытые повреждения груди
Закрытые повреждения груди подразделяются на две группы: без повреждения и с повреждением каркаса грудной клетки. Первая группа включает ушибы, сотрясения и сдавления, а вторая - переломы ребер и грудины.
Ушибы грудной клетки возникают при сильном ударе по грудной клетке, падении на твердый предмет. Для ушиба характерно повреждение мягких тканей грудной клетки в виде болезненной припухлости, обычно вызванной внутримышечным или подкожным кровоизлиянием. При наличии данного повреждения необходимо исключить переломы ребер и повреждения органов грудной клетки.
Неотложная помощь. Местно - холод, ненаркотические анальгетики. Консультация хирурга.
Сотрясения грудной клетки возникают при падениях с высоты или сильном, неожиданном, резком и коротком сжатии грудной клетки. Диагностика строится на анамнезе, отсутствии видимых наружных следов повреждений, выраженной общей реакции организма, вплоть до шокового состояния.
Лучевой алгоритм при ушибах, сотрясении и сдавлении грудной клетки.
Рентгенография органов грудной клетки демонстрирует переломы ребер, наличие жидкости в плевральной полости, утолщение костальной плевры, наличие облаковидных затемнений средней и высокой интенсивности, которые соответствуют кровоизлияниям в паренхиму легких. УЗИ позволяет выявить минимальное количество жидкости в плевральных полостях и наличие гемоперикарда.
Неотложная помощь. После исключения возможных повреждений внутренних органов проводится противошоковая терапия.
Сдавления грудной клетки возможны при авариях на производстве, автомобильных травмах и других ситуациях. Диагноз ставят на основании признаков так называемой травматической асфиксии: голова, лицо и грудная клетка пострадавшего приобретают багрово-фиолетовую окраску с резко выраженной нижней границей. На коже и видимых слизистых наблюдаются петехиальные высыпания.
Неотложная помощь. Купирование болевого синдрома. Кислородотерапия. Симптоматическая терапия. Срочная госпитализация в хирургический стационар.
Переломы ребер возникают при ударе, падении, сжатии грудной клетки и могут быть одиночными и множественными, со смещением или без него. При смеще-
нии возможны осложнения в виде повреждения межреберных сосудов и нервов, плевры и легкого с образованием различных видов пневмоторакса, гемоторакса, подкожной эмфиземы.
Диагностика строится на анамнезе, локализованном болевом синдроме, взаимосвязанном с дыханием, движениями грудной клетки, кашлем. К достоверным признакам перелома ребер относятся наличие патологической подвижности отломков ребер, крепитация костных фрагментов и деформация грудной клетки (при множественных переломах). При множественных переломах может развиться шоковое состояние с признаками ОДН I-III стадии.
Ведущим дополнительным методом диагностики переломов ребер является рентгенография грудной клетки. Следует еще раз отметить, что отрицательный ответ при рентгенологическом исследовании не исключает наличие переломов ребер.
Неотложная помощь. Проводится межреберная новокаиновая или спирт-новокаиновая блокада в месте перелома. Кислородотерапия. При наличии признаков шока - противошоковая терапия. Срочная госпитализация в хирургическое отделение.
Перелом грудины обычно бывает на границе ее тела и рукоятки или мечевидного отростка. Возникает типичная локализованная боль, связанная с дыханием. Дифференциальная диагностика производится, в первую очередь, с ИБС.
Неотложная помощь: обезболивание производится в/м или в/в введением 2-4 мл 50% раствора анальгина. При сильных болях показана новокаиновая или спирт-новокаиновая блокада в месте перелома. Консультация хирурга.
Открытые повреждения грудной клетки
Открытые повреждения грудной клетки подразделяются на непроникающие и проникающие, сквозные и слепые.
Непроникающие ранения относятся к числу легких или средней степени тяжести.
Неотложная помощь. Давящая асептическая повязка. Обезболивание по показаниям. Госпитализация в хирургический стационар.
Проникающие ранения. Критерием проникающего ранения является повреждение париетального листка плевры, что сопровождается поступлением воздуха в грудную клетку и возникновением пневмоторакса. Данный синдром проявляется характерным симптомокомплексом в виде нарушения дыхания, работы сердечнососудистой системы, центральной нервной системы и др.
К достоверным признакам проникающих ранений грудной клетки относятся: пневмоторакс, гемоторакс, подкожная эмфизема и кровохарканье.
Ранения с открытым пневмотораксом протекают тяжело. Больные беспокойны, обращает на себя внимание наличие выраженного акроцианоза, одышки. Дыхание поверхностное, учащенное. При глубоком вдохе боль резко усиливается. Отмечается компенсаторная тахикардия, артериальное давление в пределах нормы или понижено. При осмотре грудной клетки заметно ограничение подвижности пораженной половины грудной клетки, щадящее дыхание на стороне поражения, наличие раны и эмфиземы вокруг нее и слышимое на расстоянии присасывание воздуха через рану при вдохе и его выход из раны при выдохе. Перкуторно определяется тимпанит, а при наличии гемоторакса - тупость над его поверхностью.
Аускультативно - резкое ослабление дыхания в проекции верхней доли легкого и почти полное его отсутствие в проекции нижних долей.
Неотложная помощь. Окклюзионная асептическая герметичная повязка на рану. Купирование болевого синдрома. Кислородотерапия. Симптоматическая терапия. Срочная госпитализация в хирургическое отделение на носилках, в полусидячем положении.
Ранения с закрытым пневмотораксом протекают несколько легче, чем с открытым. Степень дыхательных и сердечно-сосудистых расстройств находится в прямой зависимости от объема пневмоторакса. Аускультативно на стороне поражения отмечается ослабление дыхательных шумов, появляется амфорическое или бронхиальное дыхание. Надежным способом диагностики является плевральная пункция.
Неотложная помощь. Купирование болевого синдрома. Кислородотерапия. Симптоматическая терапия. Срочная госпитализация в хирургическое отделение на носилках, в полусидячем положении.
Ранения, осложненные клапанным (напряженным) пневмотораксом, протекают наиболее тяжело. Смещение средостения, перегиб крупных сосудов и бронхов сопровождается тяжелой сердечно-дыхательной недостаточностью. Отмечаются цианоз кожных покровов и видимых слизистых, признаки ОДН, тахикардия, артериальная гипертензия в сочетании со снижением пульсового давления. Дыхательные движения на стороне поражения отсутствуют или ослаблены. На стороне поражения перкуторно определяется тимпанит и смещение сердечной тупости в здоровую сторону.
Неотложная помощь. Патогенетическим методом лечения является срочная декомпрессия. Плевральная пункция производится либо иглой с клапаном, либо наложением системы с подводным дренажем по Бюлау. Кислородотерапия. Симптоматическая терапия. Срочная госпитализация в хирургическое отделение на носилках, в полусидячем положении.
18.7. СИНДРОМ ДЛИТЕЛЬНОГО СДАВЛЕНИЯ
При землетрясениях, промышленных авариях, боевых действиях встречаются изолированные или комбинированные механические травмы со сдавлением мягких тканей нижних и/или верхних конечностей. После освобождения конечности (конечностей) пострадавшего из-под завала (экспозиция не менее нескольких часов) и восстановления кровотока и лимфообращения в травмированных тканях у больного наступает быстрое и значительное ухудшение общего состояния, часто с последующим смертельным исходом. Данное патологическое состояние носит название синдром длительного сдавления (СДС) - синонимы: краш-синдром, синдром длительного раздавливания, травматический токсикоз, синдром Байуотерса др. Впервые в медицинской литературе СДС был описан Н.И. Пироговым.
СДС можно определить как полисимптомное заболевание вследствие механической травмы мягких тканей, проявляющееся поэтапно возникающими нарушениями, обусловленными травматическим шоком, эндогенной токсемией и миоглобинурийным нефрозом (С.Г. Мусселиус и соавт., 1995).
Этиологическим фактором СДС является механическая травма.
Патогенез СДС связан с массивным поступлением в кровоток из мест сдавления и/или раздавливания тканей миоглобина, гистамина, серотонина, олиго- и полипептидов, калия, что обусловливает развитие полиорганной патологии.
Патогенез СДС складывается из трех компонентов:
• болевого раздражения;
• травматической токсемии;
• массивной плазмопотери.
Длительное болевое раздражение ведет к развитию симптомокомплекса, характерного для травматического шока.
Травматическая токсемия наступает в результате всасывания токсических продуктов из раздавленных мышц. Мышечная ткань теряет 75% миоглобина, 70% креатина, 66% калия, 75% фосфора. Все эти продукты после освобождения конечностей от компрессии поступают в сосудистое русло, что ведет к развитию ацидоза и гемодинамических расстройств. Циркулирующий в плазме свободный миоглобин при кислой реакции мочи в почках трансформируется в кристаллы солянокислого (гидрохлористого) гематина, которые повреждают и закупоривают почечные канальцы, что является одним из факторов развития ОПН. Токсическим воздействием обладает также гистамин, продукты аутолиза белков и другие элементы из раздавленных мышц (среднемолекулярные пептиды, ишемический токсин и т.п.).
По мнению ряда авторов, токсические вещества, обладая выраженным констрикторным действием на сосуды клубочков, поражают эпителий почечных канальцев, вызывая тем самым значительные нарушения функции почек и развитие ОПН. Ряд исследователей связывают нарушение функции почек с накоплением в крови и наличием в моче средних молекул, появляющихся при нарушении обменных процессов и изменениях синтеза ДНК в различных тканях (И.И. Шиманко, С.Г. Мусселиус, 1993).
Плазмопотеря ведет к сгущению крови и развитию тромбоза мелких сосудов поврежденной конечности.
В итоге комплекс вышеуказанных патологических изменений приводит к формированию клинической картины синдрома позиционного сдавления (СПС).
СПС является бытовой разновидностью СДС и возникает при длительном сдавливании конечностей весом собственного тела у пациентов, находящихся в коматозном состоянии.
Если при СДС вопросы диагностики в связи с четкими факторами сложностей не представляют, то СПС редко диагностируется своевременно. Это связано с обязательным наличием периода коматозного состояния (например, алкогольная кома, отравления угарным газом, барбитуратами и т.п.). После выхода из коматозного состояния или еще находясь в нем, пострадавшие обычно попадают в отделения терапевтического профиля. Иногда больные после восстановления сознания на первоначальных этапах заболевания вообще не обращаются за медицинской помощью, и только появление признаков ОПН заставляет их это сделать.
Этиология. Пусковым фактором СПС является длительное коматозное состояние, чаще всего вследствие отравления (алкоголь и его суррогаты, угарный газ, снотворные, седативные и др.), и наступающее на его фоне позиционное сдавление мягких тканей при длительном нахождении пострадавшего в неудобном положении. Обычно он лежит на твердом покрытии в вынужденном положении с подвернутыми под себя сдавленными или согнутыми конечностями.
Патогенез СПС довольно сложен и связан с основными этиологическими факторами, отравлением экзотоксическими веществами наркотического действия и позиционной травмой, которая происходит во время длительного коматозного состояния. В патогенезе СПС большое значение имеет токсемия, связанная с протеолизом тканевых ферментов, погибших в результате ишемии, плазмопотери и болевого фактора. Воздействие миоглобина и других токсических метаболитов, освобождающихся из очага сдавленных и ишемизированных тканей, проявляется тяжелым эндотоксикозом, приводящим к нарушению функций многих органов и систем.
Классическая клиника СДС проявляется после устранения компрессии. В результате вызванного поступлением в кровоток продуктов нарушенного метаболизма, резорбции продуктов распада клеток, болевой импульсации из очага повреждения, а также непосредственного влияния экзотоксинов (суррогаты наркотиков и алкоголя) на мягкие ткани развивается синдром полиорганной недостаточности, в котором на раннем этапе преобладают явления острой почечной недостаточности (ОПН). ОПН развивается вследствие нарушения канальцевого транспорта миоглобина. Тяжесть последней варьирует от нефропатии легкой степени до развернутой ОПН в стадии олигоанурии (Г.В. Кондранин, Б.М. Дрязгов,
М.В. Трашахов, 2000).
Клиническая классификация СДС
Оценивая тяжесть состояния пострадавших, необходимо учитывать длительность и силу раздавливания, обширность травмированных тканей, наличие повреждений сосудов и костей, вероятность возникновения осложнений со стороны других органов и систем (И.И. Шиманко, С.Г. Мусселиус, 1993).
В зависимости от обширности повреждения и длительности раздавливания различают четыре формы течения СДС и два периода.
Формы течения СДС
Крайне тяжелая форма развивается при раздавливании обеих нижних конечностей в течение 8 и более ч и обычно заканчивается смертью на 1-2-й день после травмы при явлениях острой сердечной недостаточности.
Тяжелая форма возникает при раздавливании одной или обеих нижних конечностей в течение 6-7 ч. Она протекает с типичными симптомами почечной недостаточности во всех периодах болезни.
Форма средней степени тяжести возникает при раздавливании мягких тканей конечностей в течение 4-5 ч, протекает без выраженной сосудистой недостаточности в раннем периоде развития болезни и с легкой почечной недостаточностью в дальнейшем.
Легкая форма развивается при раздавливании мягких тканей отдельных сегментов конечностей длительностью до 4 ч. Нарушения функции сердечно-сосудистой системы и почек выражены слабо, часто остается незамеченными.
Тяжесть клинической картины СДС зависит от сопутствующих повреждений внутренних органов, сосудов, костей и характера осложнений, развивающихся впоследствии.
Периоды СДС
В течении СДС выделяют период компрессии и посткомпрессионный период (Э.А. Нечаев и соавт., 1993).
Период компрессии исчисляется временем от момента начала компрессии до ее ликвидации. Наиболее характерными клиническими симптомами данного периода является психическая депрессия, проявляющаяся апатией, сонливостью, заторможенностью. У некоторых больных отмечается психомоторное возбуждение. Типичны жалобы на боли и чувство распирания в сдавленных частях тела, жажду, затрудненное дыхание. При наличии сочетанной травмы будут преобладать симптомы ведущей патологии.
В посткомпрессионном периоде СДС выделяют три периода:
• ранний посткомпрессионный период;
• промежуточный период;
• поздний (восстановительный) период.
Ранний посткомпрессионный период СДС (с момента освобождения от компрессии до 3-х суток) характеризуется преобладанием симптомов сердечно-сосудистой недостаточности, напоминающих своеобразный шок: имеется выраженный болевой синдром, психоэмоциональный стресс, нестабильность гемодинамики. Основная причина смерти - острая сосудистая недостаточность (ОСН). Если больной в этот период не умирает, у него отмечается некоторое субъективное улучшение состояния, однако оно быстро переходит в следующий период заболевания.
Промежуточный период СДС начинается с 4-х и продолжается до 18-х суток. Характеризуется развитием комбинированной интоксикации, обусловленной всасыванием продуктов распада, и нарастающей азотемией на фоне сформировавшейся ОПН. Преобладают симптомы олигоанурической фазы ОПН, протекающей, как правило, на фоне значительно выраженной гиперкалиемии и гиперфосфатемии. Развиваются общие и местные инфекционные осложнения. Причина смерти - ОПН. При положительном течении заболевания на 9-12-й день наступает полиурическая фаза ОПН. Функция почек постепенно восстанавливается.
Поздний (восстановительный) период (с 18-х до 30-45-х суток) характеризуется преобладанием симптомов полиурической фазы ОПН и местных симптомов, обусловленных повреждением мышц и нервов травмированной части тела. Купируются общие и местные инфекционные осложнения. Формируется четко выраженная атрофия пораженных мышц, контрактуры, ограничения подвижности суставов. К концу восстановительного периода нормализуется диурез, и начинается период выздоровления.
Клиника синдрома длительного сдавления
Диагностика СДС основывается на обстоятельствах травмы и признаках перенесенного сдавления (бледность кожных покровов, ослабленная пульсация периферических артерий, быстро нарастающий и приобретающий деревянистую плотность отек конечностей, постепенное исчезновение пульсации сосудов и прогрессивное ухудшение состояния).
После устранения компрессии обычно через 5-15 мин появляются боли в поврежденной конечности. Пострадавшие жалуются на слабость, тошноту, рвоту.
Травмированная конечность как бы расплющена, на ней видны вмятины от неровных поверхностей раздавливающих предметов. Пульс учащен, артериальное давление нормальное или слегка пониженное.
К концу 1-го часа после устранения компрессии травмированные части тела (обычно конечности) становятся отечными, приобретают деревянистую плотность, движения в суставах ограничены или невозможны из-за болей. Кожа в зоне повреждения на месте наибольшего раздавливания становится багрово-синюшной, на ней появляются пузыри, наполненные геморрагической жидкостью. Пульсация артерий в дистальных отделах конечности исчезает.
По мере нарастания отека прогрессивно ухудшается общее состояние. Пульс становится частым и слабым, артериальное давление снижается до 70-80 мм рт.ст., развиваются вялость и заторможенность. Уже на 1-3-и сутки после травмы, т.е. в раннем периоде СДС, развивается олигурия или анурия. Иногда после освобождения из-под развалин при первом мочеиспускании выделяется значительное количество мочи. Обычно это моча, которая находилась в мочевом пузыре еще до травмы и в период компрессии. В последующем у больного, как правило, развивается олигоанурия. Если в это время катетером удается вывести несколько миллилитров мочи, то можно видеть, что она имеет лаково-красную, позднее - темно-бурую окраску, обусловленную наличием миоглобина, поступающего в кровь из раздавленных тканей, и гемоглобина из очагов кровоизлияний. В такой моче обнаруживают до 6-12% и более белка, гиалиновые и зернистые цилиндры, кристаллы гидрохлористого (солянокислого) гематина и глыбки аморфного миоглобина, небольшое количество свежих эритроцитов.
В менее тяжелых случаях в раннем периоде СДС нарушения гемодинамики не столь ярко выражены и могут остаться незамеченными. Тем не менее в промежуточном периоде у многих больных развивается тяжелая ОПН. В этот период боли и отек поврежденной конечности уменьшаются, а состояние больных ухудшается, так как на первый план в картине болезни начинает выступать ОПН, которая, как правило, сопровождается резко выраженными азотемией, гиперкалиемией и гиперфосфатемией.
Содержание калия плазмы достигает 6 ммоль/л и более. Если в это время гиперкалиемию плазмы устранить с помощью гемодиализа, то через сутки, а иногда и раньше она снова достигает прежнего уровня. Это обусловлено тем, что калий в больших количествах продолжает поступать в плазму крови из раздавленных тканей. Более чем у 50% больных одновременно с этим развиваются гипермагниемия и гипокальциемия.
Выраженные водно-электролитные нарушения при СДС обычно сочетаются с метаболическим ацидозом. Температура тела в этом периоде обычно повышена. Больные вялы, заторможенны. На месте наибольшей компрессии кожа некротизируется и отторгается. Рана быстро инфицируется, что приводит к развитию флегмон и гнойных затеков.
В поврежденных конечностях в это время появляются жгучие боли, обусловленные травматическим невритом. Последний чаще встречается при повреждении верхних конечностей (56,5%), чем нижних (35,7%).
На 9-12-й день обычно наступает полиурическая фаза острой почечной недостаточности. Функция почек постепенно восстанавливается. У многих больных в этом периоде развивается типичная для ОПН анемия.
Мышцы на травмированных частях тела подвергаются атрофии, иногда развиваются тугоподвижность в суставах, контрактуры.
Принципы лечения СДС
Принципы лечения СДС:
• поддержка кровообращения и дыхания (коррекция волемии, кардиотоники, катехоламины, компоненты крови, ИВЛ);
• своевременная хирургическая, травматологическая помощь (фасциотомия, некрэктомия, остеосинтез, ампутация конечностей, пластика дефектов ткани);
• коррекция КЩС, водно-электролитного баланса;
• детоксикация (гемодиализ, гемофильтрация, ультрафильтрация, гемосорбция, гепатопротекторы);
• анальгезия, анестезия, психотропная терапия;
• гипербарическая оксигенация;
• энтеральное и парентеральное питание.
Примечания. 1. При рН крови ниже 6,0 наступает почечный блок (Lalich J., 1955). В этих случаях находящийся в плазме свободный гемоглобин начинает превращаться в гидрохлористый гематин, который задерживается в канальцах, что способствует формированию миоглобинурийного нефроза, чего не наблюдается при щелочной моче. Профилактика данного осложнения достигается ощелачиванием плазмы в/в капельным введением 4% раствора гидрокарбоната натрия до получения щелочной реакции мочи.
2. Коррекция нарушенных реологических свойств крови достигается использованием гепарина, трентала, фибринолитически активной или свежезамороженной плазмы.
Объем помощи на этапах медицинской эвакуации
Судьба пострадавшего с СДС во многом зависит от правильности оказания медицинской помощи на этапах эвакуации.
Доврачебная медицинская помощь
Доврачебная медицинская помощь на месте поражения. Идеальным вариантом для оказания неотложной помощи на месте поражения является присутствие не менее двух спасателей. При освобождении из-под завала один из них освобождает конечность от сдавления, начиная от центра и к периферии с целью предупреждения возникновения турникетного шока (синдром включения), другой одновременно в том же направлении бинтует конечность эластичным бинтом, умеренно сдавливая мягкие ткани - это значительно уменьшает приток венозной крови и предупреждает нарастание отека конечности. После извлечения из-под завала оказывают симптоматическую помощь, производят транспортную иммобилизацию, и больного транспортируют в стационар. По возможности на этапе эвакуации производят охлаждение пораженной конечности всеми доступными средствами.
К наложению жгута выше уровня сдавления в настоящее время отношение сдержанное, тем более что отсутствие контроля за ним в процессе эвакуации может привести к необратимым изменениям в тканях и явиться причиной последующей ампутации. Наложение жгута показано только в двух случаях: при явных признаках нежизнеспособности конечности и с целью остановки наружного кровотечения при повреждении магистральной артерии.
Квалифицированная медицинская помощь
Квалифицированная медицинская помощь на этапе медицинской эвакуации (участковая больница, центральная районная больница) должна выполняться в неотложном порядке и включать в себя следующее:
• выполнение операций по жизненным показаниям;
• адекватное обезболивание;
• инфузионную терапию через катетер растворами коллоидов и глюкозы;
• внутривенное введение растворов хлористого кальция как ингибитора калия;
• введение антигистаминных препаратов, гормонов;
• контроль диуреза и стимуляцию функции почек;
• футлярную новокаиновую блокаду выше уровня сдавления;
• общее согревание, соле-щелочное питье, горячий чай;
• исправление иммобилизации;
• симптоматическую терапию.
После оказания квалифицированной медицинской помощи и выведения из шокового состояния больной должен быть эвакуирован в специализированное лечебное учреждение, имеющее необходимую аппаратуру для проведения диализно-фильтрационных методов лечения.
Быстрое перемещение пострадавших с места катастрофы в лечебное учреждение, способное оказать специализированную медицинскую помощь, является одним из решающих условий благоприятного исхода лечения СДС.
Эвакуация пораженных с СДС должна осуществляться в первую очередь в положении лежа на носилках, наиболее щадящим транспортом, желательно в специализированное отделение.
Интенсивная терапия в раннем периоде СДС должна быть направлена на поддержание адекватного общего и периферического кровообращения, коррекцию гомеостаза и предупреждение развития острой почечной недостаточности (ОПН). Для этого проводят коррекцию ацидоза, устранение водно-электролитных нарушений, восполнение объема циркулирующей крови, создают управляемую гемодилюцию в физиологических пределах (гематокрит - 0,35). Объем инфузионной терапии может быть от 1500 до 2500 мл в зависимости от показателей центральной гемодинамики. Коррекцию гомеостаза обеспечивают введением внутривенно ощелачивающих растворов, например 4% раствора натрия гидрокарбоната в количестве от 600 до 2000 мл в сутки под контролем КЩС, с адекватной коррекцией водно-электролитных нарушений, введением кристаллоидных и среднемолекулярных коллоидных растворов. Применяют 10 мл/кг реополиглюкина или 8 мл/кг гемодеза, а также 10-15 мл/кг растворов электролитов. Инфузионная терапия осуществляется под контролем центрального венозного давления, гематокрита и содержания электролитов.
Создание управляемой гемодилюции способствует уменьшению концентрации миоглобина в плазме крови, что вместе с ощелачиванием первичной мочи препятствует механической закупорке просвета почечных канальцев.
Следует осторожно относиться к назначению препаратов калия, так как в раннем периоде СДС нередко регистрируется гиперкалиемия. Коррекцию К+ осуществляют под тщательным контролем его содержания в плазме и ЭКГ-контролем.
Консервативная терапия помимо проведения инфузионной терапии и коррекции параметров КЩС должна включать обязательное применение антиагрегантов, антиоксидантов, антикоагулянтов.
Для стимуляции диуреза используют спазмолитики, ощелачивание мочи под контролем рН, салуретики в адекватных дозировках. Если при достижении основных показателей гомеостаза диурез не восстанавливается, то следует назначить внутривенно раствор лазикса в разовой дозе не менее 1,5-2 мг/кг. В дальнейшем при отсутствии диуреза дозу рекомендуют увеличить до 3 мг/кг. Суточная доза при этом не должна превышать 500-700 мг. Стимуляция диуреза более суток нецелесообразна.
В случае восстановления диуреза его надо поддерживать на уровне не менее 2000 мл/сут., используя при необходимости лазикс. При сохранении олигоанурии на вторые сутки необходимо ограничить введение жидкости в пределах физиологических потребностей с учетом потерь, отменить назначение лазикса. Считается, что 2-е сутки являются критическими в отношении восстановления выделительной функции почек. Сохраняющаяся к 3-м суткам олигоанурия позволяет констатировать развитие ОПН, что требует коррекции объема и состава проводимой инфузионной терапии. Если в результате консервативной терапии восстанавливается выделительная функция почек, о чем свидетельствует снижение концентрации мочевины, креатинина, К+, стабилизируется объем выделяемой мочи, то можно считать, что степень поражения почек не превысила уровня нефропатии. В противном случае характер поражения почек следует трактовать
как ОПН.
Обязательным является включение в проводимую терапию антибиотиков, за исключением нефротоксичных. Предпочтение следует отдавать цефалоспоринам и метронидазолу.
Для лечения болевого синдрома рекомендуется использовать трамадол (трамал).
При выраженной гипопротеинемии (содержание общего белка меньше 40 г/л) показано введение белковых препаратов (альбумин) и растворов гидроксиэтилкрахмала (рефортан, стабизол, инфукол и др.).
Показанием к переливанию препаратов красной крови (переносчиков газов) при острой анемии вследствие массивной кровопотери является потеря 25-30% объема циркулирующей крови, сопровождающейся снижением уровня гемоглобина ниже 70-80 г/л и гематокрита ниже 25% и возникновением циркуляторных нарушений.
При неэффективности консервативной терапии применяют методы активной детоксикации: фильтрационно-конвективные (гемодиализ, ультрафильтрация, гемоультрафильтрация) и методы гравитационной хирургии крови (плазмаферез, гемосорбция).
Объем оперативного вмешательства
Фасциотомия относится к наиболее частому оперативному вмешательству при СДС. Показания к ее проведению:
• выраженный, прогрессирующий отек поврежденной конечности с усиливающимся нарушением лимфо- и кровообращения;
• ишемическая контрактура (некроз) отдельных групп мышц;
• гнойная (анаэробная) инфекция;
• наличие очагов некроза или нагноения при сомнительных результатах определения их локализации с помощью других диагностических методов.
Ампутация. Показаниями к ампутации у пострадавших с СДС являются:
• разрушение (размозжение) конечности;
• тотальный ишемический некроз (гангрена);
• прогрессирующая раневая и общая инфекция при безуспешности других активных методов детоксикации;
• повторные аррозивные кровотечения из магистральных сосудов при обширных гнойных ранах конечностей.
Ампутация может быть показаной при тяжелой форме СДС в первые часы после травмы при невозможности в ближайшие несколько суток эвакуировать пострадавших в центр экстракорпоральных методов детоксикации. Иногда ампутацию вынуждены производить на месте происшествия при невозможности устранить сдавливающий конечность фактор.
Лампасные разрезы и «так называемые лампасные разрезы» (множественные надсечки кожи, что сопровождается повреждением нервов) противопоказаны, так как нарушение целостности кожного покрова приводит в раннем периоде к гнойно-септическим осложнениям. В более позднем периоде возникают повторные аррозивные кровотечения, а у некоторых больных развивается генерализованный сепсис.
Лампасные разрезы в сочетании с травмированными нервными стволами при заживлении могут образовывать келоидные деформирующие рубцы, что значительно удлиняет сроки восстановления функции конечностей, реабилитации больных, выписку их из стационара, а также восстановление трудоспособности. В то же время при сохранении целостности кожных покровов у больных с выраженными отеками конечностей повторные диализно-фильтрационные методы очень быстро снимают отеки и обеспечивают раннее восстановление функции конечностей и трудоспособности больного.
Специализированная медицинская помощь
Основной принцип оказания специализированной медицинской помощи больным с СДС и СПС - лечение ОПН с помощью диализно-фильтрационных методов в сочетании с симптоматической терапией. Данный вид помощи должен оказываться в лечебных учреждениях, имеющих необходимую аппаратуру и подготовленный медперсонал. Не следует заниматься попытками оказания специализированной медицинской помощи на местах, где отсутствуют условия для проведения диализно-фильтрационных методов лечения, так как в должном объеме оказать помощь не удастся, но будет упущено время.
Показаниями для проведения срочного гемодиализа являются гиперкалиемия, гипергидратация легочной ткани, гиперосмолярный синдром, азотемия.
При раннем токсикозе для удаления из организма токсических метаболитов (олиго- и полипептидов, молекул средней массы, миоглобина и др.) эффективными являются методы сорбционной детоксикации (гемосорбция, плазмосорбция, лимфосорбция) и плазмаферез.
Больным, находящимся на гемодиализе, необходимо восполнять потребность во всех витаминах (прежде всего группы В, С, Е, РР).
При тяжелой степени интоксикации и сопутствующих осложнениях (неустойчивая гемодинамика, кровотечение) оптимальным методом детоксикации является лечебная лимфорея, лимфосорбция, лимфодиализ.
При тяжелом клиническом течении эндогенной интоксикации, осложняющем СДС, активные методы лечения рекомендуется дополнять химио- и фотогемотерапией. С этой целью применяют непрямое электрохимическое окисление крови внутривенным введением раствора гипохлорита натрия (ГХН). Одним из основных лечебных эффектов ГХН является способность существенно снижать степень эндотоксемии. Гипохлорит натрия обладает свойствами аитикоагулянта прямого действия, а также проявляет себя как антисептик широкого спектра действия. Отмечена эффективность препарата в отношении большинства выявленных патогенных микроорганизмов. Инфузию гипохлорита натрия рекомендуется осуществлять в центральную вену (подключичную, яремную, бедренную) через поливиниловый катетер со скоростью 50-70 кап. в минуту 0,6% раствора в объеме, не превышающем 1/10 ОЦК за один сеанс (Мусселиус С.Г., 1998).
Из методов фотогемотерапии в составе комплексного лечения применяют метод ультрафиолетовой обработки крови (УФО) и интравазальную фотомодификацию крови.
Сочетание фотогемотерапии с гемосорбцией или плазмаферезом значительно повышает эффективность данного метода при лечении эндотоксемии. Под действием кванта света, оказывающего деструктивный эффект на токсические метаболиты и бактериальные токсины, происходит их выведение из сосудистого русла активным методом, что приводит к отчетливому снижению токсических свойств крови.
Благотворное влияние отмечено при применении УФО крови и внутривенного введения ГХН на реологические свойства крови. При сочетании этих методов лечения отмечено улучшение агрегационно-адгезионных свойств эритроцитов и тромбоцитов, снижение вязкости крови. Улучшение реологии крови, устранение микроциркуляторных нарушений в целом приводит к снижению степени эндотоксемии и уменьшению органных нарушений.
Очередность и продолжительность проведения методов детоксикации должны устанавливаться в зависимости от стадии заболевания и клинико-лабораторных показателей.
18.8. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ КРОВОТЕЧЕНИЯХ
18.8.1. ОСНОВНЫЕ ВИДЫ КРОВОТЕЧЕНИЙ
Острая кровопотеря представляет собой синдром, проявляющийся комплексом компенсаторных и патологических реакций, возникающий в ответ на первичное уменьшение ОЦК.
Патогенез. В организме взрослого мужчины массой 70 кг содержится 5000 мл крови (нормальный ОЦК для мужчин 70 и 60 мл/кг для женщин). При острой кровопотере в организме происходит ряд однотипных изменений, важнейшим из них является уменьшение ОЦК. Это влечет за собой уменьшение АД, снижение
венозного возврата, падение сердечного выброса. Ответной реакцией на уменьшение ОЦК является резкое возрастание активности симпатоадреналовой системы, проявляющееся массивным выбросом в кровоток катехоламинов.
Это вызывает вазоконстрикцию и централизацию кровообращения с целью поддержать на приемлемом для жизни уровне кровоснабжение жизненно важных органов: головного мозга и сердца.
Возникающая на фоне острой кровопотери активация ренин-ангиотензин- альдостероновой системы способствует задержке воды в организме.
Гемодилюция, возникающая на фоне кровотечения, за счет компенсаторного поступления в сосудистое русло воды из интерстициального пространства способствует улучшению реологических свойств крови и улучшению перфузии тканей, однако в конечном итоге падение концентрации эритроцитов способствует формированию гемической гипоксии.
Повреждение кровеносных сосудов запускает гиперкоагуляцию, что на первоначальных этапах протекает как нормальная физиологическая реакция, однако при продолжающемся кровотечении и отсутствии должного лечения гиперкоагуляционный синдром вызывает формирование грубой органной патологии за счет формирования синдрома диссеминированного внутрисосудистого свертывания.
Зависимость между объемом кровопотери и основными патофизиологическими сдвигами представлена в табл. 18-1.
Таблица 18-1. Объем кровопотери и патофизиологические сдвиги
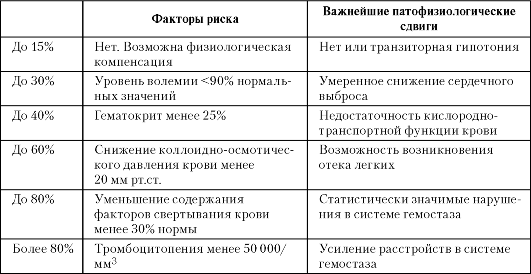 Классификация кровотечений
Классификация кровотечений
Классификация кровотечений осуществляется по источнику, клиническим проявлениям, времени возникновения, в зависимости от локализации источника кровотечения, от объема дефицита ОЦК и скорости кровопотери.
По источнику.
• Артериальные кровотечения.
• Венозные кровотечения.
• Паренхиматозные (и капиллярные) кровотечения.
• Смешанные кровотечения. По клиническим проявлениям.
• Наружные кровотечения.
• Внутренние кровотечения.
• Скрытые кровотечения. По времени возникновения.
• Первичные кровотечения.
• Вторичные кровотечения: ранние вторичные, поздние вторичные.
В зависимости от локализации источника кровотечения: легочные, пищеводные, желудочные, кишечные, почечные и т.д.
В зависимости от объема дефицита ОЦК в процентах у взрослого пациента массой 70 кг, мл (% ОЦК, классификация ВОЗ, 2001 г.):
I (легкая) степень тяжести кровопотери - 15% и менее (<750 мл);
II (средняя) степень тяжести кровопотери - 15-30% (750-1500 мл);
III (тяжелая) степень тяжести кровопотери - 30-40% (1 500-2000 мл);
IV (крайне тяжелая) степень тяжести кровопотери более - 40% (>2000 мл). По скорости кровопотери.
• Молниеносные (чаще массивные).
• Острые кровопотери.
• Хронические кровопотери.
I. Классификация кровотечений по источнику.
• Артериальные кровотечения. Кровь алая вытекает пульсирующей струей. Если пострадавшему не оказать немедленной помощи (остановить кровотечение любым доступным методом), возможна быстрая гибель.
• Для венозных кровотечений характерно вытекание крови медленной струей, темного цвета. Если повреждены вены мелкого диаметра, возможна спонтанная остановка кровотечения.
• При повреждении внутренних органов возможно возникновение паренхиматозных и капиллярных кровотечений. Они отличаются тем, что кровоточит вся тканевая поверхность.
II. Классификация по клиническим проявлениям.
• Наружные кровотечения наблюдаются при травмах с повреждением наружных покровов тела и сложностей для диагностики не представляют.
• Внутренние кровотечения являются наиболее трудными в диагностическом и лечебном плане, особенно при безболевом варианте их возникновения. Не следует забывать, что при внутриполостных кровотечениях кровь долго не сворачивается, а при внутритканевых весьма проблематично определить реальный объем кровопотери.
• Скрытые кровотечения не имеют ярких внешних проявлений и определяются специальными методами исследования.
III. Классификация по времени возникновения:
Выделяют кровотечения первичные и вторичные. Первичные кровотечения возникают сразу после повреждения сосуда, а вторичные - через некоторое время и в свою очередь подразделяются на ранние и поздние. Ранние вторичные кровотечения возникают в первые часы или сутки после повреждения. Основной причиной их возникновения является механический отрыв тромба в результате повышения АД или купирование сосудистого спазма. Поздние вторичные кровотечения в
основном связаны с нагноением раны, аррозией стенки сосуда или с нарушением свертывающих свойств крови.
IV. Классификация в зависимости от локализации источника кровотечения.
Выделяют легочные, пищеводные, желудочные, кишечные, почечные и т.д.
Классификация кровотечений в зависимости от объема дефицита ОЦК
Существует значительное количество классификаций кровопотерь что в конечном итоге вносит дезориентацию в выработку единых подходов к лечению. Для применения в системе здравоохранения Российской Федерации в качестве классификации острой кровопотери рекомендуется классификация ВОЗ (2001), выделяющая IV степени тяжести кровопотери (табл. 18-2). Переход на данную классификацию позволит стандартизировать терапию кровопотери (адаптированной к конкретному контингенту пациентов) с коррекцией трансфузионной терапии (дополнительная трансфузия эритроцитов, альбумина, свежезамороженной плазмы и продуктов ее переработки, тромбоцитов) с учетом показателей лабораторного контроля и клинических данных.
Таблица 18-2. Классификация острой кровопотери
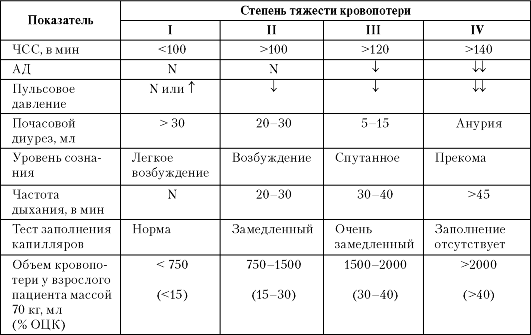 Острая кровопотеря в объеме менее 10% ОЦК (<500 мл) протекает бессимптомно, лечения при отсутствии сопутствующей патологии не требуется.
Острая кровопотеря в объеме менее 10% ОЦК (<500 мл) протекает бессимптомно, лечения при отсутствии сопутствующей патологии не требуется.
I (легкая) степень тяжести кровопотери. Клинические симптомы могут отсутствовать или появляется компенсаторная ортостатическая тахикардия (учащение ЧСС не менее 20 в 1 мин) при переводе больного из горизонтального в вертикальное положение. Уровень сознания - легкое возбуждение. Изменений АД и мочеотделения не отмечается. Формируется дефицит интерстициального пространства, который довольно легко компенсируется.
II (средняя) степень тяжести кровопотери. Основным клиническим признаком является ортостатическая гипотензия (падение систолического АД не менее чем на 15 мм рт.ст.). В горизонтальном положении АД обычно в пределах нормы, но может быть и несколько понижено. Уровень сознания - сознание ясное, однако больной возбужден, беспокоен или слегка заторможен, мочеотделение сохранено. Отмечается умеренное снижение сердечного выброса. Возможно развитие шокового состояния при длительном отсутствии компенсаторного лечения.
III (тяжелая) степень тяжести кровопотери. На первое место выступает артериальная гипотензия в положении лежа и олигурия (количество мочи 100-500 мл/ 24 ч). Уровень сознания - появляются количественные нарушения сознания: спутанное сознание, оглушение. При отсутствии срочного лечения развитие шокового состояния неизбежно.
IV (крайне тяжелая) степень тяжести кровопотери. Характеризуется крайне низким АД (систолическое АД 50-60 мм рт.ст.). Сердечный выброс приобретает критический уровень, усиливается недостаточность кислородно-транспортной функции крови, нарастает дефицит факторов свертывания крови, происходит дальнейшее снижение коллоидно-осмотического давления плазмы. Анурия. Усиливаются количественные нарушения сознания: глубокое оглушение может перейти в сопор, а затем и кому. Развитие шокового состояния неизбежно. Без немедленной компенсации кровопотери возможна смерть от нарушения метаболизма жизненно важных органов и нарушений свертывающих свойств крови.
Примечание. Особыми формами острой кровопотери являются острая массивная кровопотеря и молниеносная.
Под термином «острая массивная кровопотеря» понимают острую невосполненую потерю 30% ОЦК менее чем за 2 ч или восполненную потерю 70% ОЦК за тот же период времени. Острая массивная кровопотеря всегда сопровождается выраженными нарушениями системы гемостаза, что требует соответствующей трансфузионной терапии.
Под термином «молниеносная кровопотеря» понимают острую невосполненную потерю 50% (2 500 мл) ОЦК за 5-10 мин. Она приводит к быстрой гибели больного от рефлекторной остановки сердца: синдром «пустого сердца». Общее состояние таких пострадавших следует расценивать как предагональное, что требует немедленных реанимационных мероприятий.
Клиника. Наружные кровотечения затруднений для диагностики и определения тактики лечения не представляют. Сложности возникают, как правило, при безболевых вариантах хронических или острых внутренних кровотечений. Следует помнить, что при кровопотере до 10-15% ОЦК клиническая симптоматика бывает довольно скудной и проявляется умеренной тахикардией и одышкой; возможно возникновение обморочного состояния. При кровопотере более 15% ОЦК наступает централизация кровообращения и развивается типичная картина гиповолемического (геморрагического) шока (см. раздел «Неотложная помощь при шоке»).
18.8.2. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ КРОВОПОТЕРЕ
Общие принципы терапии наружной острой кровопотери
Общие принципы терапии острой кровопотери складываются из следующих компонентов:
• немедленная временная остановка наружного кровотечения;
• ликвидация дефицита ОЦК;
• контроль эффективности терапии.
Правила неотложной помощи при кровопотере представлены в главе 7. Остановка наружного кровотечения.
Общие принципы инфузионной терапии острых кровотечений
Главными задачами при лечении острой кровопотери являются:
• нормализация и поддержание на адекватном уровне органного кровотока путем восполнения ОЦК;
• восстановление кислородно-транспортной функции крови путем восполнения переносчиков кислорода (эритроциты) до уровня минимальной достаточности потребления кислорода тканями;
• восстановление дефицита факторов свертывания крови.
Ведущим направлением лечения острой кровопотери является устранение гиповолемии и нормализация ОЦК. Это достигается сочетанным применением кристаллоидов и плазмозамещающих растворов (искусственных коллоидов). Выбор препаратов зависит от степени тяжести кровопотери и выраженности побочных эффектов.
Основными диагностическими задачами, решение которых необходимо выполнить при выборе трансфузиологической тактики восполнения острой кровопотери и оценки ее эффективности, является оценка объема и темпа кровопотери и оценка степени компенсации связанных с кровопотерей нарушений.
Способы определения объема кровопотери. Несмотря на кажущуюся простоту вопроса в настоящее время не существует универсального, абсолютно достоверного, доступного метода измерения объема кровопотери. Все методы имеют ту или иную степень погрешности. Рекомендуемыми являются:
• гравиметрический метод (метод практически пригоден только для измерения операционной кровопотери);
• определение дефицита глобулярного объема;
• примерная оценка в зависимости от источника (если он известен);
• оценка по показателям гемодинамики (шоковый индекс Альговера-Бурри);
• оценка объема и степени тяжести кровопотери по комплексу показателей (см. табл. 18-2).
Способы оценки степени компенсации кровопотери:
• оценка показателей гемодинамики и перфузии органов включает измерение АД, ЧСС, ЦВД, почасового диуреза, показателей оксигенации, оценку КЩС;
Примечание. При развитии клиники тяжелого геморрагического шока рекомендуется инвазивное измерение АД, измерение ДЗЛК, сердечного выброса.
• оценка состояния системы гемостаза включает определение показателей гемостазиограммы;
• оценка дефицита эритроцитов и состояния транспорта кислорода включает измерение концентрации гемоглобина, гематокрита, подсчет числа эритроцитов.
Инфузионные среды
В качестве инфузионных сред для лечения острой кровопотери используют следующие лекарственные средства: противоанемические, свежезамороженную плазму, тромбоцитарный концентрат, раствор альбумина, плазмозаменители.
Противоанемические средства.
К противоанемическим средствам относятся эритроцитсодержащие трансфузионные среды: (эритроцитарная донорская масса (ЭМ); эритроцитарная масса, обедненная лейкоцитами и тромбоцитами (ЭМОЛТ); размороженная эритроцитарная масса).
Примечание. Переливание цельной консервированной донорской крови всегда имеет факторы риска (см. раздел Принципы лечения гиповолемического шока), поэтому в настоящее время показания к ее использованию весьма ограничены: массивные кровопотери с явлениями развившегося гиповолемического шока и анемической гипоксией, массивные обменные трансфузии, особенно в военнополевых условиях, при массовых поступлениях раненых и больных при катастрофах. В мирное время следует строго придерживаться концепции компонентной терапии (А.А. Бунятян и соавт., 2006).
Главная цель применения противоанемических средств при острой кровопотере - поддержание адекватной доставки О2 к тканям. Факторами, влияющими на потребление тканями кислорода, являются минутный объем сердца (МОС) [синоним - сердечный выброс (СВ)], содержание О2 в крови и коэффициент экстракции О2.
Многочисленные экспериментальные и клинические наблюдения позволяют однозначно утверждать, что недостаточность транспорта О2 формируется при кровопотере не менее 40% ОЦК (см. табл. 18.1), следовательно, использовать эритроцитарную массу как переносчик кислорода нужно при кровопотере III-IV степени тяжести.
Показания к переливанию переносчиков газов крови
В инструкции по применению компонентов крови, утвержденной приказом Министерства здравоохранения Российской Федерации от 25.02.2002 г. ?363, написано: «Показанием к переливанию переносчиков газов крови при острой анемии вследствие массивной кровопотери является потеря 25-30% объема циркулирующей крови, сопровождающаяся снижением уровня гемоглобина ниже 70-80 г/л, гематокрита ниже 25% и возникновением циркуляторных нарушений».
Снижение уровня гемоглобина до 80-90 г/л у лиц пожилого возраста, в особенности страдающих ИБС.
Объем трансфузии определяется исходя из полученных клинических и лабораторных показателей, но должен составлять не менее 300-400 мл эритроцитарной массы или 2 доз эритроцитарной массы, обедненной лейкоцитами и тромбоцитами (ЭМОЛТ).
Примечание. Одна доза ЭМОЛТ (270±20 мл) по содержанию эритроцитов эквивалентна одной дозе (510 мл) донорской крови.
Свежезамороженная плазма
Свежезамороженная плазма (СЗП) относится к группе корректоров коагуляционного гемостаза. В ней содержится альбумин, факторы свертывания, фибринолиза, комплемента, иммуноглобулины, ингибиторы протеаз.
Главная цель применения СЗП - восполнить дефицит факторов свертывания крови. Единственным признанным Американским и Европейским обществами трансфузионной медицины показанием к переливанию СЗП является наличие клинически значимого дефицита факторов свертывания крови.
В соответствии с вышеприведенным приказом показаниями к трансфузии СЗП является:
• острая массивная кровопотеря (более 30% ОЦК) с развитием геморрагического шока и ДВС-синдрома;
• снижение концентрации фибриногена до 0,8 г/л;
• снижение протромбинового индекса менее 60%;
• удлинение ТВ или АЧТВ более чем в 1,8 раза от контроля.
Доза СЗП определяется выраженностью указанных расстройств. Разовая доза составляет, как правило, 10-20 мл/кг.
Тромбоцитарный концентрат
Тромбоцитарный концентрат (ТК) представляет собой суспензию жизнеспособных и гемостатически активных тромбоцитов в плазме.
Главная цель применения ТК - предупредить возможное нарушение свертывания крови при тяжелой и особенно крайне тяжелой степени тяжести кровопотери.
Показаниями к назначению ТК является снижение числа тромбоцитов менее 50×109/л или же снижение индуцированной агрегации тромбоцитов в половину от нормы.
Условная единица измерения ТК - 1 доза, приготовленная из 500 мл консервированной крови. Содержит 55 млрд тромбоцитов в 50-70 мл плазмы. Обычно назначают 1 дозу КТ на 10 кг массы больного.
Примечание. ТК имеет небольшой срок хранения (3-5 суток), поэтому в большинстве случаев службы переливания крови не имеют его дежурного запаса.
Раствор альбумина
Основная физиологическая роль альбумина, концентрация которого в плазме составляет от 35 до 50 г/л, состоит в поддержании онкотического давления плазмы и обеспечении транспортной функции крови (В. Городецкий, 2003).
Раствор альбумина человека представляет собой препарат плазмы. Альбумины на 80% обеспечивают коллоидно-онкотическое (КОД) давление плазмы, равное 28 мм рт.ст.
Главная цель применения раствора альбумина человека - нормализовать коллоидно-онкотическое давление крови.
Показаниями к трансфузии раствора альбумина являются снижение общего белка менее 52 г/л и снижение содержания альбумина менее 27 г/л.
Для восполнения дефицита альбумина, обусловленного острой кровопотерей, наиболее показано применение 5% раствора. Разовая доза составляет 200-400 мл.
Плазмозаменители
К плазмозаменителям относятся синтетические коллоидные и кристаллоидные объемозамещающие растворы: растворы желатина, декстраны, растворы гидроксиэтилкрахмалов (ГЭК), растворы полиэтиленгликоля, солевые растворы и растворы сахаров.
Главная цель применения плазмозаменителей при острой кровопотере - восполнить дефицит ОЦК.
Фармакологические свойства плазмозаменителей представлены в табл. 18-3. Одним из важнейших показателей плазмозаменителей является волемический эффект - отношение прироста ОЦК к объему введенного коллоида. Волемический эффект более 100% указывает на переход жидкости из интерстиция в сосудистое русло, менее 100% - на обратный процесс.
Механизм действия любых коллоидов, без учета их специфических свойств, заключается в следующем: происходит улучшение реологических свойств крови за счет гемодилюции, в связи с уменьшением ее относительной вязкости, повышением КОД, дезагрегацией эритроцитов. Каждые 500 мл коллоидов, введенные в/в в течение 15 мин, снижают гематокрит на 4-6%. При гемодилюционном снижении гематокрита менее 28% может развиться гемодилюционная коагулопатия (Барышев Б.А., 2003).
Растворы желатина. Желатина является высокомолекулярным водорастворимым веществом животного происхождения. В сравнении с другими белками не обладает специфичностью, что делает возможным использовать его в качестве кровезаменителя.
К препаратам, созданным на основе желатина, относятся Желатиноль, Модежель, Гелофузин (модифицированный (сукцинилированный) желатин). В сравнительном аспекте первые два препарата обладают более низким волемическим эффектом (Желатиноль 60%, Модежель 40-60%), поэтому их чаще применяют в качестве плазмозамещающих средств при геморрагиях, операционном и травматическом шоке I и II степени, для заполнения аппаратов искусственного кровообращения.
Гелофузин [модифицированный (сукцинилированный) желатин] не оказывает ингибирующего воздействия на первичный и вторичный гемостаз, обладает 100% волемическим эффектом длительностью волемического эффекта 3-4 ч. Разрешенная максимальная суточная доза данного препарата до 200 мл/кг/24 ч, что позволяет использовать его при массивных кровотечениях в объеме до 10-15 л в сутки, а это в конечном итоге приводит к значительному увеличению ОЦК и
СВ.
Гелофузин понижает вязкость крови, это улучшает микроциркуляцию и кислородно-транспортную функцию крови (необходимо следить, чтобы Ht не стал менее 25% и у пожилых менее 30%). Благодаря коллоидно-онкотическому давлению гелофузина, равному 33,3 мм рт.ст., на фоне его применения снижается развитие интерстициальных отеков, он не накапливается в тканях, обладает выраженным детоксикационным эффектом.
Гелофузин выводится 95% почками и 5% кишечником, не оказывает отрицательного воздействия на первичный и вторичный гемостаз, допускается использование при почечной недостаточности.
Таблица 18-3. Фармакологические свойства кровезаменителей на основе желатина, декстрана, гидроксиэтилкрахмала и полиэтиленгликоля (цит. по Б.А. Барышев, 2001)
 Окончание табл. 18-3
Окончание табл. 18-3
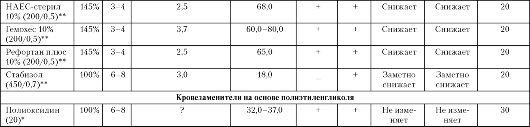 Примечание. * - молекулярная масса, килодальтон; ** - молекулярная масса, килодальтон/степень замещения.
Примечание. * - молекулярная масса, килодальтон; ** - молекулярная масса, килодальтон/степень замещения.
Отмечается двухкратная экономическая выгода гелофузина при аналогичном влиянии на показатели гемодинамики в сравнении с растворами гидроксиэтилкрахмала (ГЭК). Он улучшает микроциркуляцию тканей эффективней, чем препараты ГЭК.
Примечание. 1. При введении 2000-3000 мл гелофузина необходим контроль уровня белка крови. При его снижении ниже 52 г/л требуется проведение коррекции растворами альбумина.
Растворы декстранов. Являются плазмозаменителями (искусственными коллоидами), состоящими из полимеров глюкозы. Известны декстраны со средней молекулярной массой 60 000-70 000 Да (полиглюкин, полифер), и с низкой молекулярной массой 40 000 Да (реополиглюкин, реоглюман, реомакродекс). Среднемолекулярные декстраны нормализуют главным образом показатели макроциркуляции, низкомелекулярные - микроциркуляции.
Примечания.
• Полифер - раствор 6% полиглюкина + 0,015 - 0,020% связанного железа.
• Реоглюман - раствор 10% реополиглюкина + 5% раствор маннитола и 0,9% раствора натрия хлорида.
Среднемолекулярные декстраны (полиглюкин, полифер, зарубежные аналоги: макродекс, интрадекс и другие) являются оптимальными плазмозаменителями для лечения острой кровопотери. Они обладают 120% волемическим эффектом и продолжительностью действия 4-6 ч. Благодаря большой молекулярной массе (60 000-70 000 Да) и высокому коллоидно-осмотическому давлению (КОД) полиглюкин в сосудистом русле притягивает к себе воду и образует стойкое и длительное увеличение ОЦК.
За счет выраженного волемического эффекта полиглюкин эффективно повышает ОЦК, АД, УОС, СВ. Препарат улучшает реологические свойства крови и микроциркуляцию.
Разрешенная безопасная максимальная доза полиглюкина - 20 мл/кг/24 ч, суточная - 1500 мл. Превышение данной дозы может вызвать декстрановый синдром (повреждение легких, почек, гипокоагуляция), возникновение интерстициальной гипергидратации. Продолжительность клинического эффекта - 4-6 ч. Из организма полиглюкин выводится преимущественно почками.
При использовании полиглюкина всегда следует помнить о его волемическом эффекте (120%). При быстром в/в введении полиглюкина возможно формирование перегрузки сосудистой системы за счет осмотического эффекта препарата и форсированного привлечения в сосудистое русло жидкости из интерстициального пространства, поэтому использование данного декстрана должно сочетаться с инфузиями кристаллоидных растворов.
Растворы декстранов занимают первое место среди плазмозаменителей по ингибирующему воздействию на первичный и вторичный гемостаз, что в конечном итоге может вызвать нарушения в системе свертывания крови. Введение декстранов может сопровождаться аллергическими и анафилактическими реакциями и нарушением реологических свойств крови.
Растворы гидроксиэтилкрахмала (ГЭК) являются плазмозаменителями (искусственными коллоидами), полученными из амилопектинового крахмала, и состоящие из полимеризованных остатков глюкозы. В зависимости от средней молекулярной массы, которая колеблется от 200 000 до 450 000 Да, растворы ГЭК подразделяются на две фармакологические группы: пентакрахмалы и гетакрахмалы.
К пентакрахмалам относятся растворы ГЭК с молекулярной массой 200 000 Да и степенью замещения 0,4 (ГЭК 130/0,4, например, волювен), степенью замещения 0,5 (ГЭК 200/05, например, ХАЕС - стерил - 6% и 10%, Гемохес - 6% и 10%, Рефортан - 6% и Рефортан плюс - 10%, Инфукол ГЭК - 6% и 10%).
К гетакрахмалам относятся растворы ГЭК с молекулярной массой 450 000 Да и степенью замещения 0,6-0,8 (ГЭК 450/0,7, например стабизол). Растворы ГЭК 450/0,7, в сравнительном аспекте с ГЭК 130/0,4 и ГЭК 200/05 обладают способностью более долго удерживать воду в сосудистом русле.
Растворы ГЭК нормализуют нарушенную гемодинамику за счет увеличения ОЦК, АД, УОС, СВ; наступающая на фоне их применения гемодилюция улучшает реологические свойства крови за счет снижения Ht, снижается агрегация тромбоцитов, в конечном итоге улучшается доставка и потребление тканями кислорода. Они не высвобождают гистамин, аллергические реакции редки, нет риска инфекции.
Растворы ГЭК оказывают ингибирующее воздействие на первичный и вторичный гемостаз. Продолжительность волемического эффекта растворов ГЭК и максимально безопасные суточные дозы представлены в табл. 18-3.
Солевые растворы (изотонический раствор хлорида натрия, Рингер-лактат, лактасол и др.). Изотонический раствор хлорида натрия был первым препаратом, использованным для лечения кровопотери и дегидратации. Главная цель применения кристаллоидов при лечении острой кровопотери - восполнение дефицита объема интерстициального пространства, а не сосудистого русла.
Каждые 500 мл изоосмолярных электролитов, введенных в/в в течение 15 мин, вызывают 100% волемический эффект. В течение последующих 15 мин 80% перемещается в интерстиций, а 20% воды остается в сосудистом русле, т.е. волемический эффект снижается со 100% до 20% (цит. по Б.А. Барышев, 2003).
Через 3 ч от начала введения изотонический раствор полностью уходит из сосудистого русла. Могут возникнуть отрицательные эффекты при использовании больших объемов солевых растворов: гипергидратация, периферические отеки, отек легких. Введение больших количеств изотонического раствора может вызвать формирование гиперхлоремического ацидоза и повышенное выведения калия из организма.
Растворы сахаров. Включение растворов глюкозы или других растворов сахаров (например, глюкостерил) в протокол инфузионно-трансфузионной терапии при острой кровопотере целесообразно только для профилактики и лечения гипогликемии.
Поддержка внутрисосудистого объема растворами глюкозы неэффективна, а гипергликемия увеличивает неврологический дефицит, способствуя ишемическому повреждению нейронов. Образующаяся свободная вода при метаболизме глюкозы быстро пересекает интерстициальный сектор и проникает в клетки (в том числе головного мозга), вызывая их дополнительную гидратацию.
В критических ситуациях можно использовать струйное в/в введение растворов сахаров для кратковременной коррекции ОЦК.
Показания к использованию плазмозаменителей
В зависимости от степени тяжести кровопотери и выраженности циркуляторных нарушений допустимо использование всех типов синтетических коллоидов.
Основным фактором, лимитирующим объем инфузии синтетических коллоидно-осмотических растворов (КОР), является их модифицирующее воздействие на систему гемостаза. Рациональнее использовать препараты с минимальными гемостазиологическими эффектами - ГЭК 130/0,4, ГЭК 200/0,5 (6% растворы, например, рефортан, стабизол, инфукол, волювер и др.) и модифицированный желатин (4% гелофузин). Допустимо комбинированное использование растворов, в частности рациональна комбинация ГЭК 200/0,5 (например, 10% раствор Инфукола) с модифицированным желатином. Доза и скорость введения препаратов определяются объемом и темпом кровопотери.
При проведении инфузионной терапии необходимо соблюдать максимально безопасные суточные дозы (см. выше).
Основные задачи инфузионной терапии при кровопотерях различной степени тяжести
В патогенезе острой кровопотери первичны гиповолемия и снижение сердечного выброса, а затем анемия и другие патофизиологические сдвиги (см. табл. 18- 1). Это определяет основные задачи инфузионной терапии (см. табл. 18-4).
I (легкая) степень тяжести кровопотери. Основной задачей является восполнение дефицита объема интерстициального пространства, а не сосудистого русла. Достигается сочетанным использованием кристаллоидов и плазмозамещающих растворов (искусственных коллоидов).
II (средняя) степень тяжести кровопотери. Основной задачей является восполнение нормального сердечного выброса для обеспечения перфузии тканей путем устранения дефицита объема жидкости сосудистого русла (дефицит ОЦК). Достигается сочетанным использованием кристаллоидов и плазмозамещающих растворов (искусственных коллоидов).
III (тяжелая) степень тяжести кровопотери. Основной задачей является восстановление кислородно-транспортной функции крови, сердечного выброса, коллоидно-осмотического давления плазмы, факторов свертывания крови. Достигается сочетанным использованием различных форм эритроцитарной массы (донорская эритроцитарная масса; аутоэритроцитарная масса; эритроцитарная масса, обедненная лейкоцитами и тромбоцитами (ЭМОЛТ); размороженная эритроцитарная масса) в сочетании с кристаллоидами и плазмозамещающими растворами (искусственными коллоидами).
IV (крайне тяжелая) степень тяжести кровопотери. Основной задачей является восстановление дефицита факторов свертывания крови. Достигается сочетанным применением СЗП, тромбоцитарной массы и других препаратов, содержащих факторы свертывания крови.
18.8.3. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ КРОВОТЕЧЕНИЯХ В ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
При диагностике кровотеченией на фоне острой патологии органов брюшной полости следует придерживаться следующего алгоритма обследования.
• Установление факта кровотечения.
• Установление источника кровотечения.
Таблица 18-4. Протокол инфузионно-трансфузионной терапии (ИТТ) при острой кровопотере
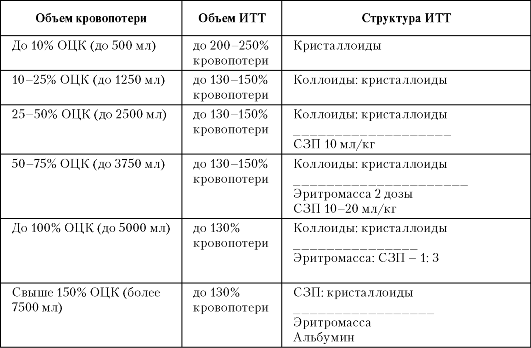 Примечания. Показания для дополнительных трансфузий:
Примечания. Показания для дополнительных трансфузий:
Эритроцитной массы - снижение Hb менее 60-80 г/л или Ht менее 25%, дефицит ОЦК более 40% (>2 000 мл), а также тахикардия, не объясняемая другими причинами, снижение показателей оксигенации (без признаков легочной недостаточности);
СЗП - снижение протромбинового индекса менее 60%, снижение фибриногена менее 0,8 г/л, удлинение ТВ и АЧТВ более чем в 1,8 раза от контрольных показателей;
Альбумина - снижение общего белка менее 52 г/л или альбумина менее 27 г/л;
Концентрата тромбоцитов - снижение числа тромбоцитов менее 50×109/л или же снижение индуцированной агрегации тромбоцитов в половину от нормы. Обычно назначают 1 дозу КТ на 10 кг массы больного.
При составлении протокола инфузионной терапии следует помнить, что при кровопотере любой степени тяжести на первоначальных этапах гипоксия тканей наступает не из-за гемической гипоксии, а в результате циркуляторных нарушений, поэтому объем кровезамещения должен составлять 150-170% по отношению к общей кровопотере. Проведение инфузионной терапии не исключает необходимости остановки кровотечения, обезболивания, применения сосудоактивных и других лекарственных препаратов.
«Переливание крови с целью коррекции анемии не гарантирует улучшения оксигенации тканей, поэтому содержание гемоглобина в крови может быть обманчиво в качестве критерия для назначения гемотрансфузии. При острой кровопотере величина гематокрита отражает проводимую инфузионную терапию, но не является показателем наличия и выраженности кровотечения» (P. Marino, 1998).
• Вид кровотечения.
• Степень кровопотери.
Кровотечения при острой патологии органов живота могут быть трех типов.
• В просвет желудочно-кишечного тракта (ЖКТ).
• В свободную брюшную полость.
• В забрюшинное пространство.
Наиболее частой причиной кровотечений в просвет ЖКТ является язвенная болезнь желудка и двенадцатиперстной кишки - от 55 до 85% всех случаев острых желудочно-кишечных кровотечений (ОЖКК) (В.Т. Зайцев и соавт., 1984; В.Д. Братусь и соавт., 1984; R. Gajo и соавт., 1980, и др.). Варикозное расширение вен пищевода и кардии при портальной гипертензии как источник ОЖКК встречается в 5-18% случаев (В.И. Стручков и соавт., 1977). Кровотечения из распадающихся раковых опухолей пищеварительного канала составляют 8-10% (В.И. Стручков и соавт., 1977). Кровотечения при синдроме Маллори-Вейсса встречаются в 2,5- 7,5% всех случаев ОЖКК (В.Т. Зайцев и соавт., 1989).
Кровотечения в просвет ЖКТ клинически проявляются РВОТОЙ КРОВЬЮ, чаще всего типа «кофейной гущи», И МЕЛЕНОЙ. (Первая характерна для ОЖКК из верхних отделов ЖКТ: пищевод, желудок, двенадцатиперстная кишка. При кровотечениях из нижних отделов ЖКТ: толстый кишечник, прямая кишка, - из заднего прохода может выделяться свежая или малоизмененная кровь).
При оказании неотложной помощи при данной патологии нужно всегда помнить, что угрозу для жизни больного представляет непосредственно само кровотечение, а не вызвавшая его причина; поэтому при проведении интенсивной терапии все должно быть направлено на остановку кровотечения и восполнение
ОЦК.
Что должно вызвать наибольшую настороженность у врача: просто мелена или мелена в сочетании с кровавой рвотой? Бесспорно, сочетание мелены с кровавой рвотой указывает на значительно больший объем и темп кровопотери, чем при изолированной мелене. Истекающая кровь (например, из язвы желудка) не успевает полностью поступить в кишечник, и ее избыток выводится из полости желудка с рвотой, однако это наблюдается не всегда. При высоких источниках кровотечения (например, язва пищевода) возможно наличие кровавой рвоты при незначительных по объему кровотечениях, а при низких источниках (например, постбульбарные язвы) даже обильное кровотечение будет протекать без кровавой рвоты. Кровотечение в полость кишечника чаще всего бывает безболезненным и проявляется меленой только спустя несколько часов. До ее появления на мысль о наличии внутрикишечного кровотечения может навести развитие у больного внезапного обморока, довольно быстро проходящего в горизонтальном положении, особенно с приподнятым ножным концом, однако с долго сохраняющимися признаками циркуляторной недостаточности. Решающим в данном случае может быть лабораторное исследование красной крови, пальцевое исследование прямой кишки.
Кровотечения в свободную брюшную полость наиболее часто возникают при внематочной беременности и разрыве паренхиматозных органов, сосудов брыжейки при травме, разрыве аневризмы брюшного отдела аорты.
Забрюшинные кровотечения встречаются значительно реже вышеуказанных; их возникновение наиболее часто отмечается у больных с травмой забрюшинного пространства, нарушениями свертываемости крови или в результате разрыва
аневризмы брюшного отдела аорты. Кровоизлияния в забрюшинное пространство вызывают иррадиацию болей в спину. Боли по характеру постоянные, нарастающей интенсивности. Если кровоизлияние захватывает поясничные мышцы, боли будут иррадиировать в область передней поверхности бедра и усиливаться при движении.
Неотложные меры при кровотечениях из органов ЖКТ
Как только обнаруживается, что у больного возникла кровавая рвота и/ или мелена, следует начинать проводить комплекс интенсивных мероприятий, направленных на стабилизацию гемодинамики и вывод пострадавшего из состояния декомпенсации по важнейшим параметрам организма.
В большинстве случаев характер кровотечения позволяет на первоначальных этапах лечения применить консервативную гемостатическую терапию. Ее условно можно разделить на общую и местную.
Общая гемостатическая консервативная терапия
Больному назначают строгий постельный режим, запрещают прием воды и пищи, на живот рекомендуется положить пузырь со льдом.
Примечание. Следует знать, что сосудосуживающего эффекта пузырь со льдом не дает, но оказывает дисциплинирующее влияние на больного.
Показаны средства, обладающие гемостатическими и ангиопротективными свойствами. Препаратом выбора для этой цели является дицинон. Гемостатическое действие дицинона (синонимы: этамзилат, циклонамид) при в/в введении начинается через 5-15 мин, максимальный эффект наступает через 1-2 ч, действие длится 4-6 ч и более. Вводят в/в 2-4 мл 12,5% р-ра, затем через каждые 4-6 ч по 2 мл. Можно вводить в/в капельно, добавляя к обычным растворам для инфузий.
В комплекс общих гемостатических мероприятий включают применение внутривенной капельной инфузии 5% раствора эпсилон-аминокапроновой кислоты по 100 мл через каждые 4 ч; 5-10% раствор аскорбиновой кислоты по 1-2 мл в/в, 10% раствора кальция хлорида (до 50-60 мл/24 ч) в/в, в/м введение 1% или 0,3% раствора викасола (соответственно, 1-2 и 3-5 мл).
При массивных кровотечениях теряется большое количество белков, главным образом альбуминов. Инфузионая терапия проводится в соответствие с протоколом, приведенном в разделе Общие принципы инфузионной терапии острых кровотечений.
Примечания.
• Не следует стремиться к быстрому и полному восполнению кровопотери, чтобы не вызвать значительного повышения АД и возобновления кровотечения.
• Хлорид кальция и аскорбиновая кислота не действуют на идущее кровотечение, более целесообразны для профилактических целей.
• Викасол начинает оказывать гемостатический эффект через 12-18 ч после введения в организм.
Местная гемостатическая консервативная терапия
• Простым и доступным, но малоэффективным средством местной гемостатической консервативной терапии является прием кубиков льда per os.
• Местным гемостатическим эффектом при приеме per os, обладают 10% раствор кальция хлорида, 5% раствор эпсилон-аминокапроновой кислоты, 0,2% раствор тромбина и некоторые другие препараты. Можно использовать измельченную гемостатическую губку per os по 1 столовой ложке каждые 1-2 ч.
• В настоящее время широко используется проведение местного гемостаза через эндоскоп в виде диатермокоагуляции, инъекции различных препаратов в подслизистый слой вблизи источника кровотечения, орошения места кровотечения гемостатическими растворами, пленкообразующими препаратами, наложение кровоостанавливающих клемм на кровоточащий сосуд.
Если больной поступает в критическом состоянии, принимающий его врач должен оказать неотложную помощь и после этого или параллельно с проводимым лечением проконсультировать больного у хирурга. До его осмотра и определения окончательного диагноза следует воздержаться от введения больному наркотических препаратов.
18.8.4. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ЛЕГОЧНОМ КРОВОТЕЧЕНИИ
Легочное кровотечение представляет собой выделение сгустков и/или жидкой крови при кашле.
Кровохарканье (гемофтиз) - выделение при кашле мокроты с прожилками крови.
Легочное кровотечение развивается как при непосредственном повреждении сосудов дыхательной системы, так и при осложнении различных заболеваний и травм, протекающих с деструкцией легочной ткани и как следствие поражением сосудов органов грудной клетки. Легочное кровотечение наблюдается при: остром гнойном и хроническом абсцессе легкого, гангренозных деструкциях легочной ткани, бронхоэктатической болезни, хроническом деформирующем бронхите, метапневмоническом фиброзе, одиночных бронхиальных кистах и поликистозе, осложненных нагноением; аневризматическом расширении бронхиальных артерий, склонных к разрыву; при опухолях легочной ткани и их распадах; различных формах туберкулеза легких, особенно в фазе распада; казеозной пневмонии, метатуберкулезном фиброзе, свищевых формах туберкулеза бронхов и лимфатических узлов, раке легкого, полипах и сосудистых опухолях, аспергиллезе, легочном эндометриозе, артериовенозной аневризме, тромбоэмболии ветвей легочных артерий, гипертензии малого круга кровообращения, геморрагических диатезах, вследствие травмы легкого, трахеи и бронхов, аспирированного инородного тела, гнойно-некротических послеоперационных осложнений в культе бронха, варикозном расширении вен гортани и трахеи и др. Легочное кровотечение может развиться как осложнение при заболеваниях, связанных с повышенной кровоточивостью (ДВС-синдром, болезни печени, системы крови и др.).
В зависимости от количества выделенной крови при кашле различают три степени легочных кровотечений (классификация В.И. Стручкова и Л.М. Недвецкой,
1982).
I степень - небольшое выделение до 100 мл крови одномоментно или в течение нескольких часов.
II степень - среднее кровотечение, объем кровопотери из дыхательных путей от 100 мл до 300 мл.
III степень - большое кровотечение, выделение от 300 до 500 мл крови; профузное кровотечение - более 500 мл крови, нередко приводит к смерти от асфиксии кровью.
При оценке количества выделенной крови необходимо учитывать примесь мокроты, слюны, рвотных масс.
Клиническая картина легочного кровотечения аналогична клинике кровотечения из других органов и зависит от объема кровопотери и состояния системы гемостаза больного. Оно развивается внезапно во время кашля, ему может предшествовать кровохарканье, иногда возникает кровоизлияние ртом. Выделяется жидкая алая кровь с пузырьками воздуха, у больного появляются страх, возбуждение, кожные покровы бледные, прохладные на ощупь, возможен холодный липкий пот, развивается одышка, тахикардия, изменение артериального давления зависит от выраженности кровопотери. При аускультации легких выслушиваются крупно- и среднепузырчатые булькающие хрипы на стороне кровотечения. Если поражаются сосуды небольшого калибра, то возможна самостоятельная остановка кровотечения в результате свертывания крови и образования обтурирующего сгустка в дренажном бронхе. Выделение жидкой крови с кашлем прекращается, но продолжается необильное выделение темных сгустков из бронхов здоровых долей легких в течение 1-2 суток. Сгустки крови, оставшиеся в полости бронхов способствуют усилению поражения легочной ткани. В доле легкого, выключенной из вентиляции обтурирующим сгустком крови, развивается ателектазирование с последующим формированием пневмонии, что еще больше усугубляет течение легочной патологии. Сгустки крови являются питательной средой для роста патогенной микрофлоры, что способствует развитию инфекционных осложнений.
Возможен рецидив легочного кровотечения, который характеризуется повторным появлением алой крови при кашле. Тяжелое и профузное кровотечение может привести к развитию геморрагического шока и декомпенсированной анемии.
При развитии легочного кровотечения у больного необходимо провести дифференциальную диагностику источника кровотечения (легочное, носовое, пищеводно-желудочное кровотечение или из ротовой полости), определить объем наружной кровопотери. Необходимо уточить анамнез заболевания, а также наличие и характер сопутствующих заболеваний.
Проведение перкуссии и аускультации малоинформативны для диагностики источника легочного кровотечения, но уточняют диагноз и осложнения. Проведение лабораторных исследований помогает диагностировать наличие кровотечения и оценить систему коагуляции.
Наибольшей информативностью в диагностике причины и источника кровотечения обладают бронхоскопия и рентгенография органов грудной клетки.
При проведении обзорной рентгенографии органов грудной клетки рентгенологическая картина зависит от нозологической формы: наличие обтурационного ателектаза и нарушение структурности корня легкого, деструкция или полость неправильной формы и т.д. Данная методика позволяет диагностировать поздние осложнения легочного кровотечения - крупноочаговую сливную или полисегментарную пневмонию. Детализация рентгенологических изменений осуществляется обычной и компьютерной томографией.
Диагностическую бронхоскопию проводят на высоте кровотечения, и после его остановки. При необильном кровотечении определяют бронх, из которого вытекает кровь: долевой, зональный или сегментарный. При остановленном кровотечении обнаруживают обтурирующий сгусток крови. В случае обильного
кровотечения при бронхоскопии удается установить лишь сторону кровотечения - из правого или левого главного бронха. Выполнение бронхоскопическое исследования возможно фиброволокновой оптикой и жестким бронхоскопом Фриделя. На высоте кровотечения и после состоявшегося кровотечения II, III степени исследование выполняется жестким бронхоскопом Фриделя под общей анестезией, так как это позволяет выполнить временную окклюзию бронха с целью гемостаза. После состоявшегося кровотечения I степени и при кровохарканье допустимо выполнение фибробронхоскопии, но должны быть обеспечены условия для немедленного перехода к ригидной бронхоскопии. При возникновении трудностей в диагностике выполняют контрастное исследование легочных и бронхиальных артерий.
Сложности в диагностике и возможности визуализации источника легочного кровотечения приводят к возникновению трудностей при лечении данного заболевания.
В связи с невозможностью воздействовать непосредственно на кровоточащий сосуд, особенно на догоспитальном этапе и в неспециализированном стационаре, с целью остановки кровотечения следует использовать все известные методы консервативной гемостатической терапии. В качестве гемостатических средств назначают аскорбиновую кислоту (500 мг), дицинон (250-500 мг), кальция хлорид, проводят трансфузию свежезамороженной плазмы (см. раздел 18.8.2. Неотложная помощь при кровопотере). Данные лечебные мероприятия позволяют предупредить развитие рецидива кровотечения. При профузном кровотечении возможно развитие геморрагического шока, лечебные мероприятия по его экстренной коррекции описаны в разделе 18.9.2. Гиповолемический шок.
Для обеспечения эффективного дыхания необходимо восстановить проходимость дыхательных путей, провести санацию ротовой, носовой полостей и трахеобронхиального дерева, обеспечить подачу кислорода больному и при необходимости произвести интубацию трахеи с последующим переводом пострадавшего на ИВЛ (см. главу 20. Общие вопросы реаниматологии).
Для прекращения или уменьшения интенсивности кровотечения необходимо снизить давление в сосудах малого круга кровообращения и артериальное давление до безопасного уровня. На догоспитальном этапе при отсутствии геморрагического шока для уменьшения венозного возврата в правые отделы сердца оптимальным является придание больному полусидячего положения с опущенными ногами и/или наложение жгутов на вены в средней трети бедра продолжительностью 30-50 мин пульс на артериях стопы и подколенной артерии должен быть сохранен).
Снижение легочной гипертензии достигают внутривенным введением эуфиллина, нитроглицерина, ганглиоблокаторов в минимальных дозах под контролем АД. Рекомендуется снижение систолического АД до 110-100 мм рт.ст., особенно у лиц с аневризматическими расширениями бронхиальный артерий.
При психомоторном возбуждении, беспокойстве больного назначают седативную терапию (реланиум и др.).
Интенсивный кашель препятствует остановке легочного кровотечения, поэтому его необходимо уменьшить приемом алкалоидов опия и другими противокашлевыми препаратами, но полностью не купировать, так как выкашливание крови из здоровых бронхов предупреждает возникновение обтурации бронхов и последующего развития пневмонии.
Необходимо оптимизировать этиопатогенетическое лечение основного заболевания легкого.
Больных с легочным кровотечением следует госпитализировать в торакальное отделение. Во время перевозки больной должен лежать на больном боку. Перед транспортировкой необходимо выполнить лечебно-диагностическую бронхоскопию, временную окклюзию кровоточащего бронха стерильной поролоновой губкой, что предупреждает рецидив кровотечения.
В специализированном отделении выполняются: баллонная окклюзия и орошение слизистой оболочки окклюзированного бронха раствором адреналина; эмболизация кровоточащих бронхиальных артерий; эндобронхиальная лазерная фотокоагуляция неоперабельного рака бронха. Методом выбора у операбельных больных является радикальная операция: лобэктомия, билобэктомия и пневмонэктомия. Ограниченное применение имеют пневмоперитонеум, искусственный пневмоторакс и торакопластика (Р.Н. Калашников, 2002).
18.9. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ШОКЕ
18.9.1. ОПРЕДЕЛЕНИЕ ПОНЯТИЯ И КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ШОКОВЫХ СОСТОЯНИЙ
В данном разделе рассматриваются вопросы этиологии, патогенеза, клиники и лечения шоковых состояний.
Основной функцией кровообращения является доставка кислорода к тканям. Для выполнения этой задачи необходимыми условиями являются:
• нормальная нагнетательная функция сердца, обеспечивающая объем кровотока, отвечающий потребностям организма, как в состоянии покоя, так и в экстремальных условиях;
• артериальная и венозная сосудистая сеть, способная менять свою емкость, благодаря чему регулируется приток крови к различным органам и системам;
• должный объем циркулирующей крови при достаточном насыщении гемоглобина кислородом.
Любое значительное нарушение даже одного из указанных компонентов кровообращения будет сопровождаться неадекватной перфузией и недостаточным поступлением кислорода в ткани, что в конечном итоге может вызвать развитие шока.
Шок (от англ. shock - удар, сотрясение) представляет собой условное понятие, обозначающее целый ряд синдромно сходных клинических состояний, характеризующихся гипотензией, критическим снижением кровотока в тканях (гипоперфузия), развитием гипоксии тканей и гипотермией.
Примечание. Для облегчения запоминания: шок - мнемонически это правило четырех букв Г: Гипотензия, Гипоперфузия, Гипоксия (тканей) и Гипотермия.
Учитывая бесспорное первостепенное значение системы кровообращения в патогенезе любого шока, всю систему макроциркуляции можно условно разделить на три составные части: сердце, сосуды, кровь - и рассмотреть отдельно каждую из этих составляющих (рис. 18-6).
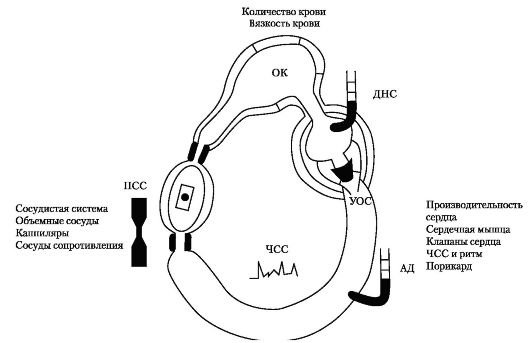 Рис. 18-6. Схема системы макроциркуляции
Рис. 18-6. Схема системы макроциркуляции
I. Сердце
Его производительность определяют следующие факторы: состояние сердечной мышцы, клапанов, число сердечных сокращений (ЧСС) и ритм, состояние перикарда и величина венозного возврата, а также периферическое сосудистое сопротивление (ПСС) для правого и левого желудочков. Благоприятное сочетание данных факторов определяет нормальную производительность сердца, в основе которой лежит УДАРНЫЙ ОБЪЕМ СЕРДЦА (УОС = 50-80 мл) и производная от него величина - МИНУТНЫЙ ОБЪЕМ СЕРДЦА [МОС, синоним - СЕРДЕЧНЫЙ ВЫБРОС (СВ)] (МОС = УОЧЧСС, норма 3-6 л). Важным показателем, определяющим адекватность работы сердца, является конечное диастолическое давление в левом желудочке (синоним - ДАВЛЕНИЕ НАПОЛНЕНИЯ СЕРДЦА (ДНС) - давление крови в момент окончания диастолического наполнения полостей сердца. При патологических состояниях любой из вышеперечисленных факторов, определяющих работу сердца, может меняться как в отдельности, так и в совокупности, что в конечном итоге ведет к нарушению его нормальной производительности.
II. Сосуды
• Сосуды системы кровообращения условно можно подразделить на пять видов. Сосуды-буферы, или артерии. Их функция преимущественно пассивная и
заключается в транспортировке крови от сердца к системе микроциркуляции.
Следует подчеркнуть, что артерии практически не меняют своего просвета
при любых, даже экстремальных ситуациях в организме.
• Сосуды-емкости, или вены. Они выполняют транспортную функцию возврата крови к сердцу с периферии. Это более активная, чем артерии, система кровообращения, способная при различных условиях изменять свой объем во много раз.
• Сосуды распределения (сопротивления) - это артериолы и венулы. Они регулируют кровоток через КАПИЛЛЯРОН (структурная единица системы микроциркуляции) и являются главным физиологическим средством распределения сердечного выброса по органам и тканям.
• Сосуды обмена - капилляры. Они производят присоединение системы кровообращения непосредственно к органам и тканям.
• Сосуды-шунты. Это артериовенозные анастомозы, регулирующие периферическое сопротивление при спазме артериол сокращением кровотока через капилляры.
Три первых функциональных части кровообращения (сердце, сосуды-буферы и сосуды-емкости) образуют систему МАКРОЦИРКУЛЯЦИИ - хорошо видимую и поэтому кажущуюся самой главной в кровообращении. Задача данной системы - обеспечить транспорт крови. На самом же деле в клинико-физиологическом аспекте гораздо важнее знать о состоянии системы микроциркуляции, состоящей из сосудов распределения (артериолы и венулы), сосудов обмена и сосудов-шунтов. Если считать СЕРДЕЧНЫЙ ВЫБРОС главным показателем адекватности работы сердца (а это бесспорно), то любые расстройства кровообращения можно легко увязать с его изменениями.
Патологические синдромы на уровне макроциркуляции
На уровне макроциркуляции можно выделить пять клинических синдромов.
• Острая недостаточность кровообращения - синдром, характеризующийся снижением сердечного выброса независимо от венозного возврата.
• Острая сердечная недостаточность - синдром, характеризующийся снижением сердечного выброса при нормальном или даже повышенном венозном возврате.
• Острая сосудистая недостаточность - синдром, характеризующийся нарушением венозного возврата из-за увеличения емкости сосудистого русла.
• Обморок - синдром, характеризующийся потерей сознания в результате кратковременного нарушения кровоснабжения мозга, вызванного острой сосудистой недостаточностью.
• Коллапс - остро развивающаяся сосудистая недостаточность, характеризующаяся прежде всего падением сосудистого тонуса и относительным уменьшением ОЦК.
Методы контроля системы макроциркуляции
• Артериальное давление. Измерение АД является наиболее распространенным и самым простым методом контроля гемодинамики, однако при работе по данной методике следует помнить, что получаемая информация отражает состояние самой пассивной части кровообращения - состояние артерий, в то время как вены - самая активная часть кровообращения, выпадают из поля зрения. Динамическое измерение АД у тяжелобольных не дает представления о состоянии гемодинамики в целом, но несет объективную информацию о динамике патологического процесса.
Следует помнить, что компенсаторные механизмы организма способны достаточно долго удерживать системное артериальное давление на уровне, близком к норме; снижение АД при шоковых состояниях всегда происходит уже после существенных патофизиологических сдвигов.
• Центральное венозное давление (ЦВД) - это по своей сути есть измерение давления в правом предсердии. Норма 60-120 мм водного столба. В процессе работы с больными важны не столько абсолютные величины, сколько их динамика. Низкое ЦВД, как правило, указывает на несоответствие объема крови емкости сосудистого русла. Высокое ЦВД возможно при гиперволемии (избыточная трансфузия) и при несостоятельности сердца как насоса (острая или хроническая сердечная недостаточность). В первом варианте сердечный выброс будет повышен, во втором снижен.
• Наиболее точную информацию о состоянии центральной гемодинамики дает определение конечного диастолического давления в левом желудочке. Это важный показатель функционального состояния сердца, быстро реагирующий на все изменения в организме. Данную величину можно определять как инвазивными (при помощи катетеризации левых отделов сердца), так и неинвазивными методами, однако длительное пребывание катетера в левом желудочке нежелательно в связи с высокой вероятностью развития осложнений, в первую очередь нарушений ритма, поэтому на практике о величине конечного диастолического давления и производных от него величин судят по косвенному показателю - величине давления заклинивания в легочных капиллярах (ДЗЛК). При отсутствии выраженных органических изменений легочных сосудов, стеноза левого атриовентрикулярного отверстия, резкой гипоксии и ацидоза диастолическое (конечное) давление в легочной артерии и «заклинивающее» легочно-капиллярное давление не отличаются от среднего давления заполнения левого желудочка более чем на 1-2 мм рт. ст. и обычно превышают среднее диастолическое давление в левом желудочке на 2-6 мм рт.ст.
Примечание. Для определения ДЗЛК после пункции и катетеризации v. subclavia с правой стороны в легочную артерию вводят специальный «плавающий» катетер Сван-Ганса, на дистальном конце которого имеется баллончик и специальный датчик. Баллончик раздувают до тех пор, пока не наступает прекращение кровотока в легочной артерии. В итоге образуется столб крови между концом катетера и левым предсердием, а давление с двух концов столба будет равным. Давление в конце катетера при этом равно давлению в левом предсердии (Р. Marino, 1998).
Нормальные величины давления в левом желудочке (LVP)
Пиковое давление (LVSP) - 100-140 мм рт.ст.
Среднее давление (LVMP) - 33-48 мм рт.ст.
Диастолическое давление (LVDP) - 0-2 мм рт.ст.
Конечное диастолическое давление (КДД, LVEDP) - 1-12 мм рт.ст.
Нормальные величины давления в легочной артерии (PAP)
Пиковое давление (PAPs) - 25-30 мм рт.ст. Диастолическое давление (PAPd) - 10-15 мм рт.ст. Среднее давление (PAPm) - 17-23 мм рт.ст. Система микроциркуляции
Общая протяженность капиллярного русла у взрослого человека превышает 100 000 км. Функциональная задача системы микроциркуляции - регуляция распределения сердечного выброса соответственно потребностям органов и присоединение сосудистой циркуляции к общему водно-электролитному обращению. Структурной единицей системы микроциркуляции является КАПИЛЛЯРОН, состоящий из артериолы, венулы, капилляров и артерио-венозного анастомоза.
Органный капиллярный кровоток зависит от уровня изгоняющего давления, просвета артериол (в свою очередь зависящего от сосудистого тонуса как сопротивления органному кровотоку) и реологических свойств крови.
Кроме этого, существует два физиологических механизма, регулирующих кровоток через капиллярон: изменение тонуса сосудов и проницаемости капиллярной стенки.
Гипоксия, респираторный и метаболический ацидоз могут влиять на эти механизмы непосредственно или через определенные вещества. Накопление кислых продуктов вызывает вазодилатацию с увеличением кровотока через капиллярон, благодаря чему ацидоз снижается, так как избыток кислых продуктов удаляется.
Специфическим сосудорасширяющим действием обладают некоторые вещества, образующиеся непосредственно в тканях: брадикинин, гистамин, лактат, пируват, адениловая и инозиновая кислоты, ферритин и др.
Говоря о системе микроциркуляции, нужно помнить о так называемой вазомоции - физиологическом, периодическом прекращении и возобновлении тока крови в капиллярах. Одновременно в организме в условиях покоя «работает» 10% всех капилляров.
Методы контроля системы микроциркуляции
Состояние системы микроциркуляции характеризуют множество параметров, с которыми можно ознакомиться в специальной литературе. Приводим один из важнейших: Индекс общего периферического сопротивления сосудов [ИОПСС, синоним: периферическое сосудистое сопротивление (ПСС)]. Этот показатель характеризует общее сопротивление всей сосудистой системы выбрасываемому сердцем потоку крови (Р. Marino, 1998).
ИОПСС [дин × с/(см5Хм2)] = (САД - ЦВД)/СИ × 80
САД - среднее АД, мм рт.ст.
ЦВД - центральное венозное давление.
СИ - сердечный индекс. Этот показатель получается в результате деления сердечного выброса, определенного методом термодилюции, на величину площади поверхности тела:
СИ [л/(мин × м 2)] = СВ/площадь поверхности тела, где СВ - сердечный выброс (МОС) в л/мин.
Коэффициент 80 переводит давление и объем в дин×с/см 5.
Примечание. Данный показатель (ИОПСС) рассчитывается на основании информации, полученной при помощи катетера, введенного в легочную артерию, или при помощи неинвазивных функциональных методов исследования, например, тетраполярной грудной реовазографии.
Симптом белого пятна. Показателем, отражающим состояние системы микроциркуляции, является время капиллярного наполнения, которое в норме состав-
ляет, не более 2 с. Для его определения необходимо произвести пальцевое нажатие на кожу в области грудины или лба в течение 5 с, затем прекратить надавливание и зафиксировать время, за которое кожные покровы восстановят свой первоначальный цвет. Этот показатель называют также симптомом бледного пятна, и хотя он не является ни специфическим, ни чувствительным критерием шока, в совокупности с данными ЧСС и уровня АД он позволяет диагностировать шок и определить его стадию. При декомпенсированном шоке время капиллярного наполнения может составлять 6-8 с. Повторное определение данного показателя во время терапии шока позволяет судить о ее эффективности или о потребности в дополнительной коррекции.
Нарушения микроциркуляции
Механизмы нарушения микроциркуляции едины для всех видов шока. Периферическая вазоконстрикция как ответная реакция на уменьшение МОС блокирует капиллярный кровоток спазмом пре- и посткапиллярного сфинктеров, в результате чего гидростатическое давление в капиллярах уменьшается. Это вызывает переход жидкости из интерстиция в сосуды системы микроциркуляции. При уменьшении капиллярного кровотока нарушается доставка кислорода и энергетических субстратов к тканям и выведение отработанных продуктов жизнедеятельности, что способствует формированию ацидоза. Закисление в капилляроне способствует снятию спазма прекапиллярного сфинктера при сохраненном высоком тонусе его посткапиллярного отдела. Кровь начинает свободно поступать в систему микроциркуляции, но ее отток нарушен. Повышается внутрикапиллярное давление, плазма крови начинает пропотевать в интерстиций, развивается агрегация, а в последующем - стаз форменных элементов крови и далее сладж-синдром. С микротромбоза в системе капилляров, в свою очередь, начинается развитие грозного осложнения - диссеминированного внутрисосудистого свертывания (ДВС-синдрома).
Важнейшие клинические критерии расстройств микроциркуляции
• Уменьшение диуреза до 0,5 мл/мин (менее 30 мл/ч).
• Возрастание температурного градиента между кожей и прямой кишкой более 2 °С.
• Наличие метаболического ацидоза.
• Симптом «белого пятна» более 2 с, мраморность кожи. III. КРОВЬ
Основные функции крови: транспорт кислорода, питательных веществ, гормонов, регуляция водно-электролитного обмена и кислотно-щелочного состояния, и теплового равновесия. ДЛЯ НОРМАЛЬНОЙ ФУНКЦИИ СЕРДЦА ПРЕЖДЕ ВСЕГО НЕОБХОДИМ ДОЛЖНЫЙ ОБЪЕМ ЦИРКУЛИРУЮЩЕЙ КРОВИ.
Дефицит объема (гиповолемия) - наиболее частая причина шока. Избыток жидкости в сосудистом русле называется гиперволемией.
Состав крови определяет ее реологические свойства. Реологические свойства крови зависят от ВЯЗКОСТИ (она зависит от концентрации БЕЛКА в плазме и
ГЕМАТОКРИТА) и СКОРОСТИ тока крови.
Основным феноменом реологических расстройств крови является агрегация эритроцитов, совпадающая с повышением вязкости. В основе этого явления, как правило, лежит замедление кровотока. Агрегация эритроцитов может быть как
ложной, так и истинной, в дальнейшем порождающей явления сладжа (английское слово sludge можно перевести как «отстой»). Агрегация «закрывает» капиллярон, и участок ткани, который он снабжает кровью, становится ишемизированным.
Всякое нарушение кровотока в системе микроциркуляции проходит четыре этапа.
• Нарушение реологических свойств крови (агрегация).
• Секвестрация крови.
• Гиповолемия.
• Генерализованное поражение микроциркуляции и метаболизма. Секвестрация - скопление крови в капилляроне и выключение его из общего
кровотока. Отличие секвестрации от депонирования заключается в том, что физико-химические свойства крови в депо не нарушены и выброшенная из него кровь немедленно годится в употребление. Секвестрированная же кровь должна пройти через легочно-капиллярный фильтр. Там она не только очищается от агрегатов клеток, капель жира, активных полипептидов и др. опасных метаболитов, но и нормализуются ее свертывающие свойства, белковый состав и т.д. Принципы терапии нарушений реологических свойств крови.
• Инфузионная терапия с целью восполнения дефицита жидкости.
• Увеличение скорости кровотока.
• Использование антикоагулянтов и антиагрегантов.
Классификация шоковых состояний
В соответствии с современными понятиями об основных этиологических и патогенетических факторах развития шока его можно отнести к одной из четырех категорий в зависимости от нарушения того или иного компонента кровообращения.
• Гиповолемический шок.
• Кардиогенный шок.
• Сосудистый шок (шок, связанный с пониженной резистентностью сосудов).
• Обструктивный шок (в основе его развития лежит наличие препятствия кровотоку в систему макроциркуляции, что наблюдается при напряженном пневмотораксе, гидротораксе, гемотораксе, тампонаде перикарда, ТЭЛА).
Разновидностями гиповолемического шока являются геморрагический, травматический, ожоговый и ангидремический (дегидратационный) шоки. К сосудистым видам шока относятся септический, анафилактический, нейрогенный, адреналовый, экзотоксический и бактериально-токсический шоки.
Примечание. В свою очередь, каждый из этих видов шока имеет свою клиническую классификацию. При травматическом шоке часто используют классификацию В.К. Гостищева (1993), при гиповолемическом шоке - классификацию Н.М. Федоровского (2002), в кардиологии общепризнана классификация кардиогенного шока Е.И. Чазова (1969), и т.д.
Клинические признаки шокового состояния
Синдромный диагноз «шок» ставят больному при наличии острого нарушения функции кровообращения, которое проявляется следующими симптомами:
• холодная, влажная, бледно-цианотичная или мраморная кожа;
• увеличение времени капиллярного наполнения более 3 с;
• затемненное сознание;
• диспноэ;
• олигурия;
• тахикардия;
• уменьшение артериального и пульсового давления.
В тех случаях, когда у больного имеются бесспорные признаки кровопотери, но еще отсутствует гипотензия, нужно решить вопрос, развился шок или нет. В данной ситуации удобно пользоваться патогенетической классификацией Г.А. Рябова (1979). Исходя из патогенеза, автор предлагает выделять три стадии в развитии гиповолемического (геморрагического) шока (табл. 18-5). Данная классификация
Таблица 18-5. Патогенетическая классификация, основные клинические симптомы
и компенсаторные механизмы гиповолемического шока (по Г.А. Рябову, 1979)
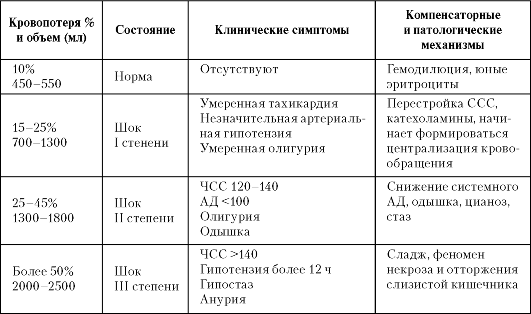 остается актуальной и по сей день.
остается актуальной и по сей день.
Шок первой стадии - компенсированный обратимый шок (синдром малого выброса).
Шок второй стадии - декомпенсированный обратимый шок. Шок третьей стадии - необратимый шок.
Острая кровопотеря в объеме до 500 мл у взрослого человека протекает практически бессимптомно и при отсутствии серьезной сопутствующей патологии не требует лечения.
При шоке ПЕРВОЙ СТАДИИ организм хорошо компенсирует острую кровопотерю физиологическими изменениями деятельности ССС. Сознание полностью адекватное, иногда отмечается некоторое возбуждение. При осмотре обращают на себя внимание незначительная бледность кожных покровов и наличие запустевших, нитевидных вен на руках. Верхние и нижние конечности на ощупь прохладные. Пульс слабого наполнения, умеренная тахикардия. АД несмотря на снижение
сердечного выброса остается в пределах нормы, а иногда даже отмечается его увеличение. ЦВД на уровне нижней границы нормы или ниже, умеренная олигурия. Незначительные признаки субкомпенсированного ацидоза. С патогенетической точки зрения, первую стадию шока можно расценивать как начало формирования централизации кровообращения.
Для шока ВТОРОЙ СТАДИИ ведущим клиническим симптомом является снижение системного давления. В основе этого явления лежит истощение возможностей организма при помощи спазма периферических сосудов компенсировать малый сердечный выброс. В результате нарушения кровоснабжения сердца падает его сократительная способность. Это в еще большей степени нарушает органную перфузию и усиливает ацидоз. В системе микроциркуляции развивается стаз. Клинически вторая стадия проявляется спутанностью сознания, компенсаторной тахикардией (ЧСС 120-140 в 1 мин) и одышкой, низким пульсовым АД, венозной гипотонией, низким или отрицательным ЦВД. Причиной появления одышки является метаболический ацидоз и формирующийся респираторный дистресссиндром. Прогностически плохими предвестниками в данной стадии шока является появление у больного акроцианоза на фоне общей бледности в сочетании с гипотонией и олигоанурией.
Шок ТРЕТЬЕЙ СТАДИИ возникает при быстрой потере 40-50% ОЦК или при некомпенсированной в течение нескольких часов потере меньшего объема крови. С точки зрения патогенеза, принципиальным отличием третьей фазы шока от второй является переход стаза в системе микроциркуляции в сладж-синдром. Это сопровождается, помимо начала первой фазы ДВС-синдрома, феноменом некроза и отторжения слизистой оболочки кишечника. В основе данного явления лежит переполнение сосудов кишечника кровью, выходом плазмы в интерстиций и последующим отторжением. Клинически состояние больного характеризуется как крайне тяжелое. Сознание отсутствует. Отмечаются резкая бледность кожных покровов, холодный пот, низкая температура тела, олигоанурия. Пульс на периферии определяется с большим трудом или вообще отсутствует, ЧСС более 140, АД менее 60 мм рт.ст. или совсем не определяется.
Вышеприведенная патогенетическая классификация шока (Г.А. Рябов, 1979) с успехом используется и в настоящее время. В частности, в книге: Ю.П. Бутылин, В.Ю. Бутылин, Д.Ю. Бутылин. «Интенсивная терапия неотложных состояний», авторами используется данная классификация.
Однако кроме патогенетической классификации в повседневной работе используются и клинические классификации шока, в частности травматического и гиповолемического.
Критерии контроля шока
В качестве экспресс-диагностики шока можно использовать определение «шокового индекса» (ШИ) - это отношение частоты сердечных сокращений за 1 мин к величине систолического давления (П.Г. Брюсов, 1985).
Нормальная величина ШИ = 60/120 = 0,5
Примечание. 60 - ЧСС в 1 мин, 120 - нормальная величина систолического АД в мм рт.ст.
При шоке I степени (кровопотеря 15-25% ОЦК) ШИ=1 (100/100).
При шоке II степени (кровопотеря 25-45% ОЦК) ШИ=1,5 (120/80).
При шоке III степени (кровопотеря более 50% ОЦК) ШИ=2 (140/70).
В диагностике шока на первоначальном этапе используют общедоступные клинические тесты, на втором - лабораторные и специальные методы исследования. В конечном итоге контроль направлен на выяснение механизмов возникновения шока, определения его глубины и эффективности проводимых мер при помощи анализа показателей, представленных в виде двух групп: «давление/кровоток» и «транспорт О2» (см. выше), а какой классификацией шока пользоваться, не имеет принципиального значения.
Для адекватного лечения необходимо осуществлять постоянный контроль за состоянием сознания, температурой и цветом кожных покровов, ЦВД, АД, МОС, УО, ОЦК, ЧСС и ритмом, кислотно-щелочным и водно-электролитным состоянием, вязкостью крови и гематокритом, почасовым диурезом и плотностью мочи, свертывающей системой крови, функцией легких, основными биохимическими параметрами, определением температурного градиента между кожными покровами и прямой кишкой и т.д. Вообще по данному разделу можно сказать, что здесь предела нет и быть не может. Очень многое в объеме исследований зависит от уровня оснащенности конкретного лечебного учреждения. При умелом подходе к вопросам оценки полученной информации можно обойтись минимумом, и, в то же время, самые совершенные методы исследования, выполненные по расширенной программе, не помогут больному, если врач не может их правильно интерпретировать.
18.9.2. ГИПОВОЛЕМИЧЕСКИЙ ШОК
Ведущим признаком большинства видов шока является абсолютный или относительный гиповолемический синдром. Абсолютная гиповолемия наблюдается при явной или скрытой потере крови, потере жидкости через ЖКТ, почки (ангидремический шок) и кожу при ожоговом шоке, а также на фоне синдрома капиллярной утечки, максимальная выраженность которого наблюдается при септическом шоке. Относительная гиповолемия возникает при внезапном увеличении емкости сосудистого русла, что наблюдается при сосудистых видах шока в результате падения сосудистого тонуса. Обычно патогенез гиповолемического шока рассматривают на примере геморрагического шока.
Пусковым механизмом в развитии гиповолемического шока является синдром малого выброса, формирующийся в ответ на снижение венозного возврата (рис. 18-7). Данный вид шока развивается, как правило, не столько в связи с уменьшением ОЦК, сколько в результате интенсивности кровопотери. При кровопотере до 10% от ОЦК (это примерно до 500 мл крови) организм за счет моторики венозного русла (в нем в норме содержится до 70% объема крови, в артериях - 15%, в капиллярах - 12% и в камерах сердца - 3%) довольно успешно справляется с данной ситуацией, давление наполнения (ДН) правых отделов сердца остается в пределах нормы, ЦВД держится на должном уровне, ударный объем (УО) не страдает. При потере более 10% от ОЦК, приток крови с периферии в малый круг начинает уменьшаться, ДЗЛК уменьшается, ДН правых отделов сердца падает, ЦВД становится ниже нормы, вследствие этого снижается УО.
Данный патологический сдвиг компенсируется тахикардией (уменьшение ОЦК на 10% и более резко стимулирует функцию надпочечников, а КА через воз-
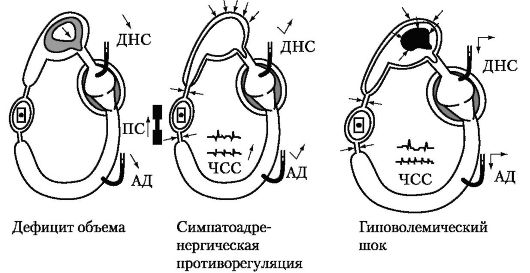 Рис. 18-7. Патогенез гиповолемического шока
Рис. 18-7. Патогенез гиповолемического шока
действие на β-рецепторы сердца, вызывают увеличение ЧСС), в результате чего МОС возрастает. При истощении компенсаторных механизмов (это проявляется уменьшением венозного возврата на 25-30%) УО уменьшается ниже критической величины и развивается СИНДРОМ МАЛОГО ВЫБРОСА. Он частично купируется компенсаторной тахикардией и вазоконстрикцией. (В основе вазоконстрикции, так же как и увеличения ЧСС, лежит массивный выброс катехоламинов: непосредственно после кровопотери их уровень в крови возрастает в 50-100 раз). Поскольку периферический спазм неравномерен (см. выше: Действие катехоламинов на систему микроциркуляции), кровоток перераспределяется: за счет резкого сокращения перфузии всех органов и систем, на фоне значительно возрастающего ОПСС, организму некоторое время удается поддержать кровоснабжение сердца и головного мозга на приемлемом для жизни уровне. Данный феномен называется ЦЕНТРАЛИЗАЦИЕЙ КРОВООБРАЩЕНИЯ. Само по себе это явление можно расценивать как биологически целесообразную реакцию, необходимую организму для проведения компенсаторных изменений с целью нормализации состояния внутренней среды за счет перераспределения объемов водных секторов. Однако если организм самостоятельно не в силах справиться с кровопотерей, то вазоконстрикция на фоне затянувшегося синдрома малого выброса приводит к глубокой гипоксии тканей с неизбежным развитием АЦИДОЗА (при гипоксии, вызванной значительной кровопотерей, потребности организма в кислороде покрываются приблизительно на 50%).
При шоковом состоянии происходят значительные нарушения водно-электролитного равновесия. Под влиянием ацидоза развивается постепенная потеря тонуса прекапиллярного сфинктера, на фоне сохранившегося тонуса посткапиллярной части капиллярона. Прекапиллярный сфинктер перестает реагировать даже на высокие концентрации эндогенных катехоламинов (КА). Повышение гидростатического давления в сочетании с повышенной проницаемостью сосудистой стенки способствует переходу воды и электролитов в интерстиций. Повышается вязкость крови, возникает ее стаз, а в последующем и сладж, что вызывает возникновение коагулопатии.
При гиповолемических состояниях из разрушенных лейкоцитов и поврежденных тканей выделяются протеолитические ферменты и попадают в плазму
крови. Под их влиянием пептиды, имеющие своим источником α-глобулиновую фракцию сыворотки крови (такие, как ангиотензин, брадикинин)2, активируются и начинают оказывать угнетающее действие на миокард. Сумма этих активных пептидов называется фактор MDF (myocardial depressant factor).
В условиях нормальной оксигенации абсолютное большинство энергии (98%) вырабатывается в цикле Кребса (цикл трикарбоновых кислот). При гипоксии данный процесс нарушается и выработка энергии начинает сопровождаться накоплением большого количества лактата, недоокисленных аминокислот и жирных кислот, что вызывает развитие метаболического ацидоза. Гипоксия в сочетании с ацидозом вызывает выход ионов калия из клетки и вход в нее воды и ионов натрия, что еще более нарушает ее биоэнергетику.
Заключение. В основе гиповолемического (геморрагического) шока лежит острое снижение объема циркулирующей жидкости (ОЦЖ). В результате уменьшения ОЦЖ падает УОС, снижается давление наполнения правых отделов сердца, уменьшается ЦВД и АД. В ответ на экстремальное воздействие организм отвечает массивным выбросом в кровоток КА, они, в свою очередь, через стимуляцию β-рецепторов сердца вызывают увеличение ЧСС, а через воздействие на α-рецепторы, заложенные в стенках кровеносных сосудов, вызывают их констрикцию. В то же время адреналин расширяет сосуды сердца и головного мозга, что в сочетании с увеличенной ЧСС обеспечивает приемлемый для жизни уровень кровоснабжения этих двух жизненно важных органов. Формируется ЦЕНТРАЛИЗАЦИЯ КРОВООБРАЩЕНИЯ. Если данное состояние держится более нескольких часов, в системе микроциркуляции развивается МЕТАБОЛИЧЕСКИЙ АЦИДОЗ. Шоковое состояние сопровождается нарушением нормальной энергетики, накоплением ЛАКТАТА, дизэлектремией, возникновением коагулопатии.
Н.М. Федоровский приводит нижеследующую классификацию гиповолемического шока.
«В зависимости от степени тяжести различают 4 стадии шока:
I (легкая степень) - снижение систолического АД до 100-90 мм рт.ст., тахикардия до 100-110 в минуту, шоковый индекс 1,0-1,1;
II (средняя степень) - снижение систолического АД до 80-70 мм рт.ст., тахикардия до 120-130 в минуту, шоковый индекс 1,5;
III (тяжелая степень) - систолическое АД ниже 70 мм рт.ст., тахикардия свыше 140 в минуту, шоковый индекс более 2, кровопотеря более 20% ОЦК;
IV (крайне тяжелая степень) - АД ниже 60 мм рт.ст., тахикардия более 140 в минуту, шоковый индекс более 2, кровопотеря 40-50% ОЦК».
Ключевыми звеньями в гиповолемического шока являются низкий СВ, низкое ДЗЛК, высокое ОПСС, что в конечном итоге вызывает неадекватную оксигенацию тканей.
Принципы лечения гиповолемического шока
Напомним основные патофизиологические характеристики шока:
• абсолютный или относительный дефицит ОЦК;
• низкий СВ;
• низкое ДЗЛК;
• симпатоадреналовая реакция;
• высокое ОПСС;
• расстройство насосной функции сердца;
• гипоксия клеток в сочетании с ацидозом и накоплением лактата.
В аспекте этих положений, лечение шоковых состояний должно включать оказание помощи по жизненным показаниям и целенаправленное воздействие на основные патогенетические звенья:
• немедленная остановка кровотечения, при необходимости адекватное обезболивание;
• обеспечение венозного доступа и проведение адекватной инфузионной терапии;
• лечение острой дыхательной недостаточности, нормализация доставки О2 и метаболизма тканей;
• постоянная инсуффляция кислорода с его содержанием во вдыхаемой смеси 35-45% (поток кислорода 3-5 л/мин);
• лечение острой сердечной недостаточности;
• катетеризация мочевого пузыря с целью контроля диуреза;
• нормализация СВ, ДЗЛК, ОПСС.
Абсолютный или относительный дефицит ОЦК устраняется инфузионной терапией, направленной на устранение гиповолемии, под контролем СВ, ДЗЛК, ОПСС, ЦВД и почасового диуреза. Всегда нужно помнить, что при шоковых состояниях возможна рефлекторная остановка сердца - «синдром пустого сердца», поэтому с первых этапов лечения, пока еще не установлен точный диагноз и не определен дефицит ОЦК, необходимо быстро обеспечить венозный доступ (допускается катетеризация двух и более периферических вен) и наладить струйное переливание жидкостей.
Основной целью проводимой при шоке инфузионной терапии является устранение абсолютной или относительной гиповолемии, а также восстановление интерстициального водного сектора. Инфузионная терапия гиповолемического шока включает в себя использование кристаллоидов, коллоидов и препаратов крови.
К кристаллоидам относятся растворы, содержащие воду и электролиты, из которых основным является натрий. Известно, что в организме натрий содержится преимущественно в экстрацеллюлярном пространстве, при этом 80% экстрацеллюлярного натрия находится во внесосудистом секторе, поэтому большая часть переливаемых растворов хлорида натрия поступает в интерстициальный сектор и только 20% задерживается в сосудистом русле. Таким образом, кристаллоидные растворы предназначены прежде всего для восполнения интерстициального пространства. Потеря жидкости интерстициального сектора наблюдается в начальных стадиях гиповолемического шока, и ее восполнение с помощью кристаллоидных растворов является исходной целью проводимой инфузионной терапии. К кристаллоидным растворам относится физиологический раствор хлорида натрия, раствор Рингера, а также многокомпонентные растворы, такие, как Лактосол, Трисоль, Ацесоль и др. Стандартным кристаллоидным раствором является изотонический раствор хлорида натрия, который содержит 9 г хлорида натрия на 1 л раствора и имеет осмолярность 308 ммоль/л, а рН 5,7, в связи с чем инфузия больших объемом физиологического раствора может привести к развитию гиперхлоремического метаболического ацидоза. Терапию большинства видов шока следует начинать с внутривенного болюсного введения 20 мл/кг физиологического раствора в течение 20 мин с последующей оценкой основных показателей центральной и периферической гемодинамики (ЧСС, АД, время капиллярного наполнения) и решением вопроса о назначении второго болюса при отсутствии
нормализации данных параметров.
При необходимости быстрой начальной коррекции гиповолемии в условиях ограниченности медицинских ресурсов (догоспитальная помощь) могут использоваться малые объемы гипертонических растворов. Так, внутривенное введение в течение 2 мин 4 мл/кг 7,5% раствора хлорида натрия на 30 мин стабилизирует АД, что позволяет доставить пациента в стационар и затем продолжить инфузионнотрансфузионную терапию.
К коллоидам относятся растворы высокомолекулярных органических соединений, не способных в нормальных условиях проникать через стенку сосудов и обладающих способностью привлекать и удерживать воду в сосудистом русле, тем самым увеличивая объем циркулирующей жидкости. К коллоидам относятся 5% и 25% раствор альбумина, 6% и 10% раствор гидроксиэтилкрахмала, декстраны (Полиглюкин, Реополиглюкин), растворы желатиноля. Наиболее выраженным плазмоэкспандерным действием обладает 25% раствор альбумина, коллоидноосмотическое давление которого составляет 70 мм рт.ст. После переливания 100 мл данного раствора объем циркулирующей плазмы увеличивается на 500 мл. Однако в связи с потенциальным риском трансмиссивных инфекций (вирусный гепатит) использование препаратов альбумина в настоящее время ограничено лишь случаями тяжелой гипопротеинемии (общий белок менее 50 г/л) или гипоальбуминемии (альбумин менее 25 г/л). Сходными с 5% альбумином свойствами обладает 6% раствор гидроксиэтилкрахмала (ГЭК) (Рефортан, Инфукол, Стабизол), коллоидно-осмотическое давление которого составляет 30 мм рт.ст. Элиминация ГЭК из организма происходит через почки после расщепления сывороточной амилазой до более мелких субстратов. Этот процесс занимает несколько суток, поэтому через 24 ч после инфузии раствора ГЭК в плазме сохраняется 50% его исходного осмотического эффекта.
К коллоидным препаратам относятся также растворы декстранов, представляющие собой полисахариды, имеющие высокую молекулярную массу. После инфузии раствора декстранов в сосудистое русло из интерстициального сектора привлекается такой же объем жидкости, что имеет большую гемодинамическую значимость при абсолютной или относительной гиповолемии. Однако в отличие от растворов ГЭК декстраны обладают рядом побочных эффектов, ограничивающих их использование. Угнетение агрегации тромбоцитов, снижение активации VIII фактора и ускорение фибринолиза лежит, с одной стороны, в основе реолитического действия растворов декстранов, а с другой стороны, может явиться причиной развития геморрагического синдрома. Использование декстранов сопровождается в 1% случаев развитием аллергических реакций, а у ряда пациентов может вести к появлению острой почечной недостаточности, предположительным механизмом развития которой является снижение эффективного фильтрационного давления на фоне гиперосмолярности крови в почечных клубочках. При назначении декстранов необходимо учитывать также особенности их элиминации. Известно, что большая часть поступивших в организм декстранов подвергается метаболизму в ретикулоэндотелиальной системе, основным назначением которой является элиминация образующихся в организме эндотоксинов. Если декстраны назначаются пациентам с эндотоксикозом, то это может привести к увеличению его клинических проявлений, в связи с тем, что ретикулоэндотелиальная система выключается из своей основной работы, и нарастает эндотоксинемия.
В связи с медленным метаболизмом, а также неспособностью проникать через
почечный барьер, коллоидные препараты намного дольше, чем кристаллоиды, задерживаются в сосудистом русле. Однако при развитии синдрома капиллярной утечки как следствие порозности капилляров на фоне персестирующей гипоксии или гиперцитокинемии, а также при повышении гидростатического давления коллоиды могут проникать в интерстициальный сектор и вызывать развитие отека легких.
Таким образом, использование как кристаллоидов, так и коллоидов имеет свои преимущества и недостатки, что порождает в научной среде споры относительно того, какие растворы следует назначать пациентам в состоянии шока. И хотя современные протоколы инфузионой терапии включают в себя как кристаллоиды для восполнения интерстициального сектора, так и коллоиды для нормализации объема циркулирующей жидкости, доказательные исследования не обнаружили различий в выживаемости пациентов с гиповолемическим шоком при использовании изолированно коллоидов и кристаллоидов.
Средняя доза коллоидных растворов при шоке составляет 10-20 мл/кг, также как и физиологический раствор, инфузию коллоидов осуществляют в течение 20- 30 мин. При относительной или абсолютной гиповолемии коллоидные препараты вводятся, как правило, при неэффективности одного - двух болюсов физиологического раствора. Суммарный объем инфузионных растворов должен превышать измеренный или предполагаемый объем кровопотери на 60-80%. Соотношение кристаллоидных и коллоидных растворов должно быть не менее чем 1:1. Чем сильнее кровопотеря, тем больше требуется кристаллоидных растворов для предупреждения опасного дефицита внутриклеточной жидкости. При массивной кровопотере это соотношение может быть доведено до 2:1 и более.
Показания к трансфузии препаратов крови в настоящее время значительно ограничены. При геморрагическом шоке необходимость в гемотрансфузии может возникнуть при неэффективности трех болюсов кристаллоидов/коллоидов.
Если, несмотря на адекватную инфузионную терапию (за 40-60 мин под контролем ЦВД перелито 1,0-1,5 л), отсутствует подъем артериального давления, можно думать об острой сосудистой недостаточности и в комплекс лечебных мероприятий следует включать назначение биологических аминов. После ликвидации геморрагического шока и устранения непосредственной угрозы для жизни больного начинается этап лечения, направленный на коррекцию нарушений отдельных звеньев гомеостаза. Задачи этого этапа определяют преимущественно в зависимости от данных лабораторной диагностики: корригируют избыточную гемодилюцию, КЩС, нарушения в системе гемостаза и т.д.
При разработке программы инфузионной терапии следует принять решение - переливать больному препараты красной крови или нет. В инструкции по применению компонентов крови, утвержденной приказом Министерства здравоохранения Российской Федерации от 25.02.2002 г. ? 363, написано: «Показанием к переливанию переносчиков газов крови при острой анемии вследствие массивной кровопотери является потеря 25-30% объема циркулирующей крови, сопровождающуюся снижением уровня гемоглобина ниже 70-80 г/л и гематокрита ниже 25% и возникновением циркуляторных нарушений...
... В настоящее время утвердился принцип возмещения конкретных, недостающих организму больного компонентов крови при различных патологических состояниях. Показаний к переливанию цельной консервированной донорской крови нет, за исключением случаев острых массивных кровопотерь, когда отсутствуют
кровезаменители или плазма свежезамороженная, эритроцитная масса или взвесь.
Цельная консервированная донорская кровь используется при проведении обменного переливания в терапии гемолитической болезни новорожденных».
Во всех остальных случаях следует тщательно оценить все возможные за и против проведения данной операции. Переливание препаратов красной крови желательно начинать после остановки кровотечения.
Переливание консервированной донорской крови всегда имеет следующие факторы риска
• иммунологический фактор (специфический и неспецифический);
• инфекционный фактор (гепатит В, сифилис, ВИЧ и т.д.);
• метаболический фактор (ацидоз, цитратно-калиевая интоксикация);
• микросгустки;
• холодовой фактор;
• ошибки и нарушения техники переливания.
Чтобы четко представлять себе все достоинства и недостатки гемотрансфузий, нужно знать кислородно-транспортные функции крови. Один литр донорской крови содержит 0,8 л крови и 0,2 л консерванта, следовательно, гематокрит переливаемой крови будет уже не 0,40, а 0,32 г/л. Соответственно этому гемоглобин снижается со 150 до 120 г/л, а кислородная емкость с 20 до 16% по объему. Известно, что к 3-му дню хранения консервированной крови концентрация в ней фосфорных фракций гемоглобина, от которых зависит отдача кислорода тканям, заметно снижается. Так, содержание в гемоглобине такого важного вещества как 2, 3-ДФГ (2, 3-дифосфоглицерат), ответственного за транспортную функцию кислорода кровью, уменьшается на 50%. Следовательно, утилизация кислорода тканями реципиента из переливаемой крови 3 дней хранения составляет не 5, а лишь 2-3% по объему, т.е., чтобы добиться полной компенсации в переносе кислорода донорской кровью, ее нужно переливать в объеме в 2 раза превышающем объем кровопотери (теоретически). Кроме этого, доказано, что одна четверть донорской крови сразу секвестрируется. В консервированных эритроцитах прямо пропорционально срокам хранения уменьшается аденозинтрифосфат (АТФ), что затрудняет их вход в капилляры и вызывает сброс через артериовенозный шунт, в результате этого транспорт кислорода еще больше нарушается.
В условиях кислой среды консерванта уже через 15-20 мин начинают образовываться микросгустки, на 3-и сутки их определяется до 30 000, а на 21-е сутки - до 100 000 шт. в 1 мл крови. Часть из них в последующем задерживается в легких, способствуя формированию дистресс-синдрома легких.
Вышеизложенное позволяет сделать вывод, что при гемоглобине у больного ниже 70-80 г/л и гематокрита ниже 25% нужно использовать кровь со сроком хранения не более 3 суток, при остальных ситуациях можно использовать препараты красной крови и с большими сроками хранения. При составлении программы инфузионной терапии следует помнить, что удельный вес донорской крови не должен превышать 60% объема кровопотери. Следует подчеркнуть, что одновременно (т.е. в процессе непрерывного лечения) введение более 2-2,5 л консервированной крови представляет серьезную опасность из-за возможности развития синдрома гомологичной крови (В.А. Климанский, Я.А. Рудаев, 1984).
В вышеуказанной инструкции по применению компонентов крови, написано: «По жизненным показаниям и при отсутствии одногруппных по системе АВО
компонентов крови (за исключением детей) допускается переливание резус-отрицательных переносчиков газов крови 0(I) группы реципиенту с любой другой группой крови в количестве до 500 мл. Резус-отрицательная эритроцитная масса или взвесь от доноров группы А(II) или В(III) по витальным показаниям могут быть перелиты реципиенту с АВ(IV)-группой, независимо от его резус-принадлежности. При отсутствии одногруппной плазмы реципиенту может быть перелита плазма группы АВ(IV)».
В дополнение к вышеизложенному необходимо знать следующее. В гражданском паспорте или в военном билете у некоторых граждан может встретиться штамп, поставленный в медицинском учреждении с группой крови и резус-фактором. Пользоваться этими данными можно только при массовых поступлениях раненых и пораженных во время стихийных бедствий, военных действий и т.д. Во всех прочих случаях перед каждой гемотрансфузией необходимо повторное определение группы крови и резус-фактора реципиента.
С первых этапов начала лечения гиповолемического шока следует постоянно помнить о возможности возникновения у больного преренальной формы острой почечной недостаточности (ОПН). При уменьшении давления в а. renalis до 80 мм рт.ст. фильтрационная функция почек уменьшается, а при давлении 60 мм рт.ст. и менее полностью прекращается. Если это состояние будет длиться час и более, функциональное нарушение экскреторной функции почек может перейти в органическое. Поэтому как только на фоне инфузионной терапии у больного отметится тенденция к подъему АД, следует начать проводить превентивное лечение ОПН. С этой целью можно вводить в/в лазикс (фуросемид) по 40-60 мг 2-3 раза в сутки. После стабилизации систолического АД на уровне 90-100 мм рт.ст. можно подключить в/в медленное введение 2,4% - 10 мл эуфиллина 3-4 раза в сутки. Если при адекватной инфузионной терапии и положительной динамике ЦВД и АД моча не выделяется, следует прибегать к назначению осмодиуретиков. Оптимальным препаратом является 10-15-20% раствор маннитола. Он хорошо фильтруется, но не реабсорбируется в почках. Рекомендуемая доза: 1-1,5 г/кг массы больного. Если же и на фоне использования осмодиуретиков не удается получить мочу, это указывает на формирование грозного осложнения - ренальной формы ОПН.
Целенаправленное воздействие на реологические свойства крови достигается назначением реолитиков и антиагрегантов: гепарина, трентала, курантила.
Улучшение доставки кислорода к тканям за счет повышения его напряжения в крови и коррекции гипоксемии, что достигается оксигенотерапией, а в случае декомпенсированного шока или при невозможности коррегировать артериальную гипотензию в течение часа - искусственной вентиляцией легких.
Коррекция кислотно-щелочного состояния. Важность этого принципа лечения связана с тем, что при сохраняющемся ацидозе снижается контрактильность миокарда, возникает легочная гипертензия, снижается чувствительность адренорецепторов к катехоламинам.
Абсолютным показанием для инфузии бикарбоната натрия является ВЕ более - 8.
Но не всегда есть возможность проконтролировать КЩС, поэтому при субкомпенсированном шоке, сопровождающимся накоплением лактата в тканях, на что может указывать симптом бледного пятна более 5 с, и наличие олигурии, показано введение бикарбоната натрия в дозе 1-2 ммоль/кг (2-4 мл/кг) за 20-30 мин. Если на фоне проводимой параллельно инфузионной терапии перфузия тканей не улучшается, требуется повторное введение той же дозы, половина которой вводит-
ся за 30 мин, а оставшаяся часть - в течение несколько часов. Инфузия бикарбоната натрия должны вводиться под контролем КЩС, так как при передозировке может резко снизиться уровень ионизированного кальция в крови с развитием судорог. Раствор соды нельзя смешивать с дофамином, так как он инактивируется в щелочной среде.
Учитывая, что конечной целью терапии шока является нормализация доставки энергетического субстрата к клетке, важным принципом лечения является энергетическая дотация. Поэтому параллельно волемической нагрузке необходимо введение 10-20% растворов глюкозы в объеме, не превышающем скорость ее утилизации в тканях, которая при шоке снижается до 0,25-0,4 г/кг/час. Однако данное положение в большей степени применимо к ожоговому и септическому шоку, характеризующимся относительно длительным течением.
Антиоксидантная фармакотерапия. В настоящее время установлено, что препараты, обладающие антиоксидантным эффектом, в частности церулоплазмин, способны оказывать иммунопротекторное действие при шоковых и терминальных состояниях. Назначение препарата в дозе не менее 1000 мг/сут приводит к быстрому уменьшению содержания продуктов перекисного окисления липидов (ПОЛ) - в частности малонового диальдегида. Среди клинических эффектов у больных, находившихся в шоке и получавших в составе лечения церулоплазмин, отмечалось снижение частоты легочных осложнений: респираторного дисстресссиндрома, пневмонии, трахеобронхитов, а в последующем достоверное уменьшение гнойно-септических осложнений и гемотрансфузий плазмы, тромбоцитарной массы и отмытых эритроцитов (Крайнова Т.А., Ефремова Л.М., 2005).
Стероидная терапия. Раньше этому принципу придавали ведущее значение в терапии шока. В настоящее время показания для введения гормонов при шоке сузились. Гормоны показаны при развитии надпочечниковой недостаточности или при стрессе у пациента с хронической надпочечниковой недостаточностью (пациенты с эндокринопатиями, тимомегалией, ожирением, иммунодефицитным состоянием). Вводят гидрокортизон внутривенно капельно в суточной дозе 30-70 мг/кг, первоначально на этапе выведения из шока - 15-20 мг/кг. Суточная потребность в гидрокортизоне составляет при этом 50-100 мг/м2 поверхности тела.
18.9.3. ТРАВМАТИЧЕСКИЙ ШОК
По своему патогенезу данный вид шока является гиповолемическим и очень похож на геморрагический шок, так как в основе его развития находится прежде всего явная или скрытая кровопотеря, возникающая при повреждении сосудов, костей и мягких тканей организма. Необходимо помнить о том, что закрытые переломы костей без повреждения кожных покровов всегда сопровождаются скрытой кровопотерей, возникающей в результате образования внутритканевой гематомы (табл. 18-6).
Таким образом, констатация вида и характера травматического повреждения позволяет судить о предполагаемом объеме кровопотери и ожидаемой стадии шока, что дает возможность начать проведение адекватной противошоковой терапии еще до развития декомпенсированной стадии. Важным фактором в патогенезе травматического шока является также мощная болевая импульсация, идущая с места
Таблица 18-6. Кровопотеря при травме (переломы)
 травмы в центральную нервную систему (ЦНС). В ответ на это организм отвечает гиперкатехоламинемией, клинически проявляющейся возбуждением пациента, неадекватной оценкой своего состояния, иногда отказом от проведения лечения. Это период называют эректильной фазой шока, данная фаза наблюдается обычно на догоспитальном этапе, а ввиду своей кратковременности на госпитальном этапе ее редко удается увидеть; в последующем у больного развивается вторая фаза - торпидная фаза шока, в основе которой лежит энергетическое голодание в результате истощения запасов эндогенной энергии, уменьшение УО, замедление капиллярного кровотока, возрастание вязкости крови и последующая ее секвестрация.
травмы в центральную нервную систему (ЦНС). В ответ на это организм отвечает гиперкатехоламинемией, клинически проявляющейся возбуждением пациента, неадекватной оценкой своего состояния, иногда отказом от проведения лечения. Это период называют эректильной фазой шока, данная фаза наблюдается обычно на догоспитальном этапе, а ввиду своей кратковременности на госпитальном этапе ее редко удается увидеть; в последующем у больного развивается вторая фаза - торпидная фаза шока, в основе которой лежит энергетическое голодание в результате истощения запасов эндогенной энергии, уменьшение УО, замедление капиллярного кровотока, возрастание вязкости крови и последующая ее секвестрация.
Кроме патологических процессов, характерных для любой шоковой реакции, тяжелая травма сопровождается специфическими проявлениями - синдромом жировой эмболии, синдромом острого паренхиматозного повреждения легких, синдромом диссеминированного внутрисосудистого свертывания крови. Клиническая классификация травматического шока (Гостищев В.К., 1993): «По тяжести клинических проявлений торпидной фазы шока различают 4 степени.
При шоке I степени сознание сохранено, больной контактен, слегка заторможен. Артериальное систолическое давление снижено до 90 мм рт.ст., пульс слегка учащен. Кожные покровы бледные, иногда появляется мышечная дрожь. При надавливании пальцем на ногтевое ложе кровоток восстанавливается замедленно.
При шоке II степени больной заторможен. Кожные покровы бледные, холодные, липкий пот. Выражен цианоз ногтевого ложа, при надавливании пальцем кровоток восстанавливается очень медленно. Артериальное систолическое давление снижено до 90-70 мм рт.ст. Пульс слабого наполнения, учащенный - 110-120 в минуту. Центральное венозное давление снижено. Дыхание поверхностное.
При шоке III степени состояние больного крайне тяжелое: он адинамичен, заторможен, на вопросы отвечает односложно, не реагирует на боль. Кожные покровы бледные, холодные с синюшным оттенком. Дыхание поверхностное, частое, иногда урежено. Пульс частый - до 130-140 в минуту. Артериальное систолическое давление низкое - 70-50 мм рт.ст. Центральное венозное давление - 0 или отрицательное. Прекращается мочеотделение.
При шоке IV степени отмечается преагональное состояние: кожа и слизистые оболочки бледные с синюшным оттенком, дыхание частое, поверхностное, пульс частый, слабого наполнения, артериальное систолическое давление 50 мм рт.ст. и ниже».
Принципы лечения травматического шока
Травматический шок по своему патогенезу является гиповолемическим, поэтому обозначенные выше принципы интенсивной терапии применимы и при травматическом шоке. Одной из главных задач лечения является более раннее его начало с соблюдением преемственности оказания помощи на догоспитальном и госпитальном этапах. Лечебно-реанимационные действия следует начинать уже на месте происшествия и продолжать во время транспортировки пострадавшего в стационар.
На догоспитальном этапе применяют такие методы противошоковой терапии, которые не требуют большой затраты времени и достаточно надежны:
• придание телу пациента оптимального положения (Тренделенбурга, Фовлера, Волковича-Дьяконова, дренажного, горизонтального на щите);
• проведение мероприятий по поддержанию внешнего дыхания (санация трахеобронхиального дерева - профилактика и устранение аспирационного синдрома, интубация трахеи, ларингеальная маска, Комбитрубка, коникотомия, вспомогательная или заместительная ИВЛ, наложение окклюзионной повязки при открытом пневмотораксе, пункция плевральной полости при напряженном пневмотораксе);
• временная остановка кровотечения (кровоостанавливающий жгут, зажим, давящая повязка, пальцевое прижатие артерии, тугая тампонада раны, противошоковый костюм и др.);
• восполнение объема циркулирующей крови (солевые растворы через рот, инфузия кровозамещающих растворов внутривенно, внутрикостно, с ориентацией на ответную реакцию организма - системное артериальное давление должно находиться выше критического уровня (80 мм рт.ст.);
• обезболивание и блокирование эмоционально-стрессовых реакций: новокаиновые блокады, нестероидные противовоспалительные препараты, например кетонал 100-200 мг изолировано или в сочетании с опиатами (фентанил 0,1 мг внутривенно) или опиоидами (трамадол 100 мг внутривенно), воздействие на биологически активные точки и др.;
• иммобилизация зон переломов, обширных мягкотканных повреждений, сосудов, нервов (транспортные шины, вакуумные матрасы, жесткие щиты, воротник типа Шанса и др.);
• местное охлаждение поврежденных участков тела (гипотермические пакеты, импровизированные холодные компрессы, лед, снег, вода);
• органопротекторы (антигипоксанты, антиоксиданты);
• кортикостероидные гормоны;
• профилактика и лечение жировой эмболии (липостабил, глюкозо-новокаиновая смесь, перфторан и др.).
На госпитальном этапе, при поступлении больного с шокогенной травмой в стационар для оценки его состояния приходится учитывать большое число факторов. Прежде всего необходимо выделить ведущие повреждения (см. табл. 18-7), число и тяжесть локальных травм. Нередко сочетание двух или более тяжелых повреждений затрудняет определение ведущей, доминирующей травмы. Все это усложняет диагностику и выбор лечения.
Таблица 18-7. Ведущие повреждения по группам сочетанных травм
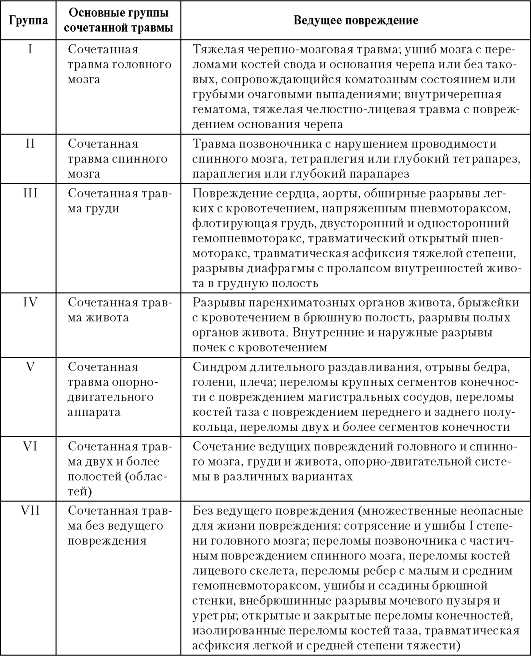 18.9.4. ОЖОГОВЫЙ ШОК
18.9.4. ОЖОГОВЫЙ ШОК
Ожоговый шок представляет собой начальную стадию ожоговой болезни и развивается вследствие шокогенной болевой травмы и прогрессирующей плазмопотери. Ожоговый шок диагностируется в тех случаях, когда общая площадь
ожогов у детей до 1 года является 8% поверхности тела, у детей старше 1 года - 10% при I, IIА стадии ожога и более 5% при глубоком ожоге III стадии. У взрослых шокогенная поверхность составляет 20% при поверхностных и 10% при глубоких ожогах. Сопутствующее ожоговое поражение дыхательных путей (ОДП) эквивалентно 15-30 ед. индекса Франка (ИФ) и увеличивает тяжесть шока (Р.И. Муразян, Н.Р. Панченков, 1983; А.А. Алексеев, В.А. Лавров, В.Н. Дутиков, 1995; В.А. Жегалов и др., 2003).
При установлении глубины и площади ожога обычно пользуются критерии, приведенные в разделе 18.10. Неотложная помощь при термических поражениях и химических ожогах. Основными патогенетическими моментами ожогового шока являются боль, гиповолемия, плазмопотеря, гипонатриемия и гипокалиемия, развивающаяся по мере нормализации диуреза, когда потери калия составляют до 200 ммоль на 1 л мочи. При некоррегированной гипокалиемии закономерно развивается парез кишечника, синдром транслокации кишечной флоры, что имеет первостепенное значение в развитии гнойно-септических осложнений. На фоне выраженной централизации кровотока ишемизируется слизистая ЖКТ, что часто приводит к развитию стрессовых язв и кровотечения, усугубляющего уже имеющуюся гиповолемию. Активация синдрома системного воспалительного ответа и вызванного им эндотоксикоза, катаболизма, энергетического дефицита, синдрома капиллярной утечки, полиорганной дисфункции может реализоваться в дальнейшем в сепсис. При пожаре возможно отравление угарным газом, на что будет указывать бордовая окраска кожи и синдром угнетения ЦНС, а также отравление продуктами горения (цианиды, фосген, галогеновые кислоты), часто сопровождающееся развитием отека легких. Ожоговая травма может осложниться раневой инфекцией, в том числе столбняком.
На возникновение и тяжесть течения ожогового шока влияет множество факторов, в частности ожог дыхательных путей (ОДП). ОДП - своеобразное поражение дыхательного тракта, которое может возникнуть при вдыхании горячего воздуха, пара, дыма, частиц копоти, даже языков пламени и т.д.
При сочетании ожога кожи и ОДП ожоговый шок может развиться при площади поражения, примерно вдвое меньшей, чем без ОДП. Считается, что ОДП оказывает на пораженного такое же воздействие, как и глубокий ожог кожи площадью около 10-15% поверхности тела.
ОДП необходимо заподозрить в случаях, если ожог произошел в закрытом помещении или в полузамкнутом пространстве: пожар в доме, подвале, в горных выработках, в транспортном средстве; если ожог вызван паром, пламенем; если горела одежда; если есть ожог груди, шеи, а тем более лица.
Комплекс реакций, направленных на поддержание жизнедеятельности организма, одинаков как при ожогах на площади 20% поверхности тела, так и при субтотальных ожогах. Различие у отдельных индивидуумов заключается в степени адекватности реакции систем реализации стресса на травму, в соотношении: индивидуальные возможности адаптации/тяжесть травмы. Ниже приведены общепринятые классификации тяжести ожогового шока в зависимости от площади и глубины поражения (см. табл. 18-8 и 18-9).
Таблица 18-8. Оценка тяжести ожогового шока по площади и глубине поражения
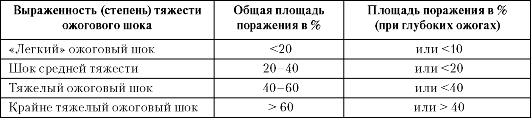 Таблица 18-9. Характеристика тяжести ожогового шока
Таблица 18-9. Характеристика тяжести ожогового шока
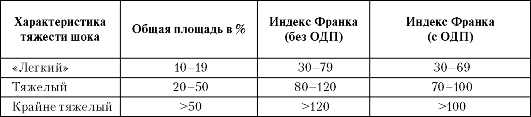 Принципы лечения ожогового шока
Принципы лечения ожогового шока
Терапия ожогового шока строится на следующих принципах.
• Коррекция гиповолемии, гипопротеинемии и дисэлектролитемии.
• Уменьшение сосудистой проницаемости.
• Ограничение избыточной активации синдрома системного воспалительного ответа и протекция функции органов.
• Антибактериальная терапия.
• Анальгезия.
На догоспитальном этапе при отсутствии возможности проведения инфузионной терапии и при сохраненном сознании пациенту дают пить солевые растворы, проводят анальгезию и накладывают на ожоговые поверхности стерильные повязки, обильно смоченные фурациллином.
На госпитальном этапе последовательность лечебных мероприятий должна быть следующей.
• Восстановление проходимости верхних дыхательных путей, оксигенотерапия, решение вопроса об интубации трахеи и проведении ИВЛ у пациентов с ожогом верхних дыхательных путей, у пациентов, которым на месте проводились реанимационные мероприятия, при глубоком ожоге площадью более 60-80% с целью уменьшения потребления и увеличения доставки тканям кислорода, а также при тяжелом отравлении угарным газом.
• Анальгезия ненаркотическими или наркотическими анальгетиками.
• Болюсная инфузия 20 мл/кг раствора Рингера или 0,9% раствора хлористого натрия. Учитывая тот факт, что продолжительность ожогового шока может составлять сутки и более, дальнейшая инфузионная терапия должна быть направлена на восполнение физиологической потребности и продолжающейся потери жидкости. Качественный состав инфузионной терапии определяется патогенезом ожогового шока - плазмопотерей с ожоговой поверхности
на фоне выраженного катаболизма и выведения из организма калия, что требует восполнение теряемой воды, натрия, калия и белка. Следовательно, основу инфузионной терапии ожогового шока должны составлять глюкозосолевые и белковые препараты. Необходимо помнить о том, что вследствие выраженного синдрома капиллярной утечки в первые 8 ч идет интенсивная потеря альбумина в ожоговую рану, поэтому не рекомендуется использовать белковые препараты в первые 6-8 ч терапии ожогового шока. В объем инфузионной терапии могут быть включены коллоиды, однако на фоне выраженного синдрома капиллярной утечки нельзя исключить вероятность их выхода в интерстициальный сектор с развитием клиники отека бронхов, легких и головного мозга. В стадии инфицирования ожоговой раны всегда имеет место перегрузка ретикулоэндотелиальной системы (РЭС) неконтролируемо накапливающимися микроорганизмами. Поэтому дополнительная нагрузка на РЭС в виде декстранов может привести к быстрой декомпенсации ее функции. По мере восстановления диуреза в инфузионную терапию включают раствор калия хлорида - 30-40 ммоль/л. Нормализация содержания калия в крови имеет значение в плане профилактики развития пареза кишечника и синдрома транслокации кишечной микрофлоры, что лежит в патогенезе развития сепсиса.
• Устанавливают назогастральный зонд, опорожняют желудок и вводят антациды 30 мл/м2 через каждые 1-2 ч. В настоящее время придерживаются тактики раннего начала энтерального введения жидкости и кормления, так как это предотвращает образование стрессовых язв и транслокацию кишечной микрофлоры.
• С целью уменьшения сосудистой проницаемости используют этамзилат натрия в дозе 0,1 мл/кг/сут, преднизолон, который при ожоге более 30% поверхности тела назначают в дозе 3 мг/кг/сут на 3 дня, а при ожоге более 50% - 5 мг/кг/сут на 5 дней. Аскорбиновую кислоту назначают в дозе 1 г/м2 ожоговой поверхности в сутки.
• Профилактика столбняка осуществляется у иммунизированных пациентов, получивших последнюю дозу более 5 лет назад, введением 0,5 мл столбнячного анатоксина, а у неиммунизированных пациентов - введением противостолбнячного человеческого иммуноглобулина в дозе 250-500 тыс. Ед в/м.
• Антибактериальную терапию препаратами широкого спектра назначают с целью санации хронических очагов инфекции и подавления транслоцированной микрофлоры. В первые сутки ожоговой болезни проницаемость антибиотиков в ожоговую рану значительно снижена, в связи с чем для профилактики и лечения раневой инфекции нужно использовать местные антибактериальные препараты.
• С самого начала терапии необходим строгий контроль диуреза.
• С целью улучшения перфузии тканей, особенно подлежащих к ожоговой поверхности, и доставки кислорода, а также с целью улучшения почечного, мезентериального, легочного кровотока в стадию ожогового шока показано использование трентала в дозе 5-10 мг/кг, который одновременно уменьшает выработку фактора некроза опухоли - одного из пусковых медиаторов синдрома системного воспалительного ответа.
18.9.5. СЕПТИЧЕСКИЙ ШОК
Септический шок является одним из самых тяжелых видов шоков. Летальность при нем составляет от 50 до 75%. По своему патогенезу септический шок является одновременно сосудистым, кардиогенным и гиповолемическим. В основе его развития лежит накопление провоспалительных медиаторов, вызывающих повреждение эндотелия, активацию ДВС-синдрома, выраженные нарушения микроциркуляции с генерализованным спазмом одних зон и паралитической вазодилатацией других, в том числе вследствие накопления в тканях оксида азота (NO). Накопление эндотоксинов микроорганизмов и выраженный метаболический ацидоз препятствуют взаимодействию катехоламинов с сосудистыми рецепторами, вызывают депрессию миокарда, активизируют катаболизм и приводят к значительному повышению потребности тканей в кислороде, которая не может быть обеспечена в результате снижения его доставки. Выраженный синдром капиллярной утечки, вызванный действием медиаторов воспаления на сосудистый эндотелий, обусловливает за счет пропотевания жидкой части крови в интерстиций формирование тяжелой и быстро прогрессирующей гиповолемии.
Для септического шока клинически характерно наличие двух стадий. В стадию теплого шока имеет место гипердинамия кровообращения за счет активации работы сердца и раскрытия артериовенозных шунтов (рис. 18-8). Так, если в нормальных условиях через A-V шунт проходит около 5% органного кровотока, то при септическом шоке эта величина неуклонно возрастает, что способствует формированию кислородного дефицита в системе капилляров. Усиленный сброс артериальной крови через A-V шунт вызывает формирование весьма нехарактерного для шоковых состояний признака: кожные покровы становятся теплыми, иногда даже горячими на ощупь. Отмечается гиперемия кожи, гипертермия, тахикардия, ранним признаком септического шока может быть повышенное выделение гипотоничной мочи. Кроме этого, бактериальные токсины нарушают усвоение кислорода посредственно в клетках. В ответ организм реагирует увеличением МОС посредством повышения УО и ЧСС с одновременным снижением ПСС. Эту стадию теплого шока иногда обозначают как гипердинамическую фазу (Э.К. Айламазян, 1995).
На пике развития септического шока (стадия теплого шока, гипердинамическая фаза) основные показатели центральной гемодинамики будут следующие: АД, УО, ЦВД, ДН в пределах верхней границы нормы или незначительно увеличены, умеренная тахикардия, сниженное ПСС. По мере нарастания интоксикации УО
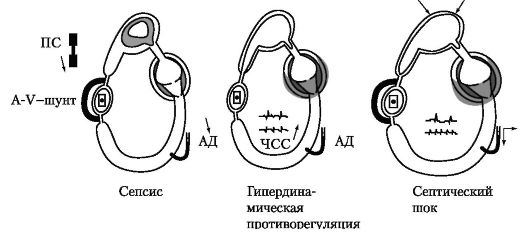 Рис. 18-8. Патогенез септического шока
Рис. 18-8. Патогенез септического шока
приходит к нормальным величинам, а затем начинает прогрессивно уменьшаться, что способствует переходу шока в стадию холодного шока, гиподинамическую фазу (Э.К. Айламазян, 1995). В ее основе лежит переход к гиподинамическому типу кровообращения и развитие синдрома малого выброса вследствие прогрессирующего ухудшения контрактильности миокарда и падения общего периферического сопротивления. Больной становится вялым, безучастным к окружающим, кожа приобретает серый, с выраженным нарушением микроциркуляции в виде мраморности, резко положительного симптома бледного пятна, отмечается прогрессирующая гипотония, тахикардия, олигоанурия, быстро нарастает синдром острого повреждения легких. Летальность в холодную стадию шока приближается к 80-90%.
Данный вариант патологии наиболее часто встречается в акушерско-гинекологической практике у молодых женщин и протекает крайне бурно - летальный исход может наступить буквально через несколько часов. Ключевыми звеньями в патогенезе септического шока являются высокий СВ, низкие ДЗЛК и ОПСС, что вызывает неадекватную оксигенацию тканей.
Принципы лечения септического шока
Неотложному хирургическому лечению подлежат все очаги инфекционного воспаления как первичные, так и вторичные, которые должны быть диагностированы и санированы в самый короткий срок (вскрытие, вторичная хирургическая обработка, дренирование). Хирургическим методам санации инфекционных очагов принадлежит основная роль в борьбе с интоксикацией организма. Без их правильного и своевременного проведения любое другое лечение окажется бесперспективным. Исходя из вышеизложенного, естественной рекомендацией для начала лечения септического шока была бы оперативная санация септического очага. Однако это не так. Кратковременность протекания процесса и его бурный характер буквально в течение нескольких часов приводит к декомпенсации жизненно важных функций, без коррекции которых речи об операции быть не может, тем более что в настоящее время нет единой оперативной тактики лечения данной патологии. Основной целью лечения септического шока является обеспечение необходимой доставки кислорода тканям, для чего необходимо в течение не менее 24-48 ч удерживать организм больного в следующих параметрах:
• систолический индекс не менее 4,5 л/мин/м2;
• показатель доставки кислорода тканям (ДО2) не менее 500 мл/мин/м2, хотя не все специалисты согласны с необходимостью повышенной доставки, так как это может привести к увеличению повреждения тканей на фоне резкой активации синдрома перекисного окисления липидов и быть неэффективным вследствие сниженной экстракции кислорода;
• гемоглобин на уровне 100-120 г/л, гематокрит - 30-33%;
• РаО2 не менее 60 мм рт.ст., St О2 не менее 90%, что достигается методами оксигенотерапии и ИВЛ;
• среднее артериальное давление должно быть не менее 80 мм рт.ст.;
• общее периферическое сопротивление не менее 1100-1200 дин сек/см2 м2;
• потребление кислорода (VO2) не менее 150 мл/мин/м2;
• диурез - не менее 0,7 мл/кг/час.
Для достижения этих параметров необходимо поддержание сосудистого тонуса и сердечного выброса. Это достигается следующими лечебными мероприятиями.
• Для обеспечения адекватной доставки кислорода необходимо прежде всего восполнить объем циркулирующей жидкости, дефицит которой обусловлен пропотеванием жидкой части крови в интерстиций на фоне значительно выраженного синдрома капиллярной утечки. Это достигается болюсной инфузией за 20-30 мин 10-20 мл/кг физиологического раствора. Не исключено, что переливаемая жидкость также будет покидать сосудистое русло, что, с одной стороны, потребует 2-3 болюсов инфузии, а с другой стороны может привести к развитию отека легких, появление которого не является отражением ошибочной терапии, а является закономерным следствием попытки восполнить ОЦЖ. Поэтому необходимо по возможности ограничить использование синтетических кровезаменителей, осторожно относиться к плазме, так как она является донатором комплемента - одного из основных медиаторов воспалительного ответа. В объем инфузионной терапии должна быть включена сода с целью коррекции метаболического ацидоза под контролем показателей КЩС.
• В связи с тем, что в патогенезе развития септического шока лежит, в том числе, сосудистая недостаточность, обусловленная снижением ОПСС, немаловажная роль в лечении принадлежит инотропной и вазопрессорной терапии. Если систолический индекс не менее 4,5 - ограничиваются только вазопрессорами
- норадреналином в дозе 0,5-5 мкг/кг/мин, менее эффективно - дофамином в дозе 15 мкг/кг/мин. При снижении на фоне терапии сердечного индекса добавляют кардиотоническую поддержку - добутрекс, дофамин - 5 мкг/кг/ мин или изадрин 0,4-4 мкг/кг/мин.
• При исходном систолическом индексе менее 4,5 терапию начинают с добутрекса 0,5-5 мкг/кг/мин, если при этом среднее давление ниже 80 мм рт.ст.
- добавляют норадреналин.
• В сомнительной ситуации терапию начинают с норадреналина, при необходимости добавляют добутрекс.
• Для управления сердечным выбросом добутамин можно сочетать с адреналином или изадрином. Для управления ОПСС норадреналин можно сочетать с адреналином или дофамином.
• При сохраняющейся олигурии добавляют лазикс или дофамин в дозе 2,5- 5 мкг/кг/мин.
• Каждые 4 ч контролируют параметры транспорта кислорода.
• Отмену сосудистой поддержки производят через 24-36 ч периода стабильного состояния. Иногда требуется несколько дней для отмены норадреналина. В течение первых 2 дней с целью компенсации синдрома отмены альфа-агонистов проводят дополнительную инфузионную нагрузку 10-20 мл/кг/сут.
• При выведении из шока нужно обязательно осуществлять энергодотацию в виде глюкозы 0,5 г/кг/час.
• Стероидная терапия при септическом шоке направлена на подавление активности NO-синтетазы, восстановление сенситизации адренергических рецепторов, подавления активности провоспалительных медиаторов. Назначается гидрокортизон в дозе 100 мг болюсно внутривенно, затем 0,18 мг/кг/час в период сосудистой поддержки и 0,08 мг/кг/час в дальнейшем со снижением на 24 мг (0,3 мг/кг или 13,8 мг/м2) каждые сутки.
 Рис. 18-9. Патогенез анафилактического шока
Рис. 18-9. Патогенез анафилактического шока
18.9.6. АНАФИЛАКТИЧЕСКИЙ ШОК
В основе анафилактического шока лежит массивный выброс в кровоток гистамина, серотонина и прочих биологически активных веществ на фоне повторного попадания в организм аллергена. Данные вещества оказывают паралитическое влияние на прекапиллярный сфинктер в системе микроциркуляции, в результате периферическое сосудистое сопротивление резко уменьшается и имеющийся объем крови становится слишком малым по отношению к сосудистому руслу (рис. 18-9). Иначе этот процесс условно можно определить как децентрализацию кровообращения, т.е. фактически возникает внезапная гиповолемия без потери ОЦК. Регистрируются низкие ОПСС и ДЗЛК и нормальный или пониженый СВ.
Под влиянием биологически активных веществ быстро повышается проницаемость клеточных мембран, в результате этого возникают интерстициальные отеки, прежде всего в головном мозге и легких, а переход жидкой части крови в интерстиций способствует ее сгущению и еще большему уменьшению ОЦК. Все это происходит на фоне практически мгновенно развивающегося полного или частичного ларинго- и бронхиолоспазма, что клинически проявляется возникновением признаков ОДН. Появляются спастические сокращения кишечника, мочевого пузыря и матки с соответствующей клинической картиной. Защитная симпатоадреналовая реакция, характерная для многих других видов шока, здесь не проявляется, так как сама реакция на симпатическое раздражение нарушена.
Принципы лечения анафилактического шока
Принципы лечения анафилактического шока строятся на особенностях его патогенеза:
• относительная гиповолемия на фоне пареза системы микроциркуляции;
• ларинго- и бронхиолоспазм;
• повышенная проницаемость клеточных мембран;
• нарушенная симпатоадреналовая реакция на эндогенные КА;
• спастическое сокращение гладких мышц органов брюшной полости. Исходя из вышеизложенного, неотложная помощь должна осуществляться в
следующей последовательности.
• При наличии показаний - проведение комплекса реанимационных мероприятий (см. Глава 20. Общие вопросы реаниматологии).
• По возможности устранение контакта с аллергеном. Наложение жгута на конечность оправдано при подкожном введении препарата или при укусе насекомыми в конечности. При внутривенном введении большая часть
препарата успевает поступить в сосудистое русло, поэтому наложение жгута бесполезно. В тех случаях, когда невозможно наложить жгут выше места введения аллергена (например, анафилактический шок развился в ответ на введение раствора антибиотика в ягодицу), следует обколоть место инъекции разведенным раствором адреналина по 0,1 мл, что замедлит всасывание аллергена.
• Вводится в/в медленно 1 мл 0,1% раствора адреналина, разведенного в 10-20 мл физиологического раствора. При затруднениях пункции периферической вены допустимо введение адреналина в мягкие ткани подъязычной области.
• Осуществляется внутривенная струйная инфузионная терапия 10-20 мл/кг кристаллоида или коллоида.
5. Для купирования бронхоспазма показано медленное в/в введение 5-10 мл 2,4% раствора эуфиллина.
• Глюкокортикоиды (преднизолон 2-3 мг/кг) показаны для предотвращения дальнейшей либерации гистамина и с целью стабилизации клеточных мембран.
• В отношении использования антигистаминных препаратов (димедрол, супрастин, пипольфен и т.п.) при лечении анафилактического шока нужно знать следующее:
- данные препараты обладают в десятки раз более слабым десенсибилизирующим и мембраностабилизирующим эффектом по сравнению с глюкокортикоидами, что само по себе делает их использование нецелесообразным при лечении анафилактического шока;
- почти все препараты этой группы обладают слабовыраженным ганглиоблокирующим эффектом, который наиболее четко проявляется при исходной гипотензии. Это объясняет, почему при их в/в введении у больных с данной патологией на фоне низкого исходного АД происходит еще большее его падение.
Исходя из вышеизложенного использование антигистаминных препаратов при оказании неотложной помощи больным, находящимся в анафилактическом шоке, не показано.
18.10. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ТЕРМИЧЕСКИХ ПОРАЖЕНИЯХ И ХИМИЧЕСКИХ ОЖОГАХ
18.10.1. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ТЕРМИЧЕСКИХ ОЖОГАХ
В повседневной работе врачу общей практики иногда приходится оказывать неотложную помощь при термических ожогах, возникающих в результате несчастных случаев в быту, производственных травмах при нарушении техники безопасности, и др.
Ожогом называется повреждение тканей, вызванное действием высокой температуры, электрического тока или коррозивных жидкостей (кислоты, щелочи и др.). По этиологии ожоги можно разделить на термические, химические, радиационные и электроожоги. Человека, получившего термическую травму, называют обожженным.
По данным ВОЗ, ожоги занимают третье место среди прочих травм. Ожоговый травматизм в США и Японии достигает 290-300 случаев на 100 тыс. населения, а в России (по данным коллегии Минздрава РФ 2002 г.) - 384 случая на 100 тыс. населения, причем 28,4% из них нуждаются в госпитализации. Стабильная и достаточно высокая летальность (5,4%), а при ожоговом шоке от 9 до 13%, позволяет сделать вывод, что проблема термических ожогов (термической травмы) всегда является актуальной.
Одной из главных причин высокой летальности среди пострадавших с тяжелыми ожогами является отсутствие единой концепции лечения тяжелообожженных, единого подхода к профилактике и лечению таких грозных осложнений, как полиорганная недостаточность, ожоговый сепсис, поражение нервной системы, что влечет за собой гибель и инвалидизацию пациентов (М.И. Кузин, В.К. Сологуб, В.В. Юденич, 1982; В.К. Гусак, Н.Е. Повстяной, Л.Г. Анищенко, 1992; Н.И. Атясов, 1994; И.П. Назаров, Ю.С. Винник 2002).
Термические ожоги классифицируют:
• по глубине поражения (I, II, ША, ШБ и IV степени);
• по площади поражения, в % к площади поверхности тела (ППТ);
• по периодам течения ожоговой болезни (шок, острая ожоговая токсемия, септикотоксемия, реконвалесценция или ожоговое истощение);
• по фазам течения раневого процесса (первичные анатомо-функциональные изменения, реактивновоспалительный процесс, регенерация).
Воздействие термического фактора на организм человека приводит к поражению многих органов и систем.
Наибольшее значение имеет разрушение кожи глубокими термическими повреждениями. Кожа - это наружный покров тела, который защищает человека от воздействий внешней среды и играет ключевую роль в терморегуляции, различных видах рецепции, водно-электролитном балансе, защите от бактериальной инфекции и т.д.
У пострадавших тяжелые термические ожоги вызывают значительные потери тепла, интенсивное перераспределение жидкости, потери белка. Кроме того, у обожженных часто возникают инфекции. Среди ранних осложнений после поступления в стационар преобладает гиповолемический шок, а наиболее частым осложнением является сепсис. Причиной смерти в первые 24 ч после поступления в отделения интенсивной терапии (ОИТ) чаще всего является гиповолемический шок. Критическим сроком при ожоговой травме следует считать первые 7-8 ч.
Патогенез. Глубина повреждения при ожогах зависит от характера термического агента, его температуры, длительности действия и степени прогревания (гипертермии) глубоких слоев кожи и подлежащих тканей.
Ведущими патофизиологическими факторами при термических поражениях являются:
• интенсивная болевая (ноцицептивная) импульсация из очага поражения;
• мощная симпатоадреналовая реакция, с активацией и перевозбуждением стресс-реализующих структур, сопровождающаяся нарушениями в системе микроциркуляции;
• гиповолемия и вторичная эритремия в результате усиленной потери жидкой части крови из сосудов в связи с их повышенной проницаемостью и через поврежденные кожные покровы.
При ожогах изменения происходят как в месте поражения (зоне некроза и перинекротической зоне), так и в непораженных органах и тканях в первую очередь в ЦНС, сердечно-сосудистой, дыхательной системах и органах ЖКТ.
Патогенез местных нарушений при ожоге определяется сочетанным действием биологически активных веществ (БАВ), выделяющихся в большом количестве вследствие массивного разрушения тканей. Под влиянием БАВ развиваются нарушения микроциркуляции, повышается проницаемость сосудов, появляется отек тканей с развитием тканевого ацидоза. Генерализованный клеточный отек возникает по причине диффузных нарушений проницаемости клеточных мембран для натрия. Поэтому отек развивается не только в области поврежденных, но и неповрежденных тканей.
В зависимости от степени нарушения кровообращения в обожженной коже принято различать (условно) две зоны: зону первичного некроза (необратимых изменений) и вторичного некроза (зону перинекроза), к которой относят пораженные, но еще жизнеспособные клетки. Дальнейшее формирование некроза (в послеожоговом периоде) происходит за счет перинекротических тканей, где имеют место выраженные нарушения кровообращения и биохимических процессов. Известно, что время воздействия термического агента по продолжительности значительно меньше существования тканевой гипертермии.
Основным морфологическим субстратом развития патологических процессов в организме при термической (ожоговой) травме является область перинекроза, где ткани прогреваются (во время и после ожога) до температуры +45...+60 °С.
В перинекротической зоне сужение мелких артерий с последующим паретическим расширением артериол, капилляров и венул приводит к развитию экссудации и возникновению отека. На фоне деструктивных процессов развивается тканевая гиперосмия, снижается осмотическое давление крови с усилением экссудации и развитием отека тканей. Усилению экссудации и дальнейшему развитию отека способствует выход части белков плазмы (в первую очередь альбуминов) с развитием гипопротеинемии, повышением тканевого онкотического давления и снижением внутрисосудистого онкотического давления.
Основным механизмом экссудации является повышение проницаемости сосудистой стенки, которое наиболее активно протекает в первые 8 ч после ожоговой травмы.
Потери жидкости усугубляются испарением с поверхности ожоговой раны вследствие потери кожного барьера «защиты воды» и достигают 100-150 мл с квадратного метра площади поверхности тела в час (Jelenko C.et al., 1972).
Ожоги вызывают гиповолемию в результате массивного перемещения жидкости из внутрисосудистого во внесосудистое пространство и экссудации через поврежденную кожу. Также может наступить сгущение крови (из-за внутрисосудистой потери жидкости) или анемия. Причиной анемии является разрушение эритроцитов, которое происходит как непосредственно вследствие ожога, так и в результате стаза и снижения осмотической резистентности.
При соответствующем восстановлении объема жидкости гемоконцентрация встречается редко. Необходимо поддерживать гематокрит в рамках оптимальных значений от 30 до 40%.
Изменения у обожженных в непораженной части организма
Изменения в ЦНС. Мощный информационно-энергетический поток с места поражения, приводящий к возбуждению ЦНС, совпадает по времени с развитием гиповолемии и нарушением регионарного кровообращения, в том числе и в ЦНС. У обожженных часто развивается энцефалопатия.
Развивающееся в этой ситуации перевозбуждение стресс-реализующих структур усугубляет расстройства гемодинамики. Это проявляется как на уровне микроциркуляции, так и на уровне центральной гемодинамики (ЦГД). Последнее связывается с воздействием на сердечную мышцу БАВ, приводящее к снижению УО за счет отрицательного инотропного действия (Ф.З. Меерсон, М.Г. Пшенникова,
1988).
Ожоговая травма сопровождается развитием гиповолемии, более выраженной в период шока, с дефицитом ОЦК 25-40%, причем дефицит объема циркулирующей плазмы (ОЦП) составляет около 35%, а глобулярного объема 25%. В период токсемии отмечается дальнейшее снижение глобулярного объема.
По мере увеличения площади ожогов гиповолемия нарастает и наблюдается тенденция к более выраженному дефициту плазменного компонента в период ожогового шока, а в период токсемии - глобулярного.
Таким образом, в максимально короткие сроки после травмы необходимо не только быстро восполнить ОЦК, но, что даже более важно на догоспитальном этапе, устранить перевозбуждение стресс-реализующих систем.
Увеличение проницаемости сосудов в малом круге кровообращения приводит к нарушению газообмена в легких. При ожогах имеют место все виды гипоксии. Нарушения в системе дыхания могут быть вызваны опоясывающими (циркулярными) ожогами грудной клетки в случае некроза на всю толщину кожи, когда уменьшается растяжимость грудной клетки, что может привести к гипоксемии и дыхательной недостаточности. У тяжелообожженных отмечаются нарушения негазообменных функций легких, в том числе фильтрационной, кроме того, дыхательные пути могут поражаться термическими факторами с развитием ОДН.
Функция желудочно-кишечного тракта (ЖКТ) ухудшается сразу после ожога изза развития пареза желудка и кишечника. Также имеют место поражения печени в раннем послеожоговом периоде. В разные сроки после ожогов возникают эрозии слизистой оболочки ЖКТ, которые могут привести к желудочному кровотечению или перфорации. Встречаются и другие осложнения, например тромбоз мезентеральных сосудов.
Особое значение у больных с ожоговой травмой приобретает нарушение моторики ЖКТ, которое усугубляет ожоговую токсемию, так как из кишечника при нарушении пассажа пищевых масс токсины попадают в кровь и оказывают отрицательное влияние на организм больных. Ретикулоэндотелиальная система (РЭС), одной из функций которой является обезвреживание токсинов, поступающих в организм, в том числе и из кишечника, в основном сосредоточена в печени и частично представлена в легких. В остром периоде ожоговой болезни (особенно при шоке) на фоне снижения органного кровотока «печеночная» РЭС испытывает перенапряжение в связи с повышенной нагрузкой, ее функции на себя частично принимает РЭС легких, в результате чего нарушаются негазообменные легочные функции с развитием или усугублением уже имеющейся ОДН (Зильбер А.П., 1984;
1989).
Нарушения в мочевыделительной системе у тяжелообожженных могут быть вызваны снижением почечного кровотока из-за гиповолемии, снижения СВ, органного кровотока и АД. Почечный кровоток также может быть снижен по причинам специфичным для ожоговой травмы: это канальцевая обструкция как результат рабдомиолиза и гемоглобинурия на фоне гемолиза.
Эндокринная система. При ожоговом стрессе в крови отмечается значительное повышение содержания катехоламинов, кортикостероидов, глюкагона и других гормонов, что приводит в конечном итоге к потере мышечной массы, а также к ускоренному распаду азотсодержащих веществ (Vanstrum G.S., 1989).
Костно-мышечная система. Циркулярные ожоги конечностей могут приводить к нарушению функции сосудов из-за возросшего интерстициального давления. Чтобы предотвратить ишемический некроз дистальных отделов, в частности пальцев, необходимо рассечение некротических тканей.
После ожога у больных отмечают разнообразные изменения в системе крови. Это может быть микроангиопатическая гемолитическая анемия. В раннем послеожоговом периоде наблюдают тромбоцитопению по причине усиления агрегации тромбоцитов и их улавливания в легких. Тромбоцитопения через 10-14 суток после ожогов сменяется увеличением количества тромбоцитов, которое может сохраняться в течение нескольких месяцев.
У пострадавших после ожогового повреждения иммунная система находится в подавленном состоянии недели и месяцы, а раны служат хорошей средой для бактериального роста.
Классификация термических ожогов
В зависимости от интенсивности теплового воздействия различают низкотемпературные (горячие жидкости, пар, асфальт, расплавленная смола) и высокотемпературные (открытое пламя, расплавленный металл, зажигательные смеси) факторы. Выраженность гипертермии тканей прямо пропорциональна интенсивности и продолжительности нагревания или воздействия термического фактора. Чем больше степень перегрева тканей, начиная от 41 ° и выше, тем быстрее происходит гибель клеток.
Омертвевшие в результате действия термического фактора ткани получили название струпа. Незначительный нагрев кожи (до 60 °) приводит к формированию влажного или колликвационного струпа, который является хорошей средой для возникновения и существования инфекции. В случае более высокого разогрева формируется плотный, сухой или коагуляционный струп.
Местные изменения при ожоговой травме характеризуются глубиной и площадью поражения. Для оценки глубины поражения в нашей стране обычно пользуются классификацией ожогов, принятой на XXVII Всесоюзном съезде хирургов в
1960 г.
В прогностическом плане по способности самостоятельного полноценного заживления все ожоги делят на две группы: поверхностные (I-IIIA степени) и глубокие (III Б-IV степени). Поверхностные ожоги могут самостоятельно (без операции) зажить полноценно, т.е. без образования рубца. Глубокие ожоги неспособны к полноценному самостоятельному заживлению. Без кожной пластики они заживают с образованием более или менее грубого рубца.
Поверхностные ожоги.
I степень. Некроза тканей нет. Отмечаются гиперемия и отек кожи. Поражаются только поверхностные слои эпидермиса, отмечается картина асептического воспаления с парезом капилляров, повышением их проницаемости и отеком зоны поражения. Ожог заживает за 3-4 дня с полным восстановлением структуры кожи (в случае отсутствия инфекции). Единственное последствие такого ожога - местное шелушение.
II степень. Некроза тканей нет. Имеет место более глубокое поражение эпидермиса и повреждение клеток всех его слоев с выраженным экссудативным воспалением. Воспаление серозное и не сопровождается нагноением при правильном ведении ран. Кожа болезненная, гиперемированная, отечная. На коже (сразу после ожога или спустя некоторое время) появляются небольшие и ненапряженные пузыри, наполненные опалесцирующей или светло-желтой прозрачной жидкостью, которая по своему составу напоминает плазму. Если пузыри разрушены, то спиртовая проба резко положительна. Эпителизация происходит в течение 7-14 суток. Из осложнений может оставаться местная гиперпигментация.
III А степень. Некроз есть, но частично сохранен ростковый слой кожи, поэтому возможна эпителизация со дна раны. Резко выражены сосудистые изменения с распространением отека на всю толщину кожи. Образуется струп, сухой или влажный, светло-желтого, коричневого или серого оттенков (в зависимости от характера термического агента и места ожога). Влажный струп возникает под действием сравнительно невысокой температуры, поэтому нехарактерен для глубоких ожогов. Кожа отечна, пастозна, отмечается мраморность или пожелтение кожи. Сухой струп образуется при воздействии высокой температуры и характерен для более глубоких повреждений. Цвет сухого струпа бурый или черный. Через несколько дней после ожога он приобретает четкие границы. Тактильная и болевая чувствительность кожи могут быть сохранены, но чаще снижены. Пузыри большей частью разрушены, содержимое жидкое или желеобразное, насыщенно желтого цвета. Дно раны розовое, влажное. Спиртовая проба сомнительная. Эпителизация ран длится от 4 до 6 недель, при воспалении - до 3 месяцев.
Глубокие ожоги.
III Б степень. Некроз поражает кожу на всю толщу с частичным захватом подкожно-жировой клетчатки. Характерны некоторое углубление ожога вследствие развившихся сосудистых нарушений и развитие патогенной микрофлоры как и при ожогах IIIA степени в ранах. Струп более ригидный и темный, желтый, серый или имеет все оттенки коричневого. Если есть пузыри, то они обычно с геморрагическим содержимым, при их разрушении видно, что дно ожоговой раны сухое, тусклое, с бледными отдельными пятнами или полностью белесоватое, иногда с мраморным рисунком; болевая чувствительность резко снижена или вовсе отсутствует. В общих чертах течение патологических раневых процессов напоминает ожоги при IIIA степени, но отличается тем, что самостоятельного заживления ран не происходит.
IV степень. Некроз и поражение глубоких структур (фасций, мышц и костей). В области ожога имеется коричневый или черный, различной толщины ожоговый струп, сквозь который может просматриваться тромбированная поверхностная венозная сеть. По сравнению с ожогами III A и III Б степени больше выражена интоксикация, чаще возникают местные гнойные осложнения.
Диагностика глубины поражения представляет определенные трудности, особенно в первые минуты и часы после ожога, когда наблюдается внешнее сходство различных степеней ожога, особенно III А-III Б степени. Наиболее точно диагностировать глубину поражения обычно удается к 3-5-му, а иногда только к 7-14-му дню.
Известно, что тяжесть поражения при ожоговой травме определяется не только глубиной, но площадью и локализацией ожога.
Решающее значение площади ожоговой поверхности, как и глубины поражения, очевидно для прогноза и тактики лечения. Многочисленные методики, предложенные отечественными и зарубежными авторами (Г.Д. Вилявин 1956; S. Berkow, 1924), в настоящее время не применяются, так как они сложны и имеют погрешности в подсчете. Наиболее удобными и менее трудоемкими (в практическом применении) являются методики «правило девяток» и «правило ладони».
Согласно «правилу девяток» (A. Wallace 1951) поверхность головы и шеи взрослых составляет 9% от площади поверхности тела (ППТ), одной верхней конечности - 9%, нижней конечности - 18% (бедро - 9%, голень и стопа - 9%); передняя поверхность туловища - 18%, задняя - 18%; промежность и наружные половые органы - 1% ППТ. Вся поверхность тела взрослых спереди составляет 51%, сзади - 49% п.т. В связи с изменением площади различных частей тела с возрастом у детей рекомендуется пользоваться таблицей (Lund C., Browder N., 1944).
Ограниченные ожоги (до 5% у детей и до 10% у взрослых) вызывают преимущественно местные расстройства или быстро проходящую общую реакцию. При обширных ожогах (более 5% у детей и 10% у взрослых) в организме развивается комплекс общих расстройств, следствием которых является развитие ожоговой болезни.
Критическая поверхность ожога, когда невозможна никакая физиологическая компенсация, составляет 15% для взрослых и 10% для детей.
Несмотря на обилие факторов, влияющих на тяжесть поражения, следует стремиться правильно прогнозировать тяжесть ожога и его исход. Наиболее простым приемом прогнозирования тяжести и исхода ожога у взрослых является правило сотни.
По этому правилу определяют прогностический индекс как сумму возраста пострадавшего и общей площади ожога. При этом ожог дыхательных путей учитывается как 10% поражения. Если полученная сумма (прогностический индекс) не превышает 60, - прогноз благоприятный. По данным литературы, летальность при индексе до 60 составляет около 1,1% (Мусалатов Х.А., 1994). При индексе 61-80 прогноз относительно благоприятный, 81-100 - сомнительный, 101 и более - неблагоприятный. При индексе 101 и более летальность превышает 80%.
Для определения прогноза ожоговой болезни наиболее удобно пользоваться индексом Франка (ИФ). При вычислении ИФ исходят из того, что каждый процент поверхностного ожога соответствует 1 единице индекса, а каждый процент глубокого ожога - 3 единицам. Сопутствующие ожоги дыхательных путей (ОДП) эквивалентны 15-30 ед. ИФ в зависимости от их тяжести. Индекс Франка имеет большое значение на этапе оказания квалифицированной и специализированной медицинской помощи.
Если ИФ составляет 65-75 ед., то прогноз ожидается благоприятный; более 75 ед. - сомнительный и неблагоприятный - более 100-120 ед.
Формулировка диагноза ожоговой травмы
Правильное написание диагноза ожога подразумевает следующую последовательность (Цит. по Парамонов Б.А., Порембский Я.О., Яблонский В.Г., 2000).
• На первое место ставят слово «ожог».
• На второе место ставят этиологический фактор - пламя, горячая жидкость, горячий пар, кислота и т.д.
• На третьем месте помещается дробь: в числителе отражают площадь в процентах общего и глубокого поражения, при этом площадь глубокого ожога пишут в скобках; в знаменателе указывают глубину поражения римскими цифрами.
• На четвертом месте перечисляют пораженные участки тела.
• Далее отмечают сопутствующие ожогам кожи поражения, связанные с действием термического агента (ожоги верхних дыхательных путей, отравление оксидом углерода и продуктами горения, общее перегревание).
• При обширных поражениях отражают наличие ожогового шока с указанием степени его тяжести.
• Далее перечисляются сопутствующие травмы и заболевания.
В случае, когда у пострадавшего помимо ожогов кожи имеется поражение дыхательных путей, общее перегревание и другие поражения, на первое место в диагнозе ставят определение «Многофакторное поражение... »
Принципы оказания неотложной помощи при ожогах
На месте получения травмы:
• прекращение действия термического агента;
• охлаждение обожженных поверхностей;
• купирование болевого синдрома;
• обработка раневой поверхности;
• обильное питье (теплый чай, щелочная вода и др.) при отсутствии тошноты и рвоты.
Перед транспортировкой:
• купирование болевого синдрома;
• нейролептики;
• антигистаминные препараты;
• обработка раневой поверхности, если она не была произведена до приезда бригады СП.
В процессе транспортировки (более 1 ч):
• ингаляция кислорода;
• анестезия наркотическими аналгетиками;
• прием щелочно-солевых растворов при отсутствии тошноты и рвоты;
• в/в введение коллоидов и/или кристаллоидов;
• кардиотоники.
Квалифицированная врачебная помощь в условиях стационара (главная первоначальная цель - купировать ожоговый шок). Специализированная медицинская помощь.
Неотложная помощь на месте получения травмы (догоспитальный этап медицинской помощи)
Основные цели неотложной помощи: спасение жизни пострадавшего, предупреждение тяжелых осложнений, снижение выраженности основных проявлений ожоговой травмы (боли, обезвоживания). Неотложная помощь (вообще, а не только при ожогах) включает три группы мероприятий:
• немедленное прекращение воздействия внешних повреждающих факторов и удаление пострадавшего из неблагоприятных условий, в которые он попал;
• оказание неотложной помощи пострадавшему в зависимости от характера и вида травмы;
• организация скорейшей доставки (транспортировки) пострадавшего в лечебное (желательно специализированное) учреждение.
Удаление пострадавшего из опасной зоны и прекращение действия термического агента. Эти мероприятия осуществляется всеми возможными способами. Необходимо прекратить действие поражающих факторов (горячей воды, дыма, химических веществ) на организм. Вынести пострадавшего (при пожаре) из помещения на воздух. При необходимости восстановить и поддерживать проходимость дыхательных путей. Для прекращение действия термического агента можно использовать воду, снег, песок и другие подручные средства. Использовать подручные тканевые изделия следует в последнюю очередь, так как они создают условия для более длительного воздействия высоких температур на пострадавшего. После ликвидации воздействия термического агента следует произвести быстрое охлаждение обожженных участков. При поражении кистей рук необходимо снять кольца, браслеты и пр. для предотвращения отека и ишемии пальцев.
Охлаждение обожженных поверхностей часто является практически единственным действенным методом местного воздействия при оказании первой помощи. Даже спустя 30 мин и более имеет смысл охлаждать ткани, так как это снижает выраженность отека и ранних воспалительных явлений. Оно может быть осуществлено с помощью длительного промывания холодной водой (если это ожоги I-II степени), прикладыванием криопакетов, полиэтиленовых пакетов или резиновых пузырей со льдом, снегом, холодной водой и др. Охлаждение должно проводиться не менее 10-15 мин, не задерживая транспортировки пострадавшего. Оно препятствует прогреванию глубжележащих тканей (тем самым способствуя ограничению глубины термического повреждения), уменьшает боль и степень развития отека. При отсутствии возможности применения охлаждающих агентов обожженные поверхности следует оставить открытыми с целью их охлаждения воздухом.
Купирование болевого синдрома. Болевой синдром в первые часы после ожога является результатом температурного воздействия на ткани и расположенные в них нервные рецепторы. Хотя выраженность болевого синдрома трудно оценить объективно, известно, что при поверхностных ожогах его интенсивность существенно выше, чем при глубоких поражениях, при которых погибают не только нервные рецепторы, но и поверхностные нервы. Поэтому патогенетически оправдано, кроме охлаждения, применение аналгетиков. Препараты НЛА на этом этапе из-за кратковременности эффекта, как правило, не применяются. Также не применяются морфиноподобные аналгетики из-за их побочных эффектов. Допустимо применение препаратов ряда нестероидных противовоспалительных средств (НПВС) - аналгина, баралгина, диклофенака, кеторола в общепринятых дозах.
Обработка раневой поверхности на месте происшествия. Категорически запрещается убирать с пораженной поверхности части обгоревшей одежды, вскрывать ожоговые пузыри. Части обгоревшей одежды следует оставлять в ране, отрезав их ножницами от целой ткани. Пораженную поверхность следует закрыть стерильной повязкой, обильно смоченной раствором любого антисептика (например, фурацилина). Допустимо закрывать рану сухой стерильной повязкой, но это не оптимальный вариант, так как происходит ее быстрое прилипание (присыхание) к ожоговой поверхности, в результате чего возможно травмирование раны при последующем снятии повязки. Не рекомендуется на этапе оказания первой помощи использовать препараты на жировой основе (мази, жиры), так как они создают условия, препятствующие образованию сухого струпа, обладают «термостатическими» свойствами, способствуя тем самым быстрому размножению микроорганизмов. В крайнем случае обожженный участок можно на несколько часов (этап транспортировки) оставить без повязки.
Обильное питье. До приезда бригады скорой помощи (СП) пострадавшему, при обширных ожогах и отсутствии тошноты и рвоты, следует дать теплый чай, щелочную воду и др. Если больной даже не испытывает жажды (это бывает редко), следует проявить настойчивость и убедить его принять хотя бы 0,5-1 л жидкости, особенно, если период последующей транспортировки займет несколько часов. Это необходимо для коррекции развивающейся гиповолемии.
Госпитальный этап медицинской помощи
(выполняется бригадой СП, перед транспортировкой в стационар)
• Купирование болевого синдрома. Для снятия болевого синдрома, особенно при обширных ожогах, пострадавшим вводят транквилизаторы (седуксен), нейролептики (дроперидол), обезболивающие (баралгин, аналгин, кеторол и другие производные ряда нестероидных противовоспалительных средств (НПВС), кетамин (в субнаркотических дозах, внутривенно капельно - 0,5 мг/ кг МТ в час) применение кетамина оправдано тем, что он стимулирует сердечную деятельность. Наркотические аналгетики (морфин, омнопон, промедол, фентанил) и их синтетические заменители (лексир, фортрал, дипидолор) не используют в связи с их отрицательным действием на ЖКТ (тошнота, рвота, парез кишечника). В отдельных случаях можно использовать ингаляционные анестетики (закись азота).
• Нейролептики. Дроперидол, введенный в/в в объеме 2-4 мл, служит определенной защитой против возможного развития шокового состояния или для его частичного купирования (смягчения) при уже развившемся шоке. Необходимо помнить, что при гиповолемии дроперидол может способствовать, особенно у пострадавших старших возрастных групп, усилению гипотензии.
Антигистаминные препараты (димедрол, супрастин, пипольфен и др.) усиливают эффект наркотических препаратов и нейролептиков, обладают седативным действием, предупреждают возникновение часто наблюдаемой при ожоговом шоке рвоты.
Обработка раневой поверхности, если она не была произведена до приезда бригады СП, производится по вышеизложенной методике. Снимать удовлетворительно наложенную повязку для осмотра ожоговой раны нельзя.
Следует подчеркнуть, что на данном этапе оказания неотложной помощи никакие манипуляции на ожоговой ране: туалет, удаление обрывков одежды или вскрытие пузырей - не проводят.
При наличии у пострадавшего клиники ожогового шока, начиная с момента приезда бригады СП, а при возможности и раньше, следует начинать противошоковое лечение, основой которого является в/в инфузионная терапия. Ее следует продолжать и в процессе транспортировки больного в стационар.
Этап транспортировки в стационар (более 1 ч)
Во время транспортировки пострадавшего в стационар обеспечивают проходимость верхних дыхательных путей, продолжают начатую противошоковую инфузионную терапию в/в введением плазмозамещающих и (или) электролитных растворов, ингаляцию кислорода, обеспечивают адекватную анестезию, при необходимости вводят кардиотоники, дают обильное щелочное питье и осуществляют симптоматическую терапию.
Квалифицированная медицинская помощь
Осуществляется в условиях стационара. Главная цель данного этапа лечения - купировать шоковое состояние.
Местное и общее лечение ожогов
Местное лечение ожогов. Важно согласование общего и местного лечения. Основа выбора оптимальной тактики местного лечения - принцип минимизации дополнительного стресса у пациента.
Местное лечение ожоговой раны в зависимости от глубины поражения включает три основных этапа: туалет обожженной поверхности, консервативное лечение обожженной поверхности и хирургическое лечение раны при глубоких ожогах ШБ-IV степени.
Местное лечение возможно после выведения больного из шокового состояния. Туалет обожженной поверхности проводят щадящим способом с соблюдением всех правил асептики. Кожу вокруг раны обрабатывают спиртом или йодопироном, рану орошают раствором фурацилина и удаляют обрывки пузырей. Неповрежденные пузыри необходимо вскрыть для их опорожнения или удалить, для предотвращения образования недренируемого гнойника в случае их инфицирования. Дальнейшее лечение обожженной поверхности можно проводить открыто или под повязкой.
Закрытый метод является единственно возможным при амбулаторном лечении. Без наложения повязки невозможна транспортировка пострадавших. Повязка защищает рану от воздействия внешней среды. При обширных (шокогенных) ожогах перевязки необходимо выполнять под наркозом.
При ведении ожоговых ран открытым методом ускоряется процесс образования струпа под влиянием высушивающего действия воздуха, инфракрасных облучателей или локальных изоляторах с регулируемой абактериальной средой. При открытом методе лечения возможно постоянное наблюдение за изменениями, происходящими в ожоговой ране.
При традиционном повязочном методе лечения ожогов II степени используют эмульсии и мази, которые обладают бактерицидным или обезболивающим действием (0,5% фурацилиновая, 0,1% гентамициновая, 2% линкомициновая, 2% неомициновая). Ожоги II степени заживают через одну-две недели после травмы.
При ожогах III A степени в фазе гнойного воспаления и отторжения поверхностного струпа применяются влажно-высыхающие повязки с растворами антисептиков (фурацилин, риваноль, йодопирон, хлоргексидин).
По мере стихания экссудативных явлений после отторжения некротического струпа и начала эпителизации следует переходить от растворов к мазевым повязкам.
Ожоги IIIA степени заживают от четырех до шести недель и лишь иногда, при поражении глубоких слоев дермы, процесс затягивается до трех месяцев.
Если эпителизация ожогов длительная, применяют стимуляторы репаративных процессов (алоэ, стекловидное тело, витамины, анаболические стероиды).
Местное консервативное лечение ожогов IIIБ-IV степени определяется характером и фазой раневого процесса.
Лекарственные средства, применяемые в 1-й фазе раневого процесса, должны обладать выраженным осмотическим, некролитическим, антибактериальным и по возможности очищающим действием, т.е. они должны способствовать очищению раны от нежизнеспособных тканей, подавлению микрофлоры и оттоку экссудата из раны в повязку.
Главным недостатком большинства применяемых в настоящее время препаратов для лечения ожоговых ран является недостаточная осмотическая активность, низкое антимикробное и некролитическое действие.
Использование различных мазей на жировой основе в первой фазе раневого процесса мало оправдано из-за гидрофобности их основы, не позволяющей поглощать раневое отделяемое. Вследствие этого ухудшаются возможности очищения ран от гноя и некротических масс, что задерживает процесс репарации.
Традиционными препаратами при местном лечении гнойных ран являются растворы антисептиков, что можно объяснить их доступностью, простотой использования и дешевизной. Необходимой антибактериальной активностью из группы препаратов - антисептиков обладают лишь современные антисептики с широким спектром действия: йодопирон, диоксидин, нитрофурановые производные.
Аэрозольные препараты при лечении ран должны применяться ограниченно. В особой степени это относится к аэрозолям - распылителям, содержащим антибактериальные препараты. Такие аэрозоли являются серьезным источником возникновения лекарственных поражений дыхательной системы, а среди медицинских работников являются одной из причин развития аллергических заболеваний. Пенообразующие аэрозоли лишены этих недостатков.
18.10.2. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ХИМИЧЕСКИХ ОЖОГАХ КОЖИ
Данный вид ожогов встречается в результате производственных травм, нарушений техники безопасности, несчастных случаев в быту и др. В зависимости от состава химические вещества оказывают различное воздействие на кожу. Кислоты образуют коагуляционный, а крепкие щелочи - колликвационный некроз. Глубина поражения при химическом ожоге во многом зависит от концентрации вещества и времени экспозиции. Следует помнить, что при химических ожогах редко появляются пузыри, характерные для термических ожогов II-III степени.
Химические поражения кожи случаются значительно реже, чем термические, и составляют, по данным разных авторов, от 2,5 до 5,1% случаев в общей структуре ожогового травматизма. Чаще всего они имеют ограниченный характер и в 90%
случаев не превышают 10% поверхности тела. В 43-51% к возникновению ожогов приводит действие кислот, в 21,5-25% - щелочей, в остальных случаях поражения вызваны воздействием прочих химических веществ (Цит. по Парамонов Б.А., Порембский Я.О., Яблонский В.П., 2000).
Химические ожоги возникают в результате попадания на кожу агрессивных веществ, так называемых коррозивных ядов, чаще - крепких растворов кислот и щелочей, способных в течение короткого времени вызывать омертвение тканей. Поражающее действие химических веществ начинается в момент соприкосновения их с тканями и продолжается до завершения химических реакций.
При воздействии на кожу степень повреждения зависит от таких факторов, как: свойства вещества, его концентрация, длительность контакта. Имеет значение также проницаемость и устойчивость тканей в месте повреждения. Ожоги щелочью, как правило, глубже и серьезнее, чем кислотой.
Некоторые вещества, вызывающие химические ожоги, например фосфор, всасываясь, оказывают общетоксическое действие, что вызывает жизнеопасные нарушения.
Причиной обширных и даже угрожающих жизни ожогов в результате повреждения кожных покровов могут быть инфекционные процессы и медикаментозные реакции. 10% поражение коррозивными ядами (по площади) организмом самостоятельно не компенсируется, требуется терапия.
Глубина поражения кожи, распространенность ожога, длительность заживления зависят от количества попавшего вещества, его концентрации, времени пребывания на коже, а также от быстроты удаления и нейтрализации вещества. Ожоги, вызываемые минеральными кислотами, щелочами, солями тяжелых и щелочных металлов, галогенопроизводными являются наиболее частым видом производственной травмы. При действии на кожу концентрированных кислот и щелочей происходит быстрое нарушение целостности клеток и их гибель, вследствие чего первичным проявлением может быть некроз, возникающий практически немедленно после попадания вещества на кожу. При попадании на кожу менее концентрированных растворов поражение может выявляться по истечению некоторого срока, иногда - даже через несколько дней.
Поражения кислотами
Кислоты вызывают коагуляцию тканевых белков и обезвоживают ткани. Сила поражающего действия кислот зависит от концентрации в них водородных ионов, а также от способности растворяться в жирах кожи. В месте контакта с кислотой образуется плотный сухой струп, который имеет четкие границы и, как правило, не возвышается над кожей, а даже западает. По краям имеется полоса гиперемии, свидетельствующая о развитии воспалительной реакции. Глубина поражения может быть различной, но чаще всего случаются глубокие поражения. Сильное прижигающее и обезвоживающее действие кислот практически полностью исключает образование пузырей.
Неорганические кислоты
Внешний вид участка ожога зависит от типа химического вещества. При ожогах серной кислотой струп коричневый или черный, азотной - желто-зеленого оттенка, соляной - светло-желтый. В ранние сроки может также ощущаться запах вещества, вызвавшего ожог.
Серная кислота. При действии данного вещества нередко возникают ожоги IV степени. При действии серной кислоты на ткани происходит выделение тепла, поэтому поражение часто имеет характер термохимического. При попадании на кожу концентрированной серной кислоты возникает резкая боль, вокруг области ожога появляются покраснение кожи и нарастающий отек. Как правило, пузыри не успевают образоваться, так как быстро наступает омертвение тканей с образованием грязновато-серой пленки или коричневого струпа. Струп бывает белого цвета, впоследствии приобретает темно-красную окраску. При действии на кожу общее (резорбтивное) действие, как правило, выражено слабо. В связи с тем, что серная кислота может «парить» с выделением серного ангидрида, возможно развитие тяжелых ингаляционных поражений.
Азотная кислота. Поражает кожу сильнее, чем серная. На ткани действуют не только ионы водорода, но и анионы, что приводит к разложению белка. Кроме того, азотная кислота может вызвать ингаляционные поражения пятиокисью азота при испарении азотной кислоты на воздухе. Если кислота более 30% концентрации, то она вызывает образование струпа зеленовато-желтого цвета. При контакте азотной кислоты с органическими материалами (одежда, солома, древесные стружки) возможно их возгорание с выделением окиси азота.
Соляная кислота. Хлористоводородная кислота существует в нескольких разновидностях: синтетическая (содержит не менее 31% HCl, а также примеси мышьяка, железа и тяжелых металлов); техническая кислота (27,5% раствор HCl с примесями серной кислоты и железа); ингибированная кислота (19-20% HCl); кислота для пищевой промышленности (до 31% HCl) с примесью свободного хлора, серной и сернистой кислот.
«Царская водка» (смесь соляной и азотной кислот). Царская водка по своему действию стоит ближе к азотной кислоте. Обладает резко выраженным прижигающим действием.
Плавиковая кислота, или фтористо-водородная кислота, - это водный 40-70% раствор фтористого водорода. Для поражения плавиковой кислотой характерен скрытый период длительностью от 4 до 6 ч, в течение которого развиваются дистрофические изменения в коже и тканях. Кожа становится белой, возникает интенсивная боль, появляются пузыри на коже, при вскрытии которых обнаруживаются студнеобразные «вареные» ткани, в которых быстро развивается нагноение. В силу того, что ионы фтора глубоко проникают в ткани, действие плавиковой кислоты продолжается даже после ее удаления с кожи, что и способствует иногда развитию тяжелых поражений.
Органические кислоты
Считается, что органические кислоты, относясь к «слабым», по силе поражающего действия на ткани организма человека уступают неорганическим кислотам. В то же время органические кислоты испаряются и при развитии ингаляционных поражений резко выражено их резорбтивное действие.
Уксусная кислота, даже концентрированная, глубоко в кожу не проникает, чему препятствует вызванный ею поверхностный струп.
Карболовая кислота и ее производные. Карболовая кислота состоит из 90% фенола и 10% воды. Для нас наибольшее значение имеет ее дериват лизол, обладающий раздражающим и прижигающим действием. Карболовая кислота - протоп-
лазматический яд, который коагулирует белки с образованием плотного струпа. Ее соединения могут способствовать образованию пузырей и участков глубокого некроза, что зависит от длительности нахождения этих веществ на коже.
Фенол оказывает выраженное действие на ЦНС и угнетение дыхательного центра при его резорбции даже через неповрежденные участки кожи.
Муравьиная кислота. Муравьиная кислота, так же как и ее альдегид (формальдегид), водные растворы которого называют формалином, обладают способностью коагулировать белки с образованием на коже струпа белого цвета. Эти же препараты могут оказывать и общетоксическое действие, проникая через кожу.
Поражения щелочами
Существует условное разделение щелочей на «сильные» и «слабые», в зависимости от того, насколько глубоко эти вещества могут проникать вглубь тканей.
В отличие от кислот, щелочи (особенно их концентрированные растворы) быстрее нарушают целостность кожных барьеров за счет гидроксильных радикалов, способствующих растворению и эмульгированию жиров кожи, что дает им возможность глубже и «шире» проникать в ткани пострадавших. Щелочи вызывают также большие по величине, чем область их контакта с поверхностью кожи, участки влажного некроза с образованием рыхлого, грязно-белого струпа. При воздействии щелочей на ткани отсутствует демаркационный вал и значительно медленней, чем при ожогах кислотами, идут репаративные процессы с формированием грануляций. Особенно опасны нагретые щелочи, они растворяют не только кожу и подкожно-жировую клетчатку, но даже ногти и волосы. Чаще всего встречаемые щелочи - это гидрат окиси кальция (гашеная известь), окись кальция (негашеная известь), едкий натр (каустическая сода), едкий калий, гидроокись аммония. Наибольшие поражения тканей возникают под действием каустической соды и едкого калия, они вызывают покраснение кожи, образование пузырей, в меньшей степени оказывают воздействие гашеная и негашеная известь, но только при длительной экспозиции. Нашатырный спирт, как правило, вызывает воспалительную реакцию с образованием местного отека, если же действие было длительным, может произойти некроз эпидермиса.
Неотложная помощь. Оказание неотложной помощи данной категории пострадавшим требует наличия определенных знаний о характере действия химических веществ. Это необходимо для того, чтобы правильно оказать помощь и при этом самому не получить поражение. Во многих случаях без наличия защитной одежды, противогазов, а также при отсутствии работающей приточно-вытяжной вентиляции к пострадавшему опасно приближаться. Следует защищать глаза от попадания паров и брызг агрессивных жидкостей. В частности, при работе с плавиковой кислотой, разрушающей стекло, необходимо применять специальные жировые смазки для стекол очков, а лучше применять очки из органического стекла.
Основным действием при оказании первой помощи пострадавшему является немедленное удаление химического вещества.
При оказании помощи следует учитывать особенности происходящих при этом химических реакций. В частности, при соединении ряда химических соединений (серной кислоты, извести и др.) с водой происходит реакция с большим выделением тепла. Поэтому целесообразно использовать проточную холодную воду.
При поражении кожи плавиковой кислотой необходимо тщательно и длительно (в течение 3-5 ч и более) промывать кожу для удаления не только самой кислоты, но и глубоко проникших в ткани кожи ионов фтора.
Необходимо немедленно удалить одежду, пропитанную кислотой или щелочью, и обильно промыть пораженный участок проточной водой (не менее 10-15 мин), но не под напором! Если помощь оказывается с некоторым опозданием, продолжительность обмывания увеличивают до 30-40 мин. При ожогах фтористоводородной (плавиковой) кислотой промывание раны следует проводить не менее 2-3 ч. Эффективность первой помощи оценивают по исчезновению характерного запаха химического вещества или по изменению цвета лакмусовой бумаги. После обмывания пораженные места можно промыть раствором натрия бикарбоната при ожогах кислотами, или лимонной (1% уксусной) кислотой при ожогах щелочами. Затем накладывают сухую асептическую повязку и вводят обезболивающее средство.
Нерационально применение нейтрализующих растворов без предварительного смывания химического агента проточной водой. Установлено, что нейтрализация агрессивных веществ происходит только в поверхностных слоях кожи, а в глубине их взаимодействие с тканями продолжается. Однако при некоторых видах химических ожогов соединения, нейтрализующие поражающее вещество, все же следует использовать (см. табл. 18-10). При наличии шока борьба с его проявлениями проводится по общепринятым методикам (см. раздел 18.9.4. Ожоговый шок).
Таблица 18-10. Нейтрализующие вещества, рекомендуемые при некоторых видах
химических ожогов (Сводные данные: Р.И. Муразян, Н.Р. Панченков, 1983; В.М. Бурмистров, А.И. Буглаев, 1986)
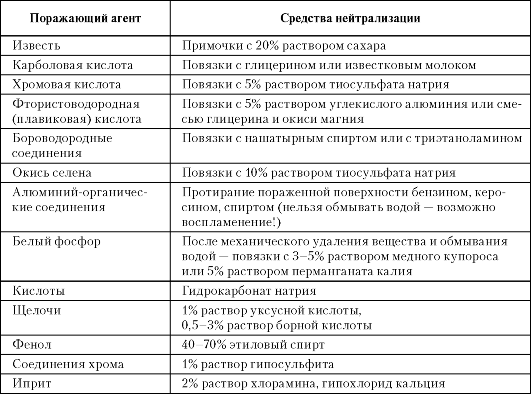 Рекомендованные ранее другие способы нейтрализации химических веществ на практике оказались малоэффективными (Парамонов Б.А, Порембский Я.О., Яблонский В.Г., 2000).
Рекомендованные ранее другие способы нейтрализации химических веществ на практике оказались малоэффективными (Парамонов Б.А, Порембский Я.О., Яблонский В.Г., 2000).
Далеко не всегда под рукой пострадавшего оказываются нужные реактивы. Кроме того, довольно сложно определить, какое количество антидота необходимо для полной нейтрализации. В ряде случаев при осуществлении химической нейтрализации выделяется большое количество тепла, что оказывает неблагоприятное влияние на ткани. Часто попытки прибегнуть к методу нейтрализации ведут лишь к потере драгоценного времени.
В ряде случаев обработка пораженного участка смоченным тампоном приводит к тому, что вещество лишь еще глубже втирается в кожу. Поэтому лучше смывать попавшее вещество струей воды. Таким образом, метод смывания химических веществ с кожи до сих пор остается основным. Вместе с тем далеко не всегда можно использовать воду. В ряде случаев целесообразно использовать другие вещества. В частности, алюминий, органические соединения, воспламеняющиеся при соприкосновении с водой, смываются керосином, бензином или спиртом.
После проведенного промывания иногда можно прибегнуть к химической нейтрализации. При этом нельзя использовать концентрированные растворы нейтрализующих составов. В случае ожогов, вызванных действием концентрированных кислот, используют «кашицу» из соды.
При ожогах щелочами раны промывают слабыми подкисленными растворами.
При ожогах известью используется 20% раствор сахара в виде примочек, который переводит раздражающий кожу гидрат окиси кальция в нейтральное соединение.
При ожогах, вызванных солями металлов (азотнокислым серебром, медным купоросом, хлористым цинком), применяют 2-5% раствор двууглекислой соды.
При ожогах плавиковой кислотой кожу пораженных участков обрабатывают 10-12% раствором аммиака в течение 1-3 мин с последующим промыванием водой. Эти процедуры повторяют многократно в течение 30-40 мин. Кроме того, применяют 5% раствор углекислого алюминия или присыпку с порошком-смесью двууглекислого натрия с борной кислотой. Можно наложить также повязку со смесью глицерина и окиси магния.
При ожогах карболовой кислотой накладывают повязки с глицерином. При ожогах фосфором должна быть немедленно снята одежда, а пострадавший погружен в ванну с водой.
18.10.3. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ЭЛЕКТРОТРАВМЕ
Поражения электрическим током возникают чаще всего вследствие непосредственного контакта с токопроводящим проводником или через электрическую дугу, образующуюся в результате ионизации воздуха между человеком и источником электричества.
Электрический ток распространяется преимущественно по тканям с высокой электропроводностью (кровь, спинномозговая жидкость, мышцы), наименьшей электропроводностью обладают сухая кожа, кости, жировая ткань.
Электротравмой называют местные и общие изменения в организме, вызванные действием электрической энергии. В структуре травматических повреждений
человека электротравма встречается редко - 1-2,5% от всех механических повреждений. Частота летальных исходов от поражения электричеством составляет 10% (Парамонов Б.А., Порембский Я.О., Яблонский В.Г., 2000).
Различают несколько вариантов поражения техническим электричеством.
• При непосредственном контакте с проводником электрического тока.
• Бесконтактно. Через дуговой контакт при поражении током высокого напряжения.
• «Шаговое напряжение», которое возникает из-за разности потенциалов на двух конечностях, касающихся земли вблизи лежащего на грунте провода.
Электроожоги вследствие воздействия электрического тока возникают потому, что электрическая энергия преобразуется в тепловую и при этом существенно повреждает ткани и органы. Причем в наибольшей степени страдают ткани с высоким сопротивлением - кожа и кости.
Направление распространения электрического тока часто скрыто. Есть такое понятие как «путь прохождения электрического тока через тело человека», наиболее опасными считаются те, которые проходят через сердце. При этом возникает фибрилляция миокарда. Ожоги же распространяются вглубь тканей по типу «воронки» или «айсберга», когда видимая часть ожога значительно меньше по величине, чем невидимая. На коже находят метки электрического тока. Функциональное обследование может и не выявить точную локализацию и выраженность поврежденных тканей.
Для электротравмы характерны «скрытый» период клинических проявлений, медленное отторжение некротических тканей, заторможенность регенеративных процессов, очаги остеолиза в костях, а также отсутствие воспалительных изменений вокруг мест приложения тока (ожогов) (Неговский В.А., 1977).
Клинические наблюдения показывают, что при внезапной смерти здорового человека реанимационные мероприятия могут быть эффективными даже спустя 8-10 мин после наступления фибрилляции сердца или остановки дыхания (Неговский В.А., 1977).
Включение человека в цепь электрического тока может быть одноили двуполюсным. Чаще встречается однополюсное подключение, когда пострадавший прикасается к одному полюсу. Однополюсное включение в цепь при отсутствии заземления неопасно. Двухполюсное подключение подразумевает прикосновение пострадавшего к двум источникам электрического тока. При таком включении исход травмы зависит от путей прохождения электрического тока по телу пострадавшего.
Выделяют своеобразную форму поражения человека электрическим током под названием «шаговое напряжение». Шаговое напряжение - это такой вид поражения человека электрическим током, когда он попадает в «электрический кратер». «Электрический кратер» образуется при электризации почвы, в случаях соприкосновения с ней оборванного провода линии высоковольтной передачи. Поражение электрическим током возникает при движении человека поперек концентрических линий «электрического кратера».
Чем шире шаг человека, тем больше разность потенциалов между точками опоры человека, т.е. подошвами и тем сильнее действие электричества. Поэтому в «электрическом кратере» необходимо передвигаться «гусиным шагом» т.е. так, чтобы носок обуви одной ноги касался (на земле) пятки другой ноги. Безопаснее если человек будет двигаться под острым углом к концентрическим линиям кратера.
Поражающее действие электрического тока зависит от его физических характеристик, а также условий контакта и свойств организма пострадавших. Физические характеристики тока складываются из его силы, напряжения, частоты и типа.
Сила тока. Опасным для жизни человека ток становится когда его величина равна или превышает 0,1 А. Определяющим фактором, от которого зависит поражение электрическим током человека, является электрическое сопротивление тела человека, которое формирует величину протекающего тока и интенсивность поглощения энергии. На электрическое сопротивление тела человека, главным образом его кожного покрова, влияет множество факторов: влажность кожи, ее целостность, состояние нервной проводимости, влажность окружающей среды, время года и т.д. Наибольшее сопротивление имеет сухая кожа, ее увлажнение снижает сопротивление во много раз, что способствует увеличению силы тока, проходящего через тело человека, а значит и его опасность для жизни пострадавшего. В зависимости от мощности тока (напряжения) электротравму можно разделить следующим образом.
• Низковольтная, до 1 000 Вт напряжения.
• Высоковольтная, напряжение составляет выше 1 000 Вт.
• Сверхвысоковольтная, десятки и сотни кВт (Парамонов Б.А., Порембский Я.О., Яблонский В.Г., 2000; Петрова И.Ф., Петров Н.В., Торяник Е.Н., 2000).
Токи, сила которых достигает 25-80 мА, могут при достаточной экспозиции вызвать острую электрическую асфиксию. Наибольшую опасность для жизни представляют токи силой более 100мА, обусловливающие прекращение координированных сокращений сердца и наступление фибрилляции.
Токи высокого напряжения вызывают смертельные поражения в меньшем проценте случаев, чем токи боле низкого напряжения. При высоком напряжении поражается преимущественно дыхательный аппарат.
Переменный ток значительно опаснее постоянного. С ростом напряжения увеличивается поражающая сила постоянного тока. Ток частотой порядка 50 Гц наиболее опасен в отношении развития фибрилляции желудочков, ток, частотой порядка 200 Гц вызывает остановку дыхания.
Весьма неблагоприятно на исход лечения влияет продолжительность воздействия тока.
Тетаническое сокращение дыхательных мышц возникает при прохождении тока вдоль туловища. В момент замыкания тока происходит сильный выдох, так как мышцы выдоха сильнее, чем мышцы вдоха. При величине тока 15-25 мА возникают судорожные сокращения мышц, которые становятся настолько сильными, что пострадавший лишается возможности самостоятельно отключиться от токонесущего предмета (феномен «неотпускающего тока»). Токи, сила которых достигает 25-80 мА (при достаточной экспозиции), могут вызвать острую электрическую асфиксию. Трансбульбарное прохождение тока может вызвать спазм голосовой щели.
При прохождении тока через сердце возникают различные нарушения функции возбудимости и проводимости, характер которых определяется физическими параметрами тока и временем его воздействия.
Остановка сердца при электротравме не всегда связана с фибрилляцией желудочков но может быть обусловлена раздражением блуждающего нерва (Неговский В.А., 1977).
Так, напряжение до 40 В обычно не вызывает смертельных поражений человека. Смертельные и тяжелые поражения чаще всего отмечаются при воздействии
электрического тока бытового назначения. Его напряжение составляет 127-220 В, а частота 50 Гц. Промышленный трехфазный электрический ток с частотой 50 Гц вызывает тяжелую электротравму.
При прохождении низковольтного (до 1 000 В) тока через организм человека смерть происходит чаще всего вследствие развития фибрилляции сердца.
Токи высокого напряжения (свыше 1000 В) оказывают выраженное теплотворное действие в местах контакта, что приводит к возникновению электроожогов.
Низковольтный (до 500 В) переменный ток более опасен для человека, чем постоянный, свыше 500 В более опасен постоянный ток. Наиболее опасным для человека является действие переменного тока с частотой 50 Гц (тока бытового назначения), вызывающего фибрилляцию сердца.
Для возникновения поражений электрическим током большое значение имеют пути его прохождения через организм человека, так называемые «петли тока». Наиболее опасна та «петля тока», которая проходит через сердце, например: левая рука - левая нога или рука - рука.
Наиболее тяжелые последствия имеют место при прохождении тока от одной руки к другой, от левой руки или от обеих рук к ногам, от головы к рукам или ногам.
Клинические проявления воздействия электрическим током подразделяются на общие (электротравма) и местные (электроожоги). Нередко они сочетаются.
Возможны потеря сознания (кратковременная или глубокая и длительная), цианоз, гипотензия, нередко повышается АД вследствие сосудистого спазма. При резком угнетении сердечно-сосудистой деятельности и дыхания пострадавшие иногда производят впечатление умерших («мнимая смерть»). Это состояние, как правило, обратимо при своевременном реанимационном пособии. В ряде случаев при потере сознания пострадавший не способен оторваться от токонесущего проводника, а при падении с высоты получает механические травмы различной тяжести.
Определенное значение имеют электрохимический и механический эффекты. При действии токов очень высокого напряжения могут возникать повреждения в виде расслоения тканей и даже отрывы конечностей (взрывоподобное действие электрического разряда). Вследствие судорожного сокращения мышц возможны отрывные и компрессионные переломы костей.
Электроожоги практически всегда бывают глубокими (III Б-IV степени). Ткани повреждаются в местах входа и выхода тока, на соприкасающихся поверхностях тела по пути кратчайшего прохождения тока, иногда в зоне заземления. Пораженные ткани обычно представлены сухим струпом, как бы вдавленным по отношению к окружающей неповрежденной коже. Возможна вторичная гибель тканей из-за спазма и тромбоза кровеносных сосудов, в том числе и магистральных. Процесс отторжения омертвевших тканей протекает длительно из-за большой глубины поражения (некроз мышц, сухожилий и даже костей). Нередко развиваются гнойные осложнения.
Электрические ожоги часто сочетаются с термическими, вызванными вспышкой электрической дуги, воспламенением одежды. Для таких ожогов характерно закопчение и металлизация обожженных участков как следствие «разбрызгивания» и сгорания мелких металлических частиц проводников. Поражаются преимущественно открытые части тела (лицо, кисти), а ожоги обычно поверхностные, но при воспламенении одежды они, как правило, глубокие.
При повреждении организма человека электрическим током различают специфическое и неспецифическое его воздействие. К специфическим видам воздейс-
твия тока относят биологическое, электрохимическое, тепловое и механическое. К неспецифическим видам воздействия тока относят воздействие яркой вспышки (вольтовой дуги) на органы зрения, разрывы полых органов, переломы костей при судорожных сокращениях мышц и т.д.
Биологическое действие тока заключается в том, что, оказывая действие на нервные рецепторы и ткани организма, он вызывает фибрилляцию миокарда, вызывая тоническое сокращение мышц, нарушает функцию внешнего дыхания, артериальную гипертензию и т.д. Электрохимическое и тепловое действие тока заключается в том, что возникают электроожоги и прежде всего в местах входа и выхода электрического тока при прохождению его через тело человека, прежде всего это кожа и кости. Что касается механического воздействия тока, то оно заключается в расслоении и разрыве тканей из-за быстрого выделения большого количества тепловой энергии при прохождении токов высокого напряжения через ткани человека.
Клиническая картина травмы имеет своеобразный характер, который заключается в том, что прохождение электрического тока через организм человека вызывает общие нарушения и местные изменения тканей. Как сроки развития, так и степень выраженности этих нарушений могут быть разными. К примеру, смерть пострадавших может быть мгновенной, а может наступить через несколько дней после травмы. Воздействие электрического тока высоких энергий, особенно в случаях выраженных ожогов, может и не вызывать гибели пострадавшего. Но ведущими симптомами в клинике поражения электрическим током являются нарушения в сердечно-сосудистой системе и системе дыхания. Это - фибрилляция миокарда, мерцательная аритмия, ишемические изменения в миокарде вплоть до некроза. Тяжесть и исход электротравмы во многом зависят от общего состояния пострадавшего, его возраста, наличия и выраженности сопутствующей патологии.
Среди местных проявлений при поражении электрическим током превалируют электроожоги, которые в зависимости от величины напряжения могут быть различной глубины, но редко (в чистом виде) занимают большую площадь. В основном поражение распространяется на всю толщу кожи и подкожно-жировую клетчатку в виде воронки, т.е. чем глубже ожог, тем большие массивы тканей он поражает. Такое явление еще называют феноменом айсберга. Прохождение электричества через конечности иногда сопровождается повреждением сосудистонервного пучка, что заставляет нередко производить в дальнейшем ампутации. Наиболее тяжело протекают электроожоги головы из-за того, что малое количество мягких тканей и высокое сопротивление костей черепа создают такие условия, при которых токи высокого напряжения вызывают ожоги IV степени. При электроожогах у пострадавших на коже часто находят различной окраски, от белой до черной, мозолевидные образования с западением в центре, которые по форме соответствуют токонесущим контактам, так называемые «метки тока».
В настоящее время из-за отсутствия единой классификации электротравм, в практической деятельности применяется классификация, где учитывается четыре степени тяжести поражения (Цит. по Парамонов Б.А., Порембский Я.О.,
Яблонский В.П., 2000):
I степень - кратковременные судорожные сокращения мышц без потери сознания;
II степень - судорожное сокращение мышц с потерей сознания, но сохранившимся дыханием и функцией сердца;
III степень - потеря сознания и нарушение сердечной деятельности или дыхания (либо того и другого вместе);
IV степень - моментальная смерть.
Неотложная помощь при поражении электричеством заключается в том, что выполнение относительно простых мероприятий в первые минуты после электротравмы часто позволяет сохранить жизнь пострадавшему. Главное условие оказания помощи - это обесточить пострадавшего, т.е. прекратить действие электрического тока на человека путем отключения тока, либо оттащить пострадавшего от токонесущего предмета с соблюдением всех правил и мер предосторожности (согласно инструкции). Во всех случаях развития клинической смерти в том числе «состоянии мнимой смерти», которая для непрофессионала ничем не отличается (внешне) от клинической смерти, необходимо проводить комплекс реанимационных мероприятий в течение 40-45 мин (желательно до появления самостоятельного дыхания), либо до появления трупных пятен (при неэффективности реанимационных мероприятий). В случаях нарушения ритмической деятельности сердца обязательна электрическая кардиоверсия либо дефибрилляция, при отсутствии дефибриллятора реанимационные мероприятия необходимо начинать с механической дефибрилляции, т.е. прекардиального удара.
В случаях положительного исхода реанимационных мероприятий больных необходимо госпитализировать на 3 дня с соблюдением постельного режима независимо от тяжести поражения, если нет необходимости проведения терапии локальных проявлений электротравмы. Наличие неврологических и психопатологических последствий воздействия электрического тока у пострадавших требует наблюдения или консультации специалистов разного профиля (терапевтов, невропатологов и др.).
18.10.4. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ХОЛОДОВОЙ ТРАВМЕ (ОТМОРОЖЕНИЯ, ОБЩЕЕ ОХЛАЖДЕНИЕ ОРГАНИЗМА)
Отморожения
Отморожения определяются как патологический синдром, возникающий при длительном воздействии низких температур на отдельные участки тела, чаще конечности.
Патогенез. При длительном воздействии низких температур наступает расстройство кровообращения в коже, а затем и в глубжележащих тканях с неизбежным нарушением терморегуляции, микроциркуляции, КЩС, водно-электролитного обмена, иннервации и др. Процесс может носить как обратимый, так и необратимый характер.
Классификация. В течении холодовой травмы выделяют дореактивный и реактивный периоды, четыре стадии течения процесса и четыре степени отморожения.
Дореактивный период исчисляется с момента получения холодовой травмы и до начала согревания. Реактивный период развивается после согревания, и для него характерно развитие гипоксии, воспаления и некроза тканей. Клинически степени отморожения и глубину поражения достоверно можно установить только через 12-24 ч после воздействия холодового агента, а иногда и позже.
Дореактивный период
Любая форма холодовой травмы начинается со «скрытого периода». Для него характерно появление первичных симптомов холодового поражения в виде ощущения онемения, зуда, «одеревенения». Ходьба становится невозможной, или больной жалуется, что он не чувствует движений стоп и прикосновений к почве. Иногда возникают сильные, ломящие боли в стопах и икрах. Обычны жалобы на «холодные ноги». В этой стадии кожа пятнистая (мраморная) или слегка цианотично-серая. Ощущения при отморожении, о которых рассказывают больные, сводятся к различным формам нарушения чувствительности. Первоначальное ощущение холода вскоре сменяется покалыванием, жжением, извращением ощущений и анестезией. В отмороженной конечности появляется чувство тяжести, ощущение мурашек, при ходьбе нет чувства грунта. При обнаружении пострадавший заторможен, двигательная активность затруднена. Кожные покровы бледносинюшного цвета, холодные на ощупь. Тактильная и болевая чувствительность отсутствует или резко снижена. Возможно подавление зрачковых рефлексов. Температура тела меньше 36 °С. Схематически возникновение болей при отморожениях можно представить следующим образом (таб. 18-11).
Таблица 18-11. Соотношение болевого синдрома и стадии отморожения
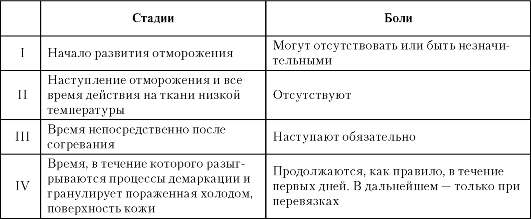 Реактивный период
Реактивный период
Интенсивность болей после согревания зависит от глубины и распространения патологического процесса.
При отморожениях I степени пострадавшие испытывают колющие и жгучие боли в местах поражения, ломоту в суставах, иногда нестерпимый зуд, заставляющий больных расчесывать кожу; чувство отека кожи, различного рода парастезии. Объективно при осмотре пораженного участка отмечается отек кожи и изменение ее окраски. Цвет кожи чаще всего бывает темно-синим, багрово-красным; иногда вся кожа имеет мраморный вид из-за сочетания белого, синего и красного цветов на различных участках. Изменения внешнего вида кожи обычно равномерно захватывают всю стопу, кисть, или большую их часть. В этом заключается одно из отличий отморожений I степени от остальных степеней, при которых тяжесть объективных изменений возрастает по направлению к периферии тела (Т.Я. Арьев, 1966).
При отморожениях II степени болевые ощущения те же, что и при отморожениях I степени, но более интенсивны, появляются в промежуток времени, предшествующий развитию «скрытого» периода, исчезают в скрытом периоде и, как правило, возникают вновь при развитии отека. Обычно боли держатся 2-3 дня, но в некоторых случаях и дольше. Неодинаковой является и интенсивность болей. Чаще всего они незначительны или даже отсутствуют вовсе, но у некоторых больных они бывают очень сильными. Объективную картину при отморожении II степени определяют пузыри, которые появляются обычно в течение первых двух дней, но могут возникать и позже, до 7-8-го дня включительно. Содержимое пузырей обычно прозрачное, по консистенции оно иногда желеобразное. Дно пузыря розового цвета, обычно покрыто фибринозным налетом. В результате отморожения II степени, при котором практически отсутствуют явления некроза, структура кожи существенно не меняется, грануляций и рубцов не возникает.
При отморожении III степени субъективные ощущения в общем аналогичны ощущениям при отморожении II степени, но более интенсивны и продолжительны. Объективную картину определяет некроз кожи и подлежащих слоев мягких тканей. Развитие патологического процесса проходит три стадии: 1) стадию омертвения и пузырей; 2) стадию отторжения некротических тканей и развития грануляций; 3) стадию рубцевания и эпителизации.
Отморожения IV степени. Объективные признаки тотального омертвения при отморожении до согревания не имеют особенностей. Интенсивность болевого синдрома зависит от объема и глубины поражения тканей. Отчетливая демаркационная линия образуется, в среднем, на 12-й день.
Неотложная помощь. Неотложная помощь заключается в восстановлении температуры тканей, борьбе с шоком, нормализации кровообращения, ликвидации тканевой гипоксии.
Восстановление температуры тканей. Пострадавшего необходимо внести в теплое помещение, раздеть. Пораженную конечность обрабатывают спиртом или любым другим антисептиком, вытирают насухо и на нее накладывают теплоизолирующую повязку: слой марли, толстый слой ваты, вновь слой марли и далее прорезиненной тканью закрывают всю конечность. В домашних условиях можно использовать любой теплоизолирующий материал (например, пальто, одеяло и др.). В условиях клиники можно применить метод активного, но не форсированного согревания в ванне со слабым раствором перманганата калия. Пораженную конечность предварительно осторожно растирают сухой, желательно, шерстяной тканью. Согревание начинают с температуры воды в 18 °С, поднимая ее до 35 °С в течение 10-15 мин. Возникновение болевого синдрома и быстрое его окончание во время проведения данной процедуры является хорошим прогностическим признаком и указывает на наличие отморожения I, максимум, II степени. После купирования болевого синдрома и окончания согревания накладывают повязку с вазелином, мазью Вишневского. Вопрос о госпитализации решается в индивидуальном порядке после консультации хирурга. Если при растирании и согревании конечности болевой синдром возникает, но не проходит, а пораженная конечность остается бледной и холодной, то это указывает на глубокое отморожение III-IV степени и является бесспорным показанием для госпитализации пострадавшего. При лечении больных в дореактивном периоде широкое применение получила УВЧ-терапия. Отмечается значительное болеутоляющее действие этой процедуры, а также резкое уменьшение последующего отека пораженных тканей (В.П. Котельников, 1988).
Сразу после холодовой агрессии энергетические потребности организма оказываются значительно увеличенными и удовлетворяются за счет повышенного катаболизма. Это дает основание использовать больным с отморожением алкоголь. Он действует как снотворное, анальгезирующее, питательное и энергетическое средство. Для купирования болевого синдрома используются наркотики в общепринятых дозах.
Борьба с шоком, нормализация кровообращения, ликвидация тканевой гипоксии производится по принципам, изложенным в разделе «Неотложная помощь при шоке».
При обсуждении методик лечения отморожений на этапе доврачебной и первой врачебной помощи необходимо акцентировать внимание медицинских работников на двух вопросах: растирание пораженной конечности снегом и дача алкоголя.
Растирание пораженной конечности снегом. Широко распространенное в быту мнение, что пораженную конечность на этапе оказания первой помощи необходимо растирать снегом, следует признать неправомочным, так как это не способствует согреванию пораженной конечности и восстановлению микроциркуляции крови. Кроме того, кристаллы снега вызывают микротравмы пораженной кожи, что в последующем чревато осложнениями (инфицирование кожи).
Дача алкоголя в умеренной дозе (50-100 мл 40% спирта) вызывает расширение сосудов в системе микроциркуляции, благодаря чему органный кровоток увеличивается и, как следствие этого, возникает ощущение тепла в зоне отморожения, что обусловлено усиленной теплоотдачей. Таким образом, применение алкоголя при отморожениях должно быть строго дифференцированным. Если после обнаружения пострадавший будет помещен в теплое помещение в течение ближайших 15-20 мин, использование алкоголя показано в вышеуказанном количестве. Во всех других случаях дача алкоголя непосредственно на месте обнаружения пострадавшего противопоказана.
Специализированная медицинская помощь
Данный вид помощи при отморожениях включает в себя комплекс консервативных и оперативных способов лечения в реактивном периоде холодовой травмы. Главное направление консервативного лечения - максимально восстановить жизнеспособность пораженных тканей. Для этого используют антикоагулянты и дезагреганты, ингибиторы биологически активных веществ, десенсибилизирующие средства, иммунологическую и трансфузионную терапию и др. Оперативное лечение заключается в проведении некрэктомии на уровне демаркационной линии в отдаленные сроки после отморожений.
Общее охлаждение организма
Общее охлаждение определяется как патологический синдром, возникающий при длительном воздействии низких температур на весь организм.
Различают общее охлаждение организма и отморожение. В клинической практике часто встречается сочетание общего охлаждения и отморожения.
Этиология. Случаи охлаждения организма человека встречаются более часто в экстремальных климатических условиях, однако они возможны и в обычных условиях. Следует подчеркнуть, что данное состояние возникает не обязательно при отрицательной температуре, а чаще наблюдается при небольших цифрах тем-
пературы выше 0 °С. Охлаждающими факторами чаще всего являются воздух и вода, или их взаимосочетание. Повреждающее действие низких температур значительно усиливается при повышенной влажности воздуха и ветре. При попадании в воду охлаждение организма происходит значительно быстрее, чем на воздухе. Так, при температуре воды 15 °С человек остается живым до 6 ч, при температуре 1 °С - только 30 мин. Скорость и глубина охлаждения организма зависят не только от силы и времени холодового воздействия, но и состояния организма. Устойчивость к холодовой травме снижена при психическом перевозбуждении, физическом утомлении, голодании, алкогольном опьянении, механических травмах, заболеваниях, а также в детском и старческом возрасте.
Патогенез. При охлаждении организма нарушается тепловой баланс, и теплоотдача превышает теплопродукцию. Охлаждение организма приводит к снижению скорости обменных процессов и «минимализации функций», что может быть основой защитного эффекта гипотермии. Именно это наблюдается при искусственной гипотермии в медицинской практике, например при кардиохирургических операциях. Однако при непреднамеренном, случайном охлаждении организма, когда включены мощные механизмы защиты в ответ на раздражение «холодовых» рецепторов кожи, не происходит адекватного замедления всех биохимических реакций, следствием чего является дискоординация метаболизма, приводящая к гипотермической патологии.
В процессе охлаждения организма различают фазы компенсации и декомпенсации. В фазе компенсации в ответ на холодовое воздействие и умеренное снижение температуры тела наблюдается возбуждение ЦНС, активизация гипоталамо-гипофизарно-надпочечниковой системы, мобилизация депонированных липидов и гликогена. На начальных этапах охлаждения организма резко возрастают сократительный термогенез и несократительная термопродукция за счет энергии макроэргических связей окислительных процессов. Одновременно ограничивается теплоотдача за счет спазма артериол и падения тканевого кровотока. При длительном, интенсивном воздействии холода наступает фаза декомпенсации. Характерным для нее является снижение интенсивности обмена веществ, истощение клеток ЦНС и эндокринных желез. Энергетические ресурсы, в основном углеводы, истощаются, подавляется микросомальное окисление различных субстратов, теплообразование резко снижается. Отмечается повышенное образование продуктов перекисного окисления липидов, не компенсируемое системой антиоксидантов, нарушение проницаемости мембранных структур всех типов. Тонус артериальных сосудов падает, отмечается дилатация вен, снижение среднего капилярного давления, шунтирование кровотока через артерио-венозные анастомозы. Эффективность работы сердца снижается из-за уменьшенного притока крови к нему и ультраструктурных изменений в миокардиальных клетках. Из-за повышенного выведения почками катионов снижается концентрация ионов натрия, калия, кальция, что приводит к существенным сдвигам водно-электролитного равновесия. В результате углубления гипоксии, накопления молочной кислоты возникает метаболический ацидоз, нервногуморальные связи между органами нарушаются, и может наступить гибель организма.
Непосредственной причиной смерти при переохлаждении в холодной воде обычно является ОССН, а на воздухе - остановка дыхания, наступающая при понижении температуры в продолговатом мозге до 23-24 °С.
Морфологические изменения. Уже через 1-2 ч от начала охлаждения организма отмечаются многообразные изменения микроциркуляторного русла: артериолярная констрикция, венулярная дилатация, внутрисосудистая агрегация форменных элементов крови. При углублении охлаждения организма находят полнокровие внутренних органов, отек легких, очаговые некрозы и кровоизлияния в мозг, слизистую оболочку желудка, перицеллюлярный, периваскулярный, внутриклеточный отеки в миокарде, истощение запасов гликогена и рибонуклеиновой кислоты, некробиотические изменения эпителия прямых канальцев почек, сморщивание клеток надпочечников с исчезновением из них липидов и гликогена.
Клиника. В клиническом течении охлаждения организма различают 4 стадии глубины охлаждения (Радушкевич В.Л., 1996).
В I стадии температура «гомеостатического ядра» (ректальная, пищеводная) практически не изменена и составляет 37 °-36,5 °С, общая температура тела при ней остается в пределах нормы. Данная стадия характеризуется усиленной функцией защитных механизмов организма, благодаря чему уменьшается теплоотдача, а потеря тепла компенсируется усиленным термогенезом. Данная стадия находится на грани между нормой и патологией. Пострадавшие предъявляют жалобы на ощущение холода. Сознание ясное. Дыхание и АД в пределах нормы. Кожные покровы бледные, холодные на ощупь, имеется симптом «гусиной кожи», отмечаются повышение мышечного тонуса, учащение дыхания и пульса, периодическая дрожь, озноб, учащенное мочеиспускание.
Во II стадии ректальная или пищеводная температура 36,5 °-35 °С, общая температура тела до 30 °С. Кожные покровы бледные, холодные на ощупь. Пострадавшие заторможены, безучастны к окружающему, речь спутанная, жалуются на головокружение, слабость; у них нарушена реальная оценка обстановки, воля к спасению утрачена. Отмечаются снижение мышечного тонуса, нарушена координация движений, постоянная дрожь, адинамия, угнетение сухожильных рефлексов, урежение пульса и дыхания, гипотония. На ЭКГ регистрируется синусовая брадикардия, удлинение и деформация комплекса QRS, смещение интервала S-T, инверсия зубца Т, удлинение интервала Q-T, появление волны u.
В III стадии температура в пищеводе или прямой кишке 35 -29°С, общая температура тела до 29-25°С. Лицо маскообразное, зрачки расширены, реакция на боль отсутствует, произвольные движения невозможны. Сознание угнетено, могут быть галлюцинации, бред, амнезия, рефлексы значительно снижены. При температуре тела от 27 ° до 25 °С психическая деятельность полностью утрачивается (кома), угнетается деятельность сердечной и дыхательной систем. Отмечаются снижение артериального давления, брадикардия (до 35-40 ударов в минуту), ослабленное, редкое дыхание (до 8-10 в минуту), икота, окоченение мышц, арефлексия, недержание мочи. На ЭКГ регистрируются разные нарушения сердечной проводимости и ритма вплоть до фибрилляции желудочков. При температуре, приближающейся к 25 °С, может исчезать глотательный рефлекс, вследствие чего нельзя давать внутрь пищу, жидкости и др.
В IV стадии пищеводная или ректальная температура 29 °-24 °С, общая температура тела до 25 °С. Сознание утрачено, наблюдаются непроизвольные движения конечностями, головой, тризм, напряжение мышц живота, может быть «плавание» глазных яблок, роговичный рефлекс слабый или утрачен, исчезает глотательный рефлекс. Артериальное давление снижено, брадикардия (до 20-30 ударов в минуту), тоны сердца глухие, дыхание поверхностное, иногда аритмичное, редкое (до 3-4 в минуту), недержание мочи и кала.
При дальнейшем снижении температуры (ниже 25 °С) происходит угнетение жизненных функций организма, возникает предагональное состояние и в последующем смерть.
По скорости общего охлаждения выделяют острое, подострое и медленное.
При остром охлаждении смертельный исход возможен в течение 1 часа. Обычно такое охлаждение происходит в воде с температурой от 0 до 10 °С, а также при комбинированном охлаждении, когда одновременно действуют влага и сильно охлажденный воздух с ветром и др. Наиболее часто данный вариант охлаждения встречается при кораблекрушениях в северных морях.
При подостром охлаждении смертельный исход возможен в течение 4 ч. Обычно это бывает при охлаждении на воздухе в комбинации с высокой влажностью и другими факторами (сильное физическое утомление, алкогольная или иная интоксикация, кровопотеря и пр.).
Медленное охлаждение, при котором смертельный исход возможен после 4 ч воздействия сниженной температуры среды. Такое охлаждение происходит только при действии воздуха, а тело защищено теплой одеждой или снеговой массой.
Диагностика общего охлаждения организма основана на анамнезе и измерении температуры тела.
Осложнения. При выведении из состояния охлаждения организма могут развиться воспалительные заболевания - бронхит, пневмония, плеврит и др. Нередко возникают психозы, астенизация, трофические нарушения, деструкция оледеневших участков. При глубоком общем охлаждении нарушаются жизненно важные функции вплоть до терминального состояния.
Неотложная помощь
• При наличии показаний - проведение реанимационных мероприятий (см. главу 20 - общие вопросы реаниматологии).
• Не рекомендуется раздевать пострадавшего на холоде, растирать его снегом, давать различное питье (вследствие возможного нарушения глотательного рефлекса может произойти аспирация).
• Принять меры по прекращению дальнейшего охлаждения, особенно головы.
• Начало проведения согревания пострадавшего на месте происшествия и на этапе транспортировки допустимо, если это не задерживает эвакуацию.
• При наличии охлаждения III-IV степени дача алкоголя на месте происшествия противопоказана, так как это может вызвать остановку дыхания или аспирацию.
• Обеспечить быструю транспортировку пострадавшего в лечебное учреждение.
В I стадии пострадавший в неотложной помощи не нуждается, достаточно устранить действие холодового фактора. При пребывании таких пострадавших в теплом помещении и даче теплого или горячего питья и пищи, температура тела восстанавливается до нормальной самостоятельно.
Во II стадии охлаждения пострадавшие нуждаются в мерах неотложной медицинской помощи, им дают теплое питье, применяют грелки, теплую ванну, солюкс и др. Причем согревание нужно производить дифференцированно. А именно, при признаках оледенения дистальных отделов конечностей их тщательно теплоизолируют, избегая наружного согревания и какой-либо травмы (сгибание пальцев, растирание их снегом и т.п.). Это позволит в дальнейшем провести успешное
размораживание «изнутри» по мере восстановления периферического кровотока.
(А.Н. Дубяга, 1976).
В III-IV стадиях на догоспитальном этапе основные усилия сосредоточены на поддержании дыхания, кровообращения. Устраняют западение языка, отсасывают слизь из дыхательных путей, вводят воздуховод, производят ингаляцию кислорода; в условиях амбулатории, специализированного медицинского транспорта применяют искусственную вентиляцию легких, кровозаменители, антигипоксанты, антиоксиданты, поверхностный наркоз. Пострадавших укутывают в одеяла, обкладывают грелками, теплоизолируют оледеневшие участки. В больнице проводят согревание пострадавшего. Практика использования искусственной гипотермии в кардиохирургии и спасения пострадавших с непреднамеренным общим охлаждением организма позволяет рекомендовать согревание в темпе 1 °С за 30-40 мин. Это достигают согреванием гомеостатического «ядра» тела путем использования на область грудной клетки УВЧ, диатермии, а также умеренным тепловым воздействием на внешние покровы (медицинские грелки, электроодеяло, светованна, обдувание теплым воздухом), подогрев дыхательной смеси при ИВЛ и др., а также стимуляцией теплопродукции в самом организме с помощью внутривенных инфузий подогретых до 40 °-42 °С растворов глюкоза с инсулином, 5-10 мл 25% раствора сернокислой магнезии внутривенно, аскорбиновой кислоты, жировых эмульсий при соотношении жиры/углеводы 1:1. Согревание необходимо проводить до достижения температуры 34 °-34,5 °С в пищеводе в условиях поверхностного наркоза, миорелаксации и продленной до 6-12 ч ИВЛ. В процессе согревания поддерживают адекватную гемодинамику (восполнение объема циркулирующей крови, симпатомиметики и др.), проводят коррекцию гидроионного баланса (растворы с ионами калия, кальция), ацидоза (4% раствор бикарбоната натрия или лактат натрия, трисамин), улучшают реологию крови (реополиглюкин, трентал, компламин, гепарин). При быстром подъеме температуры до 34 °- 35 °С для профилактики развития гипертермии внутримышечно вводят аспизол (0,1-0,5 мг/кг массы тела). При охлаждении организма III-IV стадии возможна остановка кровообращения и дыхания. В этом случае проводят сердечно-легочную реанимацию.
Прогноз. При охлаждении организма I-II стадий прогноз благоприятный. При III-IV стадиях охлаждения организма из-за частого развития грубых нарушений жизненно важных функций и сопутствующего оледенения тканей прогноз сомнительный, летальность достигает 40-70%. (Frank D.H., Robson M.C., 1980).
Профилактика включает в себя рациональную организацию труда в холодное время года, комплекса санитарно-гигиенических мероприятий (защитная одежда, антиалкогольное воспитание, адаптация к суровым условиям, закаливание).
18.10.5. НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ ХИМИЧЕСКИХ ОЖОГАХ ПИЩЕВОДА И ЖЕЛУДКА
Химические ожоги пищевода и желудка нередко встречаются в практике врача. Это связано с тем, что вещества, вызывающие химические ожоги пищевода и желудка, широко распространены в быту и на производстве. К данным веществам относятся: концентрированные растворы кислот - уксусной, хлористо-водородной, азотной и серной и др., кислотный и щелочной электролиты, концентриро-
ванные растворы солей тяжелых металлов: хлористого цинка и медного купороса; сильные окислители: перекись водорода и перманганат калия; жидкости для прочистки канализационных труб; растворы щелочей - нашатырный спирт, каустическая сода и др.
Среди пострадавших большую группу занимают мужчины и не менее половины составляют дети. Большинство мужчин употребляют едкие вещества непреднамеренно, чаще всего в состоянии алкогольного опьянения и похмелья, принимая их за алкогольный напиток, чай, воду. Часть травм происходит на производстве вследствие нарушения правил техники безопасности. Меньшую группу среди пострадавших составляют женщины, у которых ожоги едкими веществами чаще являются следствием незавершенного суицида.
Особенностью патологии является развитие ожоговой болезни вследствие прижигающего действия этих веществ на слизистые оболочки желудочно-кишечного тракта и поражение дыхательных путей из-за вдыхания паров летучих едких веществ.
Распространенность поражения стенок пищевода и желудка определяются видом, объемом, концентрацией выпитой едкой жидкости и продолжительностью ее воздействия на слизистые оболочки.
В зависимости от характера взаимодействия химического вещества со слизистой оболочкой развивается коагуляционный, или колликвационный, некроз. При приеме щелочей формируется колликвационный некроз. Гидроксильные ионы щелочи вызывают омыление жиров и образование щелочных альбуминатов, ткани теряют свою структуру и представляют массу, почти не задерживающую свободные гидроксильные ионы от проникновения вглубь, происходит растворение и разжижение тканей. Это объясняет большую глубину и обширность повреждения тканей при приеме концентрированного раствора щелочи.
При воздействии кислых радикалов развивается сухой коагуляционный некроз ткани, который способствует свертыванию белков как на поверхности, так и в глубоком мышечном слое, тем самым он в некоторой степени препятствует проникновению свободных ионов водорода в глубину.
Наиболее поражаемыми участками являются слизистая полости рта, глотки, пищевода (особенно в местах физиологических сужений вследствие спазма мускулатуры: в области входа в пищевод, аортального, бронхиального и диафрагмального сегментов, пищеводно-желудочного перехода, выходного отдела желудка и в зоне сфинктеров двенадцатиперстной кишки). При приеме кислот значительно больше страдает слизистая желудка, так как содержимое желудка имеет кислую среду, а кишечник при этом поражается меньше из-за щелочной реакции кишечного сока. При приеме едких щелочей в большей степени поражается слизистая пищевода. Рвота сопровождается повторным воздействием едкого вещества на пищевод, что еще больше усугубляет его поражения. Поражение желудка наиболее выражено при приеме прижигающей жидкости натощак. Прием жидкости залпом может не сопровождаться повреждением пищевода, но привести к тяжелому ожогу стенки желудка. Известна задержка едкой жидкости.
По глубине повреждения выделяют 3 степени поражения стенки пищевода и желудкА (Р.Н. Калашников, 2002).
I степень - повреждение в пределах эпителиального слоя без некроза слизистой оболочки. Происходит слущивание поверхности слоевэпителия без образования тканевых дефектов и рубцов.
II степень - некроз ткани в пределах слизистой оболочки с последующим образованием эрозий. В результате заживления циркулярных эрозивных поверхностей возможно образование мембранозной рубцовой стриктуры.
III А степень - некроз в пределах мышечной оболочки пищевода и желудка с формированием язвенных дефектов после отторжения некроза. Заживление рубцом язвенных поверхностей ведет к возникновению кольцевидных и трубчатых стриктур.
III Б степень - некроз всей толщи стенки органа с развитием тяжелейших инфекционных осложнений - гнилостного медиастинита и перитонита. Высока вероятность летального исхода у пострадавших с ожогом III Б степени.
Важное значение для определения лечебной тактики имеет выделение патоморфологических стадий ожога пищевода и желудка (Р.Н. Калашников, 2002).
I стадия - повреждения и начало формирования некроз тканей - продолжается от нескольких часов до одних суток. Продолжительность стадии определяется временем воздействия едкого вещества на стенку пищевода, спазмом и микротромбозами сосудов, воздействием вторичной инфекции.
II стадия - острое реактивное воспаление. Является непосредственным продолжением стадии образования некроза и длится 5-8 дней. Степень выраженности воспалительной реакции зависит от распространенности и вида некроза. Воспалительная инфильтрация стенки и сопутствующий мышечный спазм могут вызвать первичное обратимое сужение пищевода продолжительностью до недели, которое проявляется кратковременной дисфагией.
III стадия - отторжение некротических масс и образование изъязвлений. В зависимости от распространения некроза эта стадия продолжается 7-15 суток и более. В данную стадию возможно развитие рецидивных пищеводных и желудочных кровотечений, источником которых являются кровеносные сосуды, обнажаемые при отторжении некротических масс.
IV стадия - эпителизация эрозий и гранулирование язвенных дефектов. Вследствие повреждения нервных и сосудистых сплетений, травмы пищей и постоянного инфицирования грануляционная ткань растет медленно и может разрушаться.
V стадия - рубцевания продолжительностью до полугода и более. В эту стадию грануляции трансформируются в грубую соединительную ткань и образуются мозолистые кольцевидные и трубчатые стриктуры. Каллезные язвы пищевода и желудка после химического ожога не заживают в течение многих недель и месяцев. Помимо деформации просвета и циркулярного сужения происходит укорочение пищевода и образование грыжи пищеводного отверстия. Нарушается запирательный механизм пищеводно-желудочного соустья, развивается рефлюксная болезнь пищевода.
При приеме едких веществ внутрь развивается клиническая картина ожоговой болезни химической этиологии. В первые сутки клиническая картина определяется выраженностью резорбтивного (общетоксического) действия всосавшегося яда, которое зависит от площади распространения и глубины местных патоморфологических изменений, а также способностью вещества растворять липиды. Растворение межклеточных липидов вызывает быстрое попадание вещества из ЖКТ в сосудистое русло, а растворение липидов клеточных мембран вызывает проникновение его в клетки целой молекулой, где они подвергаются диссоциации с образованием кислых ионов.
Наибольшим резорбтивным действием обладают органические кислоты [уксус- ная эссенция (УЭ)], наименьшим - сильные неорганические кислоты.
Патогенез развития ожоговой болезни при химическом ожоге УЭ складывается из следующих звеньев.
• Попадая в сосудистое русло и проникая внутрь клеток, УЭ вызывает формирование субили декомпенсированного метаболического ацидоза. Накопление недоокисленных продуктов полураспада тканей, образующихся при химическом ожоге, усиливает ацидоз.
• Резорбция и последующее быстрое проникновение УЭ внутрь эритроцитов вызывает повышение осмотического давления с последующим притоком жидкости внутрь эритроцита, его разбухание и разрыв оболочки с выходом свободного гемоглобина в плазму.
• Свободный гемоглобин, попадая в почки, механически блокирует канальцы нефронов, а его химическое взаимодействие с кислыми радикалами вызывает образование кристаллов солянокислого гематина, что еще больше усиливает механическое повреждение. Все это происходит на фоне химического ожога и последующего некроза эпителия конечной части нефрона, нарушения базальной мембраны канальцев, что уже само по себе может вызвать развитие острого гемоглобинурийного нефроза.
• Ожоговое разрушение тканей, распад эритроцитов обусловливают выброс большого количества тромбопластического материала и способствуют наступлению I стадии токсической коагулопатии - стадии гиперкоагуляции.
• Нарушаются реологические свойства крови.
• Внутрисосудистый гемолиз на фоне экзотоксического шока и выраженных расстройств микроциркуляции, а также токсическая коагулопатия способствуют развитию поражения печени в виде очаговых некрозов (инфарктов) с нарушением ее основных функций.
Диагностика химических ожогов пищевода и желудка не представляет затруднений. Всегда определяется характерный запах едкого вещества. На коже лица, слизистой оболочки рта, губ видны химические ожоги. Жалобы на боли во рту, по ходу пищевода, в желудке, иногда в сочетании с умеренным мышечным напряжением брюшной стенки и симптомами раздражения брюшины (реактивный перитонит). Затруднено и болезненно глотание. Повышено слюноотделение. Может быть субфебрильная температура тела. Возможна рвота с примесью крови, рвотные массы с характерным запахом. Может развиваться реактивный панкреатит, характеризующийся опоясывающими болями и повышением диастазы в моче. При попадании едкого вещества или ее концентрированных паров в верхние дыхательные пути развиваются признаки ОДН различной степени тяжести. В первые дни возможно возникновение механической асфиксии в результате отека гортани и подсвязочного пространства, на поздних стадиях болезни - развитие трахеобронхита и пневмонии. Повторная рвота, нарушение глотания и эвакуаторной функции желудка, плазмораггия приводят к развитию гиповолемии и гемодинамическим нарушениям. Объективно отмечается тахикардия, повышение, а затем падение АД и ЦВД, одышка, снижение диуреза. Развитие метгемоглобинемии вследствие резорбции перекиси водорода, азотной кислоты, приводит к формированию сердечно-сосудистых, общемозговых расстройств и токсическому отеку легких. При выраженном резорбтивном действии органических кислот развивается внутрисосудистый гемолиз, который клинически проявляется изменением цвета мочи, которая приобретает коричневый, красный, бурый цвет. В анализах появляются анемия, гипербилирубинемия.
Окраска кожных покровов и видимых слизистых приобретает желтушную окраску.
Выделяют 3 степени гемолиза эритроцитов по определению содержания свободного гемоглобина (Нb) в плазме (Е.А. Лужников, Л.Г. Костомарова, 1989). Существует четкая зависимость между степенью гемолиза и тяжестью течения заболевания.
• Легкая степень гемолиза - при содержании до 5 г/л свободного Нb в плазме.
• Средняя степень гемолиза - при содержании от 5 до 10 г/л Hb в плазме крови.
• Тяжелая степень гемолиза - при содержании более 10 г/л Hb в плазме крови. Примечание. Свободный Hb появляется в моче, при содержании его в плазме
свыше 1,0-1,5 г/л, и моча приобретает красный цвет.
У подавляющего числа больных (70-85%) развиваются токсические нефропатия и гепатопатия различной степени тяжести, вплоть до развития острой печеночно-почечной недостаточности.
При химическом ожоге пищевода и желудка у больных возможно развитие пищеводно -желудочного кровотечения в различные периоды болезни. Ранние кровотечения возникают в 1-2-е сутки от момента развития заболевания. Причинами их могут быть поражение кровеностных сосудов слизистой оболочки едким веществом и/или развития коагулопатии потребления и активации вторичного фибринолиза (формирование ДВС-синдрома). Поздние пищеводно-желудочного кровотечения возникают в конце 1-й недели от момента воздействия едких веществ и обусловлены отторжением некротических участком ожоговой поверхности с образованием кровоточащих язв.
При глубоких ожогах пищевода и желудка (IIIA и ШБ степени) возможно развитие перфорации их стенок, что сопровождается развитием тяжелых осложнений таких как: задний гнилостно-некротический медиастинит, односторонняя или двусторонняя эмпиема плевры, перикардит, местный или распространенный перитонит.
Клиническая классификация отравлений уксусной эссенцией по степени тяжести (Е.А. Лужников, Л.Г. Костомарова, 1989)
• Легкая степень. Ожог полости рта, глотки, пищевода. Воспаление по характеру катарально-фибринозное. Гемолиз до 5 г/л. Легкая нефропатия. Гепатопатия отсутствует.
• Средняя степень. Ожог рта, глотки, пищевода и желудка. Воспаление катарально-серозное или катарально-фибринозное. Больной находится в состоянии экзотоксического шока. Гемолиз до 5-10 г/л. Токсическая нефропатия средней степени тяжести, присоединяется гепатопатия легкой, реже средней степени тяжести.
• Тяжелая степень. Ожог рта, глотки, пищевода, желудка и тонкого кишечника. Воспаление язвенно-некротическое. Ожог верхних дыхательных путей. Экзотоксический шок. Гемолиз более 10 г/л. Токсические нефропатия и гепатопатия средней или тяжелой степени, вплоть до развития ОПН.
Периоды течения ожоговой болезни химической природы аналогичны периодам ожоговой болезни, развившейся вследствие воздействия термических факторов.
Выделяют ожоговый (экзотоксический) шок (продолжительность от момента приема вещества до 1-1,5 суток), тяжесть которого зависит от выраженности
резорбтивного (общетоксического) действия всосавшегося яда, площади распространения и глубины поражения тканей; период ожоговой токсемии (развивается на 2-3-и сутки); ожоговой септицемии или инфекционных осложнений (с 4-х суток до 1,5-2 недель); период стенозирования и ожоговой астении (с конца 3-й недели до 2 и более месяцев), а также период реконвалесценции (выздоровления).
Диагностические мероприятия при химическом ожоге пищевода и желудка направлены на определение вида едкого вещества, определение глубины поражения тканей и распространенность, выявление метаболических нарушений и дисфункции внутренних органов, прежде всего, почек, печени, легких и сердца. Выполняют общий анализ крови и мочи, обзорную рентгенографию грудной клетки. Исследуют кислотно-щелочное состояние, содержание электролитов, билирубина, глюкозы, фибриногена, креатинина, мочевины, определяют уровень свободного гемоглобина, при необходимости выполняют развернутую коагулограмму. При отсутствии противопоказаний выполняют эзофагогастродуоденоскопию в сочетании с прицельной гастробиопсией для определения степени поражения тканей, выявления источника кровотечения и возможность его гемостаза, проводят в первые 4-6 суток. В период отторжения некротических масс и образования острых язв (2-3 недели заболевания) не рекомендуется выполнение диагностической эзофагоскопии, так как стенка пищевода имеет минимальную прочность и может разрушиться в момент введения воздуха и продвижения фиброгастроскопа.
При подозрении на перфорацию пищевода или желудка, а также при развии стеноза выполняют рентгеноконтрастное исследование с использованием водорастворимого вещества.
Лечение химических ожогов пищевода и желудка включает раннее удаление невсосавшегося и всосавшегося яда, применение антидотов и симптоматической терапии, направленной на купирование основных синдромов дисфункции внутренних органов.
Удаление невсосавшегося яда осуществляется при помощи тщательного, многократного прополаскивания водой ротовой полости без заглатывания воды, затем промывание желудка через зонд холодной водой (8-10 л) до чистых промывных вод. Наличие в промывных водах примеси крови не является противопоказанием для дальнейшего промывания. При отравлениях прижигающими жидкостями не рекомендуется промывание желудка «ресторанным» способом, когда сам пострадавший, или оказывающий ему помощь вызывает пальцами раздражение корня языка. Не рекомендуется проводить химическую нейтролизацию кислоты или щелочи в желудке. При нейтрализации уксусной эссенции содой пероральным путем может возникнуть острое расширение желудка! Оптимальными препаратами для нейтрализации уксусной эссенции является жженая магнезия или альмагель (Е.А. Лужников, Л.Г. Костомарова, 1989).
Перед промыванием желудка проводят обезболивание препаратами группы анальгетиков (вплоть до наркотических типа промедола или омнопона) в общепринятых дозах в зависимости от состояния больного, а зонд перед введением смазывается вазелиновым или растительным маслом. При отсутствии медикаментов или до прибытия бригады скорой помощи можно рекомендовать пострадавшему кубики льда, несколько глотков подсолнечного масла.
В условиях стационара промывание желудка проводится только в том случае, если эта процедура не была выполнена на догоспитальном этапе.
Для купирования болевого синдрома используют наркотики, глюкозоновока- иновую смесь (500 мл 5% глюкозы + 50 мл 2% новокаина), нейролептаналгезию.
Лечение экзотоксического шока проводится по правилам, изложенным в разделе 18.9.4. Ожоговый шок, и складывается из инфузионной терапии физиологическим раствором, глюкозой различной концентрации, свежезамороженной плазмой, рефортаном, полиглюкином, реополиглюкином и другими препаратами, что способствует повышению коллоидно-осмотического внутрисосудистого давления и препятствует экстравазации жидкости. Количество вводимой жидкости при тяжелом отравлении может колебаться от 3-5 до 10 л/24 ч. Контроль инфузионной терапии осуществляется по общепринятым методикам измерением показателей гемодинамики, ЦВД и почасового диуреза.
Выраженную гипотензию и повышенную проницаемость клеточных мембран ликвидируют введением глюкокортикоидов (преднизолон до 30 мг/кг/24 ч).
Патогенетическое лечение гемолиза начинают с в/в струйного введения гипертонического раствора глюкозы (10-20%) в количестве 400-500 мл с соответствующим количеством инсулина, что позволяет остановить гемолиз и даже вернуть к жизни часть разбухших, но еще не разрушенных эритроцитов.
Примечание. Данный вид лечения эффективен только в первые несколько часов после отравления, пока имеются набухшие эритроциты.
Для предупреждения образования кристаллов солянокислого гематина с первоначального этапа лечения начинается в/в введение 4% раствора гидрокарбоната натрия до изменения реакции мочи на нейтральную, а затем и щелочную. Чтобы добиться такого эффекта, иногда требуется ввести до 1,5 и более л гидрокарбоната натрия. В последующем, примерно 1-2 суток, следует таким же образом поддерживать нейтральную реакцию мочи.
Примечание. Проведение данного метода лечения возможно при сохраненной экскреторной функции почек.
Выведение свободного Hb достигается методом форсированного диуреза после предварительной водной нагрузки с последующим введением диуретиков (маннитола, фуросемида). Методика форсированного диуреза проводится после нормализации ОЦК и стабилизации гемодинамики.
Лечение токсической коагулопатии проводят антикоагулянтами прямого действия (гепарин) в дозах, зависящих от стадии ДВС-синдрома (лабораторный контроль: свертываемость, коагулограмма, и др., инструментальный контроль - фиброгастроскопия). При развитии кровотечений проводят гемостатическую терапию (см. раздел 18.8.2. Неотложная помощь при кровопотере).
Лечение токсической гепато- и нефропатии проводят по общепринятым методикам лечения печеночной и почечной недостаточности.
Профилактика ОПН осуществляется стимуляцией диуреза путем введения эуфиллина, папаверина, использования методики форсированного диуреза.
Проведение гемодиализа на ранних сроках не показано, так как свободный гемоглобин, находящийся в плазме крови, сразу производит механическую закупорку полупроницаемых мембран, используемых в аппаратах «искусственная почка». Проведение гемодиализа осуществляется в более поздние сроки отравления при наличии ОПН и нарастании уровня мочевины, креатинина и К+ плазмы до критических величин.
Для профилактики инфекционных осложнений и при развитии ожоговой инфекции применяют антибиотики широкого спектра действия, препараты, нормализующие моторику ЖКТ, - церукал, реглан и др.
При ожоге верхних дыхательных путей и признаках ОДН по показаниям выполняют интубацию трахеи или трахеостомию, проводят ИВЛ.
С целью профилактики развития рубцовых стриктур при отсутствии противопоказаний проводят слепое антеградное бужирование пищевода с 9-10-го дня после ожога.
Лечение ожоговой астении проводят с использованием диетотерапии, витоминотерапии, иммунокоррекции.
Учитывая высокую вероятность развития тяжелых осложнений данного заболевания, больных с химическими ожогами пищевода и желудка следует лечить в специализированных хирургических отделениях. Основными причинами летальных исходов при воздействии едких веществ на организм являются: экзотоксический шок, почечно-печеночная недостаточность и выраженная токсемия и тяжелые инфекционные осложнения.
Теги:
234567 Описание для анонса:
234567 Начало активности (дата): 20.06.2013 20:16:00
234567 Кем создан (ID): 1
234567



