ГЛАВА 4 АСЕПТИКА И АНТИСЕПТИКА
Асептика - комплекс мероприятий, направленных на предупреждение попадания возбудителей инфекции в рану или организм человека (В.К. Гостищев,
2001).
Антисептика - комплекс мероприятий, направленных на борьбу с инфекцией в организме человека, а также на предупреждение или ликвидацию инфекционного воспалительного процесса (В.К. Гостищев, 2000).
Источник инфекции - это места обитания, развития и размножения микроорганизмов. По отношению к организму пациента выделяют экзогенные (вне организма) и эндогенные (внутри организма) источники инфекции.
Источником экзогенной инфекции являются больные с инфекционно-воспалительными заболеваниями, бациллоносители и животные.
Основные пути передачи экзогенной инфекции: воздушно-капельный; контактный; имплантационный.
Микроорганизмы проникают в рану из внешней среды различными путями:
• воздушным - из окружающего воздуха, в котором находятся микроорганизмы;
• контактным - при соприкосновении с раной инфицированных предметов: инструментов, перевязочного материала, операционного белья, а также проникновение эпидермальной флоры пациента, при неправильной подготовке кожных покровов операционного поля перед операцией;
• имплантационным - инфицирование при оставлении в ране на длительное время или постоянно тех или иных предметов, инфицированных при выполнении операции или вследствие нарушения правил стерилизации и хранения (шовного материала, синтетических протезов, костных фиксаторов).
Для предупреждения контактного инфицирования необходимо, чтобы все, что соприкасается с раной, было стерильным (операционное белье, перевязочный и шовный материал, перчатки, инструменты, имплантационные средства). Это достигается специальной обработкой всего вышеперечисленного, а также рук хирурга и операционного поля.
Источником эндогенной инфекции являются острые и хронические воспалительные процессы в организме (инфекционно-воспалительные заболевания кожи и подкожной клетчатки, кариес, хронический тонзиллит, острый аппендицит, острый холецистит, а также микрофлора ротовой полости, кишечника, дыхательных и мочевыделительных путей).
Основные пути передачи эндогенной инфекции: контактный, гематогенный, лимфогенный.
Контактное инфицирование раны возможно при попадании в нее инфицированного экссудата, гноя, кишечного содержимого при нарушении техники хирургической манипуляции. Из очага инфекции, расположенного вне зоны оператив-
ного пособия, микроорганизмы могут быть занесены с током крови (гематогенный путь инфицирования) или лимфы (лимфогенный путь инфицирования).
Методами асептики ведется борьба с экзогенной инфекцией, а методами антисептики - с эндогенной инфекцией, в том числе проникшей из внешней среды (например, при случайных ранениях).
Деконтаминация - это процесс удаления или уничтожения микроорганизмов с целью обезвреживания и защиты, включающий в себя очистку, дезинфекцию и стерилизацию.
Очистка - процесс, в результате которого инородные тела (органические материалы, микроорганизмы и т.д.) удаляются с поверхности объекта механическим (ручная очистка), физическим (ультразвуковая очистка) и химическим (очистка детергентами, моющими порошками) способами.
Дезинфекции - процесс, уменьшающий количество патогенных микроорганизмов (кроме бактериальных спор) находящихся на живом организме, коже, медицинской аппаратуре, перевязочном материале, хирургических инструментах и т.д. Дезинфекция высокого уровня проводится для уничтожения микобактерий туберкулеза, вегетативных форм бактерий, грибов и большинства вирусов (включая вирусы гепатита и иммунодефицита человека). Применяется для предметов, контактирующих со слизистыми оболочками человека (фиброгастроскопы, бронхоскопы, фиброколоноскопы и т.д.). В качестве дезинфицирующих средств используют:
• механические (фильтрация воды, воздуха, механическое мытье предметов с применением дезсредств);
• физические (высокая температура, кипячение, сухой горячий воздух, водяной насыщенный пар, ультрафиолетовое излучение);
• химические (применение специальных дезинфицирующих средств). Стерилизация - процесс уничтожения всех известных микроорганизмов,
включая бактериальные споры. Виды стерилизации:
• физическая (сухой горячий воздух, пар, радиация, ультразвук);
• химическая (газовый и жидкостный).
Если имеется возможность использовать физическую стерилизацию или одноразовое оборудование, химическая стерилизация не применяется.
АНТИСЕПТИЧЕСКИЕ И ДЕЗИНФИЦИРУЮЩИЕ СРЕДСТВА
Возбудители заболеваний (бактерии, вирусы, патогенные грибы, простейшие и др.) всегда были и остаются объектами самого пристального внимания медицинских работников как одна из основных причин заболеваний современного человека, нарушения его здоровья, трудоспособности, экономических издержек отдельного индивидуума и всего общества в целом.
Средства, действующие на возбудителей заболеваний, подразделяются на 3 большие группы: химиотерапевтические, антисептические и дезинфицирующие.
Химиотерапевтические средства используются для воздействия на возбудителей заболеваний, находящихся в организме человека или животных, т.е. в эндосоматических биотопах. К этой группе относятся противомикробные (антибиотики, сульфаниламиды и др.), противовирусные, противомикозные, противопаразитарные и противобластомные средства.
Антисептические (anti-против, sepsis-гниение) средства используются для воздействия на возбудителей заболеваний, находящихся в эписоматических биотопах, т.е. на поверхностных покровах (коже, слизистых, в стоматологической практике - на слизистой оболочке полости рта, тканях зуба и парадонта), для промывания ран и полостей. Необходимо отметить, что некоторые лекарственные средства, используемые per os, создающие высокие концентрации в кишечнике или мочевыводящих путях и используемые именно для воздействия на возбудителей заболеваний с указанной локализацией, в настоящее время также относят к антисептикам («кишечные антисептики», «уроантисептики»). Более того, такие классические химиотерапевтические средства, как антибиотики, противомикозные и др. при их местном применении (в виде растворов, мазей, кремов) также рассматриваются как антисептики.
Дезинфицирующие (de-устранение, infectio-заражение) - это средства, используемые вне организма: для обработки выделений больных, предметов ухода за больными, инструментов и т.д. Если химиотерапевтические и антисептические средства являются средствами индивидуальной терапии, то дезинфектанты используются как для профилактики заболевания отдельного пациента, так и для профилактики распространения инфекции на уровне популяции.
Следует иметь в виду, что ряд лекарственных веществ (хлорамин, хлоргексидин, формальдегид и др.) используется и как дезинфектанты, и как антисептики (нередко в разных концентрациях и разных лекарственных формах). Это вещества так называемого двойного (бинарного) назначения.
Требования к дезинфицирующим средствам
• Должны обладать широким спектром действия.
• Иметь микробоцидный эффект.
• Хорошо растворяться в воде или образовывать с ней или воздухом стойкие активные суспензии, эмульсии, аэрозоли, туманы.
• Сохранять активность в обеззараживаемой среде.
• Не повреждать обеззараживаемые объекты.
• Обладать низкой токсичностью и аллергогенностью.
Требования к антисептическим средствам
• Желательно иметь средства широкого спектра действия (для обработки рук хирурга, операционного поля) и узкого спектра действия для терапевтической антисептики (после установления вида возбудителя и его чувствительности).
• Зачастую достаточно микробостатического действия, так как вслед за приостановкой роста возбудителей вступают в действие факторы иммунной системы. Но необходимы и микробоцидные средства (для обработки рук хирурга, операционного поля, а также для применения у больных с иммунодефицитом).
• В идеале препараты должны хорошо растворяться в липидах и плохо в воде.
• Хорошая растворимость в липидах способствует накоплению антисептика в месте нанесения, а хорошая растворимость в воде затрудняет создание противомикробной концентрации на достаточное время.
• Исходная форма антисептика, по возможности, должна иметь форму порошка (удобство хранения, точность дозировки, возможность приготовления любых лекарственных форм).
• Не должны окрашивать кожу пациента, пачкать белье, одежду, иметь неприятный запах; быть устойчивыми к свету, температуре, сохранять активность в присутствии биоорганических субстратов, при стерилизации и хранении. Препараты, используемые в стоматологической практике, должны иметь соответствующие органолептические свойства.
• Не обладать токсичностью и аллергогенностью.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ОСНОВНЫХ ДЕЗИНФЕКТАНТОВ И АНТИСЕПТИКОВ
Галогеносодержащие препараты
Хлорамин Б - порошок, растворим в воде, содержит до 29% активного хлора. Препарат широкого спектра действия (ШСД), однако в последние годы к нему регистрируются устойчивые штаммы некоторых микроорганизмов. В основном используется для дезинфекции предметов ухода и выделений, больных при кишечных и воздушно-капельных инфекциях в 1-2-3% растворах, при туберкулезе - в 5% растворе. Как антисептик используется редко (в связи с раздражающим действием): для промывания ран - в 2%, а для обработки рук - в 0,25-0,5% растворах.
Пантоцид - белый порошок, содержащий около 50% активного хлора. Выпускается в таблетках для обеззараживания воды в походных условиях (2 таблетки на 0,5 л воды).
Хлоргексидина биглюконат (гибитан) - оказывает микробоцидное или микробостатическое действие на бактерии (в большей степени на Гр+, чем на Гр-), дерматофиты, кандида. В связи с некоторым действием на возбудителей заболеваний, передающихся половым путем (гонококки, трепонема, трихомонады), может использоваться для индивидуальной профилактики венерических заболеваний. Широко используется как антисептик для обработки рук и операционного поля (0,5% водноспиртовой раствор), для промывания ран (0,05% водный раствор), а также как терапевтический антисептик в хирургии, урологии, офтальмологии и других областях медицины.
Йода раствор спиртовой 5 и 10% (йодная настойка) - неорганический препарат йода, готовится на 95% этиловом спирте. Обладает универсальным спектром микробоцидного действия, включая Гр+ и Гр- бактерий, вирусов, грибов, простейших. Применяется для профилактики инфицирования поврежденной кожи. Может вызывать токсическое и аллергическое повреждение кожи.
Йодоформ - органический препарат йода, нерастворим в воде, малорастворим в этаноле, растворим в эфире. При контакте с тканями и микроорганизмами высвобождает свободный йод. Применяется как антисептическое средство в 10% мази, присыпке для лечения инфицированных ран, язв, в стоматологии - в составе пасты с тимолом - для пломбирования каналов зубов. Возможны раздражение тканей, дерматит, аллергические реакции.
Йодинол - препарат из группы йодофоров (комплексных препаратов йода с поверхностно-активными веществами или с растворимыми в воде полимерами). Противомикробная активность йодофоров связана с присутствием в этих комплексах ионизированного, а не молекулярного йода. Ионизированный йод не ока-
зывает общетоксического действия, но сохраняет антисептическое, которое усиливается поверхностно-активными веществами. Йодинол, в частности, в качестве поверхностно-активного вещества содержит поливиниловый спирт. Применяется в виде 0,1% водного раствора для гигиенической антисептики рук, профилактики инфицирования ран, ожоговых поверхностей, а также при лечении больных с хроническим тонзиллитом, хроническим периодонтитом и т.д.
Йодопирон - смесь комплекса поливинилпирролидон йода с калия йодидом. Желто-коричневый аморфный порошок, растворимый в воде (медленно). Используется в виде 0,1%, 0,5% и 1% растворов как бактерицидное средство для обработки рук хирурга и операционного поля, а также для лечения гнойных ран. Для обработки рук хирурга применяют 0,1% раствор, для обработки операционного поля и лечения гнойных ран - 0,5% и 1% растворы. Порошок йодопирона содержит 6-8% активного йода. 1% раствор (по активному йоду) готовят в аптечных условиях; 0,1% и 0,5% растворы получают из 1% раствора непосредственно перед употреблением. Порошок йодопирона выпускается во флаконах темного стекла по 150 г. Хранение: список Б. - в сухом, защищенном от света месте. 1% раствор хранят во флаконах или банках темного стекла не более 2 месяцев.
Окислители
Перекись водорода выпускается в виде трех препаратов: раствор перекиси водорода концентрированный (пергидроль) содержит до 31% перекиси водорода, используется для приготовления «рабочих» растворов; раствор перекиси водорода 3% и гидроперит - комплексный препарат перекиси водорода и мочевины (в таблетках).
Перекись водорода обладает почти универсальным противомикробным действием, хорошо переносится кожей и слизистыми оболочками, не накапливается в организме, не оказывает токсического и аллергического действия, проявляет такие дополнительные эффекты, как механическая очистка места аппликации, дезодорация, стимуляция кровоснабжения и регенерации тканей. Вместе с тем быстро разлагается на свету, при взаимодействии с металлами, органическими веществами, щелочами. Применяется для дезинфекции, предстерилизационной очистки инструментов, для профилактической и терапевтической антисептики при ангинах, стоматитах. С целью приготовления 3% раствора для полоскания полости рта, глотки, промывания ран можно использовать таблетки гидроперита.
Калия перманганат, как и перекись водорода, обладает универсальным спектром микробоцидного действия, но пачкает белье, перевязочный материал и в настоящее время применяется сравнительно редко в виде водных растворов для полоскания рта и глотки (0,01-0,1%), промывания ран (0,1-0,5%), смазывания язвенных и ожоговых поверхностей (2-5%). До сих пор используется антикандидозное действие препарата. Как сильный окислитель иногда используется для промывания желудка при отравлении морфином (для превращения морфина в неактивный оксиморфин).
Кислоты
Кислота салициловая проявляет бактерицидное и фунгицидное действие в сочетании с противовоспалительным, кератолитическим и раздражающим действием. Применяется в виде 2-5% присыпок, 1-10% мазей, 0,1-1% спиртового раствора
при кожных заболеваниях микозной и микозно-бактериальной природы. В связи с кератолитическим и антисептическим действием входит (в качестве основного компонента) в состав мозольной жидкости и мозольного пластыря. У некоторых больных наблюдается индивидуальная непереносимость салициловой кислоты, проявляющаяся раздражением тканей и развитием аллергических реакций.
Кислота ундециленовая обладает фунгицидной и фунгистатической активностью, может применяться самостоятельно или в составе препаратов цинкундан, ундецин, микосептин и других при эпидермофитии, дрожжевых микозах, а также для профилактики микозов стоп.
Кислота борная оказывает микробоцидное действие на бактерий (включая синегнойную палочку) и фунгицидное действие. Используется в растворах при конъюнктивитах, отитах, дерматитах, опрелостях. Следует иметь в виду, что кислота борная хорошо проникает через кожу и слизистые (особенно у детей), медленно выводится и может вызывать тошноту, рвоту, понос, головную боль, судороги и даже шок. Поэтому не применяется у детей, беременных и кормящих женщин и все реже у других категорий больных.
Щелочи
Аммиака раствор (нашатырный спирт) содержит около 10% свободного аммиака. Антисептическое действие, связанное с изменением рН в щелочную сторону и с хорошими моющими свойствами, использовался для механической антисептики (при мытье рук). В связи с резким раздражающим действием может использоваться для возбуждения дыхательного центра при обмороке.
Спирты
Спирт этиловый (этанол) в высоких концентрациях (95% и 70%) оказывает микробоцидное и микробостатическое действие на Гр+ и Гр- бактерии и некоторые виды грибов. Широко используется как самостоятельно, так и в качестве растворителя других антисептических средств. За счет раздражающего действия применяется для обтирания и компрессов. В последнее время спирт как самостоятельный антисептик запрещен использовать в медицине. Его следует использовать лишь в сочетании с антисептиками других групп.
Спирт пропиловый - бесцветная жидкость с характерным алкогольным запахом, хорошо смешивается с водой. Спектр противомикробного действия аналогичен этанолу, но действие проявляется при более низких концентрациях (начинается с 13%, достигая максимума к 50-60%). Широко применяется самостоятельно и в различных комбинациях для профилактической антисептики рук и кожи в медицине и быту.
Спирт изопропиловый в 60-70% концентрациях применяется в тех же целях, что и предыдущее средство.
Альдегиды
Формальдегида раствор (формалин) оказывает микробоцидное и микробостатическое действие на бактерии, грибы, вирусы, простейших. Обладает дезинфицирующим, антисептическим и дезодорирующим действием, уменьшает потливость (т.е. является антиперспирантом).
Фенолы
Фенол (кислота карболовая) оказывает микробоцидное и микробостатическое действие на все виды Гр+ и Гр- бактерий, грибы, вирусы и простейших. Обладает раздражающим и прижигающим действием, всасывается через слизистые и поврежденную кожу и оказывает общетоксическое действие. Как дезинфектант используется в 3-5% растворах. Как антисептик используется и сам фенол, но особенно широко - его препараты, такие, как ваготил, триклозан и др.
Ваготил оказывает микробоцидное и трихомонацидное действие, обладает прижигающим и сосудосуживающим действием, стимулирует эпителизацию. В неразведенном виде применяется для прижиганий эрозий шейки матки, в водном растворе - для спринцеваний. Для ускорения эпителизации используется также при язвах, ожогах.
Триклозан - органическое производное фенола, хорошо переносится кожей, слизистыми оболочками, не токсичен, не алергенен. Обладает широким спектром микробоцидного и микробостатического действия. Используется в качестве дезодоранта, а также для хирургической (0,2-0,5% спиртовые растворы) и терапевтической (до 5%) антисептики.
Красители
Метиленовый синий обладает бактерицидным действием на Гр+ бактерии и иногда применяется в качестве антисептика при пиодермии, а также для промывания мочевого пузыря при циститах. Основное применение находит в качестве антидота при остром отравлении цианидами (переводит гемоглобин в метгемоглобин, который, связываясь с цианидами, переводит их в неактивный цианметгемоглобин).
Бриллиантовый зеленый оказывает микробоцидное действие на Гр+ и Гр- бактерии, дерматофиты, кандида. Применяется в 1-2% водных и спиртовых растворах для профилактики инфицирования мелких травм кожи, а также при легких гнойно-воспалительных заболеваниях кожи.
Этакридин (риванол) оказывает бактерицидное действие на стрептококков, однако многие штаммы стафилококков резистентны. Как правило, Гр- возбудители не чувствительны. Используется в дерматологии в составе мазей, паст, присыпок.
Соли тяжелых металлов
Цинка окись оказывает антисептическое, вяжущее и подсушивающее действие. Это вещество нерастворимо в воде и этаноле, применяется самостоятельно и в комбинации с другими антисептиками в виде 10-25% присыпок, мазей, паст, линиментов при различных кожных заболеваниях.
Цинка сульфат оказывает антисептическое и вяжущее действие, легко растворим в воде, используется в виде глазных капель при конъюнктивитах, растворов для промываний при уретритах и вагинитах.
Серебра нитрат, как и все препараты серебра, имеет микробоцидный тип действия и ШСД, включая Гр+ и Гр- бактерий и хламидий, обладает вяжущим и прижигающим эффектом. Применяется в 1-2% растворах для профилактики бленнореи и хламидиозного конъюнктивита у новорожденных, при трахоме, остром
конъюнктивите; в 2-10% растворах - для прижигания ран и язв с избыточными грануляциями, при гиперпластических рините и ларингите.
Серебра протеинат (протаргол) обладает антисептическим, противовоспалительным и вяжущим действием. Применяются водные растворы в офтальмологической, оториноларингологической и урологической практике.
Детергенты
Детергенты, или катионные мыла, обладают моющим и антисептическим действием (detergeo - стирать, чистить).
Церигель имеет в качестве действующего начала цетилпиридиний хлорид, катионное четвертично-аммониевое, поверхностно-активное вещество. Используется как антисептик для обработки рук медицинского персонала.
Роккал в качестве действующего вещества имеет бензалкониум хлорид, активный в отношении Гр+ и Гр- бактерий, кандида; в комбинации с этиловым спиртом действует и на вирусы. Использовался в качестве антисептика для обработки рук хирурга, операционного поля, используется при лечении больных с кожными заболеваниями. Входит в состав глазных капель, дезодорантов и косметических препаратов. Бензалкониум обладает также спермицидным эффектом и является действующим началом контрацептивного препарата «фарматэкс».
Мирамистин - новый антисептик из класса детергентов, активен в отношении Гр+ и Гр- микрофлоры, ряда внутриклеточных патогенов, в том числе хламидий, вирусов (простого герпеса, гриппа, ВИЧ), некоторых грибов. Повышает функциональную активность иммунных клеток, ускоряет заживление ран. Широко используется в 0,01% растворе в различных областях медицины. Так, например, в хирургической практике, салфетки, смоченные указанным раствором, накладываются на раневые и ожоговые поверхности; для экстренной профилактики заболеваний, передающихся половым путем, раствор вводится интрауретрально. В стоматологической практике раствор мирамистина широко используется для полосканий при стоматитах и перидонтитах, а также для обработки съемных зубных протезов.
Многокомпонентные средства
Виркон - многокомпонентный современный дезинфектант, включающий органические кислоты, катализаторы, окислители, сурфактант. Каждый из компонентов обеспечивает последовательное действие, что ведет к разрушению оболочек микроорганизмов, к разрушению нуклеиновых кислот. Спектр действия чрезвычайно широк и включает более 240 штаммов бактерий, патогенные грибы, вирусы (в том числе гепатита и вируса иммунодефицита человека (ВИЧ-инфекция)). Абсолютно безопасен для человека и окружающей среды (так как подвергается биологическому разложению).
4.1. ТЕХНИКА ОБРАБОТКИ РУК
Согласно приказу ? 215 МЗ РФ для обработки рук хирурга разрешены следующие препараты: первомур (рецептура С-4) и хлоргексидина биглюконат (гибитан). В настоящее время появилось множество новых средств для обработки рук хирур-
га (Ахдез 3000, велтосепт, октениман, лижен, декосепт и др.), все они имеют сертификат и разрешены к применению в лечебно-профилактических учреждениях.
Вне зависимости от способа обработки рук хирурга, вначале выполняется механическое мытье рук с одноразовым или жидким мылом (без щетки) под теплой проточной водой. Как правило, производится 3-кратное намыливание рук хирурга. Первое - гигиеническое, или обычное, выполняется до локтей. Второе и третье - специальные, в ходе которых тщательно моют ногтевые фаланги, межпальцевые промежутки, кожные складки пальцев. В ходе мытья мыло должно постоянно находиться в руках врача. Второй раз руки мылят до верхней трети предплечья, третий - до средней трети предплечья. Каждый раз мыло смывают теплой проточной водой, причем руки держат таким образом, чтобы струи воды стекали по направлению к локтевому суставу, то есть от чистого к грязному. После окончания мытья рук остатки мыла кладут в специальный лоток (не касаясь руками последнего), а водопроводный кран (смеситель) закрывают локтем. Затем врач должен осушить руки стерильными салфетками в следующей последовательности. Вначале осушают ладонную поверхность пальцев и кисти левой руки, затем правой (направление движений салфетки имеет от кончиков пальцев к лучезапястному суставу). Потом - тыльную поверхность пальцев и кисти правой руки, затем левой. В последнюю очередь осушают кожные покровы предплечий до границы средней и нижней трети. Далее руки обрабатывают различными антисептическими средствами в зависимости от способа обработки рук хирурга.
Обработка рук раствором рецептуры С-4 (Первомур)
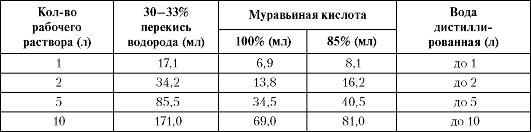
Первомур - это смесь перекиси водорода и муравьиной кислоты. Рецептуру «С-4» готовят из необходимого количества перекиси водорода и муравьиной кислоты, которые смешивают в стеклянном сосуде с притертой пробкой. Последний помещают в холодильник на 2 ч, периодически встряхивая бутыль. При взаимодействии данных препаратов образуется надмуравьиная кислота, оказывающая сильное бактерицидное действие. Полученный раствор, хранят не более суток в стеклянном сосуде с герметичной пробкой в прохладном месте. Для обработки рук используют 2,4% раствор рецептуры «С-4». Из «маточного» раствора можно приготовить до 10 л рабочего раствора, разбавив его дистиллированной водой (табл. 4-1).
Рабочий раствор годен к применению в течение одних суток. После предварительного мытья рук с мылом под проточной водой, осушения их стерильными салфетками, врач погружает руки в раствор «Первомура» в специальном тазу и производит мытье рук до границы средней и нижней трети предплечий в течение
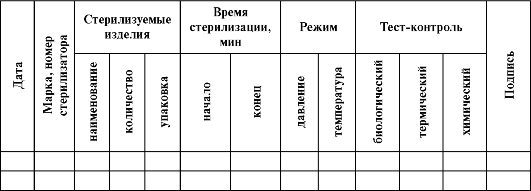
Таблица 4-1. Количество ингредиентов для приготовления рецептуры «С-4»
 1 мин. Затем повторно осушает руки стерильными салфетками и облачается в стерильное операционное белье (халат и перчатки).
1 мин. Затем повторно осушает руки стерильными салфетками и облачается в стерильное операционное белье (халат и перчатки).
Обработка рук раствором хлоргексидина биглюконата (Гибитан, Дезин, Дезискраб). Хлоргексидина биглюконат выпускается в виде 20% водного раствора. Для обработки рук используют 0,5% спиртовой раствор препарата. Для получения раствора препарат разводят в 70% этиловом спирте в соотношении 1:40. После предварительного мытья рук с мылом и последующего осушения стерильной марлевой салфеткой врач берет стерильные салфетки, смоченные 0,5% спиртовым раствором хлоргексидина биглюконата и последовательно обрабатывает руки. Сначала протирается ладонная поверхность пальцев и кисти одной руки, затем - другой руки (направление движений салфетки имеет от кончиков пальцев к лучезапястному суставу). Потом обрабатывается тыльная поверхность пальцев и кистей обеих рук. Следом обрабатываются предплечья до границы средней и нижней трети обеих рук. Время обработки рук хирурга раствором хлоргексидина биглюконата составляет 2-3 мин. Затем врач облачается в стерильный хирургический халат и стерильные перчатки.
Обработка рук различными современными препаратами
Средство «Ахдез 3000» - готовый к применению кожный антисептик в виде бесцветной прозрачной жидкости с характерным запахом. В качестве действующих веществ содержит спирт этиловый синтетический ректификованный (79%), хлоргексидина биглюконат (0,5%) в качестве действующих веществ, а в качестве функциональных добавок: глицерин (0,5%), касторовое масло (0,2%), отдушку и воду.
Средство «Октениман» - готовый к применению раствор в виде прозрачной, окрашенной в светло-синий цвет, жидкости со слабым запахом спирта. Содержит: 1-пропанола 40%, 2-пропанола 30% и октенидин дигидрохлорида 0,1% в качестве действующих веществ, а также функциональные добавки.
Средство «Велтосепт» - прозрачная бесцветная жидкость, готовая к применению. В качестве действующего вещества содержит клатрат четвертичноаммониевого соединения с карбамидом в этиловом спирте.
Средство «Лижен» - готовый к применению кожный антисептик в форме прозрачной жидкости зеленого цвета с запахом отдушки и изопропилового спирта. В качестве действующих веществ содержит клатрат дидецилдиметиламмоний бромида с мочевиной - 0,1% и изопропиловый спирт - 63%; кроме того, в состав средства входят функциональные добавки.
Средство «Декосепт Плюс» - готовое к применению дезинфицирующее средство в виде прозрачной жидкости синего цвета со спиртовым запахом. В качестве действующих веществ содержит в 100 г раствора 44,7 г 2-пропанола, 21,9 г 1-пропа- нола и 0,2 г бензалкониум хлорида; кроме этого в состав средства входят смягчающие кожу рук компоненты, отдушка, краситель.
Средство «Лизанин» - готовый раствор в виде прозрачной бесцветной жидкости со слабым спиртовым запахом, активные вещества: спирт этиловый синтетический ректификованный, четвертично-аммониевые соединения и смягчающие кожу компоненты.
Средство «Лизанол» - готовый к применению кожный антисептик в форме бесцветной прозрачной жидкости. В качестве действующих веществ содержит
изопропиловый спирт (75%), алкилдиметилбензиламмоний хлорид (0,1%); кроме того, в состав средства входят функциональные добавки. Выпускается в пластиковых флаконах вместимостью 1 л.
Средство «Октенидерм» - готовый к применению раствор в виде прозрачной бесцветной жидкости с запахом спирта. Содержит: 1-пропанола 30%, 2-пропанола 45% и октенидин дигидрохлорида 0,1% в качестве действующих веществ, а также функциональные добавки.
Обработка рук хирурга всеми вышеперечисленными средствами осуществляется однотипно, по следующей методике.
После предварительного мытья рук с мылом под теплой проточной водой и последующим их осушением стерильной марлевой салфеткой, сестра наносит на ладонные поверхности кистей рук хирурга 3-5 мл средства (из вышеперечисленных) или средство наносят при помощи специального настенного дозатора (рис. 4-1).
 Рис. 4-1. Общий вид настенного дозатора средств для обработки рук хирурга
Рис. 4-1. Общий вид настенного дозатора средств для обработки рук хирурга
Необходимо втирать его в кожу кистей и предплечий в течение 2,5 мин (поддерживая кожу рук во влажном состоянии); после этого снова наносят 5 мл средства на ладонные поверхности рук и втирают его в кожу кистей рук и предплечий в течение 2,5 мин. Общее время обработки составляет 5 мин. При этом надо следить за тем, чтобы на протяжении всего времени втирания препарата руки оставались влажными, и все участки кожи достаточно смачивались.
• Ладонь к ладони.
• Правая ладонь на тыльной стороне левой кисти.
• Левая ладонь на тыльной поверхности правой кисти.
• Ладонь к ладони рук со скрещенными растопыренными пальцами.
• Тыльная поверхность согнутых пальцев одной руки по ладонной поверхности другой руки, попеременно.
• Кругообразное растирание правого большого пальца в закрытой ладони левой руки и наоборот.
• Кругообразное втирание вперед и назад сомкнутых кончиков пальцев правой руки и левой ладони, и наоборот.
Затем движения повторяют до окончания времени экспозиции (на каждой позиции - по пять раз). Стерильные халат и перчатки надевают после полного высыхания препарата.
Ускоренный способ обработки рук хирурга
В амбулаторной практике или в вынужденных (например, военно-полевых) условиях для ускоренной обработки рук врача применяют пленкообразующий препарат «Церигель». В его состав входят: поливинилбутирол и 96% раствор этилового спирта. Руки тщательно моют теплой проточной водой с мылом, тщательно осушают стерильной салфеткой, а затем на ладонь наносят 3-5 мл препарата и быстро растирают его по всей поверхности кожи пальцев, кистей и нижней трети предплечий. Полусогнутые пальцы держат в разведенном положении в течение 2-3 мин до образования защитной пленки на поверхности кожи, обладающей выраженным бактерицидным действием. После операции пленка легко снимается марлевыми салфетками, смоченными 70% раствором этилового спирта.
4.2. СТЕРИЛИЗАЦИЯ ИНСТРУМЕНТОВ
Стерилизация инструментов и перевязочного материала включает следующие этапы:
• предстерилизационная подготовка;
• укладка и подготовка к стерилизации;
• стерилизация;
• хранение стерильного материала.
Предстерилизационная подготовка хирургических инструментов.
Все инструменты после операции должны подвергаться дезинфекции. Для этого использованные инструменты собирают в операционной в специальный таз для грязных инструментов. Затем их несут в моечную, где имеется специальная закрытая емкость с раствором дезинфицирующего средства (например: 0,1% раствор «Жавелиона», время экспозиции - 60 мин; или 5% раствор «Аламинола» - 60 мин; или 2% раствор «Бианола» - 15 мин; или 2% раствор «Бриллиант» - 60 мин; или 10% раствор «Гигасепт ФФ» - 60 мин; 1% раствор «СТЕРАНИОС 20% концентрированный» - 15 мин и т.д.), грязные инструменты погружают в дезинфицирующий раствор, разборные инструменты дезинфицируют в разобранном состоянии. Потом их моют под теплой проточной водой (в отдельной раковине) ершами и щетками. Затем погружают в эмалированную емкость с моющим раствором «А» или «Б». Состав моющего раствора «А»: 27,5% раствор перикиси водорода - 17 г., моющее средство «Прогресс, Новость, Астра, Лотос и др.» - 5,0 г., дистиллированная вода - 978 мл. Состав моющего раствора «Б»: 3% раствор перекиси водорода 200 мл, моющее средство «Прогресс, Новость, Астра, Лотос и др.» - 5,0 г, дистиллированная вода - 795 мл. Температура моющего раствора - 50 °С, время экспозиции - 15 мин. После замачивания инструменты моют в моющем растворе ершами, щетками (особенно тщательно обрабатывают замки, зубчики, насечки). Затем инструменты ополаскивают теплой проточной водой, а
в конце - дистиллированной водой. Перед ополаскиванием в дистиллированной воде необходимо провести контроль качества предстерилизационной очистки изделий, путем постановки азопирамовой или амидопириновой пробы на наличие остаточных количеств крови. Контролю подлежит 1% одновременно обработанных изделий одного наименования (но не менее трех изделий). При выявлении остатков крови (положительная проба) вся группа изделий, от которой отбирали изделия для контроля, подлежит повторной обработке до получения отрицательного результата.
Методы проведения проб на скрытую кровь
Амидопириновая проба
• Приготовление раствора. Смешивают равные количества 5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водорода (по 2-3 мл).
• Техника проведения. На стерильную вату наносят полученную смесь и протирают поршень шприца, цилиндр с наружной стороны, иглы, канюлю внутри. Затем заливают реактивы в цилиндр шприца, пропускают их через шприц на вату, проверяя цилиндр. Надевают иглу и делают то же самое, проверяя иглу. При наличии крови на вате появляется сине-зеленое окрашивание. Оно может появиться и при реакции на тройной раствор, хлорамин, лекарственные вещества.
Азопирамовая проба
• Техника проведения. Готовят 1,0-1,5% раствор солянокислого анилина в 95% растворе спирта этилового. Его хранят в холодильнике до 2 месяцев, вне холодильника - не более месяца. Перед постановкой пробы смешивают равные объемы азопирама и 3% раствора перекиси водорода.
• Техника проведения. Смесь использовать в течение 1-2 ч. Не проверять горячие инструменты, не держать раствор возле нагревательных приборов и на ярком свету. При попадании реактива на кровь в течение 1 мин появляется фиолетовое окрашивание.
Инструменты, после операции у больных с анаэробной инфекцией, дезинфицируют в 6% растворе перекиси водорода в течение 60 мин, а затем они проходят стандартную предстерилизационную подготовку, как и другие инструменты.
Укладка и подготовка к стерилизации
Инструменты стерилизуют воздушным (в сухожаровых шкафах), паровым (автоклавирование) и химическим методами. Для стерилизации в сухожаровых стерилизаторах инструменты помещают в металлические коробки (при снятых крышках, крышки стерилизуют рядом) или в упаковку из бумаги мешочной непропитанной (закладывают уже высушенные инструменты), или выкладывают их на специальные решетки стерилизатора и производят просушку инструментов при температуре - 80-85 °С, при открытой дверце стерилизатора, до полного испарения влаги с инструментов (рис. 4-2, рис. 4-3). Для стерилизации паром под давлением инструменты кладут в металлические биксы (выстланные двухслойной хлопчатобумажной простынкой (рис. 4-4, рис. 4-5) или двойные полотняные мешки (изготовленные из бязи).
 Рис. 4-2. Общий вид сухожарового стерилизатора
Рис. 4-2. Общий вид сухожарового стерилизатора
 Рис. 4-3. Общий вид сухожарового стерилизатора с хирургическими инструментами на решетках стерилизатора (с целью просушки)
Рис. 4-3. Общий вид сухожарового стерилизатора с хирургическими инструментами на решетках стерилизатора (с целью просушки)
 Рис. 4-4. Общий вид загруженного металлического бикса
Рис. 4-4. Общий вид загруженного металлического бикса
 Рис. 4-5. Общий вид загруженного биксами парового стерилизатора
Рис. 4-5. Общий вид загруженного биксами парового стерилизатора
Перед химическим методом стерилизации хирургические инструменты, после предстерилизационной обработки, выкладывают на чистые простыни и производят просушку при комнатной температуре до полного испарения влаги с поверхностей инструментов.
Стерилизация хирургических инструментов
Инструментарии для медицинских манипуляций по риску имеют следующие различия.
• Критические - проникают в стерильные ткани или сосуды: имплантаты, скальпели, иглы, другие хирургические инструменты и т.д. Стерилизация - спороцидные химические вещества, длительный контакт.
• Полукритические - соприкасаются со слизистыми оболочками (за исключением стоматологических инструментов): гибкие эндоскопы, ларингоскопы, эндотрахеальные трубки, а также другие аналогичные инструменты. Дезинфекция высокого уровня - спороцидные химические вещества, кратковременный контакт.
Термометры, ванны для гидротерапии. Дезинфекция среднего уровня - больничные дезинфицирующие средства с указанием в маркировке о наличии туберкулоцидной активности.
• Некритические - (соприкасаются с неповрежденной кожей): стетоскопы, настольные приборы, подкладные судна и др. Дезинфекция низкого уровня - больничные дезинфицирующие средства без указания в маркировке о наличии туберкулоцидной активности.
Стерилизация хирургических инструментов осуществляется несколькими методами: воздушным (сухожаровые шкафы), паровым (автоклавирование) и химическим.
Воздушный - производится в воздушных стерилизаторах, которые находятся в стерилизационной комнате операционного блока или перевязочных хирургических отделений (рис. 4-6, рис. 4-7), по двум режимам:
• при 180 °С (+2 °С или -10 °С) в течение 60 мин;
• при 160 °С (+2 °С или -10 °С) в течение 150 мин.
 Рис. 4-6. Общий вид воздушного стерилизатора снаружи
Рис. 4-6. Общий вид воздушного стерилизатора снаружи
 Рис. 4-7. Общий вид воздушного стерилизатора внутри
Рис. 4-7. Общий вид воздушного стерилизатора внутри
Оба режима рекомендуются для изделий из металла, стекла и силиконовой резины.
Паровой - производится в паровых стерилизаторах (рис. 4-8, рис. 4-9), которые располагаются в специальном помещении - автоклавной, по «основному» режиму стерилизации:
• при 132 °С (±2 °С) под давлением 2 атм. (0,2 МПа) в течение 20 мин.
Данный режим стерилизации рекомендуется для изделий коррозийно-стойкого металла, стекла, изделий из текстильных материалов.
Химический - проводится при полном погружении в раствор в закрытых емкостях из пластмассы или покрытых эмалью на время стерилизационной выдержки, после чего изделие должно быть промыто стерильной водой.
 Рис. 4-8. Общий вид парового стерилизатора снаружи
Рис. 4-8. Общий вид парового стерилизатора снаружи
 Рис. 4-9. Общий вид парового стерилизатора внутри
Рис. 4-9. Общий вид парового стерилизатора внутри
Некоторые препараты для химической (жидкостной) стерилизации
6% раствор перекиси водорода - проводится по двум режимам:
• при температуре 18 °С - 360 мин (±5 мин;
• при температуре 50 °С - 180 мин (±5 мин), температура в процессе стерилизации не поддерживается. Раствор перекиси водорода используется в течение 7 суток со дня его приготовления при условии хранения его в закрытой емкости в темном месте.
8% раствор средства «Лизоформин 3000». В состав средства в качестве действующих веществ (ДВ) входят: 9,5% глутарового альдегида, 7,5% глиоксаля и 9,6% дидецилдиметиламмония хлорида (ЧАС), а также другие компоненты - 6% алкилполиэтиленгликолевого эфира, 1,8% душистого масла, 0,5% стабилизатора и красителя Е133. Средство обладает бактерицидными (в том числе туберкулоцидными), вирулицидными (в том числе в отношении возбудителей парентеральных
вирусных гепатитов и ВИЧ-инфекции), фунгицидными (в отношении грибов рода Кандида и Трихофитон) и спороцидными свойствами. Для приготовления 1 л рабочего раствора, предназначенного для стерилизации медицинских инструментов, к 920 мл дистиллированной воды, нагретой до температуры 50±1 °С, добавляют 80 мл исходного концентрата, имеющего комнатную температуру (не ниже 20 °С), и быстро перемешивают. Стерилизацию инструментов проводят в стерильных эмалированных (без повреждения эмали) или пластмассовых емкостях, закрывающихся крышками. Изделия, подлежащие стерилизации, погружают в раствор сразу же после его приготовления. Стерилизацию осуществляют по одному из указанных ниже температурных режимов (время экспозиции - 1 ч):
• при температуре раствора 40 °С, если на протяжении всего времени стерилизационной выдержки возможно поддержание заданного значения температуры (в термостатируемых условиях);
• при начальной температуре раствора 50 °С, если в процессе стерилизационной выдержки температура раствора не поддерживается. В случае применения второго режима (начальная температура раствора 50 °С) стерилизацию проводят при температуре воздуха в помещении не ниже 20 °С в емкостях, содержащих не менее 2 л рабочего раствора средства, при соотношении объема раствора к объему, занимаемому изделиями, не менее чем 5:1. При этом допускается падение температуры раствора за время стерилизационной выдержки не ниже чем до 35 °С. После окончания стерилизационной выдержки изделия извлекают стерильными пинцетами (корнцангами) из раствора средства и переносят последние в стерильную емкость со стерильной питьевой водой для отмывания изделий от остатков средства. Емкости, используемые при отмыве стерильных изделий от остатков средства, предварительно стерилизуют паровым методом при температуре 132 °С в течение 20 мин. Воду для отмыва изделий стерилизуют в стеклянных емкостях аналогично. Отмыв осуществляют при полном погружении изделий в воду при соотношении объема воды к объему, занимаемому изделиями, не менее, чем 3:1. Инструменты из металлов отмывают последовательно в двух емкостях с водой по 5 мин. Изделия, в конструкцию которых входят полимерные материалы (кроме гибких эндоскопов), отмывают последовательно в двух водах по 10 мин. Отмытые от остатков средства стерильные изделия извлекают из воды, помещают в стерильную простыню и перекладывают изделия в стерильную стерилизационную коробку, выложенную стерильной простыней. Срок хранения простерилизованных изделий не более трех суток. Все манипуляции в процессе стерилизации и отмыва изделий от стерилизующего средства проводят в асептических условиях. Работу осуществляют в стерильных перчатках. Срок годности рабочих растворов - 14 дней.
6% раствор средства «Новодез Форте». В состав средства в качестве действующих веществ входят: 40% алкилдиметилбензиламмония хлорида и 11% глутарового альдегида. Для приготовления 1 л рабочего раствора необходимо добавить 60 мл концентрата препарата комнатной температуры к 940 мл дистиллированной воды, подогретой до 55 °С и быстро перемешать. Стерилизацию инструментов проводят в стерильных эмалированных (без повреждения эмали) или пластмассовых емкостях, закрывающихся крышками. Изделия, подлежащие стерилизации, погружают в раствор сразу же после его приготовления. Разъемные изделия погружают в раствор в разобранном виде. Стерилизуемые изделия должны быть
свободно размещены в емкости с раствором, толщина слоя раствора над изделиями должна быть не менее 1 см. Стерилизацию проводят при температуре воздуха в помещении не ниже 20 °С с, используя емкости, содержащие не менее 2 л раствора средства. Режим стерилизации хирургических инструментов, изготовленных из металла: 6% раствор средства «Новодез Форте» с начальной температурой - 50 °С (±1 °С), время экспозиции - 60 мин (Примечание: за время стерилизационной выдержки допускается падение температуры раствора не ниже чем до 35 °С). При проведении стерилизации все манипуляции выполняют, соблюдая асептические условия, используя стерильные емкости для воды, воду и инструменты, а также стерильные перчатки для защиты кожи рук. Отмыв инструментов после стерилизации осуществляется так же как при обработке средством «Лизоформин 3000». Срок годности рабочих растворов составляет 14 суток при условии хранения в закрытых емкостях в темном месте.
Средство «Делансаль» - готовая к применению прозрачная бесцветная жидкость без механических примесей с характерным запахом, содержащая 2,3-2,7% глутарового альдегида в качестве действующего вещества, а также буферные компоненты и ингибитор коррозии; рН=6,0-6,5. Средство обладает вирулицидными, бактерицидными (в том числе туберкулоцидными и спороцидными) и фунгицидными свойствами. Стерилизацию хирургических инструментов проводят путем погружения в раствор дезинфицирующего средства (температура раствора не менее 20 °С) стерилизуемых предметов на 10 ч (600 мин). Средство можно использовать многократно, если его внешний вид не изменился. При первых признаках изменения внешнего вида средства (изменение цвета, помутнение и т.п.) раствор необходимо заменить. Процесс отмыва стерилизованных инструментов не отличается от средства «Лизоформин 3000».
Средство «Бианол» - прозрачный жидкий концентрат ярко-синего цвета; имеет слабый специфический запах. Содержит глутаровый альдегид, глиоксаль и алкилдеметиламмоний хлорид в качестве действующих веществ, а также поверхностно-активное вещество, краситель и воду (рН концентрата - 4,2±0,6). Средство обладает бактерицидными, вирулицидными, фунгицидными и спороцидными свойствами. Не корродирует металлы и не повреждает термолабильные материалы. Для стерилизации инструментов применяют 20% раствор средства «Бианол» (для приготовления 1 л раствора необходимо к 800 мл дистиллированной воды добавить 200 мл концентрата), время стерилизационной выдержки в 20% растворе при температуре 21±1 °С составляет 10 ч. Рабочие растворы можно применять многократно в течение 10 суток с момента их приготовления, если их вид не изменился. При первых признаках изменения внешнего вида средства (изменение цвета или помутнение раствора, появление налета на стенках емкостей, образование хлопьев или осадка и др.) раствор необходимо заменить. Во избежание разбавления средства при многократном его использовании погружать в раствор следует только сухие изделия. Отмыв изделий после стерилизации стандартен.
Средство «Клиндезин 3000» - готовая к применению прозрачная бесцветная жидкость. Содержит 2,7% глутарового альдегида в качестве действующего вещества, а также другие компоненты; рН=6,0-7,5. Средство обладает вирулицидными, бактерицидными (в том числе туберкулоцидными и спороцидными) и фунгицидными свойствами. Стерилизацию инструментов проводят раствором, температура которого не менее 20 °С, в течение 8 ч (480 мин). Раствор для
стерилизации можно использовать многократно (не более 30 суток), если нет признаков изменения внешнего вида. Отмыв изделий после стерилизации стандартный.
Средство «Клиндезин-Форте» - продукт, состоящий из двух жидких компонентов (раствор, содержащий глутаровый альдегид, и прилагаемый к нему активатор), смешиваемых перед применением для получения активированного раствора. Основной компонент - бесцветная прозрачная жидкость с типичным запахом глутарового альдегида и примесью аромата перечной мяты, содержащая 2,5% глутарового альдегида в качестве действующего вещества; рН=3,2-4,3; расфасован в пластмассовые флаконы вместимостью 3,8 л. К каждому флакону с раствором, содержащим глутаровый альдегид, прилагается маленький пластмассовый флакон со 149 г активатора, в виде прозрачной жидкости голубого цвета, содержащего щелочные ингредиенты, ингибитор коррозии (нитрит натрия), красители. Активированный (рабочий) раствор средства представляет собой жидкость зеленого цвета; рН=7,5-8,5. Срок годности активированного раствора средства (после смешивания компонентов) составляет 28 суток при условии его хранения в закрытых емкостях в темном прохладном месте. Активированный раствор средства обладает вирулицидными, бактерицидными (в том числе туберкулоцидными и спороцидными) и фунгицидными свойствами. Фиксирует органические загрязнения, что требует их тщательного удаления с изделий до дезинфекции и стерилизации. Стерилизацию инструментов проводят раствором, температура которого не менее 20 °С, в течение 10 ч (600 мин). Отмыв изделий после стерилизации стандартен.
Средство «Деконекс 50 ПЛЮС» - концентрат зеленого цвета, содержащий в качестве действующих веществ дидецилдиметиламмоний хлорид 12%, глутаровый альдегид 9,5%, а также другие компоненты: неиогенные ПАВ, ингибиторы коррозии. Средство проявляет бактерицидное (в том числе туберкулоцидное), вирулицидное (включая возбудителей гепатитов и ВИЧ-инфекцию), фунгицидное (в отношении грибов рода Кандида и Трихофитон) и спороцидное действие. Для приготовления 1 л 8% раствора, предназначенного для стерилизации изделий медицинского назначения, к 920 мл дистиллированной воды (нагретой до температуры 50±1 °С) добавляют 80 мл концентрата, имеющего комнатную температуру (не ниже +20 °С), и быстро перемешивают. Стерилизацию проводят при температуре воздуха в помещении не ниже +20 °С в емкостях, содержащих не менее 2 л раствора (с начальной температурой раствора +50 °С) в течение 60 мин. При этом допускается падение температуры раствора за время стерилизационной выдержки не ниже, чем до 35°С. Для стерилизации раствор используют однократно. Отмыв изделий после стерилизации стандартен.
Средство «СТЕРАНИОС 20% концентрированный» - жидкий концентрат зеленого цвета со специфическим запахом. В состав средства входит глутаровый альдегид (20%) в качестве действующего вещества (ДВ), а также стабилизатор и другие вспомогательные компоненты. Выпускается в пластмассовых емкостях по 250 и 500 мл. Средство оказывает антимикробное действие на бактерии (включая, микобактерии туберкулеза и споровые формы бактерий), вирусы (включая вирусы парентеральных гепатитов и ВИЧ), патогенные грибы. Фиксирует органические загрязнения. Для стерилизации инструментов применяют 2% раствор средства (1 часть концентрата и 9 частей дистиллированной воды), время экспозиции - 6 ч (360 мин при температуре раствора - 21±1 °С). Рабочий раствор средства для
стерилизации инструментов может быть использован многократно, в течение 25 суток (при условии хранения используемого раствора в прохладном месте в плотно закрытых емкостях во избежание снижения концентрации раствора), если его вид не изменился. При первых признаках изменения внешнего вида (изменение цвета или помутнение раствора, появление налета на стенках емкостей, образование хлопьев или осадка и др.) раствор необходимо заменить до истечения указанного срока. Отмыв изделий после стерилизации стандартен.
Средство «Эригид Форте» - прозрачная бесцветная жидкость, готовая к применению. В качестве действующего вещества содержит глутаровый альдегид - 2,5%. Средство «Эригид Форте» оказывает антимикробное действие на бактерии (включая микобактерии туберкулеза), вирусы (в том числе возбудителей парентеральных гепатитов и ВИЧ-инфекции), грибы рода Кандида, дерматофиты, споры бацилл. Стерилизацию хирургических инструментов проводят в течение 6 ч, температура раствора должна быть 20-22 °С. Раствор средства может быть использован многократно в течение 30 суток, если его вид не изменился. При первых признаках изменения внешнего вида средства (изменение цвета или помутнение раствора, появление налета на стенках емкостей, образование хлопьев или осадка и др.) раствор необходимо заменить. Во избежание разбавления средства при многократном его использовании следует погружать в раствор только сухие изделия. Отмыв изделий после стерилизации стандартен.
Хранение стерильных хирургических инструментов
Стерильный хирургический инструмент хранят в специальных шкафах «Для хранения стерильного материала». Шкаф должен быть снабжен замком, ключи от которого находятся у медицинского персонала. Допуск к шкафам со стерильным материалом имеет лишь медперсонал. Если инструменты стерилизовались в биксах, специальных стерилизационных коробках (выложенных стерильной простынкой), двойных полотняных мешках или были туда помещены после стерилизации (без упаковки) любым из методов стерилизации, то срок их хранения составляет 2-3 суток (при условии, что бикс, стерилизационная коробка или мешок не вскрывались и герметично закрыты!). Инструменты, которые стерилизовались без упаковки (на решетках сухожарового шкафа, химическим методом стерилизации, паровым методом без упаковки), должны быть использованы непосредственно после стерилизации. Срок хранения стерильных хирургических инструментов, выложенных на стерильный стол, составляет 6 ч. По истечению этого времени хирургические инструменты должны повторно пройти стерилизацию любым из предложенных методов.
Контроль стерильности хирургических инструментов. Контроль стерильности хирургических инструментов осуществляется двумя способами: прямым (бактериологическое исследование микробной обсемененности хирургических инструментов) и непрямым (индикаторы стерильности, кристаллические химические вещества с известной температурой плавления, термометры и др.). В настоящее время наиболее распространенным способом непрямого контроля стерильности считается использование стандартных химических индикаторов стерильности серии «Стеритест» для воздушных и паровых стерилизаторов, а также индикаторов серии «Стеритест» для упаковки (бикс, стерилизационная коробка, полотняный мешок и упаковка из бумаги мешочной непропитанной).
Прямой способ контроля стерильности
Правила отбора проб для контроля стерильности в лечебно-профилактических учреждениях
Забор проб на стерильность проводит операционная сестра под руководством сотрудника бактериологической лаборатории, в стерильные емкости с соблюдением строжайших правил асептики непосредственно перед проведением операции.
Для контроля стерильности используют следующие питательные среды:
• сахарный бульон Хоттингера (0,5 и 1% глюкозы);
• тиогликолевую среду;
• бульон Сабуро.
Одновременный посев изделий на три вышеуказанные среды обязателен. При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконах и т.д.) должно быть достаточным для полного погружения изделия или его части.
Посев в бульон Хоттингера и тиогликолевую среду выдерживают в термостате при температуре 37 °С, среду Сабуро - при температуре 20-22 °С. Посевы инкубируют в термостате в течение 14 суток.
Посевы на стерильность хирургического инструмента
Хирургический инструментарий с помощью стерильного пинцета извлекают из бикса или мягкой упаковки и целиком погружают в пробирки с питательными средами. Как исключение в отдельных случаях, если все простерилизованные инструменты в одной упаковке крупных размеров (иглодержатели, ранорасширители и т.д.), производят смыв с поверхности инструмента марлевой салфеткой (размером 5X5 см, простерилизованной в бумажном пакете или чашке Петри). Для увлажнения салфеток стерильный физиологический раствор разливают в стерильные пробирки по 2,0 мл. Салфетку захватывают стерильным пинцетом, увлажняют физиологическим раствором из пробирки, а после протирания исследуемого объекта помещают в пробирку с тиогликолевой средой. Аналогичные смывы с других инструментов засевают в пробирки со средой Хоттингера и Сабуро.
Учет результатов
Материал стерилен при отсутствии роста во всех посевах. Материал не стерилен при росте микрофлоры.
Непрямой способ контроля стерильности
Индикаторы серии «МедИС» для контроля работы паровых и воздушных стерилизаторов (рис. 4-10).
Индикаторы ПАРОВОЙ СТЕРИЛИЗАЦИИ химические одноразовые с липким слоем на обратной стороне индикатора, закрытым защитной бумагой, МедИС-120/45, МедИС-126/30, МедИС-132/20 предназначены для оперативного визуального контроля соблюдения критических параметров паровой стерилизации - температуры стерилизации, времени стерилизационной выдержки и наличия насыщенного водяного пара, в камере паровых стерилизаторов с удалением воздуха методом продувки паром.
Индикаторы бумажные воздушной стерилизации химические многопараметрические одноразовые с липким слоем на обратной стороне индикатора,
 Рис. 4-10. Индикаторы паровой стерилизации
Рис. 4-10. Индикаторы паровой стерилизации
 Рис. 4-11. Индикаторы воздушной стерилизации
Рис. 4-11. Индикаторы воздушной стерилизации
закрытым защитной бумагой, МедИС-В-160/150, МедИС-В-180/60 предназначены для оперативного визуального контроля соблюдения критических параметров воздушной стерилизации - температуры и времени стерилизационной выдержки - в камере воздушных стерилизаторов с предельным отклонениями температуры ±3 °С. Классификация индикаторов серии «МедИС».
Таблица 4-2. Индикаторы паровой стерилизации
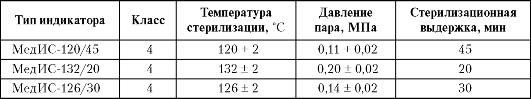 Таблица 4-3. Индикаторы воздушной стерилизации
Таблица 4-3. Индикаторы воздушной стерилизации
 Порядок проведения оперативного контроля процесса стерилизации термовременными индикаторами
Порядок проведения оперативного контроля процесса стерилизации термовременными индикаторами
Учет, интерпретацию и документирование результатов контроля проводит медицинский персонал, вскрывающий упаковку с простерилизованным изделием (изделиями) при подготовке их к использованию по назначению. При этом использованные индикаторы могут подклеиваться в журнал учета стерилизации
 Рис. 4-12. Порядок проведения оперативного контроля процесса стерилизации
Рис. 4-12. Порядок проведения оперативного контроля процесса стерилизации
 Рис. 4-13. Журнал контроля работы стерилизаторов
Рис. 4-13. Журнал контроля работы стерилизаторов
(форма 257/у) в выделенные для этого колонки и храниться в качестве документа архива в течение 12 месяцев после использования.
Журнал контроля работы стерилизаторов
Журнал входит в комплект индикаторов серии «МедИС» и «СТЕРИКОНТ». Содержит 72 страницы. Данный журнал создан на основе формы ? 257/у утвержденной приказом Минздрава СССР ? 1030 от 04.10.1980 г.
Таблица 4-4. Журнал контроля работы стерилизаторов
 Индикаторы серии «СТЕРИТЕСТ» для контроля режимов стерилизации в воздушных и паровых стерилизаторах внутри упаковки стерилизуемых объектов
Индикаторы серии «СТЕРИТЕСТ» для контроля режимов стерилизации в воздушных и паровых стерилизаторах внутри упаковки стерилизуемых объектов
Индикаторы паровой стерилизации химические одноразовые СТЕРИТЕСТ- П-120/45 и СТЕРИТЕСТ-П-132/20 предназначены для оперативного визуального контроля соблюдения критических параметров паровой стерилизации - температуры стерилизации, времени стерилизационной выдержки и наличия насыщенного водяного пара внутри стерилизуемых изделий и стерилизационных упаковок с изделиями при их стерилизации в паровых стерилизаторах с удалением воздуха из стерилизационной камеры методом продувки паром.
 Рис. 4-14. Индикаторы паровой стерилизации
Рис. 4-14. Индикаторы паровой стерилизации
Индикаторы ВОЗДУШНОЙ СТЕРИЛИЗАЦИИ трех режимов (160 °С/150 мин, 180 °С/60 мин, 200 °С/30мин) химические интегрирующие одноразовые с липким слоем на обратной стороне индикатора, закрытым защитной бумагой СТЕРИТЕСТ-Вл предназначены для оперативного визуального контроля соблюдения критических параметров воздушной стерилизации - температуры стерилизации и времени стерилизационной выдержки, ВНУТРИ УПАКОВОК И ИЗДЕЛИЙ, СТЕРИЛИЗУЕМЫХ В ВОЗДУШНЫХ СТЕРИЛИЗАТОРАХ.
Классификация индикаторов серии «Стеритест»
Таблица 4-5. Индикаторы паровой стерилизации
 Таблица 4-6. Индикаторы воздушной стерилизации
Таблица 4-6. Индикаторы воздушной стерилизации
 Преимущества индикаторов:
Преимущества индикаторов:
• на каждом индикаторе напечатан эталон конечного цвета индикаторной метки, который она приобретает при соблюдении параметров стерилизации;
• четкий, контрастный цветовой переход индикатора облегчает визуальный контроль и повышает его точность;
• липкий слой на обратной стороне индикатора облегчает его закрепление на стерилизуемых упаковках;
• индикаторы обеспечивают документирование стерилизации;
• срок годности индикаторов - 24 месяца.
Для контроля качества стерилизации (внутри упаковок и изделий) в паровых стерилизаторах используют индикаторы серии «Стеритест-П», в воздушных стерилизаторах - индикаторы серии «Стеритест-В» и «Стеритест-Вл». Для контроля условий стерилизации в камерах воздушных стерилизаторов применяются индикаторы серии «МедИС-В» или «Стериконт-В», а в камерах паровых стерилизаторов - индикаторы серии «МедИС» или «Стериконт-П».
4.3. СТЕРИЛИЗАЦИЯ ПЕРЕВЯЗОЧНОГО МАТЕРИАЛА И ОПЕРАЦИОННОГО БЕЛЬЯ
Перевязочный материал и операционное белье стерилизуют паром под давлением (автоклавирование) или пользуются готовыми, стерилизованными в заводских условиях, материалом и бельем (стерильные салфетки, шарики, вата, бинт, одноразовые перчатки, маска и медицинская шапочка). К перевязочному материалу относятся: марлевые салфетки, шарики, тампоны, турунды, бинты, большие кишечные салфетки, вата. Применяют их во время операции и перевязки с целью осушения раны, остановки кровотечения, для дренирования или тампонирования ран. Перевязочный материал готовят из марли, предварительно разрезанной на куски прямоугольной формы различного размера. Марлю складывают, подворачивая свободные края внутрь, чтобы из них не осыпались волокна ткани. Для удобства определенное количество салфеток связывают стопкой с помощью тесемки из марли, а шарики - в марлевые мешочки. Тампоны - связывают в стопки по 5-10 штук, для удобства подсчета. Перевязочный материал после использования дезинфицируют и сжигают. К операционному белью относятся: перчатки, маска, медицинская шапочка, хирургический костюм и халат, бахилы, простыни и пеленки.
Укладка и подготовка к стерилизации перевязочного материала и операционного белья
Перевязочный материал, также как и операционное белье, укладывают в металлические биксы. При отсутствии биксов допускается стерилизация перевязочного материала в двухслойных полотняных мешках. В хирургических стационарах чаще всего используется «видовая» закладка бикса, при которой в бикс укладывают определенный вид перевязочного материала или операционного белья. К крышке бикса прикреплена бирка из клеенки с названием содержимого, названия отделения, здесь же проставляются: дата стерилизации, фамилия и под-
пись осуществляющего стерилизацию. Перед закладкой бикс выстилают чистой простынкой (в два слоя) так, чтобы она закрывала дно, стенки бикса и свешивалась через края бикса. Далее производят закладку бикса материалом, не забывая при этом, укладывать в различные отделы бикса индикаторы стерильности. Затем загруженный материал укрывают сверху свободными краями простыни и закрывают бикс. «Окошки» бикса должны быть открыты для проникновения горячего пара внутрь.
Стерилизация перевязочного материала и операционного белья
Производится в металлических биксах или двухслойных полотняных мешках. Метод стерилизации - автоклавирование (горячий пар под давлением). Режимы стерилизации:
• при 132 °С (±2 °С) под давлением 2 атм. (0,2 МПа) в течение 20 мин;
• при 120 °С (±2 °С) под давлением 1,1 атм. (0,11 МПа) в течение 45 мин.
Хранение перевязочного материала и операционного белья
Происходит в стерильных закрытых биксах или двухслойных полотняных мешках. Стерильность в обычных биксах и двухслойных полотняных мешках сохраняется до 3 суток, а в биксах с фильтрами - до 20 суток и более (в зависимости от разновидности бикса). Место хранения стерильного материала описано в разделе «Хранение стерильных хирургических инструментов».
Контроль стерильности перевязочного материала и операционного белья
Прямой способ контроля стерильности
Посев на стерильность перевязочного материала. Бинты, ватные шарики, марлевые салфетки, турунды и т.п. отбирают из разных мест бикса стерильным пинцетом. Мелкие изделия целиком погружают в пробирки с питательными средами. От бинтов (внутренних частей) и крупных марлевых салфеток с помощью стерильных ножниц отрезают кусочки и погружают в пробирки с питательными средами. На каждый вид перевязочного материала используют по две пробирки каждой среды.
Посев на стерильность хирургического белья. Простерилизованными и фламбированными ножницами (смоченными в спирте и проведенными через пламя горелки) с помощью пинцета от хирургического белья отрезают небольшие кусочки ткани (завязка, внутренние швы и т.п.) и погружают в пробирки (колбы) с питательными средами, по возможности, не касаясь стенок пробирки (колбы).
Непрямой способ контроля стерильности - см. выше.
4.4. СТЕРИЛИЗАЦИЯ ШОВНОГО МАТЕРИАЛА
Существует рассасывающийся и нерассасывающийся шовный материал. Рассасывающимися натуральными нитями являются нити из кетгута, есть также и синтетические рассасывающиеся нити из дексона, викрила, окцилона и др., с различными сроками рассасывания. К нерассасывающимся натуральным нитям
относятся нити из натурального шелка (в настоящее им практически не пользуются), к синтетическим - нити из капрона, лавсана, дакрона, фторлона и др. Большинство известного шовного материала стерилизуют γ-излучением в заводских условиях. Выпускается он стерильным в специальной упаковке или ампулах. Хранят его при комнатной температуре и расходуют по мере необходимости. Металлический шовный материал (проволока, скобки) стерилизуют автоклавированием (при температуре - 132 °С, давлении - 2,0 атм., время стерилизации - 30 мин). Синтетический шовный материал, в частности капрон, стерилизуют в соответствии с методическими рекомендациями, подписанными начальником Главного эпидемиологического управления Минздрава СССР М.И. Наркевичем 19 июля 1990 г. (? 15-6/34).
Методические рекомендации по стерилизации лигатурного шовного материала
в лечебно-профилактических учреждениях
(Извлечение)
1. Общие положения.
1.1. Методические рекомендации составлены в соответствии и в развитие ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы».
1.2. Методические рекомендации предназначены для персонала лечебно-профилактических учреждений, занимающегося подготовкой лигатурного шовного материала к хирургическим манипуляциям, а также специалистов санитарноэпидемиологических и дезинфекционных станций.
1.3. Методические рекомендации распространяются на нерассасывающийся лигатурный шовный материал:
• нити хирургические шелковые крученые нестерилизованные ГОСТ 392-82;
• нити хирургические капроновые крученые нестерильные ТУ 17 РСФСР
62-2040-79;
• шнуры хирургические полиэфирные нестерильные ТУ 17 РСФСР 44-9762-85. Далее: лигатурный шовный материал.
1.4. Лигатурный шовный материал не подлежит предстерилизационной очистке в лечебно-профилактических учреждениях.
1.5. Лигатурный шовный материал готовят к стерилизации в виде косичек, мотков, наматывая на катушки, стеклянные палочки и т.д.
1.6. Стерилизацию лигатурного шовного материала проводят паровым или в экстренных случаях химическим (4,8% раствором первомура) методами, не оказывающими отрицательного воздействия на физико-механические и эксплуатационные свойства нитей.
1.7. Стерильный лигатурный шовный материал не следует хранить в этиловом спирте, так как этиловый спирт не является стерилизующим средством.
2. Стерилизация лигатурного шовного материала водяным насыщенным паром под давлением.
2.1. Подготовленный шовный материал заворачивают в два слоя упаковочного материала, регламентированного ОСТ 42-21-2-85:
• в количестве, рассчитанном на одну операцию. При возможности его помещают в стерилизационную коробку (бикс, бикс с фильтром) в одном слое упаковки. На упаковке отмечают вид шовного материала и его номер.
2.2. Лигатурный шовный материал стерилизуют водяным насыщенным паром под избыточным давлением при двух режимах:
• давление - 1,1 кгс/см2 (+ 0,2 кгс/см2), температура - 120 °С (+2 °С), время стерилизационной выдержки 45 мин (+ 3 мин);
• давление - 2,0 кгс/см2 (± 0,2 кгс/см2), температура - 132 °С (±2 °С), время стерилизационной выдержки 30 мин (+ 2 мин).
2.3. Лигатурный шовный материал, простерилизованный в упаковке, хранят в специальных шкафах для стерильных изделий.
2.4. Неиспользованный стерильный лигатурный шовный материал в случаях нарушения условий и сроков хранения может быть повторно (еще один раз) простерилизован паровым методом при температуре 120 °С.
3. Стерилизация лигатурного шовного материала 4,8% раствором первомура.
3.1. Для стерилизации лигатурного шовного материала используют 4,8% раствор первомура.
3.2. Первомур - препарат, содержащий надмуравьиную кислоту и перекись водорода (активно действующие вещества), а также муравьиную кислоту и воду. Получается при взаимодействии муравьиной кислоты и перекиси водорода. Выпускаемая промышленностью перекись водорода медицинская содержит 30-40% основного вещества (ГОСТ 177-88). Муравьиная кислота имеет концентрацию 85-100% (ГОСТ 5848-73).
3.3. Первомур представляет собой бесцветную жидкость с запахом надмуравьиной кислоты с удельным весом - 1,1 и рН - 0,6-1,3. Смешивается с водой и спиртом во всех соотношениях. Разлагается с выделением кислорода.
3.4. Стерилизацию лигатурного шовного материала проводят в асептических условиях: погружают его в 4,8% раствор первомура и выдерживают при температуре 18-20 °С в течение 15 мин в закрытой эмалированной или стеклянной (с притертой пробкой) емкости.
3.5. По окончании стерилизационной выдержки шовный материал для отмывания от стерилизующего раствора (стерильным пинцетом в асептических условиях) переносят последовательно в две стерильные емкости с физиологическим раствором, выдерживая в каждой по 5 мин. Затем шовный материал помещают в стерильную емкость (стерилизационную коробку, выложенную стерильной простыней, банку с притертой пробкой).
3.6. Способ приготовления стерилизующего средства. 4,8% рабочий раствор первомура готовят в два этапа:
• получение первомура;
• приготовление рабочего раствора разведением первомура водой.
3.6.1. При приготовлении первомура в стеклянной колбе, помещенной в кастрюлю с холодной водой, смешивают перекись водорода с муравьиной кислотой. Колбу оставляют в холодной водяной бане на 1-1,5 ч, периодически встряхивая ее содержимое. Первомур готовят в день применения.
3.6.2. 4,8% рабочий раствор получают разведением первомура дистиллированной или водопроводной водой. Рабочий раствор готовят в полиэтиленовой или стеклянной посуде, куда сначала наливают воду, а затем первомур. В такой посуде он может храниться в течение суток.
3.6.3. Количества перекиси водорода и муравьиной кислоты, необходимые для приготовления первомура, представлены в табл. 4-7.
Таблица 4-7. Состав ингредиентов для приготовления 4,8% раствора ПЕРВОМУРА
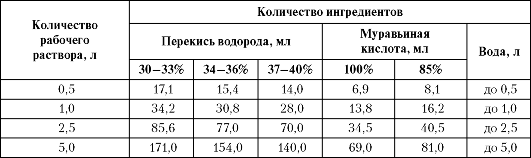 Ввиду использования реактивов с широким диапазоном концентрации в табл. 1 включены их количества, рассчитанные для разных концентраций как по перекиси водорода, так и по муравьиной кислоте. Здесь же приводятся объемы воды, требуемые для получения рабочих растворов.
Ввиду использования реактивов с широким диапазоном концентрации в табл. 1 включены их количества, рассчитанные для разных концентраций как по перекиси водорода, так и по муравьиной кислоте. Здесь же приводятся объемы воды, требуемые для получения рабочих растворов.
3.6.4. Рабочий раствор первомура характеризуется как 4,8% по суммарному содержанию в нем наиболее часто используемых в составе первомура 30-33% перекиси водорода и 100% муравьиной кислоты.
4. Методика контроля стерильности лигатурного шовного материала.
4.1. Правила отбора проб для контроля стерильности в лечебно-профилактических учреждениях.
4.1.1. В лечебно-профилактических учреждениях, имеющих централизованные стерилизационные, контролю на стерильность подлежит не менее 1% от числа одновременно простерилизованных образцов лигатурного шовного материала одного наименования.
4.1.2. В лечебно-профилактических учреждениях, не имеющих централизованных стерилизационных и осуществляющих стерилизацию в хирургических отделениях, контролю стерильности подлежат не менее 3 образцов одного вида лигатурного шовного материала.
4.1.3. Забор проб на стерильность производит операционная сестра под руководством сотрудника бактериологической лаборатории.
4.1.4. При централизации процесса стерилизации все образцы лигатурного шовного материала, подлежащие контролю, направляют в бактериологическую лабораторию в упаковке, в которой осуществляли их стерилизацию (пакеты, стерилизационные коробки-биксы, мягкая упаковка). Перед доставкой в лабораторию стерильные образцы в упаковке дополнительно завертывают в стерильную упаковку.
4.1.5. При стерилизации шовного материала в отделении забор проб производят в чистой операционной в стерильные емкости с соблюдением строжайших правил асептики.
4.2. Посев на стерильность лигатурного шовного материала.
4.2.1. Перед посевом емкости с отобранными образцами шовного материала в предбокснике протирают стерильной марлевой салфеткой, обильно смоченной 6% раствором перекиси водорода, и оставляют на 30 мин, затем вносят в бокс.
4.2.2. Перед посевом моток лигатурного шовного материала перекладывают в стерильные чашки Петри, разрезают на мелкие кусочки длиной 1-2 см.
4.2.3. Посев производят в 2 пробирки с тиогликолевой средой и в 2 пробирки с бульоном «Сабуро», помещая в каждую пробирку по 4-5 кусочков исследуемого материала.
4.2.4. Заключение о стерильности исследованных образцов лигатурного шовного материала делают после инкубирования в термостате посевов на тиогликолевую среду при температуре 32 °С, на среду «Сабуро» - 22 °С в течение 8 суток.
4.5. УТИЛИЗАЦИЯ БИОЛОГИЧЕСКИХ ОТХОДОВ
Санитарные правила и нормы СанПиН 2.1.7.728-99 «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений»
(утв. постановлением Главного государственного санитарного врача РФ от 22 января 1999 г. ? 2). Дата введения: 22 марта 1999 г. Содержание (извлечение).
1. Область применения.
1.1. Настоящие санитарные правила и нормы разработаны на основании Закона РСФСР «О санитарно-эпидемиологическом благополучии населения» в соответствии с «Положением о государственном санитарно-эпидемиологическом нормировании», утвержденным постановлением правительства Российской Федерации от 5 июня 1994 г. ? 625, и изменений и дополнений к нему, утвержденных постановлением Правительства Российской Федерации от 30 июня 1998 г. ? 680.
1.2. Настоящие правила предназначены для всех лечебно-профилактических учреждений (ЛПУ), организаций, занимающихся сбором, хранением, транспортированием отходов здравоохранения, а также проектированием и эксплуатацией установок переработки, обезвреживания и полигонов захоронения твердых отходов.
2. Общие положения.
2.1. Настоящие правила и нормы (далее СанПиН) определяют правила сбора, хранения, переработки, обезвреживания и удаления всех видов отходов лечебнопрофилактических учреждений.
Под отходами лечебно-профилактических учреждений понимаются все виды отходов, образующиеся в:
• больницах, (общегородских, клинических, специализированных, ведомственных, в составе научно-исследовательского, учебного институтов), поликлиниках (в том числе взрослых, детских, стоматологических), диспансерах;
• станциях скорой медицинской помощи; станциях переливания крови;
• учреждениях длительного ухода за больными;
• научно-исследовательских институтах и учебных заведениях медицинского профиля; ветеринарных лечебницах; аптеках; фармацевтических производствах;
• оздоровительных учреждениях (санаториях, профилакториях, домах отдыха, пансионатах);
• санитарно-профилактических учреждениях; учреждениях судебно-медицинской экспертизы;
• медицинских лабораториях (в том числе анатомических, патологоанатомических, биохимических, микробиологических, физиологических);
• частных предприятиях по оказанию медицинской помощи.
2.2. Для организации обращения с отходами и повседневного контроля в крупных и средних лечебно-профилактических учреждениях (ЛПУ) приказом руководителя учреждения назначается ответственный специалист (эпидемиолог, главная медсестра, зам. главного врача по техническим вопросам), который обязан пройти обучение в специализированном центре* по обращению с отходами и получить свидетельство (сертификат) установленного образца на право организации работ по обращению с отходами. В небольших ЛПУ и коммерческих учреждениях обучение проходит руководитель учреждения или его заместитель. В случае отсутствия данного специализированного центра обучение и выдачу свидетельств установленного образца осуществляет территориальный центр государственного санитарно-эпидемиологического надзора (ЦГСЭН).
3. Классификация медицинских отходов.
3.1. Лечебно-профилактическое учреждение вне зависимости от его профиля и коечной мощности в результате своей деятельности образует различные по фракционному составу и степени опасности отходы.
3.2. Все отходы здравоохранения разделяются по степени их эпидемиологической, токсикологической и радиационной опасности на пять классов опасности (см. ниже).
Класс А. Неопасные отходы лечебно-профилактических учреждений.
Отходы, не имеющие контакта с биологическими жидкостями пациентов, инфекционными больными, нетоксичные отходы. Пищевые отходы всех подразделений всех отделений ЛПУ кроме инфекционных (в т.ч. кожно-венерологических), фтизиатрических. Мебель, инвентарь, неисправное диагностическое оборудование, не содержащие токсических элементов. Неинфицированная бумага, смет, строительный мусор и т.д.
Класс Б. Опасные (рискованные) отходы лечебно-профилактических учреждений.
Потенциально неинфицированные отходы. Материалы и инструменты, загрязненные выделениями в том числе кровью. Патологоанатомические отходы. Органические операционные отходы (органы, ткани и т.п.). Все отходы из инфекционных отделений (в т.ч. пищевые). Отходы из микробиологических лабораторий, работающих с микроорганизмами 3-4-й группы патогенности. Биологические отходы вивариев.
Класс В. Чрезвычайно опасные отходы лечебно-профилактических учреждений.
Материалы, контактирующие с больными особо опасными инфекциями. Отходы из лабораторий, работающих с микроорганизмами 1-4-й групп патогенности. Отходы фтизиатрических, микологических больниц. Отходы от пациентов с анаэробной инфекцией
Класс Г. Отходы лечебно-профилактических учреждений, по составу близкие к промышленным.
Просроченные лекарственные средства, отходы от лекарственных и диагностических препаратов, дезсредства, не подлежащие использованию, с истекшим сроком годности. Цитостатики и другие химпрепараты. Ртуть содержащие предметы, приборы и оборудование
Класс Д. Радиоактивные отходы лечебно-профилактических учреждений.
Все виды отходов, содержащие радиоактивные компоненты
4. Общие правила организации системы сбора, временного хранения и транспортирования отходов в ЛПУ.
4.1. Организованная на территории ЛПУ система сбора, временного хранения и транспортирования отходов должна состоять из следующих звеньев:
• сбора отходов внутри медицинского подразделения;
• транспортирования и перегрузки отходов в (меж) корпусные контейнеры;
• временного хранения отходов на территории ЛПУ;
• транспортирование (меж)корпусных контейнеров к месту обезвреживания отходов.
Порядок проведения работ для каждого звена определяется соответствующими разделами данных санитарных правил.
4.2. К отходам, образующимся на территории лечебно-профилактического учреждения, в зависимости от их класса предъявляются различные требования по сбору, временному хранению и транспортированию.
4.3. Смешение отходов различных классов на всех стадиях их сбора, хранения и транспортирования недопустимо.
4.4. В каждом медицинском подразделении руководитель совместно с ответственным специалистом за сбор отходов в данном медицинском учреждении из имеющегося персонала назначает лицо, ответственное за сбор отходов. Данное лицо непосредственно на местах первичного сбора отходов осуществляет контроль за обращением с отходами и производит герметизацию одноразовых емкостей (пакетов, баков).
4.5. К работам, связанным со сбором, временным хранением и транспортированием отходов, не допускается привлечение лиц, не прошедших предварительного обучения.
4.6. Обучение персонала правилам безопасного обращения с отходами осуществляется ответственным специалистом за сбор отходов в данном медицинском учреждении.
5. Правила сбора отходов в медицинских подразделениях.
5.1. Исходя из различной степени эпидемиологической, токсикологической, радиационной опасности к отходам каждого из классов предъявляются различные требования.
5.2. Отходы класса А.
5.2.1. Отходы класса А образуются в следующих структурных подразделениях:
• палатные отходы отделений (кроме инфекционных, кожно-венерологических, фтизиатрических, микологических) ЛПУ;
• административно-хозяйственные помещения ЛПУ;
• центральные пищеблоки, буфеты отделений (кроме инфекционных, кожновенерологических, фтизиатрических, микологических);
• внекорпусной территории лечебно-профилактического учреждения.
5.2.2. Сбор отходов класса А осуществляется в многоразовые емкости или одноразовые пакеты. Одноразовые пакеты располагаются на специальных тележках или внутри многоразовых баков. Заполненные многоразовые емкости или одноразовые пакеты доставляются к местам установки (меж)корпусных контейнеров и перегружаются в контейнеры, предназначенные для сбора отходов данного класса. Многоразовая тара после сбора и опорожнения подлежит мытью и дезинфекции.
5.2.3. Крупногабаритные отходы данного класса собираются в специальные бункеры для крупногабаритных отходов. Поверхности и агрегаты крупногабаритных отходов, имевшие контакт с инфицированным материалом или больными, подвергаются обязательной дезинфекции.
5.3. Отходы класса Б. 5.3.1. Места образования:
• операционные;
• реанимационные;
• процедурные, перевязочные и другие манипуляционно-диагностические помещения ЛПУ;
• инфекционные, кожно-венерологические отделения ЛПУ;
• медицинские и патологоанатомические лаборатории;
• лаборатории, работающие с микроорганизмами 3-4-й групп патогенности;
• виварии, ветеринарные лечебницы.
5.3.2. Все отходы, образующие в этих подразделениях, после дезинфекции собираются в одноразовую герметичную упаковку.
5.3.3. Мягкая упаковка (одноразовые пакеты) закрепляется на специальных стойках (тележках).
5.3.4. После заполнения пакета примерно на 3/4 из него удаляется воздух и сотрудник, ответственный за сбор отходов в данном медицинском подразделении, осуществляет его герметизацию. Удаление воздуха и герметизация одноразового пакета производится в марлевой повязке и резиновых перчатках.
5.3.5. Органические отходы, образующиеся в операционных, лабораториях, микробиологические культуры и штаммы, вакцины, вирусологически опасный материал после дезинфекции собираются в одноразовую твердую герметическую упаковку.
5.3.6. Сбор острого инструментария (иглы, перья), прошедшего дезинфекцию, осуществляется отдельно от других видов отходов в одноразовую твердую упаковку.
5.3.7. Транспортирование всех видов отходов класса Б вне пределов медицинского подразделения осуществляется только в одноразовой упаковке после ее герметизации.
5.3.8. В установленных местах загерметезированные одноразовые емкости (баки, пакеты) помещаются в (меж)корпусные контейнеры, предназначенные для сбора отходов класса Б.
5.3.9. Одноразовые емкости (пакеты, баки) с отходами класса Б маркируются надписью «Опасные отходы. Класс Б» с нанесением кода подразделения ЛПУ, названия учреждения, даты и фамилии ответственного за сбор отходов лица.
5.4. Отходы класса В.
5.4.1. Места образования:
• подразделения для пациентов с особо опасными и карантинными инфекциями;
• лаборатории, работающие с микроорганизмами 1-2-й групп патогенности;
• фтизиатрические и микологические клиники (отделения).
5.4.2. Все отходы, образующиеся в данных подразделениях подлежат дезинфекции в соответствии с действующими нормативными документами.
5.4.3. Сбор отходов данного класса осуществляется в одноразовую упаковку. Мягкая упаковка (одноразовые пакеты) должна быть закреплена на специальных стойках (тележках).
5.4.4. После заполнения пакета примерно на 3/4 из него удаляется воздух и сотрудник, ответственный за сбор отходов в данном медицинском подразделении, осуществляет его герметизацию с соблюдением требований техники безопасности с возбудителями 1-2-й групп патогенности.
5.4.5. Микробиологические культуры и штаммы, вакцины должны собираться в одноразовую твердую герметичную упаковку.
5.4.6. Транспортирование всех видов отходов класса В вне пределов медицинского подразделения осуществляется только в одноразовой упаковке после ее герметизации.
5.4.7. В установленных местах загерметезированные одноразовые емкости (баки, пакеты) помещаются в (меж)корпусные контейнеры, предназначенные для сбора отходов класса В.
5.4.8. Одноразовые емкости (пакеты, баки) с отходами класса В маркируются надписью «Чрезвычайно опасные отходы. Класс В» с нанесением кода подразделения ЛПУ, названия учреждения, даты и фамилии ответственного за сбор отходов лица.
5.5. Отходы класса Г.
5.5.1. Места образования:
• диагностические подразделения;
• отделения химиотерапии;
• патологоанатомические отделения;
• фармацевтические цехи, аптеки, склады;
• химические лаборатории;
• административно-хозяйственные помещения.
5.5.2. Степень токсичности каждого вида отходов данного класса определяется согласно классификатору токсичных промышленных отходов и методическим рекомендациям по определению класса токсичности промышленных отходов.
5.5.3. Использованные люминесцентные лампы, ртутьсодержащие приборы и оборудование собирают в закрытые герметичные емкости. После заполнения емкости герметизируются и хранятся в вспомогательных помещениях. Вывозятся специализированными предприятиями на договорных условиях.
5.5.4. Сбор, хранение цитостатиков, относящихся к отходам 1-2-го классов токсичности, осуществляют в соответствии с классификатором токсичных промышленных отходов и другими действующими нормативными документами.
5.5.5. Отходы класса Г, относящиеся ко 2 и 3-му классам токсичности в соответствии с классификатором токсичных промышленных отходов, собираются и упаковываются в твердую упаковку, 4-го класса - в мягкую.
5.6. Отходы класса Д.
5.6.1. Места образования:
• диагностические лаборатории (отделения);
• радиоизотопные лаборатории и рентгеновские кабинеты.
5.6.2. Сбор, хранение, удаление отходов данного класса осуществляется в соответствии с требованиями правил работы с радиоактивными веществами и другими источниками ионизирующих излучений, нормами радиационной безопасности, и других действующих нормативных документов, которые регламентируют обращение с радиоактивными веществами.
5.7. В соответствии с требованиями ст. 24 Закона РСФСР «О санитарно-эпидемиологическом благополучии» не допускается:
• пересыпать отходы классов Б и В из одной емкости в другую;
• устанавливать одноразовые и многоразовые емкости около электронагревательных приборов;
• утрамбовывать любые отходы руками;
• осуществлять сбор отходов без перчаток.
6. Общий порядок проведения дезинфекции отходов и многоразового инвентаря.
Отходы класса Б и В должны быть подвергнуты обязательной дезинфекции перед сбором в одноразовую упаковку непосредственно на местах первичного сбора отходов методом погружения в дезинфицирующий раствор, подготовленный в специально выделенной для этой цели емкости.
Дезинфекция отходов классов Б и В производится в соответствии с действующими нормативными документами.
Для дезинфекции следует использовать зарегистрированные Минздравом России и рекомендованные к применению в медицинских учреждениях дезинфицирующие средства в концентрациях и времени экспозиции, указанных в соответствующих рекомендациях по их использованию. Дезинфекция производится в пределах медицинского подразделения, где образуются отходы данного класса.
6.2. Дезинфекция многоразовых сборников для отходов класса А производится ежедневно силами лечебно-профилактического учреждения.
6.3. Дезинфекцию (меж)корпусных контейнеров для сбора отходов классов Б и В, кузовов автомашин производит автотранспортная организация, вывозящая отходы один раз в неделю в местах разгрузки.
В случае аварийных ситуаций, при обнаружении открытого нахождения отходов внутри (меж)корпусных контейнеров или автотранспорта дезинфекция проводится немедленно. Для этих целей в ЛПУ необходимо организовать места для мытья и дезинфекции (меж)корпусных контейнеров и автотранспорта.
Место для дезинфекции асфальтируется и должно иметь единый сток. Сточные воды после дезинфекции собираются и сливаются в канализационную сеть медицинского учреждения.
7. Общие требования к инвентарю для организации системы сбора и удаления отходов и местам установки (меж)корпусных контейнеров.
7.1. Одноразовые пакеты, используемые для сбора отходов классов Б и В, должны обеспечивать герметизацию и возможность безопасного сбора в них до 15 кг отходов. Пакеты для сбора отходов класса Б должны иметь желтую окраску, класса В - красную, класса А - белую.
7.2. Конструкция одноразовых баков для сбора отходов класса Б и В, должна обеспечивать из герметизацию в процессе сбора и невозможность их вскрытия при транспортировке отходов вне пределов медицинского отделения (лаборатории).
7.3. Конструкция тележек (стоек) для транспортирования одноразовых пакетов должна обеспечивать возможность их закрепления и быть удобной в эксплуатации.
7.4. Конструкция многоразовых баков для сбора отходов класса А и установки одноразовых пакетов должна предусматривать крышку, а также колеса и ручки для удобного транспортирования.
7.5. Сбор отходов разных классов производится в различные контейнеры. Контейнеры для сбора отходов разных классов должны обладать легко различимыми отличиями. Контейнеры для сбора отходов одного класса должны быть полностью идентичны.
7.6. Используемые (меж)корпусные контейнеры должны обладать герметичными плотно закрывающимися крышками. Конструкция контейнеров должна быть полностью герметична и влагонепроницаема, не допускать возможность контакта посторонних лиц с их содержимым, недоступна животным.
7.7. Контейнеры для сбора отходов классов А, Б, Г располагаются на открытой площадке или в изолированном помещении медицинского корпуса. К помещениям корпуса, в которых располагаются контейнеры с отходами, предъявляются специальные требования (приложение 1).
7.8. Контейнеры для сбора отходов класса В располагаются только в изолированном помещении медицинского корпуса. К помещениям корпуса, в которых располагаются контейнеры с отходами класса В, предъявляются специальные требования (см. приложение 1).
Хранение контейнеров с отходами класса В совместно с контейнерами отходов классов А, Б, Г недопустимо.
7.9. Открытая площадка для установки контейнеров должна иметь асфальтированную поверхность и быть удобной для подъезда автотранспорта и проведения погрузочно-разгрузочных работ. Открытые площадки для установки контейнеров располагаются не менее чем в 25 м от лечебных корпусов и не менее 100 м от пищеблоков.
7.10. Допускается расположение контейнеров для сбора отходов различных классов на одной открытой площадке. На открытой площадке допускается расположение не более 5 контейнеров.
8. Условия временного хранения и удаления отходов.
8.1. Открытое хранение и контакт персонала с отходами классов Б, В, Г вне помещений медицинского подразделения не допускается.
8.2. Хранение и транспортирование отходов по территории лечебно-профилактического учреждения классов А, Б, В допускается только в герметичных многоразовых контейнерах. Смешение потока удаления отходов класса В с другими потоками не допускается. Отходы классов А, Б, В допускается хранить не более 1 суток в естественных условиях, более суток при температуре не выше 5 °С. Пищевые отходы всех классов необходимо хранить в холодильниках при температуре не выше 5 °С. Вывоз отходов классов А, Б, В должен производиться ежедневно при отсутствии на территории лечебного учреждения установки по обезвреживанию отходов.
8.3. При транспортировании отходов класса А разрешается применение автотранспорта, используемого для перевозки твердых бытовых отходов.
8.4. Основной системой сбора и удаления медицинских отходов является система «сменяемых» сборников. При системе «сменяемых» сборников отходы в контейнерах вывозят в закрытых кузовах автомашин, специально предназначенных для этих целей, а на место удаленных контейнеров устанавливают порожние сборники.
8.5. Транспортирование отходов классов А, Б, В вне территории ЛПУ допускается только в закрытых кузовах специально применяемых для этих целей автомашин. Использование автомашин, предназначенных для перевозки отходов классов Б и В, для других целей не допускается.
8.6. Хранение отходов класса Г производится в специально отведенных для этой цели вспомогательных помещениях.
8.7. Отходы класса А могут быть захоронены на обычных полигонах по захоронению твердых бытовых отходов. Отходы классов Б, В необходимо уничтожать на специальных установках по обезвреживанию отходов ЛПУ термическими методами.
8.8. Обезвреживание отходов класса Б и В может осуществляться децентрализованным или централизованным способами.
Размещение установок по термическому обезвреживанию отходов ЛПУ на территории лечебного учреждения (децентрализованный способ) рассматривается и согласовывается с территориальными центрами госсанэпиднадзора.
При централизованном способе отходы ЛПУ обезвреживаются в печах крупных мусоросжигательных заводов. Месторасположение, условия эксплуатации, уровни воздействия на окружающую среду данных заводов регламентируются соответствующими нормативными документами.
При отсутствии установки по обезвреживанию эпидемиологически безопасные патологоанатомические и органические операционные отходы (органы, ткани и т.п.) захораниваются на кладбищах в специально отведенных могилах. Другие отходы класса Б (материалы и инструменты, выделения пациентов, отходы из микробиологических лабораторий и вивариев) после дезинфекции, проведенной в соответствии с разделом 7 настоящего документа, вывозят на полигоны твердых бытовых отходов.
8.9. Транспортирование, обезвреживание и захоронение отходов класса Г осуществляется в соответствии с гигиеническими требованиями, предъявляемыми к порядку накопления, транспортирования, обезвреживания и захоронения токсичных промышленных отходов.
9. Реализация схемы сбора и удаления отходов.
Детализация и реализация планов по сбору и удалению отходов разрабатывается отдельно для каждого ЛПУ. При составлении плана сбора и удаления отходов выполняются следующие мероприятия.
9.1. Производится качественный и количественный анализ образующихся отходов. Вычисляются величины накопления отходов по классам.
9.2. Определяется количество необходимой упаковки в местах первичного сбора для каждого класса отходов.
Одноразовая упаковка, контейнеры для (меж)внутрикорпусного сбора, помещение для внутрикорпусного сбора отходов должны удовлетворять требованиям, изложенным в соответствующих пунктах данных санитарных правил.
9.3. Разрабатывается система сбора и удаления отходов с учетом требований, предъявляемых к раздельному сбору и удалению отходов различных классов, при этом учитывается:
• отходы классов Б и В должны быть подвергнуты обязательному термическому обезвреживанию;
• отходы класса А могут быть подвергнуты термическому обезвреживанию или вывезены на специальные полигоны.
9.4. Руководителем ЛПУ по согласованию с ЦГСЭН утверждается инструкция, устанавливающая правила обращения с отходами и персональную ответственность сотрудников, схема удаления отходов, включающая сведения о качественном и количественном составе отходов, местах для установки и вида емкостей для сбора отходов, местах промежуточного хранения отходов, о расходах на сбор, транспортирование и удаление отходов.
ПРИЛОЖЕНИЕ 1
Требования к внутрикорпусным помещениям для временного хранения медицинских отходов
1. Пол помещений выкладывается керамической плиткой.
2. Стены помещений выкладываются глазурованной плиткой по всей высоте.
3. Покрытие потолка влагостойкой краской.
4. Оконные блоки по серии 1.236-6 вып.1.
5. Внутренние дверные блоки по серии 1.136-10.
6. Помещение должно быть оборудовано:
• умывальником;
• поливочным краном;
• стоком воды;
• бактерицидным облучателем;
• вентиляцией.
ПРИЛОЖЕНИЕ 2
Адреса специализированных центров по организации обучения обращению с отходами лечебно-профилактических учреждений
1. НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина, 119833, г. Москва, Погодинская ул. 10, тел. 246-58-05, факс 245-03-14.
2. Центр санитарной очистки города - г. Москва, 2-й Нагатинский проезд, стр. 6Б, тел. 111-13-73.
3. Медицинская академия последипломного образования, Кафедра медицинской экологии, 195015, г. Санкт-Петербург, ул. Салтыкова-Щедрина, д. 41, тел. 275- 19-21, факс 275-19-22.
ПРИЛОЖЕНИЕ 3
* Адреса специализированных центров в г. Москве и г. Санкт-Петербурге приведены в приложении 2.
** Согласно СанПиНу 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов 1-4-й групп патогенности.
*** Общий порядок проведения дезинфекции определяется в разделе 7 «Требования к дезинфекции отходов и многоразового инструментария».
Теги:
234567 Описание для анонса:
234567 Начало активности (дата): 19.06.2013 09:05:00
234567 Кем создан (ID): 1
234567



