ГЛАВА 3 ДИАГНОСТИКА И ЛЕЧЕНИЕ МЕСТНОЙ И ГЕНЕРАЛИЗОВАННОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
В настоящее время происходит неуклонный рост гнойной хирургической инфекции. Это обусловлено снижением общей иммунорезистентности пациентов, возрастанием вирулентности гноеродных микробов, потерей их чувствительности к антибиотикам. Большинство местных гнойных процессов могут с успехом лечить и врачи общей практики.
3.1. АБСЦЕСС МЯГКИХ ТКАНЕЙ
Абсцесс - скопление гноя в полости, ограниченной пиогенной оболочкой. В зависимости от локализации абсцессов их подразделяют на поверхностные, расположенные в подкожной клетчатке, и глубокие, которые находятся в подлежащих тканях или органах.
Причинами возникновения абсцессов являются:
• прогрессирование деструктивно-воспалительного процесса, например при фурункуле, карбункуле, лимфадените;
• микробное загрязнение подкожной клетчатки при повреждении кожи (раны, ссадины и другие) и при различных инъекциях;
• перенос гноеродных микробов гематогенным или лимфогенным путем (метастазирование при сепсисе);
• нагноение гематом.
При поверхностных абсцессах подкожной клетчатки наблюдаются ограниченная болезненная припухлость, покраснение кожи, местное повышение температуры и нарушение функции той части организма, где возник абсцесс. Наиболее важным клиническим признаком является обнаружение феномена флюктуации или зыбления, обусловленное скоплением жидкости в полости абсцесса. Нередко отмечаются общие признаки воспаления, такие, как повышение температуры тела до 39 °С, тахикардия, увеличение количества лейкоцитов, сдвиг лейкоформулы влево, увеличение скорости оседания эритроцитов (СОЭ).
Обычно распознавание поверхностных абсцессов не представляет особой трудности. Тогда как диагностика глубоких абсцессов всегда затруднена и предполагает использование вспомогательных методов исследования: диагностической пункции, рентгенологического, ультразвукового исследований, компьютерной или магнитно-резонансной томографии.
В настоящее время в практике часто встречаются не только типичные абсцессы, но и так называемые «холодные», или натечные, абсцессы, возникающие при
туберкулезе костей и суставов. Они характеризуются медленным развитием в течение нескольких недель или месяцев и скрытым течением без признаков острого воспаления.
Хирургическая тактика
Небольшие поверхностные абсцессы лечит врач общей практики. В стадии воспалительного инфильтрата, когда абсцесс еще не сформировался, лечение консервативное: местно сухое тепло, физиопроцедуры, внутрь антибиотики. При появлении флюктуации, т.е. при сформировавшемся абсцессе, необходимо вскрыть гнойник с помощью одного или нескольких разрезов под местной анестезией.
В последующем необходимы перевязки и антибиотикотерапия. Достаточно эффективными и общедоступными зарекомендовали себя следующие комбинации антибиотиков: хлорамфеникол (левомицетин) и метронидазол; хлорамфеникол (левомицетин) и гентамицин, воздействующие на грамположительную и грамотрицательную аэробную и анаэробную микрофлору.
Больные с большими поверхностными, а также глубокими абсцессами должны быть направлены на стационарное лечение в отделение гнойной хирургии или хирургический стационар общего профиля.
В профилактике абсцессов существенное значение имеет педантичное соблюдение правил асептики, в том числе и при выполнении инъекций лекарственных препаратов, своевременное и эффективное лечение первичных воспалительных процессов, тщательный туалет всех открытых повреждений.
Сроки нетрудоспособности: от 2 до 4 недель в зависимости от распространенности абсцесса.
Реабилитация
Курс физиопроцедур, направленный на скорейшее заживление гнойников: лазеро- и магнитотерапия, фонофорез с гидрокортизоном.
3.2. ГЕМАТОГЕННЫЙ И ПОСТТРАВМАТИЧЕСКИЙ ОСТЕОМИЕЛИТЫ
Остеомиелит как нозологическая форма включает гнойное воспаление компактной и губчатой кости (остит), костного мозга (остеомиелит) и надкостницы (периостит).
КЛАССИФИКАЦИЯ
Классификация остеомиелита учитывает этиологию, патогенез и пути распространения инфекции.
ЭТИОЛОГИЯ
По этиологии выделяют неспецифический остеомиелит, вызываемый микробами - сапрофитами, и специфический остеомиелит туберкулезного, сифилитического, скарлатинозного, паратифозного и другого генеза.
Если возбудители заболевания проникают в кость из кровеносных сосудов, говорят о гематогенной форме остеомиелита.
При негематогенных формах происходит экзогенное микробное загрязнение. При открытых переломах кости, огнестрельных ранениях, после операций, блокад, инъекций может возникать соответственно посттравматический, огнестрельный, послеоперационный и постинъекционный остеомиелит.
Другой механизм поражения кости - распространение инфекции на нее из близлежащих инфицированных тканей при флегмонах, гнойных затеках. При неспецифическом гематогенном и посттравматическом остеомиелите на последних стадиях заболевания различия между ними сглаживаются.
КЛАССИФИКАЦИЯ
По характеру клинического течения остеомиелиты подразделяют на острые и хронические.
В категорию острого поражения кости входят начальные фазы воспаления при посттравматическом, огнестрельном и других формах остеомиелита.
В группу хронического остеомиелита переходят виды некупированного в течение 6 недель острого остеомиелита и первично хронические его формы: абсцесс Броди, склерозирующий остеомиелит Гарре и другие.
КЛИНИЧЕСКАЯ КАРТИНА
Острый гематогенный остеомиелит начинается как диффузный воспалительный процесс в костном мозге, а затем распространяется на гаверсовы каналы и надкостницу. Гнойно-деструктивный процесс протекает по типу флегмоны и сопровождается некрозом костного мозга, губчатой части и компактной пластинчатой кости. В образовавшихся через 3-4 дня гнойниках наблюдается интенсивное рассасывание костной ткани.
При раннем и адекватном применении антибактериальных препаратов абсцедирования не возникает, но чаще происходит инкапсуляция гнойника в кости, и к концу месяца начинается секвестрация нежизнеспособных фрагментов кости. Они имеют различную форму, величину и строение. Когда происходит уменьшение грануляций, секвестры оказываются свободно лежащими в очаге воспаления, угнетая локальный репаративный процесс. Перспективы самостоятельного рассасывания этих секвестров нет. Более того, в их толще вегетирует патогенная флора, препятствующая воздействию тканевых ферментов.
Несколько иначе протекает посттравматический остеомиелит, при котором выделяют три этапа: острое воспаление в краях раны с отграничением и частичным расплавлением некротизированных тканей; формирование гнойного очага, окруженного пиогенной оболочкой; образование длительно существующего гнойного очага после сращения перелома и восстановление функции поврежденного сегмента.
Клинике острого гематогенного остеомиелита предшествует период предвестников: общее недомогание, головная боль, ломота в суставах и мышцах. Вслед за ними возникают резкий озноб, гиперпирексия (39 °С и выше), общая слабость, разбитость, иногда рвота. Как правило, эти общие симптомы, будучи ведущими, в первые дни, определяют яркую клинику заболевания: быстрое ухудшение общего состояния, затемнение сознания, бред, симптомы раздражения мозговых
оболочек, иногда судороги. Внешний вид типичен для тяжело лихорадящего больного: лицо бледное, глаза запавшие, слизистые губ цианотичные, кожа сухая, с желтушным оттенком и пониженным тургором, иногда определяются точечные кровоизлияния, язык суховат, обложен белым налетом. Прием пищи вызывает тошноту и рвоту. Нарушения гемодинамики проявляются в виде учащения пульса (соответственно повышению температуры) с одновременным ослаблением его наполнения, приглушением сердечных тонов и понижением артериального давления. Учащенное поверхностное дыхание может стать следствием интоксикации либо бронхопневмонии. Тогда над легочным полем соответственно зоне поражения определяют укорочение перкуторного тона, а при аускультации выслушивают влажные мелкопузырчатые хрипы. Печень, селезенка при пальпации увеличены и болезненны. Пальпаторно выявляют болезненность почек, положительный симптом Пастернацкого, тенденция к олигурии.
Высокая температура тела по мере прогрессирования нагноения приобретает ремиттирующий характер с большими суточными колебаниями. В периферической крови значительно повышается число лейкоцитов (до 20 000-30 000) за счет увеличения нейтрофилов и сдвига лейкоформулы вплоть до появления миелоцитов; одновременно падает содержание эозинофилов и моноцитов, нарастает анемия, гемоглобин и эритроциты снижаются.
Ценным симптомом гематогенного остеомиелита в раннем периоде является локализованная болезненность в очаге поражения. Боли носят рвущий, сверлящий или стреляющий характер, часто достигая значительной интенсивности. Резкая болезненность определяется при поколачивании по локтевому суставу (поражение плечевой кости) или по пятке (поражение нижней конечности). При расположении патологического очага вблизи сустава конечность принимает полусогнутое положение вследствие рефлекторного сокращения мышц. Под отслоенной надкостницей и в окружающих мягких тканях скапливается гной.
ДИАГНОСТИКА
Диагностика острого гематогенного остеомиелита основывается на внимательном сборе анамнеза, оценке клинических симптомов. В пользу остеомиелита свидетельствуют нарушение опорной функции конечности, развитие содружественного артрита или контрактуры ближайшего сустава, соответствующей области болевой зоны. В течение 3-5 суток рентгенографические данные малоинформативны, и лишь через 7-10 дней можно обнаружить типичные периостальные изменения.
Для ранней диагностики остеомиелита целесообразно выполнить УЗИ, термографию, пункцию кости и остеотонометрию. Эти методы позволяют обнаружить усиление контуров мягких тканей, реакцию надкостницы в виде «периостального козырька» и очаг деструкции кости. Для ранней диагностики и дифференциальной диагностики с другими заболеваниями высокоинформативными являются спиральная компьютерная и магнитно-резонансная томография.
Дифференциальную диагностику следует проводить с глубоким тромбофлебитом, флегмоной мягких тканей, лимфаденитом конечностей, обострением ревматизма, доброкачественными и злокачественными опухолями, в частности с остеогенной саркомой, эозинофильной гранулемой и другими новообразованиями. Исключить опухоль поможет пункционная или операционная биопсия.
Хирургическая тактика
Больные с острым гематогенным и посттравматическим остеомиелитом подлежат экстренной госпитализации в хирургическое отделение. Комплексное лечение острого гематогенного остеомиелита включает три основных направления: хирургическое вмешательство с санацией гнойного очага в кости и его эффективное дренирование; направленная антибактериальная терапия и улучшение иммунологической реактивности организма.
С учетом возбудителей заболевания (золотистый стафилококк, другая аэробная и анаэробная микрофлора) современная антибактериальная терапия включает оксациллин или цефазолин внутривенно, а при аллергии на них - ванкомицин. При грамотрицательной бактериемии добавляют цефалоспорины третьего поколения. Не менее эффективна другая схема: внутривенное введение ципрофлоксацина с рифампицином. Антибактериальные препараты применяются не менее 4-6 недель.
При идентификации стафилококков, кишечной или синегнойной палочки к лечению добавляют соответствующие препараты для пассивной и активной иммунизации (антистафилококковая, антиколибациллярная или антисинегнойная плазма, специфический гамма-глобулин или анатоксин).
Воздействие на реактивность организма состоит в назначении дезинтоксикационной, стимулирующей и общеукрепляющей терапии (гемотрансфузии, переливание эритроцитной массы, альбумина, плазмы, реополиглюкина, полиионных растворов). По показаниям подкожно вводят гепарин по 2500 ЕД 4 раза в сутки.
Сроки нетрудоспособности колеблются от 16 до 20 недель. Результаты лечения острого гематогенного остеомиелита зависят от своевременного выполнения операции, эффективности послеоперационного промывания костномозгового пространства и адекватной общей терапии.
Реабилитация больных
В последнее время получены хорошие результаты после применения гипербарической оксигенации, плазмафереза и озонотерапии.
ТРАВМАТИЧЕСКИЙ ОСТЕОМИЕЛИТ
Травматический остеомиелит объединяет разнообразные гнойно-воспалительные осложнения открытых, в первую очередь, огнестрельных, переломов, когда он развивается почти у каждого четвертого пострадавшего.
По локализации огнестрельного остеомиелита на первом месте стоит бедро; за ним в убывающем порядке следуют голень, стопа, плечо.
Второй причиной остеомиелита после огнестрельных ранений являются открытые переломы костей. Переломы длинных трубчатых костей осложняются остеомиелитом вдвое чаще, чем мелких и плоских.
Клиническая картина посттравматического остеомиелита отличается относительной изменчивостью и для своей характеристики требует всестороннего учета патоморфологических и клинических показателей. Несмотря на разнообразие клинических форм, различают острый и хронический посттравматический остеомиелит. Острый процесс возникает через 2-3 недели после травмы, протекает
бурно. Клиническая картина складывается из местных и общих симптомов. На ее развитие существенное влияние оказывают масштабы повреждения тканей. При обширной зоне ранения наблюдаются особенно тяжелые формы. Местно определяются некротический налет, отечность раны, потускнение тканей и грануляций, гнилостно-гнойный характер отделяемого; выступающая кость, лишенная надкостницы, приобретает тусклый серый цвет. В процесс инфильтрации вовлекаются ближайшие группы мышц с образованием обширных гнойных затеков по ходу фасциальных влагалищ. Общие явления вследствие интоксикации организма проявляются в виде повышения температуры (до 38-39 °С), приобретающей интермиттирующий характер, нарастающей слабости, отсутствия аппетита, бессонницы.
ЛЕЧЕНИЕ
Лечение посттравматического остеомиелита в острой стадии должно быть комплексным и проводиться в условиях хирургического стационара. После коррекции нарушений гомеостаза выполняют радикальную секвестрэктомию с последующим пролонгированным промыванием раны антисептическими растворами.
Хорошо себя зарекомендовали следующие комбинации антибиотиков: оксациллин и ципрофлоксацин либо ванкомицин и цефтазидин или цефоперазон.
Принципиальными мерами профилактики посттравматического остеомиелита являются полноценная и качественно проведенная первичная хирургическая обработка свежей костно-мышечной раны с удалением всех нежизнеспособных тканей и инородных тел; адекватное дренирование раны; обеспечение надежной лечебной иммобилизации; интенсивная антибактериальная терапия. При этих условиях не происходит нагноения поврежденных мягких тканей, из которых инфекция переходит на кость.
При сосудистой патологии амбулаторным больным (нетяжелое течение) назначают ампициллин (сульбактам), в стационаре - внутривенно меропенем или имипенем либо комбинацию цефепима с метронидазолом или ванкомицина и метронидазола. Лечение продолжается до 4-6 недель.
Сроки нетрудоспособности индивидуальны и в основном определяются временными параметрами консолидации перелома, которые разнятся от 16 до 20 недель для плечевой и бедренной костей, до 12 недель - при переломах предплечья и голени.
Реабилитация
В комплексе мер общего воздействия эффективной является баротерапия, по показаниям - эфферентные методы: плазмаферез, ультрафиолетовое облучение крови и озонотерапия.
ХРОНИЧЕСКИЙ ОСТЕОМИЕЛИТ
Хронический остеомиелит является следствием перехода всех клинических форм острого воспалительного поражения кости в хроническое течение. В этой стадии вне зависимости от форм острого остеомиелита процесс протекает однотипно.
Диагноз хронического остеомиелита включает все его виды, когда воспаление длится более шести недель. При этом основным видом лечения является операция. В клинике хронического остеомиелита следует условно различать три фазы:
• фазу окончательного перехода острого процесса в хронический;
• фазу ремиссии;
• рецидивирование.
В первой фазе - на этапе перехода острого воспаления в хроническое - общее самочувствие пациента улучшается, снижается интоксикация, нормализуются результаты лабораторных исследований. В очаге поражения кости формируются гнойные свищи. Результаты фистулографии существенно помогают определить локализацию и размер очага поражения и план предстоящей операции. К этому времени происходит формирование костных секвестров, которые по форме бывают кортикальными, центральными, циркулярными, губчатыми, тотальными. Одновременно с формированием свободных секвестров образуется секвестральная полость (коробка), выстланная капсулой. Внутри коробки находятся гной и фрагменты некротизированной кости. Секвестральная коробка имеет одно и более отверстий, через которые гнойный экссудат поступает в свищевые ходы, а затем наружу.
В фазе ремиссии завершается формирование секвестральной коробки, выделение гноя через свищи полностью прекращается или значительно снижается.
При рецидиве заболевания у больного появляются признаки токсико-резорбтивной лихорадки, а в зоне остеомиелитического очага - все местные признаки воспаления, формируется флегмона, а затем - дополнительные свищевые ходы. Состояние больного значительно улучшается в случае своевременного вскрытия и дренирования флегмоны или при спонтанном прорыве гноя. Общие и местные клинические признаки воспаления стихают, и заболевание переходит в фазу ремиссии.
Лечение хронического остеомиелита включает несколько направлений, ведущим из которых является выполнение одного из вариантов хирургического вмешательства.
В арсенале консервативных методов лечения хронического остеомиелита как в пред-, так и в послеоперационном периоде должны найти место мероприятия адекватной коррекции гомеостаза, повышение иммунологической и неспецифической реактивности организма, активное использование инфузионно-трансфузионной терапии, медикаментозного воздействия.
Особое место занимают физические методы местного лечения: электростимуляция, диадинамические токи, фонофорез, лазеротерапия, гипербарическая оксигенация, лечебная физкультура. Этап реабилитации должен включать лечебные факторы санаторно-курортного лечения.
Особую группу составляют пациенты, у которых в течение шести месяцев не удалось достигнуть положительного эффекта от оперативного и консервативного лечения. Им для избежания необратимого поражения внутренних органов необходимо своевременно выполнять ампутацию пораженного остеомиелитом сегмента конечности с последующим переводом больного на инвалидность.
Первично-хронические остеомиелиты или атипичные формы остеомиелита с самого начала протекают подостро и диагностируются обычно в хронической стадии. К этой группе относят склерозирующий остеомиелит Гарре, абсцесс Броди, альбуминозный остеомиелит Оллье.
При склерозирующем остеомиелите Гарре поражается диафиз длинной трубчатой кости, чаще большеберцовой или бедренной. Процесс характеризуется незначительным объемом деструктивных изменений на фоне прогрессирующего склероза и бурной пролиферации костной ткани. Склерозирующая форма встречается достаточно редко, в основном у мужчин в возрасте 20-30 лет. Заболевание считают следствием малой вирулентности патогенного микроба, а также измененной реактивности организма. Процесс может доходить до гнойного воспаления, но никогда не заканчивается омертвением кости. Анатомически превалирует резкий склероз кости, ее утолщение и уплотнение с облитерацией костномозгового канала. Клинически отмечается отсутствие выраженных острых явлений. В мягких тканях образуется плотная припухлость без ясных признаков воспаления. Однако размягчение инфильтрата и образование свищей не наступает. Единственный симптом, побуждающий заболевших обратиться к врачу, - боли, резко усиливающиеся по ночам, что, в свою очередь, служит основанием подозревать остеогенную саркому, сифилис, неврит, радикулит. Рентгенологическое исследование проясняет диагноз: на снимках обнаруживается веретенообразное утолщение диафиза в виде плотного бесструктурного гомогенного нагноения, охватывающего пораженную кость в виде симметричной муфты протяженностью 8-12 см.
Абсцесс Броди - одна из форм вялотекущего хронического остеомиелита. Встречается преимущественно у молодых людей мужского пола. Он локализуется в метаэпифизарной части трубчатых, гораздо реже в плоских костях в виде одиночного фокуса округлой формы. Возникновение полости происходит по общим законам развития остеомиелита: вначале наблюдается ограниченный некроз губчатого вещества, затем наступает расплавление кости. Содержимое абсцесса чаще всего гнойное, лишь иногда полость выполнена одними грануляциями. Толщина стенки абсцесса зависит от длительности патологического процесса и составляет от нескольких миллиметров до 2-3 см. Внутренняя поверхность полости выстлана пиогенной оболочкой. Клиническая симптоматика ограничивается перемежающимися болями, которые пациент связывает с переменой погоды, физическим перенапряжением и обычно испытывает к исходу дня или ночью. В более редком варианте на первый план выступают боли в ближайшем суставе, сопровождающиеся экссудативным воспалением и водянкой. Заболевание тянется несколько лет, прежде чем на рентгенограмме обнаруживают поражение кости.
Альбуминозный остеомиелит Оллье возникает в тех случаях, когда серозный экссудат, богатый белком, не принимает гнойного характера, и процесс как бы застывает на стадии серозного воспаления. Причину этого явления следует искать не только в слабой вирулентности микроба (пневмококк, маловирулентный стрептококк, стафилококк), но и в особенностях реактивного фона организма больного. Процесс, как правило, локализуется в наружных отделах кости и лишь изредка сопровождается образованием мелких корковых секвестров. Протекающие в последующем репаративные процессы аналогичны тем, которые наблюдаются при обычных формах остеомиелита и проявляются в форме утолщения кости.
Хирургическая тактика
Плановая госпитализация в хирургическое отделение с последующим выполнением некрсеквестрэктомии.
Сроки нетрудоспособности: 13-16 недель.
Реабилитация
Трехнедельный курс санаторно-курортного лечения в санаториях для лечения патологии опорно-двигательного аппарата.
3.3. ГИДРАДЕНИТ
Гидраденит представляет собой гнойное воспаление апокриновых потовых желез, которое чаще всего вызывается золотистым или гемолитическим стафилококком. Возбудители проникают вглубь через протоки железы либо через небольшие повреждения кожи. У детей, стариков гидраденит не наблюдается, так как апокриновые железы бывают развиты только в период половой зрелости.
КЛИНИЧЕСКАЯ КАРТИНА
К возникновению заболевания предрасполагают гипергидроз, опрелость, дерматиты, экзема и просто ссадины в подмышечной ямке, полученные, например, во время бритья. Помимо причин, создающих условия для проникновения возбудителя в протоки желез, имеют значение эндокринные нарушения, в особенности сахарный диабет. Наиболее частая локализация гидраденита - подмышечные впадины; гораздо реже он встречается в генитальной, перианальной областях, а также в окружности пупка, у женщин в зоне сосков (места естественного распространения апокриновых желез).
Гидраденит начинается с появления плотного болезненного узелка диаметром 0,5-1 см в верхних слоях подкожно-жировой клетчатки. Вначале он покрыт неизмененной кожей; затем его поверхность становится неровной багрово-красной. Узел быстро увеличивается и выступает над поверхностью кожи в виде полушаровидного образования. С расплавлением инфильтрата появляется флюктуация; вскоре через образующееся небольшое отверстие начинает выделяться сливкообразный гной. Заживление в неосложненных случаях завершается через 10-15 дней образованием рубца.
Иногда в гнойно-воспалительный процесс вовлекаются сразу несколько потовых желез, и тогда развивается обширный плотный болезненный инфильтрат с бугристой неровной поверхностью.
Острое начало гидраденита часто сопровождается головной болью, подъемом температуры и характерными сдвигами в морфологическом составе периферической крови, увеличением СОЭ.
Процесс нередко приобретает подострый характер, рецидивирующее течение. К возможным осложнениям гидраденита следует отнести лимфангоит и лимфаденит, флегмону, сепсис.
Главное отличие гидраденита от лимфаденита подмышечных областей состоит в поверхностном расположении инфильтрата и более остром течении. От фурункула он отличается локализацией (подмышечная область) и отсутствием первичной фолликулярной пустулы, некротического стержня, а также полушаровидной формой припухлости.
При дифференциальной диагностике необходимо помнить о туберкулезе, лимфогранулематозе и лимфосаркоме подмышечных желез.
ЛЕЧЕНИЕ
Хирургическая тактика: лечение на стадии инфильтративного воспаления проводится в амбулаторных условиях и включает местное применение сухого тепла, УВЧ, назначение антибиотиков, активных прежде всего по отношению к стафилококкам, например полусинтетические пенициллины. При этом достаточно эффективны оксациллин, амоксициллин/клавуланат или цефалоспорины I поколения (цефалексин, цефазолин).
При абсцедировании, т.е. развитии гнойника, показано хирургическое лечение в условиях специализированного отделения - вскрытие и удаление гнойно-некротического содержимого, повторное промывание антисептиками, дренирование и последующее местное лечение с применением протеолитических ферментов, антибиотиков.
Первый эмпирический курс антибиотикотерапии проводят с использованием тех же препаратов, что и в стадии инфильтративного воспаления.
Второй и последующие курсы антибиотикотерапии должны проводиться с учетом чувствительности выделенной микрофлоры. При идентификации стафилококков, синегнойной или кишечной палочки на фоне тяжелого течения заболевания эффективна иммунотерапия соответствующей гипериммунной плазмой или гамма-глобулином. Для предупреждения инфицирования близлежащих потовых желез применяется обработка окружающей кожи этиловым или 2% борным, 10% камфорным спиртом. Проводят сеансы ультрафиолетового облучения. Перевязку завершают наложением наклейки (не повязки), чтобы не допустить «втирания» инфицированных выделений.
При рецидивирующих формах показана специфическая иммунотерапия (стафилококковый анатоксин, вакцина, аутовакцина), витамины и другие общеукрепляющие средства. Свищевые (хронические и рецидивирующие) формы гидраденита нередко требуют радикального иссечения в пределах здоровых тканей.
Сроки нетрудоспособности: 2-4 недели.
Реабилитация
Курс физиолечения, направленный на стимуляцию репаративных процессов: ультрафиолетовое облучение (УФО), ультравысокочастотное (УВЧ) облучение.
3.4. ЛИМФАДЕНИТ
Лимфаденит - воспаление лимфатического узла. Является следствием гнойных процессов кожи и подкожной клетчатки или травматических повреждений (поверхностные ожоги, инфицированные кожные раны). Возбудители заболевания - аэробы (стафилококки, стрептококки и др.) нередко в ассоциации с анаэробными неклостридиальными микробами (бактероиды, пептострептококки, фузобактерии).
В начальной стадии острого лимфаденита появляется отек и мелкоочаговая клеточная инфильтрация тканей лимфатического узла, расширение его сосудов, промежуточных и краевых синусов. При прогрессировании заболевания усиливается лейкоцитарная инфильтрация, увеличивается зона некроза в лимфоид-
но-ретикулярной ткани, что трансформируется в гнойник - острый гнойный лимфаденит. Когда гнойно-воспалительный процесс захватывает капсулу, а затем соседние ткани, в основном в жировую клетчатку, возникает аденофлегмона.
КЛАССИФИКАЦИЯ
Клинически различают серозный и гнойный лимфаденит.
При серозном лимфадените отмечается умеренное увеличение региональных лимфатических узлов в зоне расположения первичного гнойного очага. Они хорошо пальпируются, умеренно болезненные, плотные. При купировании воспаления болезненность исчезает, размеры узла уменьшаются, он становится более мягкой консистенции.
Гнойный лимфаденит характеризуется выраженными местными и общими симптомами.
КЛИНИЧЕСКАЯ КАРТИНА
Общее состояние ухудшается на фоне появления признаков токсико-резорбтивной лихорадки: ухудшается самочувствие, появляются слабость, озноб, повышается температура тела до 38 °С, тахикардия.
Местно обычно в паховой или подмышечной области определяется отечность, гиперемия кожи, при пальпации - овальной формы болезненный, малоподвижный инфильтрат, нередко спаянный с кожей. У части больных в течение 1,5-2 недель в этой зоне появляется флюктуация, свидетельствующая об абсцедировании.
При переходе гнойного воспаления в окружающую клетчатку возникает обширное расплавление лимфатических узлов и подкожной клетчатки - аденофлегмона с переходом на клетчатку, чаще подмышечной, паховой и подколенной областей.
ЛЕЧЕНИЕ
Хирургическая тактика при остром серозном лимфадените - консервативное лечение в амбулаторных условиях. Оно включает физиотерапевтические процедуры (магнитотерапию, УВЧ и др.), новокаиновую блокаду окружающих лимфоузел тканей с добавлением ферментов и антибиотиков.
Операцию при гнойном лимфадените проводят в специализированном отделении, она включает вскрытие гнойного очага, удаление некротических тканей, его санацию и дренирование. При выраженной токсико-резорбтивной лихорадке назначают лечебные мероприятия общего воздействия: антибиотики широкого спектра действия на аэробную и анаэробную микрофлору, дезинтоксикационную терапию, симптоматические средства.
Прогноз
При лимфадените обычно благоприятный. Сроки нетрудоспособности: 1-2 недели.
Реабилитация
Физиолечение, лазеротерапия, магнитотерапия.
3.5. МАСТИТ
Мастит - воспалительный процесс ткани молочной железы (ее паренхимы и интерстиция). Он встречается среди родильниц в 0,5% клинических наблюдений, после выписки из родильного дома - в 5-6%.
Среди острых маститов преобладают лактационные (послеродовые) - 85%, маститы некормящих 10-15%, беременных - до 1% (Епифанов М.В., Цыбуляк Г.Н.,
1993).
ЭТИОЛОГИЯ
Возбудителями заболевания являются стафилококки, стрептококки, а у трети заболевших смешанная микрофлора.
Реже возникают «специфические» формы мастита: гонорейные, пневмококковые, туберкулезные, сифилитические.
Ведущую роль основного источника инфицирования играет нозокомиальная (внутрибольничная) инфекция: носители патогенной микрофлоры среди медицинского персонала, инфицирование из ротовой полости ребенка, с кожи и сосков матери.
К предрасполагающим факторам мастита относятся трещины сосков, застой молока, нарушение личной гигиены, неправильный уход, гнойные заболевания кожи молочной железы.
КЛАССИФИКАЦИЯ
По клиническому течению выделяют острые и хронические маститы, а также серозную и гнойную стадию течения заболевания. В клиническом течении гнойной стадии выделяют флегмонозный, абсцедирующий и гангренозный мастит.
Хронические маститы разделяют на гнойные (как результат неадекватного лечения острого воспаления) и негнойные формы (плазмоклеточный перидуктальный процесс).
По месту воспалительного процесса выделяют воспаление млечных протоков (лактофорит); поверхностные (субареолярные, премаммарные) маститы; ретро- и интрамаммарные маститы, тотальное поражение.
КЛИНИЧЕСКАЯ КАРТИНА
Особенностью гнойно-воспалительного процесса в молочной железе, как и в других железистых органах, является быстрое его распространение на фоне слабой способности к отграничению. Вследствие лактации междольковые перегородки легко подвергаются лизису, инфекция распространяется за пределы молочной железы, формируя ретромаммарные или подкожные флегмоны.
Для плазмоклеточного перидуктального мастита характерны патологические инфильтраты вокруг молочных протоков.
При множественном внутрисосудистом тромбозе развивается гангренозная форма мастита.
При хроническом мастите образуются мелкие абсцессы с уплотнением окружающих тканей.
Серозный острый мастит возникает внезапно, температура достигает 39-40°С.
Железа напряжена, увеличена в размерах, кожа гиперемирована. Интенсивные боли в очаге воспаления, при пальпации - болезненный инфильтрат с нечеткими границами. Нередко возникают регионарный лимфаденит, лимфангоит. При активном консервативном лечении эти симптомы через 3-4 дня стихают, но пастозность железы, болезненность и субфебрильная температура могут сохраняться 10-14 дней. Уплотнение постепенно купируется, но лактационная функция железы прекращается.
При переходе воспаления в гнойно-некротическую стадию боли в железе усиливаются, приобретают постоянный характер, нарастают симптомы интоксикации (головная боль, ознобы, общая слабость, потеря аппетита, нарушение сна). Лихорадка носит гектический характер, сопровождается одышкой, тахикардией, изменениями ЭКГ. В анализах крови находят лейкоцитоз, увеличение СОЭ, снижение уровня гемоглобина и числа эритроцитов.
При абсцедирующем мастите пальпаторно обнаруживают резкую болезненность в зоне инфильтрата с размягчением или флюктуацией в центре. Для ретромаммарного абсцесса характерно увеличение всей железы, которая приподнимается спереди и приобретает полушаровидную форму, а над верхним краем железы определяется флюктуирующий инфильтрат.
Флегмонозная форма мастита характеризуется тяжелым состоянием больной, лихорадкой. Молочная железа значительно увеличена, болезненна, пастозна. Сосок обычно втянут. Инфильтрат без резких границ занимает почти всю железу. Кожа над инфильтратом гиперемирована, имеет синюшный оттенок.
Признаками гангренозного мастита являются багрово-красная или синеваточерная окраска кожи, пастозность и выраженный отек тканей, появление эпидермальных пузырей с мутной или геморрагической жидкостью.
ДИАГНОСТИКА
Дифференциальную диагностику необходимо проводить с туберкулезом, сифилисом и злокачественным поражением железы.
При туберкулезе в железе обнаруживают один или несколько плотных узлов, которые впоследствии размягчаются в связи с творожистым распадом тканей и вскрываются. При этом образуются свищи, длительно не заживающие. Диагноз уточняют выявлением в подмышечной области увеличенных сращенных с кожей мягких лимфатических узлов и гистологическим исследованием стенки свища.
Клинические проявления сифилиса возникают в III стадии заболевания в форме хронического абсцесса. Диагноз могут подтвердить анатомические данные и серологические исследования.
Злокачественное поражение молочной железы внешне бывает схожим с хроническим абсцессом, когда распад опухоли сопровождается гнойно-некротическим воспалением. Уточнению диагноза способствуют пунктуально собранный анамнез, результаты пункционной биопсии и послеоперационное гистологическое исследование удаленных тканей.
ЛЕЧЕНИЕ
Хирургическая тактика при серозном остром мастите заключается в консервативном лечении в амбулаторных условиях: местно - сухое тепло, УФО в эритемных дозах, УВЧ; наложение подвешивающей, но не сдавливающей молочную
железу повязки, оставляющей открытым сосок для периодического опорожнения: отсасывания молока, кормления ребенка.
Сцеживание не рекомендуется производить руками, ибо эти грубые манипуляции часто приводят к быстрому прогрессированию воспаления.
Назначают антибиотики, действующие на грамположительную микрофлору (пенициллин, ампициллин). При малой чувствительности форы к пенициллину применяют эритромицин. В случае назначения антибиотиков или сульфаниламидов кормление грудью прекращают. Достаточно эффективна ретромаммарная новокаиновая блокада по В.К. Гостищеву: 200 мл 0,25% раствора прокаина (новокаина), 0,5 г канамицина, 10 мг трипсина. При правильном проведении этой блокады происходит приподнимание молочной железы.
Если сцеживание молока невозможно или малоэффективно, назначают препараты, подавляющие лактацию, например бромкриптин 0,005 г 2 раза в день в течение 4-5 дней. С этой же целью применяют солевые слабительные, ножные ванны, ограничивают прием жидкости.
При переходе заболевания в гнойно-некротическую стадию показана экстренная госпитализация в хирургическое отделение и неотложная операция под общим обезболиванием. Иногда возможно вскрытие гнойника под местной анестезией.
Вскрытие ретромаммарных абсцессов выполняют только под наркозом.
При подкожной локализации гнойника проводят внутрикожную инфильтрационную анестезию 0,5% раствором прокаина (новокаина).
При интрамаммарных абсцессах кожу по линии разреза инфильтруют 0,5% раствором прокаина (новокаина) с одновременным выполнением ретромаммарной новокаиновой блокады.
Разрезы при поверхностных и интрамаммарных маститах делают в радиальном направлении вдоль хода выводных протоков (рис. 3-1), не затрагивая околососковый ореол и не доходя до соска 2-3 см.
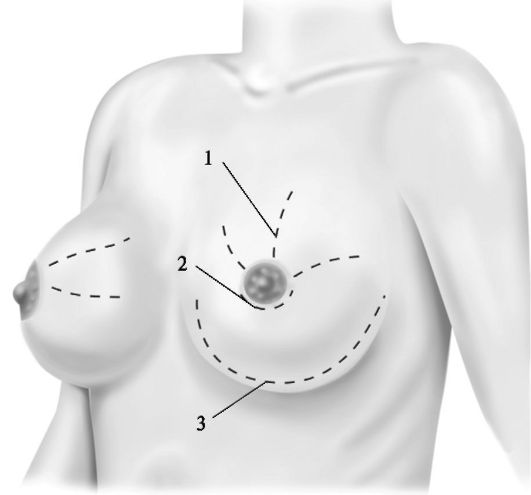 Рис. 3-1. Разрезы, применяемые при гнойном мастите. 1 - радиальные разрезы; 2 - разрез по Барденгейеру; 3 - параареолярный разрез
Рис. 3-1. Разрезы, применяемые при гнойном мастите. 1 - радиальные разрезы; 2 - разрез по Барденгейеру; 3 - параареолярный разрез
При множественных абсцессах выполняют несколько разрезов. После удаления гноя полость ревизуют, разъединяя пальцем перемычки и тяжи, опорожняя дополнительные карманы и бухты.
При ретромаммарных и глубоких интрамаммарных гнойниках производят дугообразный разрез по переходной складке под молочной железой. Затем проникают в ретромаммарную область, отслаивая молочную железу от большой грудной мышцы. Целесообразно дополнительно обработать гнойную рану ультразвуком, вакуумированием, пульсирующей струей антисептика. В последующем рану ведут открытым способом до полного ее очищения, а затем применяют отсроченный первичный или вторичные швы. Иногда после обширных некрэктомий выполняют аутодермопластику. Представлены разрезы, применяемые при гнойном мастите (см. рис. 3-1).
В тяжелых случаях флегмонозного или гангренозного воспаления показана мастэктомия, ибо обычная операция вскрытия и дренирования не приведет к выздоровлению. Она проводится после определенной предоперационной подготовки с введением сердечных препаратов, антибиотиков, восполнением объема циркулирующей крови (ОЦК), коррекцией электролитных нарушений.
Лечение хронических форм мастита консервативными методами обычно безуспешно. Выполняют радикальное иссечение гнойно-воспалительного очага с обязательным гистологическим исследованием. В послеоперационном периоде эффективны магнитотерапия и лазеротерапия.
Сроки нетрудоспособности зависят от формы и распространенности процесса и колеблются от 2 до 8 недель.
Реабилитация
Заключается в постоянном опорожнении молочной железы у родильницы во время кормления, сцеживании молока при искусственном кормлении новорожденного или остатка молока после кормления ребенка. Немаловажное значение имеет постоянный туалет молочной железы и соска после кормления. Возникающие трещины соска необходимо своевременно лечить с соблюдением всех требований асептики.
3.6. ПАНАРИЦИЙ
Панариций, по существу, объединяет группу заболеваний острого или хронического воспаления анатомических структур пальца.
Анатомо-функциональные особенности пальцев определяют специфику возникающих в них воспалительных процессов: сосредоточение на малой площади значительного количества функционально важных образований (сухожилий и их влагалища, суставов, высокочувствительных нервных окончаний); отсутствие на ладонной поверхности подкожной фасции и наличие многочисленных ячеек с заключенной в них клетчаткой, образованных тяжами из соединительной ткани, проходящих во взаимно перпендикулярных направлениях.
Такой принцип строения ограничивает подвижность кожи и способствует, во-первых, быстрому распространению воспалительного процесса вглубь, а во-
вторых, нарушению кровоснабжения и некрозу тканей из-за скапливающегося экссудата, из-за которого возрастает внутритканевое давление, что обусловливает очень сильную боль.
КЛАССИФИКАЦИЯ
Классификация панариция, в полной мере отвечающая требованиям практической хирургии, приведена ниже (М.И. Лыткин, И.Д. Косачев, 1975).
1. Поверхностный панариций:
• кожный;
• лимфатический;
• эризипелоид.
2. Ногтевой панариций:
• паронихия (околоногтевой);
• подногтевой.
3. Подкожный панариций:
• концевой фаланги;
• средней и основной фаланги.
4. Сухожильный панариций:
• ограниченные формы;
• распространенные формы.
5. Костный панариций:
• острый костный панариций;
• хронический костный панариций.
6. Гнойное поражение суставов пальца:
• суставной панариций;
• костно-суставной панариций.
7. Пандактилит:
• в форме сухого некроза;
• в форме влажного некроза;
• смешанная форма.
Основные виды панарициев представлены на (рис. 3-2).
К редким разновидностям заболевания относится лимфатический панариций, когда тяжелый воспалительный процесс, вызванный гемолитическим стрептококком, распространяется по лимфатическим сосудам и окружающим тканям.
Другую разновидность панариция - эризипелоид, вызывает палочка свиной рожи. Он наблюдается у лиц, связанных с обработкой мясной и рыбной продукции. В таких случаях воспаление характеризуется изменением серозного экссудата с имбибицией всех слоев кожи и проявляется болезненной припухлостью красного цвета с наличием границы, а в более поздние сроки беспокоит выраженный зуд.
КЛИНИЧЕСКАЯ КАРТИНА
По статистике, панарицием чаще всего поражаются ногтевые фаланги I, II, III пальцев правой руки, подверженные травматизации и загрязнению.
Наиболее распространеннымом видом возбудителей является белый или золотистый гемолитический стафилококк в монокультуре либо в ассоциации с другими микробами; гораздо реже - выделяют стрептококк, кишечную палочку, протей и еще реже представителей гнилостной и грибковой микрофлоры.
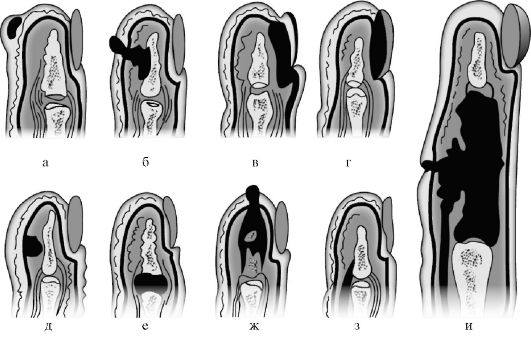 Рис. 3-2. Виды панарициев.
Рис. 3-2. Виды панарициев.
а - кожный; б - паронихия; в - подногтевой; г - подкожный; д - сухожильный; е - костный; ж - суставной; з - костно-суставной; и - пандактилит
Возникновению панариция способствует длительное воздействие на кожу рук холода, влаги, а также раздражающих и загрязняющих веществ, вибрации, т.е. факторов, нарушающих гемомикроциркуляцию и трофику тканей, а следовательно, защитную функцию кожного покрова. Отрицательное значение имеют общие факторы, понижающие реактивность организма: истощение, нарушение обмена веществ, дисфункция эндокринных органов и т.п.
Болевые ощущения в пораженной фаланге, пальце сопутствуют всем видам панариция; по их интенсивности судят о стадии заболевания, что имеет существенное значение для определения лечебной тактики.
Для стадии серозного воспаления, при которой проводится консервативное лечение, характерны умеренная боль, чувство жжения и распирания. Переход в гнойно-некротическую стадию сопровождается появлением нестерпимой боли, лишающей больного сна. Так как опускание руки вниз усиливает боль вследствие повышения внутритканевого давления, заболевшие предпочитают удерживать конечность в возвышенном положении. Усиление болевых ощущений свидетельствует о распространении и нарастании воспалительного процесса. Их стихание обычно происходит при спонтанном или оперативном вскрытии гнойного очага. Место наибольшей болезненности, определенное максимально точно с помощью пуговчатого зонда, в большинстве случаев соответствует центру гнойно-воспалительного очага.
Критериями гнойно-некротической стадии являются следующие признаки:
• длительность заболевания, превышающая 2-3 суток;
• ограничение воспалительной припухлости тканей на пальце; появление в центре воспалительного очага зоны побледнения; расширение вен на тыле
пораженного пальца и нарушение его функции; развитие регионарных лимфангоита и лимфаденита; повышение температуры тела;
• лейкоцитоз с нейтрофильным сдвигом в анализах крови;
• понижение дифференцированности мягких тканей в зоне очага на рентгенограммах.
ЛЕЧЕНИЕ
Среди дополнительных методов определения стадий панариция заслуживают внимания диафаноскопия - обнаружение очага затемнения на фоне окружающего равномерно розового цвета просвечиваемых тканей, хлорэтиловое орошение - более стойкое сохранение ледяной корочки или побледнения кожи непосредственно над очагом некротической деструкции тканей. Констатация гнойно-некротической стадии служит абсолютным показанием к хирургическому лечению панариция.
Лечебная тактика на стадии серозно-инфильтративного воспаления заключается в комплексе консервативных мер в амбулаторных условиях. Тепловые процедуры проводят в виде УВЧ, дополняя их ультрафиолетовым облучением, горячие ванны с раствором марганцовокислого калия или насыщенным раствором хлорида натрия. Не допускается наложение согревающих компрессов, тем более с мазями на жировой основе. Применяют полуспиртовые повязки либо повязки с антисептиками или антибиотиками с добавлением препаратов, проникающих через кожный барьер, например диметилсульфоксида.
Более патогенетически оправданной следует считать местную гипотермию в виде повторных хлорэтиловых орошений с последующим наложением повязки с хлорэтилом. Эффективен электрофорез с трипсином и антибиотиками. После завершения любой процедуры из комплекса консервативной терапии на стадии серозно-инфильтративного воспаления обязательно наложение гипсовой лонгеты по ладонной поверхности пальца и кисти до средней трети предплечья.
В наибольшей степени обратному развитию воспаления способствует внутривенное регионарное введение антибиотиков. В первую очередь применяются препараты, эффективные против стафилококков. Успех метода обеспечивается тем, что при внутривенном введении в выключенный из кровообращения участок конечности с экспозицией 20-30 мин достигается депонирование антибиотика в тканях за счет связывания его белками и создается концентрация, во много раз превосходящая минимальную ингибирующую даже для резистентных штаммов. В связи с этим достаточно введения антибиотиков один раз в сутки. Раствор антибиотика вводят в вену под жгутом, наложенным на нижнюю треть плеча. Еще лучше пользоваться двумя манжетами от тонометра (рис. 3-3) по следующей методике. Первую манжету накладывают на нижней трети плеча; после измерения артериального давления ее оставляют на месте. Вторую манжету помещают на нижней трети предплечья; поднимают давление в проксимальной манжете до уровня, превышающего диастолическое на 10-15 мм рт.ст. (контурируются вены). Вводят иглу в вену и присоединяют к ней резиновый переходник для облегчения смены шприцев, введения растворов. Перед вливанием антибиотика давление в проксимальной манжете поднимают на 30-40 мм рт.ст. для выключения из кровообращения дистального отдела конечности. После инфузии появляется мраморное окрашивание кожи выключенного сегмента, свидетельствующее, по-видимому, о ретроградном проникновении антибиотика в кожные сосуды.
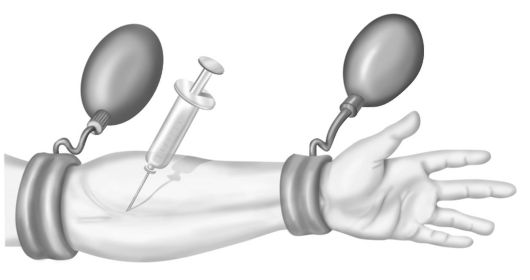 Рис. 3-3. Принцип регионарной внутривенной инфузии антибиотиков под двумя манжетами
Рис. 3-3. Принцип регионарной внутривенной инфузии антибиотиков под двумя манжетами
Сразу после окончания вливания давление в дистальной манжете на предплечье поднимают до того же уровня, что и в проксимальной - на плече, затем давление сбрасывают. Таким способом удается выключить из кровообращения минимальный участок конечности, что уменьшает болевую реакцию и сохраняет венозный сосуд для последующих инъекций.
На первой стадии воспаления больные относительно редко обращаются за врачебной помощью и чаще приходят на прием с развившимся гнойно-некротическим процессом, когда центральным пунктом лечебной программы является неотложная операция.
Ее главная цель - вскрыть и дренировать гнойный очаг. Это довольно тонкая операция, и в наборе инструментов следует предусмотреть глазные скальпели, пинцеты, крючки, ножницы; а кроме того, ложечки Фолькмана, пуговчатый зонд и прочее.
Оперативный доступ следует планировать с учетом самого короткого пути для дренирования, функциональных особенностей пораженной зоны, последствий производимых разрезов.
На пути к очагу недопустимо вскрывать интактное сухожильное влагалище.
Разрезы, производимые непосредственно на ладонной поверхности пальцев рук, впоследствии ограничивают их функцию в связи с образованием грубого чувствительного рубца. Калечащих функциональных последствий следует ожидать от переднебоковых разрезов, проходящих через межфаланговые сухожилия, а также от боковых разрезов вдоль всего пальца. Оптимальными и наиболее щадящими признаны среднебоковые разрезы по так называемой нейтральной линии пальца. Этот доступ позволяет без особых затруднений ревизовать любую структуру пальца, практически безопасен с точки зрения случайного повреждения нервов и сосудов пальца. Среднебоковые разрезы следует применять и при панариции ногтевой фаланги; клюшкообразный разрез оправдан только в случаях некроза кожи кончика пальца либо образования после его отторжения гнойного свища той же локализации. Операции вскрытия панариция может предшествовать 15-минутная глубокая теплая ванна с дезинфицирующим раствором.
Больного укладывают горизонтально, руку на подставке отводят под углом 90°. Подготовка операционного поля включает обработку всей кисти и предплечья, после чего их обкладывают стерильным бельем. В операции должен участвовать ассистент, чтобы обеспечить полноценную ревизию, вскрытие и дренирование глубоких очагов. Все члены хирургической бригады, в том числе операционная сестра, готовятся к вмешательству с полным соблюдением правил асептики.
Достаточное обезболивание при панарициях ногтевой и средней фаланг в подавляющем большинстве случаев достигается с помощью проводниковой анестезии по Оберсту-Лукашевичу. Через тонкую иглу по бокам у основания пальца вводят 1-2% раствор новокаина (тримекаина, лидокаина). Иглу постепенно продвигают на направлению к ладонной поверхности пальца; после окончания инъекции накладывают стерильный жгут из ниппельной резины, выжидают 4-5 мин для полного проявления действия анестетика.
Операции по поводу панариция проксимальной фаланги, суставного, сухожильного и костного панариция целесообразно проводить под проводниковой анестезией по Брауну-Усольцевой. Раствор анестетика вводится в межпальцевые промежутки с тыльной стороны кисти по линии, соединяющей I пястно-фаланговый сустав с серединой V пястной кости, либо под внутривенной регионарной анестезией, сочетая ее с одновременным введением антибиотика по описанной выше методике.
При тяжелых формах панариция, особенно при повторных вмешательствах, анестезию целесообразно выполнить до обработки операционного поля, которая в подобных случаях является весьма болезненной.
При вскрытии гнойно-некротического очага экссудат удаляют марлевыми шариками, а некротические ткани - ножницами и ложечкой Фолькмана; образующуюся полость промывают раствором антисептика. Особенно бережно следует относиться к надкостнице - источнику регенерации костной ткани. Осторожности требует и секвестрэктомия в зоне сухожильного влагалища, повреждение которого вызывает тяжелый тендовагинит.
При пандактилите операция помимо ликвидации гнойно-воспалительного очага имеет цель сохранения функции кисти, для ее методичного проведения бывает необходима общая анестезия. При поражении кости удаляют свободно лежащие секвестры, санируют очаг деструкции.
Сложилось отрицательное отношение к первичным ампутациям, экзартикуляциям пораженных сегментов, целого пальца.
Очень важный этап, завершающий операцию, - методически правильное дренирование. Малые размеры гнойно-некротического очага, сравнимая с операцией травматичность постановки дренажей-трубочек делают наиболее оправданным пассивное дренирование раны после вскрытия и санации панариция. Использовать марлевые турунды не следует. Дренирование достигается введением резиновых полосок, эффективность его значительно возрастает при использовании мазей на гидрофильной основе. Только отсутствие таких мазей может оправдать применение растворов антисептиков и тем более гипертонического раствора хлорида натрия.
Активное дренирование раны следует считать методом выбора в послеоперационном лечении тяжелых форм панариция (суставного, сухожильного, пандактилита). Оно обеспечивает удаление оставшихся некротизированных тканей и экссудата, позволяет осуществлять длительный антибактериальный лаваж раны и
энзимотерапию. Важно соблюдать следующие технические детали: диаметр трубки из силиконированной резины или эластичной пластмассы должен составлять 3-5 мм; желательно выведение дренажа через отдельные разрезы, 2-4 боковых отверстия не должны доходить до краев раны на 2-4 мм. После стихания процесса острого воспаления, когда необходимость активного дренирования отпадает, трубку удаляют; дальнейшее заживление раны происходит под повязкой. На рис. 3-3 показан принцип регионарной внутривенной инфузии антибиотиков под двумя манжетами.
На рис. 3-4 представлены рациональные разрезы для дренирования при гнойных процессах пальцев.
На рис. 3-5 представлена ладонная гипсовая лонгета для иммобилизации одного пальца.
На рис. 3-6 представлено функциональное положение кисти при иммобилизации.
Сроки нетрудоспособности колеблются от 1 до4 недель в зависимости от формы панариция.
Реабилитация
Заключается в переводе на облегченный труд на 3-4 месяца, ЛФК, грязелечение.
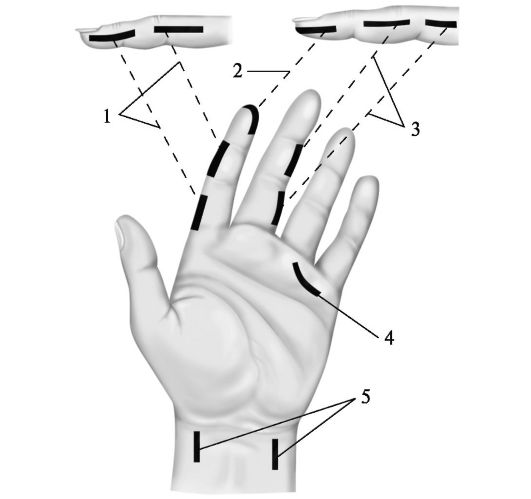 Рис. 3-4. Рациональные разрезы для дренирования при гнойных процессах пальцев. 1 - при суставном и костно-суставном панариции; 2 - разрез типа клюшки; 3 - при локализации процесса на средней и основной фалангах; 4 - на ладони при сухожильном панариции IV пальца; 5 - при сухожильном панариции I и V пальцев с распространением процесса на предплечье
Рис. 3-4. Рациональные разрезы для дренирования при гнойных процессах пальцев. 1 - при суставном и костно-суставном панариции; 2 - разрез типа клюшки; 3 - при локализации процесса на средней и основной фалангах; 4 - на ладони при сухожильном панариции IV пальца; 5 - при сухожильном панариции I и V пальцев с распространением процесса на предплечье
 Рис. 3-5. Ладонная гипсовая лонгета для иммобилизации одного пальца
Рис. 3-5. Ладонная гипсовая лонгета для иммобилизации одного пальца
 Рис. 3-6. Функциональное положение кисти при иммобилизации
Рис. 3-6. Функциональное положение кисти при иммобилизации
3.7. ФЛЕГМОНА МЯГКИХ ТКАНЕЙ
Флегмона - острое разлитое воспаление клетчаточного пространства. КЛАССИФИКАЦИЯ
В зависимости от локализации воспаления различаются флегмоны подкожные (эпифасциальные), межмышечные (субфасциальные) и флегмоны клетчаточных пространств, окружающих отдельные органы (паранефрит, парапроктит и др.) или анатомические образования (медиастинит).
По характеру воспалительного экссудата выделяют следующие виды флегмон: серозную, гнойную, геморрагическую, гнилостную; в случаях преобладания некротических процессов - некротическую флегмону. Особое место занимают анаэробные формы флегмон, в свою очередь разделяющиеся на клостридиальные и неклостридиальные типы.
ЭТИОЛОГИЯ
Этиологически флегмона может быть самостоятельным заболеванием, тогда ее называют первичной, или осложнением развившихся инфекционно-воспалительных хирургических заболеваний - панариция, карбункула, гнойного артрита, остеомиелита и других - вторичные флегмоны.
Наиболее частые возбудители, участвующие в развитии флегмон, относятся к гноеродной микрофлоре - стафилококки, стрептококки. Однако инфекционное воспаление вызывают и другие виды микробов, проникающие в клетчатку при повреждении кожи, слизистых оболочек либо гематогенным путем.
Флегмоны, развивающиеся вследствие проникновения инфекционного агента через повреждения слизистых оболочек, во многом обусловлены микрофлорой близлежащих полых органов. Так, например, из гнойных очагов, возникающих в околопрямокишечной клетчатке, постоянно высеваются ассоциации микроорганизмов, включающие грамотрицательные колиформные бактерии и анаэробы. При флегмонах шеи и средостения часто высеваются неклостридиальные анаэробы, для которых полость рта является местом их естественного обитания.
Флегмонозное, или разлитое, воспаление может развиваться при случайном, а иногда преднамеренном введении в клетчатку разнообразных лекарственных (хлорид кальция и др.) и химических (скипидар, бензин и др.) веществ.
При первичных флегмонах возбудители, как правило, проникают в подкожную клетчатку при повреждениях (микротравмах) кожи или слизистых оболочек.
В отличие от них глубокие флегмоны (межмышечные, субфасциальные) чаще являются следствием ранений, инъекций.
Воспаление клетчаточных пространств (околопочечной, околопрямокишечной, средостения и др.) чаще всего обусловлено нарушением целости слизистых оболочек соответствующих органов в результате травм либо воспалительно-дегенеративных, опухолевых заболеваний.
Воспалительный процесс в клетчатке отличается наклонностью к обширному поражению и отсутствием выраженной тенденции к отграничению. Это связано с относительно малым количеством кровеносных сосудов и соединительнотканных элементов в клетчатке, обусловливающим ее слабую сопротивляемость инфекции.
КЛИНИЧЕСКАЯ КАРТИНА
В процессе развития флегмон на первом этапе воспалительный экссудат распространяется в пределах фасциального футляра. Повышение внутритканевого давления приводит к сдавлению сосудов, ухудшению перфузии крови в клетчатке. Далее под воздействием бактериальных токсинов наступает тромбоз мелких кровеносных сосудов. В ишемизированных тканях микроорганизмы находят благоприятные условия для своего развития. Воспалительный процесс поражает все новые участки клетчатки. Экссудат, не встречая препятствий, быстро распространяется до границ фасциального футляра и по паравазальной клетчатке проникает за его пределы.
Ко 2-4-му дню заболевания экссудат приобретает гнойный, а иногда гнилостный характер, степень поражения тканей усугубляется. Наиболее часто происходит гнойное пропитывание клетчатки.
Абсцедирование флегмоны, т.е. скопление свободного гноя, как правило, наблюдается при гноеродной микрофлоре и нехарактерно для гнилостных, некротических и анаэробных форм флегмозного воспаления.
Микробные токсины, продукты гнойного расплавления тканей в большом количестве попадают в кровяное русло и обусловливают синдром эндогенной интоксикации.
Клиническая картина флегмоны вариабельна и зависит от локализации и характера воспалительного очага, вида микрофлоры и экссудата.
Кроме того, на выраженность клинических симптомов влияет стадия воспаления - серозно-инфильтративная или гнойно-некротическая.
В клинической картине флегмонозного воспаления принято различать местные симптомы воспаления и синдром эндогенной интоксикации.
Подкожные (эпифасциальные) флегмоны, вызванные возбудителями гноеродной инфекции, характеризуются типичными местными признаками воспаления. Заболевание сопровождается появлением боли, припухлости в зоне поражения. Гиперемия кожи над инфильтратом не имеет четких границ. Больной щадит пораженную часть тела, малейшие движения усиливают боль. При развитии флегмоны на конечности наступает сгибание в суставах. С первого же дня заболевания резко повышается температура тела. Нередко она достигает 40 °С и более, сопровождается ознобом. Лихорадка чаще приобретает постоянный характер. При исследовании крови обнаруживают нарастающий лейкоцитоз, нейтрофилез, увеличение СОЭ. В ближайшие 2-4 дня, если не предпринимать энергичного лечения, симптомы воспаления нарастают и достигают своего максимума.
С развитием гнойно-некротической стадии флегмонозного воспаления распространение местных признаков приостанавливается, степень выраженности претерпевает типичные изменения. Воспалительный инфильтрат, плотно-эластичный в начальной стадии, размягчается; нередко появляется флюктуация; очагов размягчения может быть несколько. Гиперемия кожи над очагами размягчения и флюктуации сменяется синюшной окраской, по периферии инфильтрата бледнеет. Боль приобретает постоянный характер, но ее выраженность может уменьшиться. Нередко выявляются сопутствующие флегмоне регионарный лимфаденит, лимфангоит и тромбофлебит.
Общие проявления инфекционно-воспалительного процесса продолжают нарастать, появляются суточные колебания температуры, превышающие 1,5 °С и сопровождающиеся ознобами; усиливаются одышка, тахикардия; нередко отмечается тенденция к артериальной гипотензии. В крови нарастает лейкоцитоз, обнаруживается выраженный сдвиг лейкоцитарной формулы влево, появляются палочкоядерные формы нейтрофилов, миелоциты и даже миелобласты.
Подкожные флегмоны, вызванные анаэробами, имеют несколько иную клиническую картину, редко встречается флюктуация инфильтрата; в крови часто обнаруживают лейкопению.
Межмышечные (субфасциальные) флегмоны обычно не сопровождаются классическим симптомокомплексом воспаления, потому что значительная удаленность воспалительного очага от покровов тела обусловливает отсутствие его кожных проявлений. Тем не менее отмечается диффузная отечность тканей, выявляемая по изменениям формы и рельефа пораженной области.
Клиническая картина флегмон, развивающихся в клетчаточных пространствах, складывается из общих проявлений гнойно-инфекционного процесса и признаков нарушений функций, близко расположенных органов, связанных с непосредственным сдавлением, смещением тканей скапливающимся экссудатом либо воспаленной инфильтрированной клетчаткой.
Для флегмон, развивающихся с участием клостридиальных анаэробов, патогномоничны багрово-синие, черные пятна на фоне гиперемированной кожи, крепитация мягких тканей при поверхностной пальпации, быстро прогрессирующий
отек пораженной области; общие проявления инфекции часто достигают картины септического шока.
Участие неспорообразующих анаэробов проявляется неярко выраженными местными симптомами воспаления. Небольшая инфильтрация носит диффузный характер («пастозность»), гиперемии кожи может не быть, а ведущий местный признак - интенсивная боль, которая не соответствует другим симптомам воспаления. Общее состояние тяжелое за счет интоксикации.
ДИАГНОСТИКА
Диагноз флегмон в случаях их поверхностной локализации не вызывает особых затруднений. Он, в первую очередь, основывается на оценке местных признаков воспаления.
Диагностика гнойно-некротической стадии воспаления в большинстве случаев основана на выявлении размягчения инфильтрата и флюктуации, которым сопутствуют изменения лейкоцитарной формулы крови. С учетом давности и динамики заболевания этих критериев обычно бывает достаточно для постановки правильного диагноза.
Клостридиальные флегмоны в силу специфичности клинических проявлений не должны представлять трудностей в дифференциальной диагностике.
Сложнее распознавание неклостридиальных анаэробных флегмон. Отсутствие типичных местных признаков воспаления нередко является причиной ошибочной диагностики тендовагинита, тромбофлебита, рожистого воспаления. Диагноз уточняют после исследования периферической крови (лейкоцитоз или лейкопения, нейтрофильный сдвиг лейкоцитарной формулы), анализа анамнестических сведений (например, рожа начинается с озноба, лихорадки с последующим присоединением гиперемии, отека кожи) и динамики заболевания.
Отсутствие благоприятного перелома в течение одних-двух суток делает более вероятным диагноз неклостридиального флегмонозного поражения, что является показанием к диагностическому разрезу и тщательной ревизии тканей. Типично для неклостридиальной анаэробной флегмоны скудное серозное отделяемое либо мутный экссудат с резким неприятным запахом, а также серый цвет клетчатки и фасций с очагами некроза. Диагноз подтверждают микроскопия мазка или посевы экссудата с применением строгой анаэробной техники.
Субфасциальные, межмышечные флегмоны следует дифференцировать с глубоким тромбофлебитом, гематогенным остеомиелитом, тромбозом артериальных сосудов.
От сосудистых поражений их отличает значительно большая болезненность при глубокой пальпации тканей в пределах фасциальных границ определенной мышечной группы; на проекции сосудистого пучка особой болезненности не отмечается, сохранена пульсация магистральных артерий. Помимо этого для артериального тромбоза, тромбофлебита нехарактерны высокая лихорадка и выраженные изменения картины крови.
Наибольшие трудности возникают при дифференцировании флегмоны с гематогенным остеомиелитом. Умеренный отек конечности, ограничение движений и болезненность при пальпации тканей встречаются при обоих видах заболевания; также не выявляется различия при исследованиях крови. Рентгенологические признаки поражения кости (остеомиелит) часто отсутствуют в первые 2-3 недели,
а болезненная нагрузка по оси конечности выявляется не всегда. В сомнительных случаях рекомендуется прибегать к диагностической пункции мягких тканей, пункции костномозгового канала, ультразвуковому исследованию с целью обнаружения скопления гноя. В качестве последнего диагностического приема допустим разрез для прямой ревизии тканей.
Диагностика первичных флегмон клетчаточных пространств представляет наибольшие трудности, в связи с чем она нередко требует сложных дополнительных исследований: ультразвукового, рентгенологического, эндоскопического и других.
Иногда к постановке правильного диагноза приходят методом исключения.
Вторичную флегмону следует заподозрить при отрицательной динамике основного заболевания. Для уточнения диагноза, как правило, требуется тщательная ревизия имеющихся гнойных полостей. Чаще всего это вторичная хирургическая обработка имеющихся ран, гнойных полостей, которая должна проводиться в условиях операционной.
Хирургическая тактика
Лечение больных с флегмонами осуществляется только в условиях стационара; амбулаторное лечение недопустимо. В стадии серозного воспаления показана консервативная терапия, основу которой составляет активное применение антибиотиков. Местно применяют сухое тепло, УВЧ. Обязательна иммобилизация пораженной конечности, области тела. Одновременно назначают болеутоляющие средства, а при явлениях интоксикации - кардиотропные средства, обильное питье, дезинтоксикационную терапию, эфферентные методы.
На стадии гнойно-некротического воспаления в неотложном порядке проводят оперативное вмешательство. Его выполняют под общей анестезией. Местное обезболивание допустимо в качестве исключения при хирургическом лечении ограниченных подкожных флегмон. Гнойную полость необходимо вскрывать анатомически обоснованным разрезом такой протяженности, которая обеспечила бы полную ревизию тканей в зоне инфекционного воспаления и проведение полноценной хирургической обработки раны.
Участки некротизированной, пропитанной гноем клетчатки и фасций подлежат иссечению, гнойные затеки - вскрытию и санации. При обширных флегмонах нередко требуется несколько параллельных разрезов.
После завершения некрэктомии дополнительно проводят санацию раны с применением ультразвука, вакуумирования, пульсирующей струи антисептика или просто с обильным промыванием антисептическим раствором.
На завершающем этапе операции осуществляют дренирование раны и накладывают повязку с протеолитическим ферментом или мазью на водорастворимой основе либо с сорбентом или раствором антисептика. После вскрытия флегмон, вызванных гноеродной микрофлорой, допускается проведение проточно-аспирационного дренирования с наложением первичных швов на операционную рану. При сложной конфигурации гнойной полости, нерадикальной хирургической обработке раны, а также при анаэробном характере микрофлоры наложение первичных швов категорически запрещается.
В послеоперационном периоде назначение антибиотиков, их выбор и сочетание прежде всего зависят от предполагаемого возбудителя или его точной идентификации; имеет значение и локализация флегмонозного воспаления.
При подозрении или при установленном участии неклостридиальных анаэробов в инфекционно-воспалительном процессе показаны препараты метронидазола (метрогил и др.) либо левомицетин или клиндамицин.
После получения результатов бактериологического исследования обычно проводят коррекцию антибиотикотерапии. При установлении стафилококковой, синегнойной или колибациллярной этиологии флегмоны больным проводят соответствующую иммунотерапию.
При выраженных явлениях общей интоксикации назначают инфузионную терапию и проводят детоксикацию организма с использованием форсированного диуреза, гемосорбции, плазмафереза; по показаниям переливают кровь, ее компоненты.
Первые перевязки после операции обычно требуют общей анестезии. По ходу перевязки необходимо тщательно осмотреть рану, дополнительно выявить и санировать все гнойные затеки, повторно обработать раневую поверхность ультразвуком, струей антисептика. После полного очищения раны накладывают вторичные швы, а при обширных поражениях проводят аутодермопластику.
Сроки нетрудоспособности вариабельны и зависят от распространенности патологического процесса, состояния внутренних органов, вирулентности инфекции, колеблются от 12 до 20 недель.
Реабилитация
Недельный курс санаторно-курортного лечения в санаториях для лечения патологии опорно-двигательного аппарата с последующим переводом на облегченный труд сроком до 3 месяцев.
3.8. ФУРУНКУЛ
Фурункул - острое гнойно-некротическое заболевание волосяного фолликула, окружающих тканей; относится к группе глубоких стафилодермий.
Возбудителем заболевания чаще является золотистый, реже белый стафилококк.
Вначале острое гнойное воспаление возникает в пределах волосяного мешочка, а далее процесс переходит на сальную железу и окружающую соединительную ткань.
Микроскопически обнаруживают некроз волосяного фолликула и окружающей соединительной ткани с центральным скоплением стафилококков; некротический очаг окружен валом из нейтрофилов, макрофагов. При множественном воспалении волосяных фолликулов говорят о фурункулезе, а при его затяжном рецидивирующем течении - о хроническом фурункулезе. Несколько фурункулов на ограниченном участке тела правильнее называть местным фурункулезом. Фурункулы могут возникать на любом участке тела, исключая кожу ладоней рук, подошв стоп.
К предрасполагающим факторам для возникновения фурункулов относятся несоблюдение санитарно-гигиенических норм, т.е. отсутствие личной гигиены, пренебрежение элементарными правилами санитарии на технических объектах,
высокая или, наоборот, чрезмерно низкая температура воздуха в помещениях, их высокая запыленность, отсутствие спецодежды и надлежащей защиты от микротравм, повышенное потоотделение, ослабление защитных сил организма в связи с неполноценным питанием, гиповитаминозом или сахарным диабетом.
Рецидивирующее течение может быть обусловлено сенсибилизацией по отношению к стафилококковой инфекции, иммунодефицитными состояниями, генетическими энзимопатиями и скрыто протекающими заболеваниями.
Созревающий фурункул вначале проявляется ощущением зуда и покалывания. Через 1-2 дня в толще кожи возникает воспалительный инфильтрат диаметром 2-3 см, конусообразно выступающий над поверхностью кожи, которая становится ярко-красной и болезненной.
На верхушке инфильтрата (устьев волосяного фолликула) проступает небольшое количество гноя (остиофолликулит) либо формируется черная точка (некроз). В дальнейшем такая пустула может подсохнуть с образованием корочки либо прорваться наружу с отхождением гноя. Обычные сроки развития гнойного расплавления в глубине инфильтрата составляют 3-5 суток, когда некротические массы отторгаются в виде стержня с гноем и остатками волоса, после чего рана очищается и выполняется грануляциями, инфильтрация, отек спадают, рана заживает с образованием белесоватого слегка втянутого рубца.
Острое течение фурункула с обычной локализацией на конечностях может осложняться регионарным лимфангоитом, лимфаденитом. Достаточно редко абсцедирующий фурункул сопровождается признаками генерализации инфекционного процесса: недомоганием, ознобом, высокой температурой и даже возникновением некротических очагов во внутренних органах (костях, мышцах, околопочечной клетчатке, почках). В большинстве случаев общей реакции организма не наблюдается.
В зависимости от локализации фурункулам отдельных областей свойственны некоторые особенности клинического течения.
Так, при поражении лица или мошонки резко выражен воспалительный отек. На местах, где кожа плотно прилегает к подлежащим тканям, отмечается выраженная болезненность (волосистая часть головы, затылок, наружный слуховой проход, тыльная сторона пальцев).
В ходе дифференциальной диагностики необходимо помнить о специфических формах воспалительного поражения кожи и подкожной клетчатки, таких, как актиномикоз, туберкулез, сифилис.
ЛЕЧЕНИЕ
Тактика ведения больных - амбулаторное лечение. Лечение одиночных фурункулов на туловище, конечностях зависит от формы и стадии гнойно-воспалительного процесса, сопутствующих осложнений. В большинстве случаев достаточным оказывается местное лечение. Вокруг инфильтрата волосы удаляют, в зоне воспаления проводят туалет кожи 70° спиртом, 2% салициловым спиртом. Фурункул смазывают 2% спиртовым раствором метилвиолета или 1% раствором бриллиантового зеленого. Повторное смазывание фурункула йодной настойкой нередко оказывает абортивное действие, так как купируется воспалительный процесс, быстро образуется гнойная корочка. Мытье пораженной области холодной водой, тем более купание в этот период не разрешается. Однако при хроническом реци-
дивирующем фурункулезе полезны теплые общие ванны с марганцовокислым калием (1:1000), зеленым мылом, другими дезинфицирующими средствами.
На стадии инфильтративного воспаления развивающегося фурункула («созревание») показаны аппликации водорастворимых мазей.
Сеансы УВЧ, сухого тепла (соллюкс, лампа Минина) в этот период оказывают отчетливый противовоспалительный эффект и способствуют облегчению боли. Однако применение согревающих компрессов противопоказано.
В стадии гнойно-некротического расплавления стержня продолжают начатую антибиотикотерапию и накладывают повязки со средствами, способствующими отторжению некротических масс, эвакуации гноя (мази на гидрофильной основе, влажно-высыхающие повязки с растворами антисептиков).
Недопустимы попытки ускорения отторжения гнойно-некротических масс путем «выдавливания» фурункула. Единственной манипуляцией может быть осторожное удаление сформировавшегося некротического стержня пинцетом.
Показанием к неотложному хирургическому лечению в условиях специализированного хирургического отделения служит абсцедирование фурункула. Как правило, операцию проводят под местной инфильтрационной анестезией. Раствор новокаина (тримекаина, лидокаина) вводят в зоне неизменных тканей на границе с очагом воспаления очень медленно, чтобы исключить болевые ощущения, связанные с инъекцией.
В отдельных случаях (обширный гнойный очаг, детский возраст и др.) требуется кратковременное общее обезболивание.
Направление операционных разрезов должно быть ориентировано соответственно ходу естественных складок кожи. По вскрытии абсцесса эвакуируют гной, некротические массы; полость промывают перекисью водорода, антисептическими растворами и дренируют полоской перчаточной резины, накладывают повязку с гидрофильной мазью или раствором антисептика. Гнойный экссудат целесообразно направить на бактериологическое исследование для идентификации микрофлоры, определения ее чувствительности к антибиотикам.
При значительных размерах гнойного очага внутрь назначают антибиотики (оксациллин, амоксициллин/клавуланат, цефалексин и др.), в случаях тяжелого течения с явлениями интоксикации их применяют парентерально.
Если в качестве причины рецидивирующего фурункулеза диагностируют сахарный диабет, необходимо исследование и лечение основного заболевания (диета с ограничением углеводов, противодиабетические препараты).
Фурункулы лица, располагающиеся выше линии рта, относят к особо опасному виду инфекционно-гнойной патологии в хирургии; примерно в 1/3 случаев наблюдается их злокачественное течение. Быстрому распространению гнойно-воспалительного процесса способствует богатая венозная и лимфатическая сеть в зоне верхней губы, носа, щек, суборбитальных областей. Тромбофлебиты, сопутствующие злокачественному течению фурункулов этих областей, быстро распространяются через угловую вену лица на систему глазной вены и напрямую проникают в кавернозный синус. В свою очередь, возникающий гнойный тромбоз синуса дает начало таким смертельно опасным осложнениям, как базальный менингит и оптохиазмальный арахноидит.
При злокачественном течении фурункула лица состояние больного быстро ухудшается; температура тела достигает высоких цифр, лицо резко отекает на стороне поражения. В процессе осторожной пальпации очага гнойного воспа-
ления определяют плотные болезненные вены. Иногда выявляют ригидность затылочных мышц - следствие раздражения мозговых оболочек, а поражение хиазмы может нарушать зрение. Однако фурункулы лица опасны не только из-за возможных менингиальных осложнений, но и в силу развивающейся септицемии, метастазирования инфекции во внутренние органы: печень, легкие и др.
Для лечения фурункулов на лице не рекомендуется применять повязки и наклейки. Важно создать максимально щадящий режим, исключить всякие прикосновения к воспалительному очагу со стороны больного, медицинского персонала. При злокачественном течении фурункула больному запрещают жевать и разговаривать; кормят только жидкой либо протертой пищей.
Профилактику стоматита осуществляют повторными промываниями (не полосканиями) полости рта струей теплого раствора антисептика (фурациллин 1:5000 и др.), а затем на слизистую оболочку наносят смесь буры с глицерином
(по 50,0 г).
Без промедления начинают энергичную антибактериальную терапию: внутривенное введение пенициллина (до 40-60 млн ЕД в сутки) в сочетании с аминогликозидом (гентамицин по 80 мг 3 раза в сутки в/м), а затем проводят курс современного высокоактивного антибиотика в соответствии с установленной чувствительностью возбудителя. Препаратами выбора являются цефалоспорины (цефалексин, цефазолин), полусинтетические пенициллины (оксациллин, амоксициллин), аминогликозиды, клиндамицин. Хорошие результаты получают от интракаротидного введения антибиотиков на стороне поражения. Одновременно с антибиотиком (в одном шприце) вводят ферментативные препараты в расчете на их противовоспалительный и потенцирующий антибактериальный эффект, например, кристаллический трипсин по 10 мг два раза в сутки.
При установлении стафилококковой природы заболевания применяют высокоэффективный метод лечения - иммунотерапию. Вначале проводят курс пассивной иммунизации, внутривенно вводится гипериммунная антистафилококковая плазма по 125 мл (4-6 мл на 1 кг массы тела) 3-6 раз с промежутком 1-2 суток либо антистафилококковый гамма-глобулин по 3-6 мл внутримышечно несколько дней подряд, всего 3-5 раз.
С целью предупреждения или купирования уже возникшего тромбофлебита с первых часов лечения необходимо осуществлять антикоагулянтную и тромболитическую терапию. Вначале капельным способом внутривенно вводят фибринолизин (20-40 тыс. ЕД) в смеси с гепарином натрия (по 10 тыс. ЕД на каждые 20 тыс. ЕД фибринолизина). Зарубежный аналог фибринолизина - стрептазу - также применяют внутривенно капельно (30 капель в минуту); 25 тыс. ЕД растворяют в 50 мл изотонического раствора хлорида натрия. Применение антикоагулянтных и тромболитических препаратов производится под контролем за состоянием гемокоагуляции. При этом нельзя допускать понижение в крови содержания фибриногена менее уровня 1 г/л, протромбинового индекса ниже 30-40%, увеличения времени свертывания крови более чем в 2 раза.
Активная консервативная тактика при лечении фурункулов лица не исключает хирургического вмешательства, которое требуется в неотложном порядке, когда воспалительный процесс приобретает распространенный гнойно-некротический характер (развитие абсцесса, флегмоны). В процессе операции иссекают гнойнонекротические ткани и ликвидируют гнойные затеки.
Пациенты с фурункулом лица подлежат обязательной экстренной госпитализации в хирургический стационар даже при отсутствии признаков злокачественного течения.
Госпитализации в хирургическое отделение требуют также больные с фурункулами в области крупных суставов: коленного, голеностопного, локтевого, лучезапястного ввиду риска развития гнойного артрита. В комплексе лечения этих больных необходима иммобилизация конечности до момента полного очищения раны.
Сроки нетрудоспособности индивидуальны и в зависимости от выраженности процесса колеблются от 1 до 4 недель.
Реабилитация
Больным с хроническим рецидивирующим фурункулезом стафилококковой этиологии, особенно при пониженной реактивности, необходимо провести курс активной иммунотерапии адсобрированным стафилококковым анатоксином (В.И. Стручков и соавт., 1986), 10 инъекций с интервалом 3 дня (0,1-0,3-0,6-0,8-
1,0-1,2-1,4-1,6-1,8-2,0).
3.9. КАРБУНКУЛ
Карбункул - острое гнойно-некротическое воспаление нескольких волосяных мешочков и сальных желез, сопровождающееся обширным очагом некроза кожи, подкожной клетчатки.
Поражение волосяных мешочков может развиваться последовательно либо одновременно как следствие перехода воспаления с одного фолликула на другой или слияния отдельных фурункулов в единый гнойно-воспалительный очаг. Карбункулы, как правило, бывают одиночными.
ЭТИОЛОГИЯ
В их этиологии, сходной с другими гнойно-воспалительными заболеваниями кожи и подкожной клетчатки, наибольший удельный вес принадлежит неполноценному питанию, сильному переохлаждению, болезням обмена веществ, таких, как сахарный диабет, ожирение.
К наиболее частым возбудителям, как и при фурункулах, относится золотистый стафилококк, редко - стрептококк. Участие в ассоциациях со стафилококком кишечной палочки, протея, стрептококка придает гнойно-некротическому процессу более тяжелый характер.
Важным фактором, определяющим развитие карбункула как тяжелой формы гнойно-некротического поражения кожи с подкожной клетчаткой, является вирулентность и другие биологические свойства микрофлоры. Определенную роль играют анатомо-физиологические особенности отдельных областей, например специфическое строение кожи в затылочной области, глубина подкожно-жирового слоя, а также возрастные изменения тканей. Пожилые пациенты более предрасположены к возникновению карбункулов.
При формировании карбункула интенсивный воспалительный процесс вызывает резкий отек тканей в зоне поражения, сдавление кровеносных и лимфатических сосудов. Возникающее нарушение кровообращения вызывает на обширном участке ишемический некроз тканей. Вокруг некротической зоны развивается нагноение, которое усиливает распад тканей. Лишенный жизнеспособности участок подвергается постепенному расплавлению и отторжению. После секвестрации образуется значительный дефект тканей, который в дальнейшем заживает вторичным натяжением с формированием грубого втянутого рубца.
Типичная локализация карбункула - задняя поверхность шеи. Реже он возникает в лопаточно-межлопаточной области, на ягодицах и переднебоковой поверхности бедер. У больных молодой и средневозрастной групп карбункул может возникнуть на лице.
КЛИНИЧЕСКАЯ КАРТИНА
Клинически заболевание начинается с появления небольшого воспалительного инфильтрата, иногда содержащего на верхушке пустулу. Инфильтрат быстро увеличивается, становится очень болезненным; кожа в зоне поражения напряжена, лоснится, нередко имеет цианотичный оттенок.
С развитием некротических изменений истонченный эпидермис частично расплавляется. Через несколько возникших отверстий выделяется небольшое количество густого гноя желтого или зеленовато-серого цвета. Поверхность карбункула приобретает вид решета, но при дальнейшем самопроизвольном течении отдельные отверстия сливаются, образуя в коже довольно большой дефект, через который постепенно отторгаются некротизированные ткани.
Прогрессирующая воспалительная реакция часто сопровождается симптомами общей интоксикации: головной болью, бессонницей, потерей аппетита, тошнотой, рвотой, гиперпирексией, иногда бредом и утратой сознания. Признаки интоксикации бывают особенно выраженными при значительных размерах карбункула либо при локализации его на лице.
Острые симптомы воспаления по мере образования гноя и отторжения некротических масс начинают стихать, что в большинстве случаев наблюдается в первые 3-4 дня. После очищения рана заполняется грануляциями, отечность уменьшается, формируется рубец, окруженный зоной пигментации. Однако воспалительная инфильтрация тканей обычно сохраняется до конца 4-5-й недели.
По частоте опасных осложнений, создающих угрозу жизни, на первом месте стоят карбункулы, локализующиеся на лице. По статистике, в половине всех случаев им сопутствуют септический тромбофлебит, тромбоз синуса, завершающиеся развитием гнойных базального менингита и арахноидита.
Карбункулы на ягодицах и конечностях также могут приобретать тяжелое септическое течение, сопровождаясь регионарным лимфангоитом, лимфаденитом.
К редким осложнениям карбункула относятся флегмона, рожистое воспаление, развивающиеся в зоне поражения.
В процессе дифференциальной диагностики не следует ограничиваться только местным диагнозом карбункула, пока не будут исключены сахарный диабет и другие системные заболевания (повторные анализы на содержание сахара в крови, моче, сахарная кривая).
От фурункула карбункул отличают наличие не одной, а нескольких гнойных «головок», большая распространенность воспалительного процесса и соответственно более выраженные клинические проявления.
Не следует забывать о возможности сибиреязвенного карбункула у людей, контактирующих с животными. Для него характерны небольшой зудящий узелок с геморрагической пустулой на верхушке, отсутствие болезненности и гнойных выделений. После прорыва пустулы рана сибиреязвенного карбункула покрывается твердым струпом черного цвета, окруженным розеткой мелких пузырьков. Явления общей интоксикации не выражены, вплоть до развития специфического сепсиса.
ЛЕЧЕНИЕ
Хирургическая тактика
Лечение больных с карбункулом проводят в условиях хирургического стационара, причем госпитализация осуществляется в неотложном порядке. На стадии инфильтративного воспаления эффективны УВЧ, УФО. Показано наложение повязки с мазью на гидрофильной основе.
В случаях злокачественного течения карбункулов необходимо как можно раньше начинать интенсивную терапию с использованием антибиотиков, анальгетиков, кардиотонических и дезинтоксикационных средств и методов, таких, как применение гемодеза, форсированного диуреза.
Для больного необходимо создать полный покой, постельный режим, иммобилизировать пораженную конечность.
Показаны переливания альбумина, введение витаминных препаратов.
В первые дни лечения ежедневно вводят антистафилококковый гамма-глобулин (4-6 мл в/м) либо гипериммунную антистафилококковую плазму (125 мл в/м).
Внутривенно назначают пенициллин до 40-60 млн ЕД в сутки в сочетании с аминогликозидами.
После определения чувствительности выделенной микрофлоры переходят на один из современных высокоактивных препаратов (цефалоспорины, полусинтетические пенициллины, клиндамицин и др.).
Одновременно с антибиотиками парентерально вводят протеолитические ферменты (трипсин, химотрипсин по 10-20 мг на протяжении 7-10 дней в/м).
Оперативное вмешательство показано при переходе воспаления в гнойнонекротическую стадию, о чем свидетельствует появление некроза кожи, выделение гноя. Непостоянный, но ценный из-за раннего появления симптом этой стадии - флюктуация. Консервативное лечение карбункула в стадии инфильтрации редко позволяет «оборвать» процесс, поэтому при прогрессировании симптомов интоксикации и отсутствии эффекта от проводимого лечения в течение 1-2 дней следует предпринять оперативное вмешательство.
Целью операции является максимально возможная санация гнойного очага, достигаемая его широким вскрытием, удалением гноя и некротических масс. Радикальное иссечение карбункула в пределах здоровых тканей выполнимо редко в силу выраженного перифокального воспаления, затрудняющего четкое разграничение здоровых и пораженных тканей. Такая операция возможна лишь при небольших размерах гнойно-воспалительного очага у молодых лиц и должна
предприниматься только в случаях прогнозируемой возможности завершения ее наложением швов с проточным дренированием раны. Наиболее часто выполняемое вмешательство при карбункуле - вскрытие его и проведение хирургической обработки раны. Рассечение гнойно-некротического очага линейным разрезом с иссечением некротизированных краев образовавшейся раны обеспечивает достаточный доступ. В ряде случаев можно ограничиться круговым иссечением некроза, заживление раны после которого происходит с образованием рубца меньших размеров. Крестообразные разрезы не оправданы по косметическим и функциональным соображениям и используются редко как исключение. Лечение раны в послеоперационном периоде проводится по общепринятым принципам.
Прогноз в большинстве случаев благоприятный. Однако при возникновении на лице карбункул еще более опасен, чем фурункул той же локализации.
Карбункулы любой локализации представляют угрозу для жизни, если они сопровождаются симптомами генерализованной инфекции.
Сроки нетрудоспособности: 4-6 недель, обусловлены наличием сопутствующих заболеваний (сахарный диабет в стадии декомпенсации и др.).
Реабилитация
При сопутствующем сахарном диабете благоприятное влияние на течение гнойно-некротического процесса оказывают корригирующая диета, инсулинотерапия.
3.10. ХИРУРГИЧЕСКИЙ СЕПСИС
Проблема диагностики и лечения сепсиса остается на протяжении многих десятилетий одной из самых сложных и наиболее актуальных задач медицинской науки.
Интерес к сепсису обусловлен не только возрастающей его частотой во всем мире, не имеющими тенденции к снижению цифрами летальности, чрезвычайно высокими затратами на стационарное и реабилитационное лечение, но и тем, что сепсис занимает все большее место в структуре заболеваний стационара любого клинического профиля как внутрибольничная инфекция.
Частота развития сепсиса в различных стационарах существенно разнится и зависит от профиля лечебного учреждения.
Общепринятым на сегодня является факт, что развитие синдрома системного ответа на воспаление (инфекцию) не является специфичным только для сепсиса.
Подобная реакция наблюдается и при целом ряде других заболеваний и повреждений. И.А. Ерюхин и соавт. (1998, 2000) считают, что политравма осложняется сепсисом в 30%, а лейкозы и злокачественные лимфомы - в 24% случаев.
Факторами риска развития сепсиса, по мнению В.Б. Белобородова (2000), являются:
• предрасполагающие состояния: нейтропения, онкологическая патология, диспротеинемия, цирроз печени, сахарный диабет, ВИЧ-инфекция и тяжелые хронические заболевания;
• операции или инвазивные процедуры, катетеризации;
• применение ряда препаратов: иммуносупрессоров, антибиотиков широкого спектра действия;
• возраст: мужчины старше 40 лет и женщины в возрасте 20-45 лет;
• предрасполагающие состояния: роды, септические аборты, травмы, обширные ожоги, язвенные поражения желудочно-кишечного тракта.
В.Б. Белобородов (2000) выделяет также факторы, способствующие повышению заболеваемости сепсисом. К ним относят:
• агрессивную химиотерапию и лучевую терапию онкологических заболеваний;
• возрастающее применение кортикостероидных и иммуносупрессивных препаратов у пациентов с небактериальными воспалительными заболеваниями и трансплантацией органов;
• динамику демографических показателей: увеличение продолжительности периода высокого риска возникновения сепсиса - выхаживание новорожденных с высокой степенью недоношенности, увеличение продолжительности жизни и количества пожилых лиц, онкологических больных и пациентов с нарушенной функцией жизненных органов, сахарным диабетом и гранулоцитопенией;
• развитие медицины: расширенное использование инвазивных устройств - хирургических эндопротезов, оборудования для дыхательной и ингаляционной терапии, внутрисосудистых и мочевых катетеров, парентерального питания;
• бессистемное использование антимикробных препаратов, которое создает условия для размножения, колонизации и развития инфекции более агрессивными и резистентными к антибиотикам микроорганизмами.
В стационарах хирургического профиля частота развития сепсиса составляет около 10%, в отделениях реанимации и интенсивной терапии она возрастает до 18%. По данным С.В. Яковлева (2004), число больных сепсисом с 1974 по 2003 гг. в США увеличилось более чем вдвое - с 300 до 700 тыс.
Экономические затраты на стационарное лечение больного сепсисом составляют от 40 тыс. до 81 тыс. $, а стоимость реабилитационного лечения доходит до 150 тыс. $.
По мнению ряда авторов, летальность больных сепсисом колеблется от 26,6 до 50% в хирургическом стационаре и достигает 80% в отделениях реанимации и интенсивной терапии.
Своевременная диагностика сепсиса имеет решающее значение. Так, в США диагноз «Сепсис» унифицирован и регистрируется во всех случаях, если у больного с установленным очагом инфекции (при наличии документированной бактериемии или без нее) одновременно имеются два или более признаков системной воспалительной реакции.
Слово «sepsis» греческого происхождения, означает гниение, разложение, ассоциируется с болезнью и смертью, впервые упоминается в IXX песне «Илиады» Гомера, создание которой относится к VIII-VII векам до н.э. Сам термин «sepsis» впервые предложен Аристотелем в IV веке до н.э.
В отечественной и зарубежной литературе встречаются несколько определений понятия «сепсис», несущих различную смысловую нагрузку. Некоторые наиболее часто встречающиеся в отечественной литературе определения понятия «сепсис» представлены ниже (табл. 3-1).
Таблица 3-1. Определения понятия «сепсис», наиболее часто встречающиеся в отечественной литературе
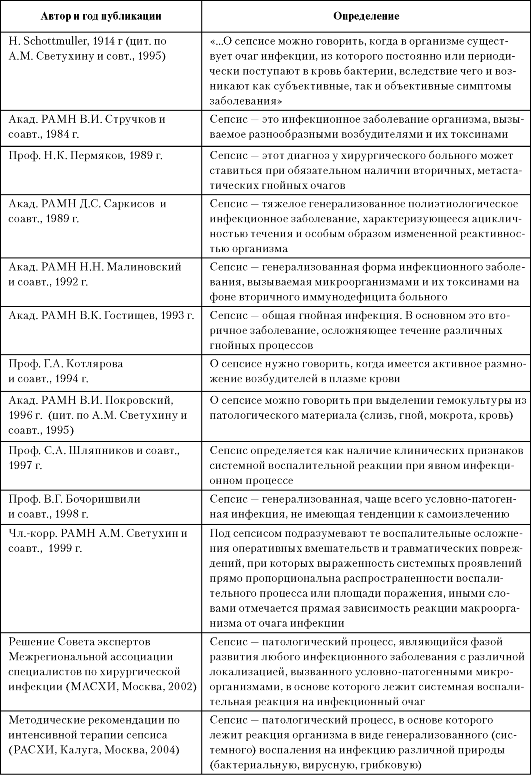 Разночтения в понимании целого ряда определений и понятий, невозможность сравнения проводимых исследований по проблеме сепсиса, постоянная путаница в терминах привели к необходимости создания единой стандартизованной терминологии.
Разночтения в понимании целого ряда определений и понятий, невозможность сравнения проводимых исследований по проблеме сепсиса, постоянная путаница в терминах привели к необходимости создания единой стандартизованной терминологии.
КЛАССИФИКАЦИЯ
Этому вопросу были посвящены международная конференция хирургов в Фулертоне (1986) и американская конференция «согласия» колледжа торакальных хирургов и врачей-интенсивистов в Чикаго (1991) под председательством R.G. Bone. Именно эта конференция стала своеобразным «рубежом» в познании сущности сепсиса как общемедицинской проблемы.
Благодаря координации усилий по изучению сепсиса путем создания межнациональных рабочих групп, организующих проведение многоцентровых исследований, в настоящее время в США и Европе используется классификация, принятая на Чикагской конференции «согласия».
Рекомендации РАСХИ по интенсивной терапии сепсиса (Калуга, Москва, 2004) утвердили данную классификацию как рабочую классификацию сепсиса. Единая стандартизованная терминология (рабочая классификация сепсиса) приведена в табл. 3-2.
Таблица 3-2. Современная рабочая классификация сепсиса
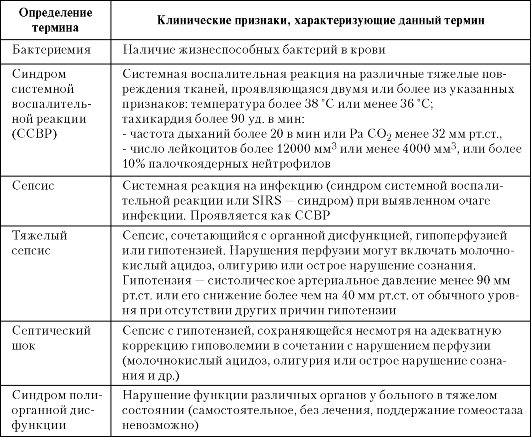 Таким образом, до 2004 г. имелись существенные разночтения в понимании определения понятия «сепсис» - от «определяемой в крови бактериемии» и «неадекватной гиперергической реакции» до «инфекционного заболевания» и «общей гнойной инфекции».
Таким образом, до 2004 г. имелись существенные разночтения в понимании определения понятия «сепсис» - от «определяемой в крови бактериемии» и «неадекватной гиперергической реакции» до «инфекционного заболевания» и «общей гнойной инфекции».
Введение единой терминологии определения различных клинических состояний, связанных с сепсисом, способствовало выработке единого языка общения врачей-клиницистов и более четкой регистрации частоты развития сепсиса.
Кроме приведенной выше рабочей классификации сепсиса существуют и несколько классификаций только хирургического сепсиса. Сводная классификация хирургического сепсиса (А.М. Светухин и соавт., 1995, В.Л. Белянин и М.Г. Рудакова, 2004) приведена ниже.
Классификация хирургического сепсиса По наличию первичного очага:
• первичный или криптогенный (без установленного источника сепсиса);
• вторичный (при наличии источника сепсиса). По виду микроба-возбудителя:
• аэробный [Грам (+) и Грам (-)];
• анаэробный (клостридиальный и неклостридиальный);
• смешанный (аэробно-анаэробный). По клиническому течению:
• молниеносный - острейший (до 1 суток);
• острый (до 14 суток);
• подострый (от 2 до 12 недель);
• хронический-рецидивирующий (более 3 месяцев). По локализации первичного очага:
• хирургический;
• одонтогенный;
• гинекологический;
• урологический;
• отогенный.
Эта классификация незаменима для практической медицины: она подразделяет сепсис по виду возбудителя, что является крайне важным при определении тактики проведения патогенетической антибиотикотерапии.
Классификация хирургического сепсиса по локализации первичного очага предложена В.С. Савельевым и Б.Р. Гельфандом (2000) (рис. 3-7).
Значительную роль в понимании сущности сепсиса сыграли исследования ряда отечественных и зарубежных ученых, предложивших несколько теорий развития сепсиса.
Еще Н.И. Пирогов (1865) высказывал гениальное предположение об обязательном участии в развитии септического процесса определенных активных факторов, при проникновении которых может наступить септицемия. «...При дальнейшем прогрессе науки нам придется только вникнуть в свойство неизвестного деятеля...» В 1914 г. H. Schottmuller предложил микробную теорию развития сепсиса. И.В. Давыдовский (1928, 1933-1961) в ряде своих работ выдвинул макробиологическую теорию возникновения сепсиса. Г.Н. Сперанский (1937) и А.В. Вишневский (1950) считали, что в основе развития сепсиса лежит нейротро-
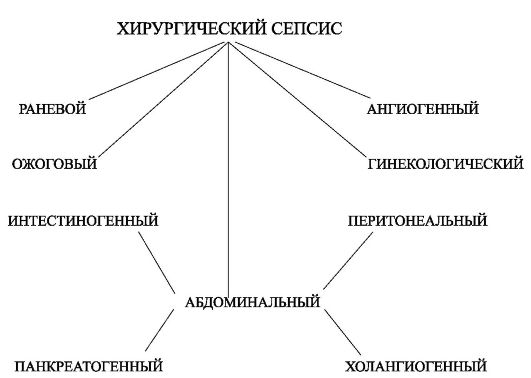 Рис. 3-7. Классификация хирургического сепсиса
Рис. 3-7. Классификация хирургического сепсиса
фическая теория. А.П. Авцын (1944), Н.И. Блинов (1952) и В.С. Савельев (1976) доказали, что причиной развития сепсиса служат выделяющиеся при его развитии токсины (токсическая теория). Наконец, R.G. Bone (1992, 1996) выдвинул цитокиновую теорию возникновения сепсиса.
В работах С.П. Глянцева (1998), R.G. Bone (1991, 1992), B. Henderson et al. (1996) и R.G. Holzheimer (1998) убедительно показано, что сепсис является результатом высвобождения целого ряда цитокинов - медиаторов повреждения эндотелия.
По данным Л.В. Ковальчука и Н.Н. Малиновского (1997), медиаторы сепсиса и их физиологическое воздействие на организм больного приведены в табл. 3-3.
Развитие системной реакции на воспаление или SIRS-синдрома является неспецифическим ответом макроорганизма на внедрение любого вида инфекции (бактериальной, вирусной или грибковой).
Бактериологическая характеристика хирургического сепсиса представлена практически всеми существующими патогенными и условнопатогенными бактериями - это стафилококки, стрептококки, кишечная палочка, грибы рода Candida, синегнойная палочка, протейные бактерии, анаэробная клостридиальная и неклостридиальная микрофлора.
ЭТИОЛОГИЯ
До настоящего времени стафилококки (Staphylococcus aureus, Staphylococcus saprophiticus и Staphylococcus epidermidis) остаются основными возбудителями сепсиса. Удельный вес стафилококков в развитии сепсиса составляет 39-45%. Стафилококки в 47,6% наблюдений являются причинной флорой развития сепсиса в монокультуре и у 10,7% больных в ассоциации с другими условно-патоген-
Таблица 3-3. Предполагаемые медиаторы сепсиса
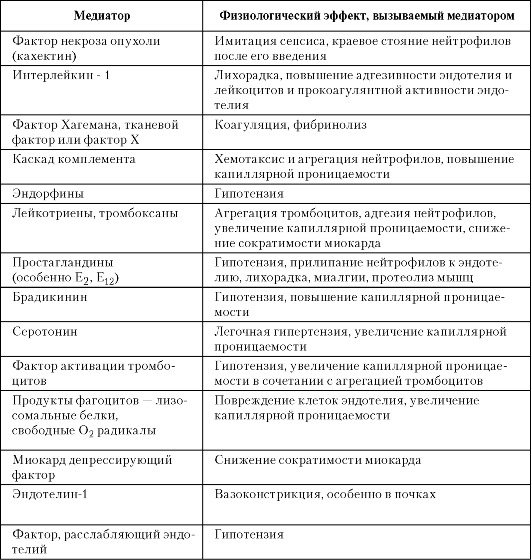 ными микроорганизмами. Среди стафилококков в 30,1% случаев при сепсисе из первичного очага высеваются стафилококки, принадлежащие виду Staphylococcus aureus.
ными микроорганизмами. Среди стафилококков в 30,1% случаев при сепсисе из первичного очага высеваются стафилококки, принадлежащие виду Staphylococcus aureus.
Значительно реже возбудителями сепсиса являются стрептококки. Из них наибольшее значение имеют Streptococcus pyogenes и Streptococcus viridans.
В развитии сепсиса большое значение имеют и бактерии семейства Enterobacteriaceae, которые достаточно часто встречаются в симбиозе с вышеописанными возбудителями. Известно, что Е. coli играет важную роль в жизнедеятельности организма. Однако попадание условно-патогенной кишечной палочки за пределы кишечника и инфицирование брюшной полости может быть причиной развития сепсиса.
Широкое применение антибиотиков привело к увеличению за последнее время случаев кандидозной инфекции и кандидозного сепсиса, возбудителями которого являются Candida albicans и Candida tropicalis. Генерализация процесса обусловлена выделением грибами токсических субстанций. Грибы вида Cаndida нечувствительны ко многим широко используемым препаратам.
Сепсис, вызванный синегнойной палочкой, обычно развивается по типу молниеносного, с выраженной шоковой реакцией. С учетом незначительной чувствительности синегнойной палочки к антибактериальным препаратам лечение синегнойного сепсиса чрезвычайно затруднено. В то же время этот возбудитель играет важную роль и в развитии госпитальной инфекции.
Специфичную группу микроорганизмов, вызывающих сепсис, представляют клостридиальные и некостридиальные анаэробы. Считается, что около 65-80% хирургической инфекции несет в себе анаэробный компонент.
Клинически значимыми возбудителями клостридиальной анаэробной инфекции являются Clostridium perfringens, Clostridium oedematiens, Clostridium septicum и Clostridium histoliticum. Все они способны образовывать большие количества экзотоксина, оказывающего мио- и нейротропное действие.
Не вызывает сомнения целесообразность включения в понятие «анаэробная инфекция» и инфекции, вызываемой группой возбудителей, не относящихся к клостридиям и являющихся неспорообразующими анаэробами семейства Bacteroides. Наиболее частыми возбудителями инфекции из патогенных анаэробов являются бактероиды и фузобактерии. Инфекция с участием бесспоровых облигатных анаэробов всегда протекает достаточно тяжело и требует интенсивных и адекватных методов лечения. По мнению A.M. Светухина (1989), эта же особенность относится и к сепсису, развившемуся с участием неклостридиальной анаэробной флоры.
Полимикробная ассоциация анаэробов - одна из основных этиологических особенностей газовой инфекции. Однако в каждом случае определенный вид микроорганизма является преобладающим и накладывает отпечаток на клинические проявления заболевания.
Раннее распознавание сепсиса имеет первостепенное значение, и роль этого факта трудно переоценить. Трудности диагностики обусловлены тем, что ни жалобы больного, ни клинические признаки сепсиса в отдельности не являются специфическими. Высевание микроорганизмов из крови при наличии входных ворот или первичного очага является подтверждением диагноза. По данным В.К. Гостищева и соавт. (1993), проводивших большие «многоцентровые» исследования, частота «положительных» посевов крови при сепсисе составляет от 30-50%
до 80%.
В клинической картине сепсиса выделяют часто встречающиеся симптомы: лихорадку, ознобы, миалгии, повышенный лейкоцитоз, эозинопению и менее часто встречающиеся проявления - ступор, кома, кровотечения из верхних отделов пищеварительного тракта, лейкопения, тромбоцитопения, гипотермия. При сепсисе наблюдаются местные (локальные) признаки инфекции (изменения в первичном очаге), системные (типичные) проявления инфекции и атипичные неспецифические проявления инфекционного процесса, связанные с измененной реактивностью организма больного на фоне тяжелой сопутствующей патологии.
КЛИНИЧЕСКАЯ КАРТИНА
Главной особенностью сепсиса является наличие первичного и вторичных пиемических гнойных очагов. При явном гнойном очаге и соответствующей клинической картине диагноз сепсиса поставить сравнительно легко.
Если видимых гнойных очагов нет, а имеются системные проявления инфекции, может возникнуть предположение о первичном или «криптогенном» сепсисе (А.М. Светухин и соавт., 1995). Причинами развития «криптогенного» сепсиса у больных хирургического стационара могут быть не только часто встречающиеся в практике отделения гнойной хирургии воспалительные заболевания мягких тканей (нагноение послеоперационной раны, постинъекционные абсцессы и флегмоны), но и пневмония, плеврит, эмпиема плевры, эндопластит, пиелонефрит, абсцессы печени, селезенки, забрюшинные флегмоны, септический тромбофлебит подключичной вены («катетер - ассоциированный» сепсис), лекарственная болезнь, септический эндокардит и т.д.
Лабораторные критерии сепсиса (как и клинические) также не имеют патогномоничных признаков, хотя порой являются ценным дополнением клинической картины.
ЛЕЧЕНИЕ
При подозрении на сепсис показана экстренная госпитализация в хирургическое отделение. Лечение больных сепсисом и септическим шоком проводится в отделениях реанимации и интенсивной терапии или при отсутствии последних в специализированных палатах интенсивной терапии профильных отделений (Б.Р. Гельфанд и соавт., 1999, 2000, D.S. Malcolm et al., 1990, J. Salvo et al., 1995, P. Haraldsen et al., 1998).
Согласно методическим рекомендациям Российской ассоциации специалистов по хирургической инфекции (РАСХИ) по интенсивной терапии сепсиса (Калуга, Москва, 2004) она подразделяется на приоритетную (радикальная санация первичного очага сепсиса, антибактериальная терапия, мероприятия, направленные на восстановление тканевой перфузии, искусственная нутритивная поддержка, селективная деконтаминация кишечника) и дополнительную, куда включают заместительную иммунотерапию (иммуноглобулины А, М, G или пентаглобин), дискретный плазмаферез при развитии полиорганной недостаточности и назначение препаратов, направленных на коррекцию гемокоагуляции.
«Краеугольным камнем» лечения сепсиса является хирургическая санация первичного и вторичных гнойных очагов в условиях хирургического стационара.
В основе санации первичного и вторичных очагов сепсиса лежит активная хирургическая тактика, суть которой подробно описана выше.
Не менее важна роль адекватной антибактериальной терапии.
Общим правилом антибактериальной терапии сепсиса считается использование «ступенчатой» антибактериальной терапии - вначале «стартовой» до получения результатов бактериологического анализа крови, затем этиотропной или патогенетической и поддерживающей (назначение антибактериальных препаратов в таблетированной форме).
Рекомендации РАСХИ (Калуга, Москва, 2004) по антибактериальной терапии сепсиса с неустановленным первичным очагом приведены в табл. 3-4.
Таблица 3-4. Рекомендации РАСХИ по антибактериальной терапии сепсиса с неустановленным первичным очагом
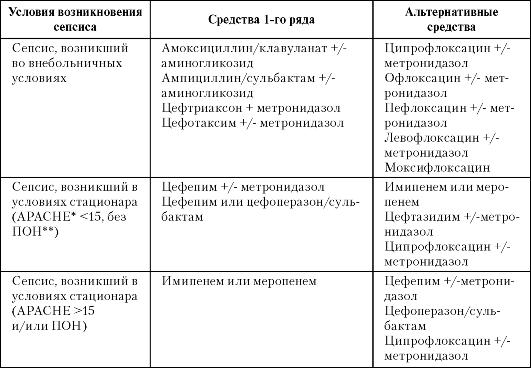 Примечание. APACHE* - Acute Physiology And Chronic Health Evaluation - шкала оценки острых и хронических функциональных нарушений. ПОН** - полиорганная недостаточность.
Примечание. APACHE* - Acute Physiology And Chronic Health Evaluation - шкала оценки острых и хронических функциональных нарушений. ПОН** - полиорганная недостаточность.
Интенсивная терапия при сепсисе направлена на устранение возникающей органной дисфункции и проводится безотлагательно.
Ее целями являются достижение следующих показателей: ЦВД - 8-12 мм рт.ст.; АД ср > 65 мм рт.ст.; диурез > 0,5 мл/кг/час и насыщение кислородом (сатурация) смешанной венозной крови > 70%. В случае если не удается добиться сатурации смешанной венозной крови > 70% при ЦВД 8-12 мм рт.ст., следует начинать трансфузию эритроцитарной массы до достижения уровня гематокрита >30% и/или инфузию допамина/добутамина.
Респираторная поддержка включает в себя повышение содержания кислорода во вдыхаемом воздухе и использование ИВЛ для поддержания постоянного положительного давления в конце выдоха (ППДКВ) в течение всего дыхательного цикла (Б.Р. Гельфанд и соавт., 2000, 2002). Начало снижения параметров респираторной поддержки возможно при регрессе патологического процесса в легких (острого респираторного дистресс-синдрома взрослых (ОРДС)или пневмонии) и устранения септического очага, поддерживающего системную воспалительную реакцию. «Отучение» от вентилятора необходимо проводить строго по протоколу.
Адренергические препараты при сепсисе используют для улучшения тканевого перфузионного давления, повышения сократимости миокарда и коррекции нарушений микроциркуляции (Б.Р. Гельфанд и соавт., 2000, 2002, W.A. Lynn et al.,
1995).
Особое значение при развитии сепсиса следует уделять проблеме полноценного питания больных сепсисом. При сепсисе происходит сдвиг обмена веществ с усилением катаболических процессов, что сопровождается стойким снижением или полным отсутствием аппетита, быстрой потерей массы тела и неизбежным развитием истощения (И.Л. Лейдерманн и соавт., 2002).
Метод деконтаминации желудочно-кишечного тракта с использованием антибактериальных препаратов селективного спектра действия в хирургии применяют сравнительно недавно последние 25-30 лет.
«Механизм действия» СДК заключается в устранении энтерогенного источника инфицирования и/или реинфицировании больных при минимальном воздействии на собственную колонизационную резистентность организма, представленную непатогенными анаэробами.
В этой связи препаратами выбора являются тобрамицин (гентамицин) - 320 мг/сут, полимиксин Е (колистин) или М - 400 мг/сут, амфотерицин В - 2000 мг/сут (Б.Р. Гельфанд и соавт., 2000).
Таким образом, использование комплекса приоритетных методов лечения дает возможность коррегировать возникшие тяжелые, характерные для сепсиса и полиорганной недостаточности нарушения гомеостаза и предотвратить развитие нозокомиальной инфекции.
Профилактика образования стресс-язв желудочно-кишечного тракта основывается на профилактическом применении блокаторов H2-рецептов и ингибиторов протонной помпы, которые снижают риск осложнений.
Профилактика тромбоза глубоких вен существенно влияет на результаты лечения больных сепсисом. С этой целью могут использоваться как нефракционированный гепарин, так и препараты низкомолекулярного гепарина (НМГ). При этом эффективность и безопасность НМГ выше, чем нефракционированного гепарина.
Особого внимания заслуживает сепсис, возникающий у больных как следствие инфекционных осложнений и выполняемых диагностических или лечебных процедур - так называемый ятрогенный сепсис.
Частота развития ятрогенного сепсиса составляет (В.С. Савельев и соавт., 2000, 2003) около 20%, его характеризуют тяжелое клиническое течение и опасный прогноз.
По классификации академика В.С. Савельева и соавт. (2000), в клинической практике выделяют виды ятрогенного сепсиса, приведенные на рис. 3-8.
Причинами развития контактного и манипуляционного ятрогенного сепсиса являются нарушение санитарногигиенического и противоэпидемического режима в отделениях анестезиологии, реанимации и и интенсивной терапии (ОРИТ) и перевязочной хирургического отделения.
В ОРИТ следует строго соблюдать принцип «одна сестра - один больной»; в перевязочной хирургического отделения необходимо использовать одноразовый инструментарий, медперсонал должен тщательно мыть руки после каждой процедуры, выполненной пациенту, и работать в перчатках.
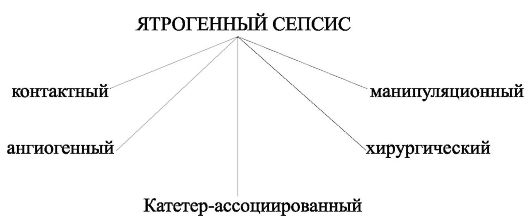 Рис. 3-8. Классификация ятрогенного сепсиса
Рис. 3-8. Классификация ятрогенного сепсиса
Под ангиогенным ятрогенным сепсисом следует понимать развитие системной воспалительной реакции на инфицированные тромботические массы (первичный очаг), которые формируются в мелких артериолах и венулах при миграции («отрыве») участка тромба при варикозной болезни поверхностных вен, инфицировании микротромбов при атеросклерозе, неспецифическом аорто-артериите и сахарном диабете. Причиной инфицирования часто являются малоинвазивные и инвазивные медицинские манипуляции - пункции артерий и вен для введения лекарственных средств и выполнение диагностических исследований - артериография, венография и т.д.
Особо следует остановиться на развитии ангиогенного сепсиса после внутривенного введения наркотических средств, который, к большому сожалению, не является редкостью в последнее время. В этих случаях имеет место «классический» вариант сепсиса, по определению древних греков и Аристотеля, истинное «гнилокровие».
Этиологическим фактором возникновения хирургического ятрогенного сепсиса (С.В. Яковлев и соавт., 2003) наиболее часто является грамположительная кокковая флора, резистентная к большинству используемых антибиотиков. При этом большая часть этого вида сепсиса вызывается ассоциацией микроорганизмов. Выявление одного вида возбудителя может быть связано либо с явным преобладанием его в ассоциации или с несовершенством методов бактериологической диагностики. При этом следует помнить о присутствии в выделяемой микрофлоре анаэробных микроорганизмов, не всегда определяемых в бактериологических лабораториях многих стационаров.
Основной причиной возникновения катетер-ассоциированного ятрогенного сепсиса является пункция и катетеризация периферической или центральной вены и установка в них катетера.
Входными воротами или первичным очагом катетер-ассоциированного сепсиса могут служить недостаточно обработанная инфицированная кожа (операционное поле); раневой (катетерный) канал, по которому введен катетер и сам установленный в периферическую или центральную вену катетер.
Лечение ятрогенного сепсиса - задача особой сложности, поскольку причиной его развития являются, как правило, антитибиотикорезистентные штаммы микроорганизмов, определяющиеся в данном отделении. Лечение больных ятро-
генным сепсисом следует проводить в отделениях реанимации и интенсивной терапии.
Основные методы интенсивной терапии ятрогенного сепсиса существенно не отличаются от описанных выше. Особенностью при подборе антибактериальной терапии является обязательное использование данных мониторинга за изменением микрофлоры в ОРИТ. Предпочтение следует отдавать моноантибактериальной «широкозахватной» терапии сепсиса с учетом данных микробиологического мониторинга.
Профилактика развития катетер-ассоциированного сепсиса заключается в соблюдении асептики при установке катетера (работа только в стерильных перчатках и одноразовыми инструментами):
• ежедневной обработке кожи вокруг катетера;
• использовании прозрачных стерильных пленок с нанесенными на них антисептиками для фиксации катетера, замене катетера через 5-7 суток;
• при появлении малейших признаков нагноения: гиперемии кожи, болезненности при пальпации в области катетера необходимы тщательный осмотр места установки катетера и по показаниям - толстоигольная пункция формирующейся паравазальной флегмоны (возможного очага) и/или сонографическое исследование этой области с последующей санацией гнойного очага.
По данным В.С. Савельева и соавт. (2000), в экономически развитых странах (США, Канада, Япония, Франция, Германия, Израиль и ряд других) летальность при ятрогенном сепсисе за последние 30 лет снизилась с 60% до 40%.
Сроки нетрудоспособности при данной патологии чрезвычайно вариабельны, 40-50% больных стойко утрачивают трудоспособность и переходят на инвалидность. У большинства пациентов временная нетрудоспособность колеблется от 18 до 20 недель.
Реабилитация
Реабилитация занимает важнейшее место в лечении септических больных. Необходимо длительное санаторно-курортное лечение в санаториях, профиль которых определяется тяжестью повреждения тех или иных органов и систем.
Теги:
234567 Описание для анонса:
234567 Начало активности (дата):
234567 Кем создан (ID): 1
234567



